海洋微生物来源的抗菌活性物质研究进展
柏凤月,倪孟祥
(中国药科大学生命科学与技术学院,江苏 南京 210009)
海洋微生物来源的抗菌活性物质研究进展
柏凤月,倪孟祥
(中国药科大学生命科学与技术学院,江苏 南京 210009)
摘要:海洋微生物因其特殊的代谢方式,能够产生许多具有新颖结构的活性物质,被认为是极具潜力的天然药物开发资源。综述了近三年海洋微生物来源的抗菌活性物质的研究进展,并对今后的发展进行了展望。
关键词:海洋微生物;抗菌活性物质;药物开发
目前,国内外对抗菌药物的开发一直集中在陆生生物资源。随着陆生生物资源日渐匮乏,从中发现新药的难度日益增大,加上多重耐药性问题的出现,新型抗菌药物的开发面临着严峻挑战。海洋是生命的摇篮,覆盖地球面积的70%,蕴藏着全球80%以上的物种。因此,海洋活性物质的开发成为研究重点。海洋微生物、海藻与海洋无脊椎动物是海洋天然活性物质的三大来源,其中,海洋微生物被认为是天然药物资源宝库[1]。
海洋微生物包括海洋细菌、海洋放线菌和海洋真菌。海洋环境的特殊性(如高压、高盐、缺氧、低温等)及海洋生物物种间复杂、广泛的生态作用赋予了海洋微生物有别于陆生生物的新陈代谢途径及适应机制,从而产生结构独特、具有一定生物活性的次级代谢产物,这些代谢产物也被称为生物活性物质,是新药来源的重要基础。自1929年弗莱明发现青霉素以来,人们已从微生物中发现了10 000多种生物活性物质,其中8 000多种具有抗菌及抗肿瘤活性,而且越来越多的研究表明许多具有开发前景的生物活性物质是由海洋微生物产生的[2],耐药现象的持续出现使得寻找新型抗菌活性物质变得更加迫切。作者综述了海洋细菌、海洋放线菌及海洋真菌来源的抗菌活性物质的研究新进展,并展望了其发展前景。
1来源于海洋细菌的抗菌活性物质
海洋细菌是海洋中分布最广、数量最多的一类微生物群体,研究发现每毫升海水中含细菌106个[3]。它们不仅能在极端条件下生存栖息,而且可产生大量多样性的新型活性物质。大多数海洋细菌都会产生抗生素,包括芽孢杆菌属Bacillus、弧菌属Vibrio、假单胞菌属Pseudomonas、黄杆菌属Flavobacterium、钦氏菌属Chainia及许多未经鉴定的菌种。研究者从海洋细菌中分离出的主要抗菌活性物质见表1。
表1海洋细菌中分离出的主要抗菌活性物质

Tab.1 The major antimicrobial bioactive substances isolated from marine bacteria
近年来研究最多的海洋细菌是芽孢杆菌属,已从中分离出多种对临床病原菌有抑制作用的活性物质。传统抗真菌剂的耐药性与毒性问题的出现增加了无毒抗真菌剂开发的需求。Tareq等[4]报道了从海洋芽孢杆菌属(Bacillussp. 109GGC020)中分离得到的4种新型脂肽化合物gageopeptides A~D。该化合物对病原性真菌立枯丝核菌、灰霉病菌、炭疽病菌具有强烈的抑菌作用(MIC=0.02~0.06 μg·mL-1),同时对革兰氏阳性菌和革兰氏阴性菌也具有有效的抑菌作用(MIC=0.04~0.08 μg·mL-1)。毒性实验表明,该类化合物无细胞毒性(GI50>25 μg·mL-1),因此可广泛应用于无毒性抗真菌剂的开发。Dusane等[5]报道了从海洋内生地衣芽孢杆菌(BacilluslicheniformisD1)中分离得到一种分子量为114 kDa的抗菌蛋白BL-DZa,该蛋白对致病白色念珠菌BY、铜绿假单胞菌PAO1及短小芽孢杆菌TiO1均具有抑菌作用。研究表明,其对白色念珠菌作用的MIC为1.6 μg·mL-1,对铜绿假单胞菌和短小芽孢杆菌的MIC均为3.12 μg·mL-1。Tareq等[6]报道了从海洋芽孢杆菌(Bacillussubtilis)中分离出的3种新型线性脂肽gageostatins A~C,研究表明,该化合物对尖孢炭疽病菌、水稻纹枯病菌及番茄灰霉病菌等病原性真菌显示出良好的抑菌活性(MIC=4~32 μg·mL-1);对金黄色葡萄球菌、伤寒沙门菌及铜绿假单胞菌等细菌显示出中等抗菌活性(MIC=8~64 μg·mL-1)。
另外,新型的抗菌活性物质陆续被发现,在解决耐药性问题上都具有很大的利用价值。Sarker等[7]报道了从海洋细菌ANAM-39中分离得到的活性物质粗提物,抑菌实验结果显示,该粗提物对蜡样芽孢杆菌、绿脓杆菌、无乳链球菌、大肠杆菌、志贺痢疾杆菌等均有抑菌作用(MIC=16~64 μg·mL-1),其中对蜡样芽孢杆菌和绿脓杆菌的抑菌作用最强。此外,抗菌活性物质还显示一定的抗真菌活性,如白色念珠菌和新型隐球菌。Chakraborty等[8]报道了从海藻共生细菌MTCC10403中分离出一种对临床病原真菌有广谱抗菌作用的多烯类抗生素7-O-methyl-5′-hydroxy-3′-heptenoate macrolactin,该化合物可以通过PKS生物途径合成。
Yin等[9]报道了从海洋假单胞菌(Pseudomonassp. CMF-2)中分离得到的抗菌蛋白CAP-1,该蛋白对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和白色念珠菌等具有广谱抗菌作用,尤其是一些海洋来源的微生物,如弧菌、创伤弧菌、溶藻弧菌、副溶血性弧菌、霍乱弧菌和鳗弧菌。该蛋白在一定的温度(20~80 ℃)和pH值(2~10)下具有稳定的抗菌活性,且对肿瘤细胞及正常细胞都无细胞毒性,因此也可作为开发无毒抗菌剂的先导化合物。
被定义为“未培养微生物”(uncultured microorganism)的海洋细菌经过简单改造培养也能够产生各种活性的代谢产物。Choi等[10]报道了被定义为“未培养海洋细菌”的代谢产物,对这2类细菌(变形菌门和拟杆菌门)进行长时间的贫瘠培养,并分离出许多具有碳骨架结构的新型生物碱类次级代谢产物,结果发现,其发酵液的有机提取物具有明显的抗菌活性,可见许多“未培养海洋细菌”可以通过简单的培养技术来分离,是新型抗菌剂开发的一个新的重要来源。
2来源于海洋放线菌的抗菌活性物质
放线菌是一类具有高含量G+C的革兰氏阳性菌,目前关于海洋放线菌的研究较少。但越来越多的研究表明,海洋放线菌能够产生大量多样性的代谢产物,成为寻找新药的重要来源[11]。研究者从海洋放线菌中分离出的主要抗菌活性物质见表2。
表2海洋放线菌来源的主要抗菌活性物质

Tab.2 The major antimicrobial bioactive substances isolated from marine actinomycetes
研究发现,海洋生物共生的放线菌能够产生具有新颖结构的抗菌活性物质。Wyche等[12]从海鞘源性放线菌属(Actinomadurasp. WMMB-499)中分离得到一种抗真菌聚酮化合物forazoline A,以两性霉素B作为阳性对照,测得其对临床白色念珠菌的MIC为16 μg·mL-1,且与两性霉素B具有协同作用。Eltamany等[13]报道了从海绵源性微球菌属(Micrococcussp. EG45)中分离得到的一种新型氧杂蒽酮类化合物microluside A。研究表明,其对粪肠球菌JH212和金黄色葡萄球菌NCTC 8325的MIC分别为10 μg·mL-1和13 μg·mL-1。
近年来,链霉菌属作为各种活性代谢产物的重要来源,研究者从中分离得到多种具有广谱抗菌作用的新型化合物。Duraikannu等[14]对海洋链霉菌(StreptomycesgancidicusVITSD1)发酵液粗提物进行了抑菌活性测试。研究表明,当发酵液粗提物浓度为5 μg·mL-1时,其对大肠杆菌、绿脓假单胞菌、伤寒沙门菌和金黄色葡萄球菌均有抑菌作用,抑菌圈直径分别为(30±0.92) mm、(28±0.93) mm、(18±0.98) mm和(20±1.02) mm。
Raju等[15]报道了从海洋沉积物中分离得到的一株链霉菌(Streptomycessp. CMBM0244),从其发酵产物中分离得到一种新型聚酮分子mollemycin A 。该化合物对革兰氏阳性菌和革兰氏阴性菌都显示出强烈的选择性抑菌作用,同时也能有效抑制多药耐药性恶性疟原虫菌株。Abirami等[16]从印度尼科巴群岛海洋沉积物来源的链霉菌(Streptomycessp. VITAK1)中分离出一种新型香豆素类活性化合物coumarin-6-ol-3,4-dihydro-4,4,5,7-tetramethyl(CDTM)。抑菌实验表明,其对多种临床病原性细菌均显示抗菌活性,其中变形杆菌是作用最敏感的菌株。Khalil等[17]报道了从海洋链霉菌(Streptomycessp. CMB-M0150)中分离得到的2种蒽环类抗生素aranciamycins I和aranciamycins J,研究表明,其对结核分枝杆菌具有强抗菌活性。
Methicillin-resistanceS.aureus(MRSA)是目前临床上数量最多的多重耐药性菌株,因此寻找新型抗MRSA药物是抗菌剂开发的重点。Jang等[18]报道了来源于海洋链霉菌(Streptomycessp.)的一类强效抗生素anthracimycin,其对临床炭疽芽孢杆菌、粪肠球菌、肺炎链球菌、金黄色葡萄球菌(包括MSSA、MRSA和耐万古霉素金黄色葡萄球菌耐药菌株)都具有强烈的抗菌活性(MIC=0.03125~0.25000 μg·mL-1),可作为新型MRSA抗生素的先导化合物。
极端环境下生存的海洋微生物更容易产生不同于其它微生物的生物活性物质。Ballav等[19]报道了从果阿河口海洋盐场分离出的几种嗜盐放线菌,主要包括链霉菌属Streptomycessp.以及稀有放线菌拟诺卡氏菌属Nocardiopsissp.、Kocuriasp.等。研究表明,这些菌株的发酵液粗提物都具有明显的抗菌活性,其中链霉菌属菌株对微生物有多重抑菌作用,而稀有放线菌属菌株的抑菌作用则具有特异性。这是国内外首次关于耐盐稀有放线菌属菌株的抗菌活性的报道,可见海洋盐场来源的嗜盐放线菌是寻找新型抗菌剂的一个潜在开发资源。
3来源于海洋真菌的抗菌活性物质
海洋真菌是研究得最多的一类海洋微生物群体。研究表明,目前许多新型抗肿瘤、抗细菌、抗真菌代谢产物都来源于海洋真菌[20]。研究者从海洋真菌中分离出的主要抗菌活性物质见表3。
表3海洋真菌来源的主要抗菌活性物质
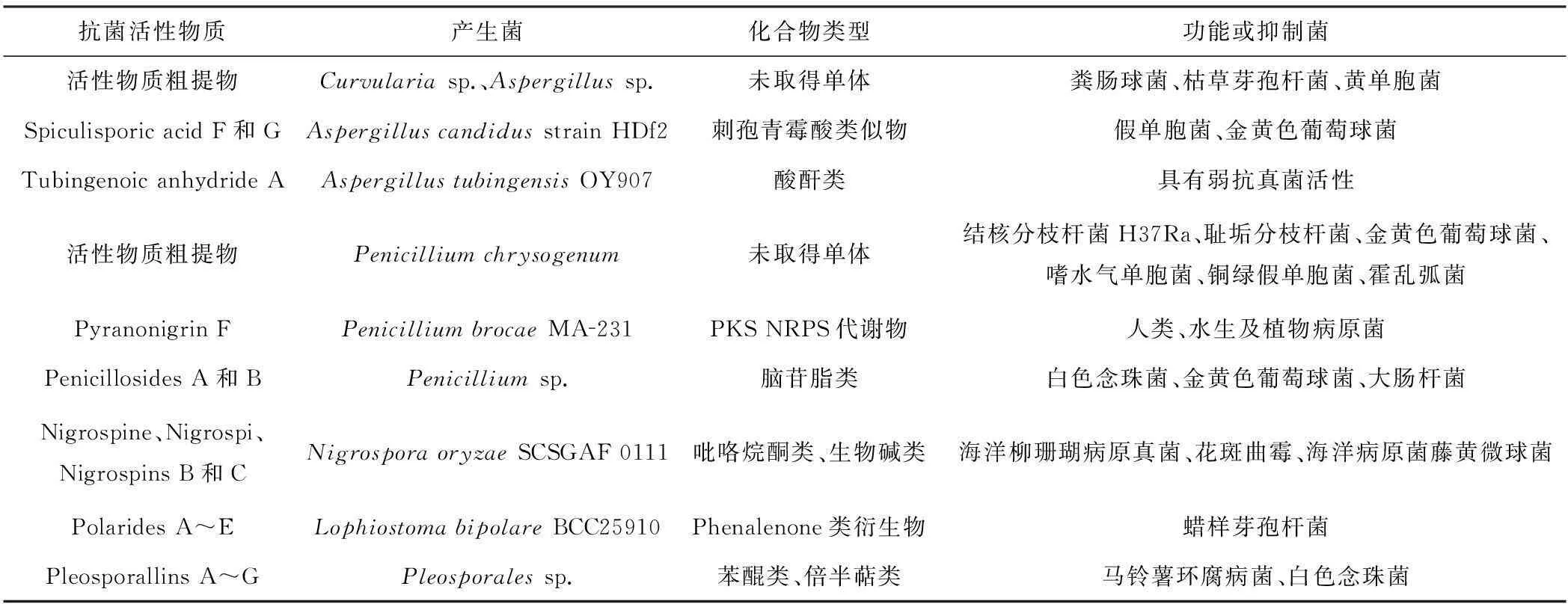
Tab.3 The major antimicrobial bioactive substances isolated from marine fungi
迄今为止,研究过的海洋真菌种类约有几千种,其中研究最多的是曲霉(Aspergillus)和青霉(Penicillium)。Swathi等[21]报道了印度海岸沉积物来源的新月弯孢霉属(Curvulariasp.)菌株和曲霉属(Aspergillussp.)菌株的发酵液粗提物具有一定的抗菌活性。研究表明,100 μg的新月弯孢霉属菌株粗提物对粪肠球菌和枯草芽孢杆菌有抑菌作用,抑菌圈直径均为27 mm;40 μg的曲霉属菌株粗提物对芽孢杆菌和黄单胞菌的抑菌效果最佳,抑菌圈直径均为12 mm。Wang等[22]从海胆共生曲霉属菌(Aspergilluscandidusstrain HDf2)的发酵产物中分离得到2种新型刺孢青霉酸类似物spiculisporic acid F和G,其显示了对假单胞菌与金黄色葡萄球菌的抗菌活性。Koch等[23]发现海洋曲霉(AspergillustubingensisOY907)能产生酸酐代谢产物tubingenoic anhydride A以及已知化合物2-羧甲基-3-己基马来酸酐。研究发现,两者具有弱抗真菌活性,在一定程度上可抑制链孢霉的生长,其MIC分别为330 μg·mL-1和207 μg·mL-1。
Visamsetti等[24]报道海绵源性产黄青霉菌(Penicilliumchrysogenum)发酵液的氯仿提取物能够产生比其乙醇提取物更强的抗菌作用,研究表明,其对结核分枝杆菌H37Ra、耻垢分枝杆菌、金黄色葡萄球菌、嗜水气单胞菌、铜绿假单胞菌和霍乱弧菌等多种细菌都有抑菌作用(MIC=31.25~1 000.00 μg·mL-1)。Meng等[25]报道了从海洋红树植物内生真菌(PenicilliumbrocaeMA-231)中分离得到的一种多氧二氢吡喃[2,3-c] pyrrole-4,5-dione衍生物pyranonigrin F以及一种已知化合物pyranonigrin A。研究表明,其对多种人类、水生及植物病原菌都有明显的抗菌活性。Murshid等[26]报道了从海鞘源性青霉属(Penicilliumsp.)菌株中分离得到的2种新型脑苷脂分子penicillosides A和B,其中penicilloside A显示抗白色念珠菌活性,抑菌圈直径为23 mm;penicilloside B显示对金黄色葡萄球菌和大肠杆菌的抗菌活性,抑菌圈直径分别为19 mm和20 mm。
研究者们还从几种不常见真菌的发酵产物中分离得到抗菌活性物质,可见海洋微生物中的稀有菌属也是新型抗菌物质开发的重点。Dong等[27]报道了从海洋黑孢霉属(NigrosporaoryzaeSCSGAF 0111)中分离得到新型吡咯烷酮化合物nigrospine、吲哚生物碱nigrospi以及2种新型橘霉素nigrospins B和nigrospins C。研究表明,分离得到的橘霉素对海洋柳珊瑚病原真菌、花斑曲霉以及海洋病原菌藤黄微球菌显示出强烈的抗菌活性。Intaraudom等[28]报道了从海洋真菌(LophiostomabipolareBCC25910)中分离得到9种phenalenone类衍生物,包括polarides A~E和bipolarols A~D以及一种二倍半萜酸类化合物,其中polarides A、polarides C及polarides E对蜡样芽孢杆菌有中等抑菌活性(MIC=12.5 μg·mL-1)。Chen等[29]报道了从海洋真菌(Pleosporalessp.)中分离得到7种新型化合物pleosporallins A~G,其中化合物pleosporallins D和pleosporallins E显示出对马铃薯环腐病菌Clavibactermichiganensissub sp.sepedonicus(MIC=9.48 μg·mL-1)和白色念珠菌Candidaalbicans的抑菌作用(MIC=7.44 μg·mL-1)。
4展望
近年来,海洋微生物来源的抗菌活性物质的研究取得了较大的进展,发现了许多新型抗菌剂。然而对海洋微生物的利用率仅有1%,只有少数的海洋活性物质应用于临床研究[30]。这可能是因为,绝大多数海洋微生物产生的活性物质含量很少,所以对于大多数活性物质来说,直接从原始的海洋微生物中提取很难满足新药开发的需求。因此,今后有关海洋微生物来源的抗菌活性物质的研究应主要集中在以下几个方面:(1)开拓更广阔的海洋微生物研究领域,将眼光转向高压、高盐等极端环境以及海底火山、极地海洋等处于原始状态的地点。(2)继续深入海洋微生物培养与活性物质分离提取的研究,利用宏基因组、蛋白质组学等新技术,优化活性物质的大规模筛选方法。(3)利用基因工程、细胞工程及发酵工程等技术,研究适合海洋微生物的发酵条件,加快海洋活性物质的产业化进程。海洋微生物是一个有潜力的新型抗菌剂来源,相信随着现代生物技术的发展和海洋资源的可持续开发利用,海洋微生物必将成为天然药物开发的优势资源。
参考文献:
[1]DUARTE K,ROCHA-SANTOS T A P,FREITAS A C,et al.Analytical techniques for discovery of bioactive compounds from marine fungi[J].Trends in Analytical Chemistry,2012,34:97-110.
[2]BHATNAGAR I,KIM S K.Pharmacologically prospective antibiotic agents and their sources:a marine microbial perspective[J].Environmental Toxicology and Pharmacology,2012,34(3):631-643.
[3]NG T B,CHEUNG R C F,WONG J H,et al.Antibacterial products of marine organisms[J].Applied Microbiology and Biotechnology,2015,99(10):4145-4173.
[4]TAREQ F S,LEE M A,LEE H S,et al.Non-cytotoxic antifungal agents:isolation and structures of gageopeptides A-D from aBacillusstrain 109GGC020[J].Journal of Agricultural and Food Chemistry,2014,62(24):5565-5572.
[5]DUSANE D H,DAMARE S R,NANCHARAIAH Y V,et al.Disruption of microbial biofilms by an extracellular protein isolated from epibiotic tropical marine strain ofBacilluslicheniformis[J].PLoS ONE,2013,8(5):e64501.
[6]TAREQ F S,LEE M A,LEE H S,et al.Gageostatins A-C,antimicrobial linear lipopeptides from a marineBacillussubtilis[J].Marine Drugs,2014,12(2):871-885.
[7]SARKER A K,HAQUE M A,SAHA U,et al.Evaluation of antibacterial,antifunfgal and cytotoxic potentials of crude metabolite of ANAM-39,a marine bacterium isolated from Sundarbans,Bangladesh[J].Bangladesh Pharmaceutical Journal,2015,18(2):103-109.
[8]CHAKRABORTY K,THILAKAN B,RAOLA V K.Polyketide family of novel antibacterial 7-O-methyl-5′-hydroxy-3′-heptenoate-macrolactin from seaweed-associatedBacillussubtilisMTCC 10403[J].Journal of Agricultural and Food Chemistry,2014,62(50):12194-12208.
[9]YIN M,LIU D,XU F,et al.A specific antimicrobial protein CAP-1 fromPseudomonassp. isolated from the jellyfishCyaneacapillata[J].International Journal of Biological Macromolecules,2016,82:488-496.
[10]CHOI E J,NAM S J,PAUL L,et al.Previously uncultured mar-ine bacteria linked to novel alkaloid production[J].Chemistry & Biology,2015,22(9):1270-1279.
[11]MANIVASAGAN P,VENKATESAN J,SIVAKUMAR K,et al.Marine actinobacterial metabolites:current status and future perspectives[J].Microbiological Research,2013,168(6):311-332.
[12]WYCHE T P,PIOTROWSKI J S,HOU Y,et al.Forazoline A:marine-derived polyketide with antifungalinvivoefficacy[J].Angewandte Chemie,2014,126(43):11767-11770.
[13]ELTAMANY E E,ABDELMOHSEN U R,IBRAHIM A K,et al.New antibacterial xanthone from the marine sponge-derivedMicrococcussp.EG45[J].Bioorganic & Medicinal Chemistry Letters,2014,24(21):4939-4942.
[14]DURAIKANNU D,CHANDRASEKARAN S D,SELVAKUMAR J N,et al.A preliminary study ofinvitroantioxidant and antibacterial activity ofStreptomycesgancidicusVITSD1 isolated from marine soil[J].Current Bioactive Compounds,2014,10(4):292-297.
[15]RAJU R,KHALIL Z G,PIGGOTT A M,et al.Mollemycin A:an antimalarial and antibacterial glyco-hexadepsipeptide-polyketide from an Australian marine-derivedStreptomycessp.CMB-M0244[J].Organic Letters,2014,16(6):1716-1719.
[16]ABIRAMI M,GOPAL J V,KANNABIRAN K.Extraction and identification of antibacterial compound from marineStreptomycessp.VITAK1 isolated from the coast of Andaman and Nicobar Islands,India[J].Applied Biochemistry and Microbiology,2015,51(4):406-410.
[17]KHALIL Z G,RAJU R,PIGGOTT A M,et al.Aranciamycins I and J,antimycobacterial anthracyclines from an Australian marine-derivedStreptomycessp.[J].Journal of Natural Products,2015,78(4):949-952.
[18]JANG K H,NAM S J,LOCKE J B,et al.Anthracimycin,a potent anthrax antibiotic from a marine-derivedActinomycete[J].Angewandte Chemie International Edition,2013,52(30):7822-7824.
[19]BALLAV S,KERKAR S,THOMAS S,et al.Halophilic and halotolerant actinomycetes from a marine saltern of Goa,India producing anti-bacterial metabolites[J].Journal of Bioscience and Bioengineering,2015,119(3):323-330.
[20]WANG Y T,XUE Y R,LIU C H.A brief review of bioactive metabolites derived from deep-sea fungi[J].Marine Drugs,2015,13(8):4594-4616.
[21]SWATHI J,SOWJANYA K M,NARENDRA K,et al.Isolation,identification & production of bioactive metabolites from marine fungi collected from coastal area of Andhra Pradesh,India[J].Journal of Pharmacy Research,2013,6(6):663-666.
[22]WANG R,GUO Z K,LI X M,et al.Spiculisporic acid analogues of the marine-derived fungus,Aspergilluscandidusstrain HDf2,and their antibacterial activity[J].Antonie van Leeuwenhoek,2015,108(1):215-219.
[23]KOCH L,LODIN A,HEROLD I,et al.Sensitivity ofNeurosporacrassato a marine-derivedAspergillustubingensisanhydride exhibiting antifungal activity that is mediated by the MAS1 protein[J].Marine Drugs,2014,12(9):4713-4731.
[24]VISAMSETTI A,RAMACHANDRAN S S,KANDASAMY D.PenicilliumchrysogenumDSOA associated with marine sponge (Tedaniaanhelans) exhibit antimycobacterial activity[J].Microbiological Research,2016,185:55-60.
[25]MENG L H,LI X M,LIU Y,et al.Polyoxygenated dihydropyrano[2,3-c]pyrrole-4,5-dione derivatives from the marine mangrove-derived endophytic fungusPenicilliumbrocaeMA-231 and their antimicrobial activity[J].Chinese Chemical Letters,2015,26(5):610-612.
[26]MURSHID S S A,BADR J M,YOUSSEF D T A.Penicillosides A and B:new cerebrosides from the marine-derived fungusPenicilliumspecies[J].Revista Brasileira de Farmacognosia,2016,26(1):29-33.
[27]DONG J J,BAO J,ZHANG X Y,et al.Alkaloids and citrinins from marine-derived fungusNigrosporaoryzaeSCSGAF 0111[J].Tetrahedron Letters,2014,55(16):2749-2753.
[28]INTARAUDOM C,NITTHITHANASILP S,RACHTAWEE P,et al.Phenalenone derivatives and the unusual tricyclic sesterterpene acid from the marine fungusLophiostomabipolareBCC25910[J].Phytochemistry,2015,120:19-27.
[29]CHEN C J,ZHOU Y Q,LIU X X,et al.Antimicrobial and anti-inflammatory compounds from a marine fungusPleosporalessp.[J].Tetrahedron Letters,2015,56(45):6183-6189.
[30]BHATNAGAR I,KIM S K.Pharmacologically prospective antibiotic agents and their sources:a marine microbial perspective[J].Environmental Toxicology and Pharmacology,2012,34(3):631-643.
Research Progress on Antimicrobial Bioactive Substances from Marine Microorganisms
BAI Feng-yue,NI Meng-xiang
(SchoolofLifeScienceandTechnology,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:Marine microorganisms can produce many bioactive substances with novel structures due to their special metabolic behaviour,so they are considered as potential resources for natural drugs discovery.The research progress on antimicrobial bioactive substances from marine microorganisms in recent three years is reviewed and their future development prospects are also presented.
Keywords:marine microorganisms;antimicrobial bioactive substances;drug discovery
收稿日期:2016-01-25
作者简介:柏凤月(1990-),女,山东滨州人,硕士研究生,研究方向:微生物制药,E-mail:baify1990@sina.cn;通讯作者:倪孟祥,副教授,E-mail:nimx_2000@aliyun.com。
doi:10.3969/j.issn.1672-5425.2016.05.004
中图分类号:R 284
文献标识码:A
文章编号:1672-5425(2016)05-0015-05

