甲基硫代腺苷对结肠癌RKO细胞增殖及RNA聚合酶Ⅲ依赖基因转录影响实验研究*
华北理工大学附属开滦总医院普外科 (唐山 063000)
王明君 张青松∆ 曹立赢 温英武 费乐学 高建超 郑景珍 钟 烁 王 瑜
甲基硫代腺苷对结肠癌RKO细胞增殖及RNA聚合酶Ⅲ依赖基因转录影响实验研究*
华北理工大学附属开滦总医院普外科 (唐山 063000)
王明君张青松∆曹立赢温英武费乐学高建超郑景珍钟烁王瑜
摘要目的:探讨甲基硫代腺苷(MTA)对结肠癌RKO细胞增殖的影响及其转录水平相关机制。方法:采用MTT比色技术及细胞计数作生存曲线的方法分析MTA对结肠癌RKO细胞增殖的影响,并采用Realtime PCR的方法分析RNA聚合酶Ⅲ依赖基因(tRNAs、5S rRNA)。结果:0.5、1、2、3mmol/L MTA作用16h后,RKO细胞的增殖能力分别为对照组的(84.1±4.5)%、(69.4±5.2)%、(55.3±3.8)%、(40.9±3.5)%(P均<0.01);MTA 0.5mmol/L作用4、8 h后,RKO细胞tRNAs、5S rRNA的转录水平分别为对照组的0.584±0.033、0.624±0.035,0.453±0.025、0.372±0.027(P均﹤0.01)。结论:MTA对RKO细胞具有明显的抗肿瘤活性,且对RNA聚合酶Ⅲ依赖基因转录的下调可能起到重要作用。
主题词@甲基硫代腺苷结肠肿瘤/病理学细胞增殖RNA聚合酶Ⅲ
甲基硫代腺苷(Methylthioadenosine,MTA)是多胺和蛋氨酸代谢过程中的代谢产物。我们以往的研究表明MTA对结肠癌RKO细胞的增殖具有明显的抑制作用[1]。本研究为明确其具体机制,着重研究MTA对结肠癌RNA聚合酶Ⅲ依赖基因(tRNAs、5S rRNA)的转录水平的影响,旨在为MTA的临床使用提供实验理论依据。
材料和方法
1材料 结肠癌RKO细胞购自ATCC公司;MTA,MTT(噻唑蓝)购自Sigma公司,MTA用二甲亚砜配成0.5 mmol/L溶剂;RKO细胞用含100 mL/L小牛血清MEM培养液培养;RNA提取试剂盒购自Genemega公司;cDNA合成试剂盒(编号28025-013)、RNaseOUT 核酸抑制剂(编号10777-019)、随机引物(编号48190-011)、0.1MDTT(编号00147)购自invitrogen公司;RT-PCR引物设计如下:tRNAs(F) 5’-GTC AGG ATG GCC GAG TGG TCT AAG-3’, (R) 5’-CCA CGC CTC CAT ACG GAG AAC CAG AAG ACC C-3’; 5S rRNA(F)5’-GGC CAT ACC ACC CTG AAC GC-3’,(R)5’-CAG CAC CCG GTA TTC CCA GG- 3’。
2方法
2.1细胞增殖检测:实验分为对照组和MTA组,药物处理前1 d种植于6孔板。MTA的浓度分别为0.5、1、2及3 mmol/L,处理过程中使每组均含有等量的二甲基亚砜。每一分组均另有2个复孔, MTA的作用时间均为16 h。在细胞被处理16 h后,弃去培养液,加入5 g/L MTT溶液(M-0283)100 μl后,再加入新鲜培养液1 ml。培养箱中放置4 h后,直接加入MTT溶解剂(M-0408)1 ml,轻轻震荡使结晶充分溶解,用比色分光仪检测A570nm和A690nm,用A570nm减去A690nm的背景值,该差值与该组存活细胞数成正比。
2.2生存曲线的绘制:实验细胞分为对照组和MTA组,药物处理前6h种植于6孔板中,初始RKO细胞数为40000个/孔,MTA的浓度0.5 mmol/L,每一分组均另有20个复孔,每隔24h取各组三孔进行细胞记数,其余各组更换一次细胞培养液,MTA组按1 mmol/L浓度加入MTA,共进行7d的细胞计数,绘制细胞生存曲线。
2.3tRNAs、5S rRNA的转录水平的检测
2.3.1药物处理及分组:实验分为溶剂对照组,MTA组。药物处理前夜细胞种植于6孔板中,16h后,向每孔加入甲基硫代腺苷溶液和DMSO,使其甲基硫代腺苷的终浓度分别为0mmol/L,0.5mmol/L,并使各组含有等量DMSO,药物处理时间为4、8h。
2.3.2Realtime PCR:在细胞被处理后,经过以下步骤:总RNA的提取(EZgeno 总RNA提取试剂盒)、cDNA的合成(M-MLV Reverse Transcriptase 试剂盒)、用合成的cDNA进行Realtime PCR:① 向96孔板中加入:Realtime 反应混合液SYBR Green 10μl、相应引物各0.5μl、cDNA5μl(1∶100稀释)、水4μl。②每个样品要在同一块反应板中除检测待测基因外,还需同时检测看家基因HPRT,每个反应在同一块反应板中至少重复2次。③加样后,在Realtime PCR仪中按以下反应程序进行:①95℃15min;②95℃15s、61℃35s,循环40次;③72℃5min;④ 4℃ forever。反应完成后,Realtime PCR仪反应程序将提供每个反应孔在同一“门槛”下的Ct值。
3统计学方法采用SPSS11.5统计学软件,数据以均数±标准差表示,进行方差分析,P<0.05表示差异有统计学意义。
结果
1 MTA对细胞增殖的影响与对照组比较,5’-MTA 0.5、1、2、3 mmol/L 作用16 h后,RKO细胞存活率分别为(84.1±4.5)% 、(69.4±5.2)%、(55.3±3.8)%、(40.9±3.5)%(P均<0.01)。重复4次实验。说明5’-MTA 0.5 mmol/L以上可明显抑制RKO细胞的增殖,这种诱导作用存在剂量依赖关系。
2MTA作用于RKO细胞的生存曲线与对照组相比,RKO细胞在0.5 mmol/L MTA作用下,1~7d内,肿瘤细胞的增殖受到了明显的抑制(附图)。
3MTA处理结肠癌RKO细胞tRNAs、5S rRNA的转录水平变化Realtime PCR分析结果表明:MTA 0.5mmol/L作用4、8h后,设定对照组的值为1,tRNAs、5S rRNA的转录水平见附表。说明0.5mM MTA作用于RKO细胞后,4、8h时间点上tRNAs、5S rRNA的转录水平出现了明显的下调。
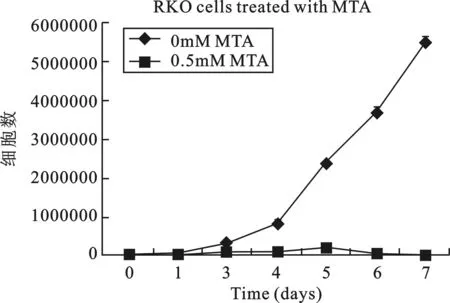
附图 MTA处理结肠癌RKO细胞的生存曲线
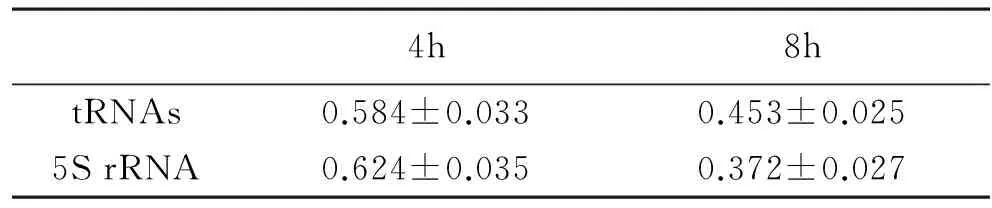
4h8htRNAs0.584±0.0330.453±0.0255SrRNA0.624±0.0350.372±0.027
注:以上各组与对照组相比较,P<0.05
讨论
许多肿瘤细胞的普遍特征是缺乏MTA代谢的关键酶MTA磷酸化酶的活性(MTAP)[2]。缺乏MTAP的细胞分泌MTA,而不是通过代谢途径分解MTA。人们根据这一特点想到了提高肿瘤细胞内的MTA浓度可能会抑制肿瘤细胞的生长[3]。研究表明,当肿瘤细胞内MTA浓度增高后,就会产生对肿瘤的增殖、侵袭性和肿瘤的发展产生抑制作用[4]。肿瘤细胞的这一代谢特点引起了人们的注意,因为这可以用于肿瘤的药物治疗。使用抗代谢药物如氨甲蝶呤阻断嘌呤的生物合成,可以有效的杀死MTAP活性的缺乏肿瘤细胞,正常细胞可通过MTA生成腺苷的途径而得到保护。由此可见,MTA的治疗会对正常细胞起保护性的作用。这种差别的原因目前还不清楚。有一种解释是可能由于这两种细胞含MTAP的不同,导致了它们在MTA的代谢的不同。更为重要的是,有研究表明长时间给予老鼠高浓度MTA并未发现有副作用出现。Tony等[5]通过建立炎症物质诱导鼠产生结肠癌的动物模型,发现MTA可明显抑制炎症物质诱导的鼠结肠癌的发生、发展。
肿瘤细胞有一个共同的特征:核浆比例失调,核仁肥大。这个特征是临床对肿瘤病理诊断的一个重要指标,至今已沿用了一个多世纪。研究表明:核糖核酸RNA(rRNA)在细胞的核仁由RNA聚合酶I 和III转录而成。RNA聚合酶I转录18S和28S 等RNAs,其分子量巨大。而RNA 聚合酶III转录的产物是一些小片断的无翻译作用的RNA,其分子常在200个核苷酸以内,包括tRNAs 和 5S rRNAs[6]。这些小分子RNA 直接参与蛋白质的合成。tRNAs 和5S rRNA 的多寡与细胞的生长,增殖和肿瘤的发生密切相关[6]。研究表明:原癌基因蛋白如Ras, c-Jun和c-Myc 促进Pol III 基因的转录,而抑癌基因蛋白如pRb, p53, PTEN和Maf1抑制Pol III基因的转录[7]。
本研究结果表明,0.5 mM以上不同浓度的MTA均可明显抑制RKO细胞的增殖, RKO细胞在MTA作用下,1~7d内,肿瘤细胞的增殖受到了明显的抑制。以上实验提示,MTA对结肠癌RKO细胞增殖抑制作用是明确的,且存在剂量依赖关系和长时间的有效性。本研究同时也提示结肠癌RKO细胞MTA作用后均出现tRNAs, 5S rRNAs转录水平水平的下调,这就从另一方面表明MTA对结肠癌RKO细胞的抗肿瘤活性,并从RNA聚合酶III转录水平的调控角度分析了MTA对结肠癌细胞增殖抑制的作用机制。同时我们也认为,RNA 聚合酶III转录的调控是一多因素、多步骤的过程,尤其是MTA对乳腺癌细胞RNA 聚合酶III的亚单位TBP、Brf1及Bdp1是如何影响的,应成为我们今后进一步研究的方向。这些研究将为MTA的临床推广提供实验依据。
参考文献
[1] 张青松.MTA对NCM460和结肠癌RKO细胞增殖和凋亡的影响[J].第四军医大学学报,2008,29(5):468-469.
[2] Baiqing Tang, Yuwaraj Kadariya.Expression of MTAP inhibits tumor-related phenotypes in HT1080 cells via a mechanism unrelated to its enzymatic function[J]. G3 (Bethesda),2015, 5(1): 35-44.
[3]Qiang Gao, Dasheng Zheng, Zhiming Yuan. Substrate preference of 5′-methylthioadenosine/S-adenosylhomocysteine nucleosidase in Burkholderia thailandensis[J]. FEMS Microbiol Lett,2013,339:110-116.
[4]Andreu-Perez P, Hernandez-Losa J. Methylthioadenosine (MTA) inhibits melanoma cell proliferation and in vivo tumor growth[J]. BMC Cancer,2010,10:265.
[5] Tony Li, Heping Yang. Effects of S-adenosylmethionine and methylthioadenosine on inflammation-induced colon cancer in mice[J]. Carcinogenesis,2012, 33 (2):427-435.
[6]Raha D, Wang Z. Close association of RNA polymerase II and many transcription factors with Pol III genes[J].Proc Natl Acad Sci USA,2010,107: 3639-3644.
[7] Zhong Q, Shi G, Zhang Q,etal. Role of phosphorylated histone H3 serine 10 in DEN-induced deregulation of Pol III genes and cell proliferation and transformation[J]. Carcinogenesis, 2013, 34: 2460-2469.
(收稿:2015-04-15)
【中图分类号】R364.7
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.03.007
*河北省唐山市科技支撑项目(14130260B)
▲通讯作者

