利用单片段代换系测交群体定位玉米株高和穗位高的杂种优势位点
胡德升,谢旭东,张向歌,杨慧丽,许蒙蒙,李卫华,薛亚东
(1.河南农业大学农学院,河南 郑州450002;2.河南省农业广播学校中牟分校,河南中牟451450)
杂种优势是提高农作物产量和品质的一种重要遗传机制现象,并在玉米、水稻等多种农作物中得到广泛应用[1]。由于杂种优势遗传机制的复杂性,尽管已提出了显性、超显性和上位性假说来解释杂种优势形成的遗传机制[2-4],但到目前为止对杂种优势的遗传机制仍知之甚少。随着不同类型的分子标记发展和高密度遗传图谱的构建,科研工作者借助不同的分离群体,从QTL位点的效应值和杂种优势位点对杂种优势形成的遗传机制进行了研究,为进一步揭示杂种优势形成的遗传机制提供了一定依据[5-10]。株高和穗位高是构成玉米株型的2个重要农艺性状。植株过高会降低种植密度、抗倒伏能力和收获指数,过低则影响群体通透性、易患病虫害、降低生物产量;穗位过高易造成植株倒伏,过低则不利于光合产物向穗部的有效运转,因此,育种家对株高和穗位高的关注仅次于产量及抗性等性状。由于株高和穗位高表现为典型的数量性状遗传,而且容易获得准确的观测值,许多学者把株高和穗位高作为模式性状进行了大量研究,定位了许多与株高和穗位高相关的 QTL[11-15],并克隆了其中一些控制株高的质量性状基因[16-18]。此外,株高和穗位高具有强优势的遗传特点,又被作为研究杂种优势遗传机制的模式性状[19]。在数量性状研究的不同分离群体中,由于单片段代换系仅有一个代换片段与轮回亲本存在差异,因此,单片段代换系的测交或者回交群体被认为是鉴定杂种优势位点的一种理想群体,并在杂种优势研究中得到一定的应用[20]。本研究利用一套单片段代换系及其测交群体对玉米株高和穗位高数量性状位点和杂种优势位点进行了分析,以期揭示玉米株高与穗位高形成的遗传机制提供基础材料,并为优良玉米新品种的选育提供理论支撑。
1 材料与方法
1.1 试验材料
本研究所用的基础材料是来自中国地方优异种质唐四平头类群的184个lx 9801背景的昌7-2单片段代换系材料[21]。2012年冬在海南乐东县南繁基地利用自交系T 7296与单片段代换系群体测交,组配了一套CSSLs×T 7296的测交群体,其中T 7296来自Reid杂种优势类群,与唐四平头组成中国黄淮海夏玉米区一个广泛利用的杂种优势利用模式。
1.2 试验方法
2013年夏,将单片段代换系(CSSLs)与T 7296的测交群体、对照种T 7296×lx 9801、单片段代换系(CSSLs)群体和3个亲本自交系(lx 9801、昌7-2、T 7296)分别种植于河南长葛市试验田和鹤壁市农科院试验田(河南浚县)。测交群体完全随机区组设计,2个重复,单行区,行长4 m,每行15株,密度65 250株·hm-2,为提高杂种优势位点检测的准确性,每10个测交组合中设1个对照。CSSLs群体与亲本自交系按照同样的田间设计,播种在同一试验田中。在玉米散粉结束后选取连续10株分别量取株高和穗位高,其中株高指从地面到植株雄穗主轴顶端的高度(cm);穗位高指地面到第1个果穗着生节间的高度(cm)。
1.3 数据处理与分析
采用SPSS 18.0统计软件,对两点试验材料的产量和穗部性状进行统计和相关性分析。以各试验点lx 9801×T 7296的观测值作为对照,利用方差分析和t测验比较每个CSSL×T 7296测验种单个性状与对照种之间的差异,在P≤0.05的显著水平下认为存在相应性状的杂种优势位点。杂种优势效应值用中亲优势表示,中亲优势(%)=[(CSSL×T 7296)表型值-对照表型值]/对照表型值×100%。杂种优势位点命名则以h+性状英文缩写+染色体序号+位点序号(如a,b,c…),如果1条染色体上仅有1个杂种优势位点则表示为:h+性状英文缩写+染色体序号。
2 结果与分析
2.1 测交群体的株高与穗位高杂种优势表型分析
CSSLs×T 7296测交群体的株高和穗位高在2个环境中均表现出较大的表型变异(表1)。在浚县点测交群体株高的平均值为279.32 cm,变异范围为263.33 ~295.00 cm,平均中亲优势为45.49%;而对照种T 7296×lx 9801的平均株高为278.33 cm,中亲优势值为43.50%。在长葛点测交群体的株高平均值略低于浚县点(274.52 cm),变异范围为252.70 ~289.93 cm,平均中亲优势值为47.15%,而对照的株高平均值为279.00 cm,中亲优势值为49.13%。
测交群体在浚县点的穗位高平均值为99.35 cm,变异范围为87.70 ~111.53 cm,平均中亲优势值为76.84%;对照种的平均穗位高为96.87c m,中亲优势为70.32%。在长葛点测交群体的穗位高平均值为 102.64 cm,变异范围为 91.07~115.80 cm,平均中亲优势值为89.64%;而对照种的平均穗位高为104.87 cm,中亲优势为93.99%。
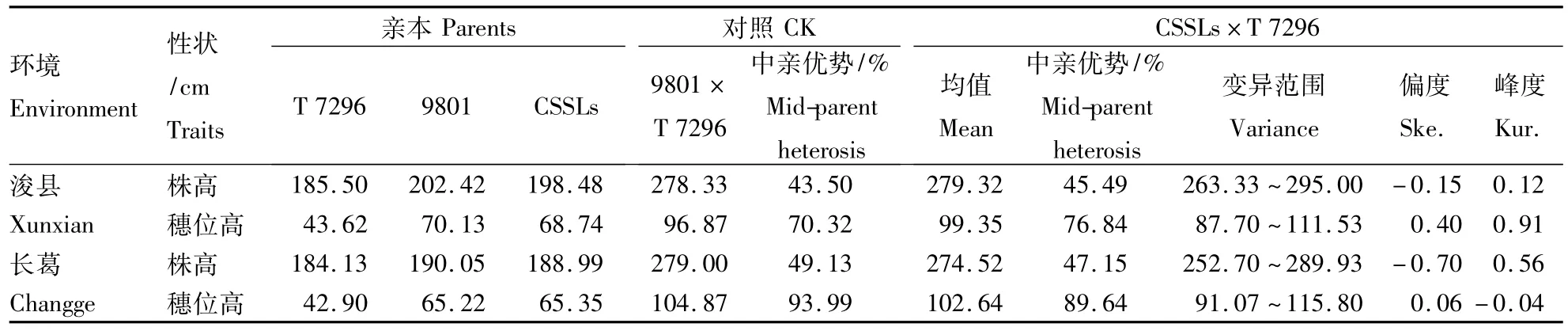
表1 CSSLs×T 7296测交群体及其对应亲本的表型分析Table 1 Performance of CSSLs×T 7296 test population and its related parents
2.2 利用单片段代换系群体定位的玉米株高和穗位高数量性状位点
利用CSSLs群体在浚县和长葛分别检测到13和11个株高的QTL,其中有8个QTL在2个环境中同时被检测到(表2)。位于第1染色体片段bnlg182-bnlg2238-umc1144上的 qPH1b,在浚县点和长葛点的加性效应分别为4.26和7.07 cm,可解释株高表型变异的2.10%和3.72%;位于第1染色体上另外1个株高QTL qPH1c在浚县和长葛中的加性效应和贡献率分别为-8.74(4.32%)和 -6.89 cm(3.63%)。位于第3染色体上的qPH3a和qPH3c在浚县和长葛点的加性效应和贡献率分别为 -8.59(4.24%)和 -6.06 cm(3.19%),-13.79(6.81%)和 -4.96 cm(2.61%)。第 4 染色体上定位了1个共同的QTL(qPH4),其加性效应及表型变异分别为 -5.11(2.52%)和 -4.96 cm(2.61%)。第6染色体上的qPH6c在浚县和长葛的加性效应分别为-12.24和-5.78 cm,可解释株高表型变异的6.05%和3.04%。第8染色体上的qPH8在浚县和长葛的加性效应及表型变异分别为 -26.09(12.89%)和 -19.33cm(10.17%)。第9染色体上的qPH9a在浚县和长葛的加性效应分别为-10.43和-11.36 cm,可解释株高表型变异的 5.15%和 5.98%。

表2 CSSLs群体中检测到的株高和穗位高QTLTable 2 QTL detected for plant height and ear height in the CSSLs population

续表2 Continuing table 2
穗位高在2个环境中共检测到13个不同的QTL,在浚县和长葛分别检测到9和8个QTL,有4个QTL在2个环境中同时被检测到。第1染色体上的qEH1c在浚县和长葛的加性效应分别为10.58和 7.96 cm,可解释穗位高表型变异的15.09%和12.20%。位于第3染色体上的qEH3a在浚县和长葛点的加性效应及表型变异分别是-5.76(8.21%)和 -6.79 cm(10.42%)。第 7 染色体上共检测到2个共同的QTL,其中qEH7a在浚县和长葛的加性效应及表型变异分别为14.90(21.25%)和7.42 cm(11.38%);qEH7b 在浚县和长葛点的加性效应及表型变异分别为 -7.13(10.17%)和 -11.13 cm(17.06%)。
3.3 利用单片段代换系测交群体定位的玉米株高与穗位高杂种优势位点
CSSLs×T 7296测交群体浚县和长葛分别检测到6个和5个株高杂种优势位点(HL),其中有2个HL在2个环境中同时被检测到(表3)。位于第1染色体上株高杂种优势位点h3PH1a在浚县和长葛点可以使株高与对照相比分别降低4.43%和5.59%;而第8染色体上的株高杂种优势位点h3PH8b位于染色体区段dupssr14-phi233376上,该位点在浚县和长葛与对照相比可以使株高分别降低 2.83%和 8.16%。
CSSLs×T 7296测交群体在浚县和长葛点各检测到4个玉米穗位高的HL,其中2个HL在2个环境中被同时检测到,主要分布在第1,3,5,7,8 和9染色体上(表3)。第8染色体上的穗位高杂种优势位点 h3EH8位于染色体片段 bnlg1194-umc2352-bnlg2235上,在浚县和长葛与对照相比可以使穗位高分别增加13.83%和10.43%;第9染色体上穗位高杂种优势位点h3EH9位于染色体片段bnlg1272-bnlg1810上,在浚县和长葛与对照相比可以使穗位高分别降低6.33%和17.99%。

表3 CSSLs×T 7296杂交群体中检测到株高和穗位高杂种优势位点Table 3 HL detected for plant height and ear height in CSSLs×T 7296 test population
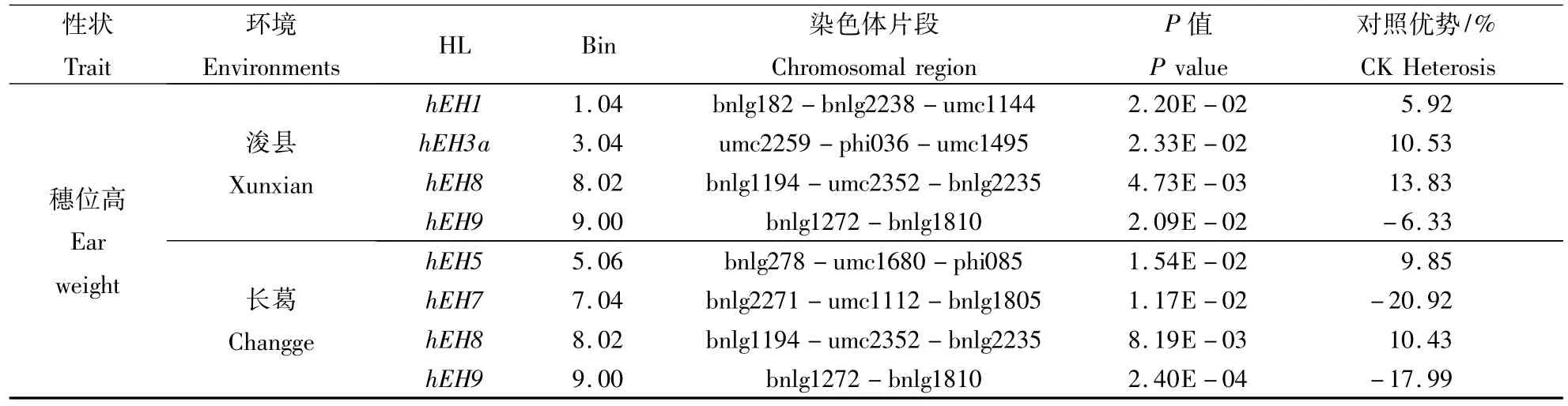
续表3 Continuing table 3
3 结论与讨论
由于杂种优势的表现受基因型、环境、基因×基因互作以及基因×环境互作等多种因素的综合影响[22],因此,准确度量某一杂种优势的表型值是对杂种优势位点进行准确定位的前提。在杂种优势研究过程中,前人曾用F2、RIL或DH的测交或回交群体、三交群体、“永久F2”群体等对多个农作物重要农艺性状的杂种遗传机制进行了剖析,但是,由于上述分离群体遗传背景的复杂性,很难将杂种优势位点直接剖分为单基因水平[5-10]。为简化分离群体遗传背景的复杂性,近期有学者利用单片段代换系与轮回亲本构建的回交群体对多个生物的杂种优势形成的遗传机制进行了剖析,检测出多个性状杂种优势位点的染色体片段[23-26],为杂种优势基因的克隆奠定了材料基础。由于杂种优势的表现除单基因水平外,还存在着全基因水平上多个基因的互作,因此,在全基因组杂合的基础上对单个杂种优势位点进行分析,可以更为准确地确定杂种优势位点。
在玉米株高与穗位高杂种优势遗传机制研究过程中,汤继华等[27]利用一套永久F2群体定位了10个玉米株高的HL,分布于玉米的7条染色体上。WEI等[28]利用一套玉米单片段代换系与非轮回亲本的回交群体对玉米株高和穗位高的杂种优势位点进行了分析,分别定位了9个株高和穗位高的HL。本研究利用一套中国优异地方种质唐四平头的2个优良自交系lx 9801和昌7-2的单片段代换系为基础材料,通过与来自 Reid类群的T 7296测交群体,分别检测到9个和6个株高与穗位高的杂种优势位点,其中株高和穗位高各有2个杂种优势位点在2个环境中同时被检测到,同时发现控制株高和穗位高的3个QTL和HL分别位于相同的染色体片段上,说明株高和穗位高的表型性状和杂种优势可能有部分相同的基因控制。本研究为进一步解析玉米株高与穗位高杂种优势形成的遗传机制提供了材料基础。
[1] BRUCE A B.The mendelian theory of heredity and the augmentation of vigor[J].Science,1910,32:627 -628.
[2] EAST E M.Heterosis[J].Genetics,1936,21:375 -397.
[3] KEEBLE F,PELLEW C.The mode of inheritance of stature and of time of flowering in peas(Pisum sativum L.) [J].Genetics,1910,1:47 -56.
[4] JONES D F.Dominance of linked factors as a means of accounting for heterosis[J].Genetics,1917,2:466 -479.
[5] SHULL G H.The composition of a field of maize[J].Am Breeders Assoc Rep,1908,4:196-301.
[6] LU H,ROMERO-SEVERSON J,BERNARBO R.Genetic basis of heterosis explored by simple sequence repeat markers in a random-mated maize population [J].Theor Appl Genet,2003,107:494 -502.
[7] STUBER C W,LINCOLN S E,WOLFF H T,et al.Identification of genetic factors contributing to heterosis in a hybrid from elite maize inbred lines using molecular markers[J].Genetics,1992,132(11):823 -839.
[8] XIAO J H,LI J M,YUAN L P,et al.Dominance is the major genetic basis of the heterosis in rice as revealed by QTL analysis using molecular markers[J].Genetics,1995,140:745-754.
[9] HUA J P,XING Y Z,WU W R,et al.Single-locus heterotic effects and dominance by dominance interaction can adequately explain the genetic basis of heterosis in an elite hybrid[J].PNAS,2003,100(5):2574-2579.
[10] KUSTER B,PIEPHO H P,UTZ H F,et al.Heterosis for biomass-related traits in Arabidopsis investigated by quantitative trait loci analysis of the triple testcross design with recombinant inbred lines [J].Genetics,2007,177:1839-1850.
[11] AUSTIN D F,LEE M,VELDBOOM L R.Genetic mapping in maize with hybrid progeny across testers and generations:plant height and flowering[J].Theor Appl Genet,2001,102:163 -176.
[12] BEAVIS W D,GRANT D,ALBERTSEN M,et al.Quantitative trait loci for plant height in four maize populations and their associations with qualitative genetic loci[J].Theor Appl Genet,1991,83:141 -145.
[13] BERKE T,ROCHEFORDd T.Quantitative trait loci for flowering,plant and ear height,and kernel traits in maize[J].Crop Science,1995,35:1542-1549.
[14]曹永国,王国英,王守才,等.玉米RFLP遗传图谱的构建及矮生基因定位[J].科学通报,1999,40:2178-2182.
[15]VELDBOOM L R,LEE M.Genetic mapping of quantitative trait loci in maize in stress and nonstress environments:Ⅱ.Plant height and flowering[J].Crop Science,1996,36:1320-1327.
[16] BENSEN R J,JOHAL G S,CRANE V C,et al.Cloning and characterization of the maize An1 gene[J].Plant Cell,1995,7(1):75 -84.
[17]SPRAY C R,KOBAYASHI M,SUZUKI Y,et al.The dwarf-1(d1)mutant of Zea mays blocks three steps in the gibberellin-biosynthetic pathway[J].PNAS,1996,93(19):10515-10518.
[18] WINKLER R G,HELENTJARIS T.The maize dwarf 3 gene encodes a cytochrome P450-mediated early step in Gibberellin biosynthesis[J].Plant Cell,1995,7(8):1307-1317.
[19]严建兵,汤华,黄宜勤,等.不同发育时期玉米株高QTL的动态分析[J].科学通报,2003,48(18):1959-1964.
[20] SEMEL Y,NISSENBAUM J,MENDA N,et al.Overdominant quantitative trait locus for yield and fitness in tomato[J].PNAS,2006,103:12981 -12986
[21]李卫华,王洪秋,袁亮,等.利用单片段代换系群体定位玉米穗部性状的QTL[J].河南农业大学学报,2013,47(2):143 -146.
[22]ZHANG Y,LI YX,WANG Y,et al.Stability of QTL across environments and QTL-by-environment interactions for plant and ear height in maize[J].Agricultural Sciences in China,2010,9:1400-1412.
[23]MER H W,LI Z K,SHU Q Y,et al.Gene actions of QTL affecting several agronomic traits resolved in a recombinant inbred rice population and two backcross population[J].Theor Appl Genet,2005,110:649 -659.
[24] SHEN G J,ZHAN W,CHEN H X,et al.Dominance and epistasis are the main contributors to heterosis for plant height in rice[J].Plant Science,2014,215/216:11-18.
[25] WANG Z Q,YU CY,LIU X,et al.Identification of indica rice chromosome segments for the improvement of japonica inbreds and hybrids [J].Theor Appl Genet,2012,124:1351-1364.
[26]YU CY,WAN J M,ZHAI H Q,et al.Study on heterosis of inter-subspecies between indica and japonica rice(Oryza sativa L.)using chromosome segment substitution lines[J].China Sci Bull,2005,50:131 -136.
[27]汤继华,马西青,滕文涛,等.利用“永久F2”群体定位玉米株高的QTL与杂种优势位点[J].科学通报,2006,51(24):2864-2869.
[27] WEI X Y,WANG B,PENG Q,et al.Heterotic loci for various morphological traits of maize detected using a single segment substitution lines test-cross population[J].Molecular Breeding,2015,35(3):1-13.

