猪流感病毒新型核糖体移码蛋白PA-X特有序列的原核表达、纯化及鉴定
宫晓倩,阮宝阳,2,刘晓敏,张 鹏,2,汪 琪,汪秀会,周艳君,李泽君,童 武,郑 浩,童光志,于 海
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 山东农业大学动物科技学院,泰安 271000)
猪流感病毒新型核糖体移码蛋白PA-X特有序列的原核表达、纯化及鉴定
宫晓倩1,阮宝阳1,2,刘晓敏1,张 鹏1,2,汪 琪1,汪秀会1,周艳君1,李泽君1,童 武1,郑 浩1,童光志1,于 海1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 山东农业大学动物科技学院,泰安 271000)
摘 要:核糖体移码蛋白PA-X是流感病毒的一种新型蛋白,为了研究该蛋白对于猪流感病毒的生物学特性的影响,我们进行了PA-X特有序列的原核表达、蛋白纯化及其鉴定。通过RT-PCR和重叠PCR方法扩增PA-X 特有序列的基因,利用基因重组技术构建原核表达载体,并进行菌液PCR和菌液测序鉴定,鉴定正确后克隆转化到BL21(DE3)中,进行蛋白表达及可溶性分析,同时用镍柱亲和层析法对其进行纯化。通过菌液PCR序列鉴定,PA-X特有序列的原核表达载体序列正确,编码框正确。转化BL21后目的蛋白表达成功,且大多数为可溶性蛋白。Western blot 结果表明制备的多克隆抗体具有良好的免疫反应性。
关键词:猪流感病毒;PA-X特有序列;原核表达;蛋白纯化;Western blot
猪流感病毒为正粘病毒科A型流感病毒属单股负链分节段的RNA病毒,分为8个节段。根据核苷酸长短,分别将它们命名为8个基因片段:节段1 (PB2基因),节段2(PB1基因),节段3(PA基因),节段4(HA基因),节段5(NP基因),节段6(NA基因),节段7(M1基因),节段8(NS1基因)[1]。同正链RNA病毒和DNA病毒相比,负链RNA病毒的主要特点是基因组RNA不具有感染性,不能直接进行感染性转录,而必须将自身携带的依赖于RNA的RNA聚合酶导入到细胞中,才指导第一轮mRNA合成,而且裸露的基因组RNA本身也不能作为模板,只有在与核蛋白(nuclear protein,NP)结合成复合物(RNA核蛋白复合物,RNP)形式时,才能作为模板起始复制和转录[2]。PA基因编码PA蛋白,它与PB2、PB1、NP蛋白以及病毒RNA一起构成核糖核蛋白体复合物(viral ribonucleoprotein complexes,vRNPs),参与病毒的组装[3]。它的N末端还具有核酸内切酶的功能,能够定位于被感染细胞的细胞核,将其前体RNA上的加帽的RNA片段切下来作为病毒转录的引物[4-6]。它的C末端可以与PB1蛋白的N末端结合[7]。
PA-X蛋白是利用PA蛋白的起始密码子来启动翻译,合成出PA蛋白的N末端,然后再通过+1核糖体阅读框架移动识别新的开放阅读框X-ORF而生成的一种新型蛋白[8]。PA-X蛋白不是流感病毒的必须部分,但一些研究证明它对病毒的致病力有着重要的影响[8-10]。为此,本实验室以1株古典H1N1亚型猪流感病毒[11]为材料,在原核表达体系中表达了X-ORF对应的61个氨基酸残基的特有序列,以用来检测PA-X蛋白的表达,为接下来的致病机理相关研究打下重要的基础。
1 材料和方法
1.1材料
1.1.1质粒、菌株和病毒 pcold-TF 载体保存于本实验室;E.coli BL21(DE3)购自全式金公司;DH5α购自天根;古典H1N1亚型猪流感病毒(A/Swine/ Guangdong/1/2011(H1N1))保存于本实验室。
1.1.2主要试剂 RNeasy Mini Kit(250) 购自QIAGEN;SuperScript III First-Strand Synthesis System for RT-PCR购自invitrogen by technologies;pfu高保真DNA聚合酶购自Agilent Technologies;限制性内切酶 Sac I,Pst I购自TAKARA公司;DNA Marker购自捷瑞公司;Gel Extraction Kit 购自OMEGA BIO-TEK公司;T4 DNA ligase购自Biolab公司;IPTG购自Merk公司;超滤离心浓缩管购自Amicon公司。
1.2方法
1.2.1引物的设计 H1N1亚型猪流感病毒的PA-X蛋白发生了20个氨基酸的截短。为了表达61个氨基酸的肽段,首先用overlapping PCR的方法使H1N1亚型猪流感病毒的41位氨基酸处的终止密码子缺失,设计引物如下:5'-CCTATGTGGATGGATTCGAA CCAAATGGCTACATTGAG-3'和5'-CTCAATGTA GCCATTTGGTTCGAATCCATCCACATAGG-3'。然后以获得的突变基因为模板,用overlapping的方法构建X-ORF的基因片段,设计引物如下:5'-GGACTGACGAAGGAATCCCAAAG-3'和5'-CTTTGGGATTCCTTCGTCAGTCC-3',通过设计以上引物,将发生移码突变的UUUC基因序列突变为UUC,使合成的基因片段只按照X-ORF的形式进行转录。61肽段对应基因序列的上游引物为X-ORF的上游引物,引入Sac I酶切位点:5'-CGAGCTCGTCAGTCCGAAAGAGGC-3';下游引物为X-ORF的下游引物,并且引入Pst I酶切位点:5'-AACTGCAGTTACTTCTCTAGACAT-3'。以上引物由上海英骏有限公司合成。
1.2.2基因扩增 提取H1N1亚型猪流感病毒的RNA,然后反转录合成cDNA文库,用overlapping PCR的方法扩增目的基因。反应条件均按照pfu的说明书进行,PCR产物在1%的琼脂糖凝胶中进行电泳检测,并且进行胶回收纯化。
1.2.3表达基因的克隆 PCR产物纯化后,用Pst I和Sac I进行双酶切,再将pcold-TF载体也分别用Pst I和Sac I进行双酶切。然后在T4 DNA ligase的作用下将目的基因片段与载体连接。重组质粒转化到DH5α感受态细胞中,挑取单个菌落,并进行菌液PCR鉴定,阳性样品送去上海英骏有限公司测序,序列正确的样品菌液进行质粒的提取。
1.2.4阳性重组质粒的诱导表达 将上面得到的阳性重组质粒转化到BL21(DE3)溶源菌中,挑取单个菌落于氨苄抗性LB培养基中摇菌16 h后进行菌液PCR鉴定,鉴定出阳性结果后,取20 uL阳性菌液与4 mL新的氨苄抗性LB液体培养基以1:200的体积比例在37℃进行活化,每个样品做8个重复。当OD600=0.8时,加入IPTG进行蛋白表达的诱导。为了摸索诱导剂的最佳浓度,分别加入终浓度为0.4、0.6、0.8、1.0 mmol/L的IPTG;为了摸索最佳诱导时间,15℃摇菌18、24 h,分别收获菌体。12 000×g高速离心3 min,弃掉上清,再用500 uL PBS重悬菌体,在冰上进行超声波破碎。待菌液变清澈后,12 000×g,4℃,离心20 min,将上清与沉淀分离,并用100 uL PBS将沉淀重悬。将上清与沉淀同时进行SDSPAGE检测。同时,也对pcold-TF空载体也进行了诱导表达,所有诱导表达条件与上面描述完全一致。
1.2.5蛋白的纯化 通过镍柱亲和层析方法对浓度最高的产物进行纯化。首先配制1×Ni-NTA 结合缓冲液:50 mmol/L NaH2P04,pH 8.0,300mmol/L NaCl,10 mmol/L咪唑(用于裂解和结合步骤);1×Ni-NTA 漂洗缓冲液:50 mmol/L NaH2P04,pH 8.0,300mmol/L NaCl,20 mmol/L咪唑(用于洗脱杂蛋白);1×Ni-NTA 洗脱缓冲液:50 mmol/ LNaH2P04,pH 8.0,300mmol/LNaCl,250 mmol/L咪唑(用于洗脱目的蛋白)。然后按照说明书的步骤将上清中的蛋白进行纯化,将洗脱组分分为4部分收集,并进行SDS-PAGE电泳分析各保存组分,然后按照上面摸索好的诱导表达条件和纯化条件将蛋白进行大量表达和纯化。
1.2.6小鼠多抗的制备及Western blot检测 将H1N1亚型猪流感病毒接种6 w的Balb/C小鼠,2 w后进行第二次攻毒,第二次攻毒d 8采血,并通过血凝抑制试验检测血清的抗体效价,当抗体效价达到一定水平时,以之为一抗,通过Western blot检测上面纯化的目的蛋白。
2 结果
2.1PA-X特有序列对应的基因片段的扩增 将以缺失41位氨基酸处的终止密码子的PA基因为模板进行PCR得到的重叠产物进行胶回收纯化,然后以之为模板,在X-ORF上下游引物的作用下进行overlapping PCR,PCR产物在1%的琼脂糖凝胶上进行电泳分析,结果得到了PA-X特有序列对应的183bp基因片段(图1),并进行胶回收纯化。
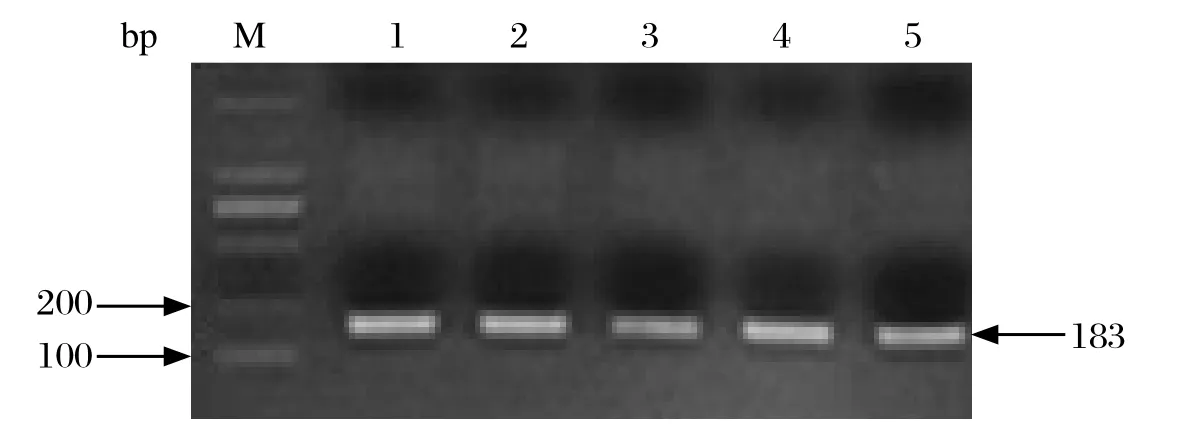
图1 重叠PCR产物电泳图Fig. 1 Electrophoretic profi le of product of overlapping PCRM: DNA分子量标准(DL2000); 1~5: PA-X特有序列的PCR产物M: DNA Marker(DL2000); 1-5: PCR products of PA-X-specifi c gene sequence
2.2阳性重组载体的菌液鉴定结果 以菌液中的重组质粒为模板,在X-ORF上下游引物的作用下进行PCR鉴定,结果得到了4个阳性克隆(图2)。取阳性克隆样品进行质粒的提取,然后将质粒测序,序列结果显示重组载体构建成功。
2.3原核表达载体的诱导表达和表达产物的SDSPAGE分析 在不同浓度的IPTG以及不同的诱导时间条件下对阳性原核表达载体进行诱导表达,表达产物进行超声波破碎,分离得到的上清和沉淀分别进行12% SDS-PAGE 分析,结果表明重组目的蛋白大部分以可溶性的上清形式存在,少量以包涵体的形式存在。IPTG的最佳诱导浓度大约为0.8mmol/L,诱导时间为24 h时,目的蛋白可以得到最大程度的表达(图3)。表达的目的蛋白约为7 kDa,标签蛋白大小约为52 kDa,结果与预期一致。
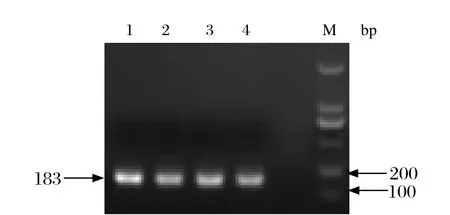
图2 阳性重组载体的菌液PCR鉴定电泳图Fig. 2 Electrophoretic profi le of bacterium solution with recombinant plasmid vectorM: DNA分子量标准(DL2000); 1~4:含有PA-X特有序列的重组载体的菌液鉴定M: DNA Marker (DL2000); 1-4: Identifi cation of prokaryotic expression vectors of PA-X-specifi c sequence in E.coli
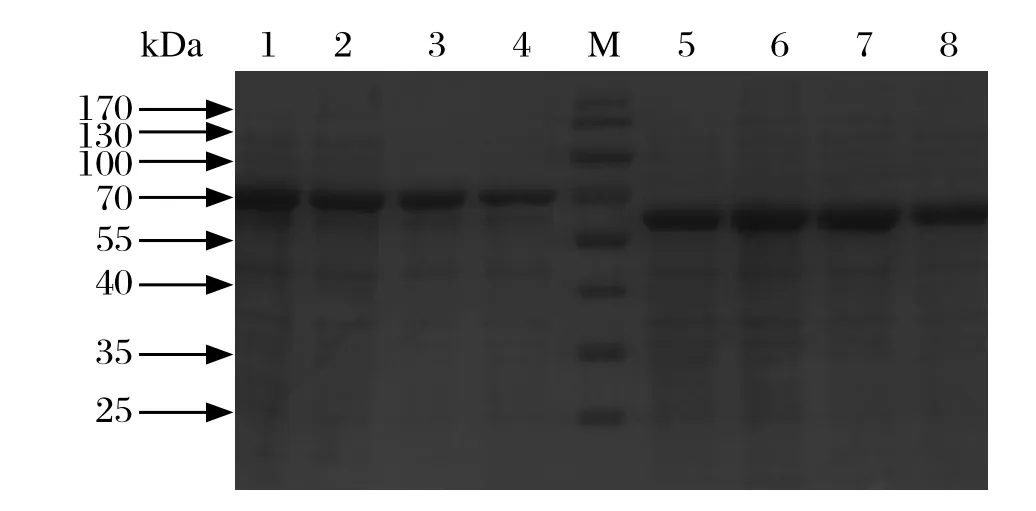
图3 诱导24 h的重组蛋白PA-X在上清中的表达SDSPAGE分析Fig. 3 Expression analysis of PA-X specifi c sequence induced for 24 h in the supernatant of E.coli by SDS-PAGEM: 蛋白分子量标准; 1~4: IPTG浓度梯度(0.4、0.6、0.8、1.0 mmol/L)的重组载体的上清; 5~8: IPTG浓度梯度(0.4、0.6、0.8、1.0 mmol/L)的空载体的上清M: Prestained Protein Marker; 1-4: The supernatant of pcold TFPA-X specifi c sequence induced by IPTG at concentration of 0.4, 0.6, 0.8, 1.0mmol/L; 5-8: The supernatant of pcold TF induced by IPTG at concentration of 0.4, 0.6, 0.8, 1.0 mmol/L
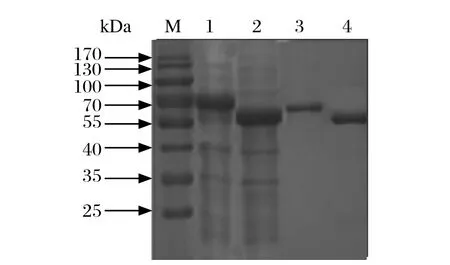
图4 重组蛋白PA-X纯化后的SDS-PAGE分析Fig. 4 SDS-PAGE analysis of the purifi ed recombinent protein PA-XM: 蛋白分子量标准; 1: 纯化前的PA-X 重组蛋白; 2: 纯化前的pcold TF; 3: 纯化后的PA-X 重组蛋白; 4: 纯化后的pcold TFM: Prestained Protein Marker; 1: The unpurifi ed PA-X recombinent protein; 2: The unpurifi ed pcold TF; 3: The purifi ed PA-X recombinent protein; 4: The purifi ed pcold TF
2.4重组蛋白的纯化鉴定 表达出的上清中的可溶性蛋白通过Ni柱纯化,结果显示洗脱缓冲液第二次洗脱出的目的蛋白纯度最高而且浓度最大,之后我们按照摸索好的诱导表达条件和纯化条件将蛋白进行大量表达和纯化(图4)。
2.5重组蛋白的免疫原性鉴定 通过血凝试验检测,二免后d8小鼠血清的抗体效价达到28,然后我们用纯化并浓缩的PA-X特有序列蛋白和TF空载体表达的蛋白跑SDS-PAGE胶,再用制得的小鼠血清为一抗,进行Western blot分析,结果发现,PA-X重组蛋白和阳性血清生成了阳性条带(图5)。这说明表达的蛋白确实含有PA-X,反过来也证明了接种H1N1亚型猪流感病毒的小鼠产生的抗PA-X的多抗具有免疫反应性。

图5 Western blot检测重组蛋白PA-XFig. 5 Western bot analysis of recombinent PA-XM: 蛋白分子量标准; 1: PA-X重组蛋白以阳性血清为一抗的Western blot结果; 2: PA-X重组蛋白以阴性血清为一抗的Western blot结果; 3: TF空载体以阳性血清为一抗的Western blot结果M: Prestained Protein Marker; 1: Western blot result (positive serum as the primary antibody) of PA-X recombinent protein; 2: Western blot result (negative serum as the primary antibody) of PA-X recombinent protein; 3: Western blot result (positive serum as the primary antibody) of pcold TF protein
3 讨论
PA-X蛋白是由Jagger等[8]在2012年发现的,他们发现在PA基因中含有一个保守的序列UCCUUUCGUC,当核糖体阅读框架移动到UUU这一密码子位置时,会发生停顿,由于密码子的兼并性,UUU和UUC对应着同一个反密码子AAG,这很容易造成核糖体往后移码一个碱基(+1 ribosomal frameshifting),从而形成一个新的开放阅读框(X-ORF),编码一种新的蛋白,命名为PA-X蛋白。PA-X蛋白分子量约为29 kDa, N末端含有与PA蛋白相同的191个氨基酸残基,因此也具有核酸内切酶的功能,而且与PA蛋白相比,功能可能会更强。PA-X的C末端则与PA蛋白不同,由X-ORF编码的61个氨基酸残基组成,分子量约为7 kDa。
Jagger 等[8]首次发现PA-X蛋白的存在,并且鉴定了PA-X能使1918年的H1N1亚型西班牙大流感病毒的毒力降低。Jiao Hu等[10]的研究成果证明PA-X蛋白可以通过抑制高致病性禽流感H5N1的复制,同时降低宿主的炎性反应程度来降低它的致病力。Khaperskyy等[12]发现PA-X蛋白可以抑制宿主的应激颗粒(SGs)的产生。所有关于PA-X的研究综合表明,PA-X蛋白可以通过调节宿主的炎性反应程度来间接降低病毒的致病力,当PA-X的表达受到抑制时,可以促进宿主的炎症反应,进而引起细胞凋亡,提高病毒的致病力[7]。
大多数情况下,X-ORF编码的肽段含有61个氨基酸残基,但是2009年甲型H1N1流感病毒、古典H1N1猪流感病毒及H1N2亚型猪流感病毒均表达41个氨基酸残基的短肽,这是由于这些病毒在大多数流感病毒均有的X-ORF的61位氨基酸处的终止密码子之前,还有一个终止密码子,这一终止密码子位于第41个氨基酸处。关于61个氨基酸的X蛋白的功能已经有相关报导[8-10],但是61肽段的X蛋白和41肽段的X蛋白在功能上有什么不同,目前为止还没有相关报道。本实验大量表达并纯化了PA-X蛋白特有的序列,为接下来对于H1N1亚型猪流感病毒的PA-X蛋白功能研究奠定了基础。
参考文献
[1] El Zowalaty M E, Bustin S A, Husseiny M I, et al. Avian influenza: virology, diagnosis and surveillance. Future Microbiol, 2013. 8(9): 1209-1227.
[2] 蒋玲艳, 王林果. 反向遗传学技术及其应用. 医学综述, 2006: 323-325.
[3] Hutchinson E C. Fodor E. Transport of the influenza virus genome from nucleus to nucleus. Viruses, 2013, 5(10): 2424-2446.
[4] Hara K, Schmidt F I, Crow M, et al. Amino acid residues in the N-terminal region of the PA subunit of influenza A virus RNA polymerase play a critical role in protein stability, endonuclease activity, cap binding, and virion RNA promoter binding. J Virol, 2006, 80(16): 7789-7798.
[5] Yuan P W, Bartlam M, Lou Z Y. Crystal structure of an avian influenza polymerase PA(N) reveals an endonuclease active site. Nature, 2009, 458(7240): 909-913.
[6] Alexandre Dias, Denis Bouvier, Thibaut Crépin. The capsnatching endonuclease of influenza virus polymerase resides in the PA subunit. Nature, 2009, 458(7240): 914-918.
[7] 谭伟, 谢芝勋. 甲型流感病毒PA蛋白新成员的研究进展.病毒学报, 2014, 30(689-693).
[8] Jagger B W, Wise H M, Kash J C, et al. An overlapping protein-coding region in influenza A virus segment 3 modulates the host response. Science, 2012, 337(6091): 199-204.
[9] Gao H, Sun Y, Hu J, et al. The contribution of PA-X to the virulence of pandemic 2009 H1N1 and highly pathogenic H5N1 avian influenza viruses. Sci Rep, 2015, 5: 8262.
[10] Hu J, Mo Y, Wang X, et al. PA-X decreases the pathogenicity of highly pathogenic H5N1 influenza A virus in avian species by inhibiting virus replication and host response. J Virol, 2015, 89(8): 4126-4142.
[11] 汪秀会, 宫晓倩, 刘晓敏, 等. 古典H1N1亚型猪流感病毒反向遗传操作平台的建立. 中国动物传染病学报, 2014, 22(6): 13-17.
[12] Khaperskyy D A, Emara M M, Johnston B P, et al. Influenza a virus host shutoff disables antiviral stressinduced translation arrest. PLoS Pathog, 2014, 10(7): e1004217.
·研究论文·
PROKARYOTIC EXPRESSION, PURIFICATION AND IDENTIFICATION OF PA-X-SPECIFIC SEQUENCE OF SWINE INFLUENZA VIRUS
GONG Xiao-qian1, RUAN Bao-yang1,2, LIU Xiao-min1, ZHANG Peng1,2, WANG Qi1, WANG Xiu-hui1, ZHOU Yan-jun1, LI Ze-jun1, TONG Wu1, ZHENG Hao1, TONG Guang-zhi1, YU Hai1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Veterinary Medicine, Shandong Agricultural University, Taian 271000, China)
Key words:Swine infl uenza virus; PA-X specifi c sequence; prokaryotic expression; purifi ed protein; Western blot
Abstract:The novel infl uenza A virus protein PA-X is a ribosomal frame-shifting product that modulates the host response and viral virulence. In the present study, PA-X protein was prokaryotically expressed, purified and characterized in order to investigate its biological functions. The PA-X coding gene was amplifi ed in RT-PCR and overlapping PCR. The prokaryotic expression vectors were constructed with the gene recombination technique and verifi ed using bacterium solution PCR and sequencing. The positive clones were transformed into E.coli BL21 (DE3) and the expressed protein was analyzed for its solubility. The PA-X products were purifi ed using nickel column chromatography. The sequences of the plasmids and open reading frames were demonstrated to be completely correct. After transformation, these plasmids expressed the expected proteins with soluble nature. Subsequently, the PA-X protein was purifi ed and used in Western blot to react with the mouse antiserum against the H1N1 swine infl uenza virus. The positive reaction between the PA-X protein and mouse antiserum was observed.
中图分类号:S852.659.5
文献标志码:A
文章编号:1674-6422(2016)01-0032-06
收稿日期:2015-07-29
基金项目:国家青年自然科学基金(31201916);上海市自然科学基金青年项目(12ZR1453500);中央级公益性科研院所基本科研业务费项目(2015JB07);中国农业科学院创新工程科研团队“动物流感病毒病原生态学”项目
作者简介:宫晓倩,女,硕士研究生,预防兽医学专业
通信作者:童光志,Email:gztong@shvri.ac.cn;于海,Email:haiyu@shvri.ac.cn

