土荆芥挥发油及其2个主要成分对玉米种子活力和根毛发育的化感效应初探
王煜,王亚男,勾洵,张红,马丹炜*
土荆芥挥发油及其2个主要成分对玉米种子活力和根毛发育的化感效应初探
王煜1,2,王亚男1,2,勾洵1,张红1,2,马丹炜1,2*
(1.四川师范大学生命科学学院,四川成都610101;2.四川师范大学细胞生物学研究室,四川成都610101)
采用培养瓶滤纸法研究土荆芥挥发油及其主要成分对伞花素(cymene)和α-萜品烯(α-terpinene)对玉米种子活力和根毛发育的化感效应.数据显示:1)土荆芥挥发油对发芽率和发芽势具有剂量依赖的抑制效应,而对伞花素和α-萜品烯的影响与对照差异不显著(P>0.05).2)挥发油和对伞花素对玉米种子活力有显著抑制(P<0.05),对伞花素的抑制效应为挥发油的17.92%;α-萜品烯对玉米种子活力有显著促进(P<0.05),当对伞花素和α-萜品烯联合作用时,对伞花素削弱了α-萜品烯的促进效应.3)挥发油对玉米根毛发育有明显抑制现象,玉米根毛弯曲缠结,数量减少甚至消失;对伞花素和α-萜品烯对根毛长度有显著促进(P<0.05).结果表明,在土荆芥挥发油对玉米种子萌发和根毛发育的化感胁迫中,对伞花素和α-萜品烯的作用较弱;对伞花素在挥发油抑制种子活力方面具有一定的贡献.
土荆芥挥发油;对伞花素;α-萜品烯;化感效应
原产南美洲的入侵植物土荆芥(Chenopodiumam brosioides L.)[1]近年来已经引起了国内外学者的关注[2-8].化感作用是土荆芥成功入侵的机制之一,土荆芥可通过淋溶[2-4]、挥发[5-7]、根系分泌[8]、残株腐解[9]等途径向周围环境释放化感物质,排挤和压制周围土著植物.在土荆芥挥发油的作用下,受体植物根细胞受到氧化胁迫,膜脂过氧化产物丙二醛含量增加,抗氧化酶活性降低[5],根细胞出现各种类型的染色体畸变,甚至发生细胞凋亡[6],最终导致植物的生长发育受到抑制[7].土荆芥挥发油成分较为复杂,随产地变化,但各地的土荆芥挥发油中普遍存在对伞花素和α-萜品烯[10-11].目前,有关土荆芥挥发油主要成分化感潜力以及它们在土荆芥挥发油化感效应中的生态学贡献尚不清楚.本研究以广泛种植于土荆芥入侵地的重要农作物玉米为受体植物,探讨了土荆芥挥发油及其2种主要成分对伞花素和α-萜品烯对玉米种子萌发和根毛生长的化感效应,旨在了解对伞花素和α-萜品烯在土荆芥挥发油化感作用的地位,为后续深入研究土荆芥化感作用机制提供依据.
1 材料和方法
1.1供试材料土荆芥植株采集于成都郊区荒地;对伞花素标准品(质量分数99.5%,德国Ehrenstoefer Quality公司)、α-萜品烯标准品(质量分数90%,国药集团化学试剂有限公司)均购自成都奥克试剂公司.受体植物玉米种子雅玉26#,购自成都市种子市场.
1.2试验方法
1.2.1 挥发油的提取及其主要成分含量测定将采集的土荆芥植株剪成小段,用水蒸气蒸馏法提取挥发油,无水Na2SO4干燥后置于4℃冰箱保存备用.
经四川大学测试中心鉴定,α-萜品烯和对伞花素是供试挥发油的主要成分.采用GC-MS单点法测得土荆芥挥发油中对伞花素的含量为156 mg/mL,气象色谱法测得α-萜品烯在土荆芥挥发油中的含量为151 mg/mL.
1.2.2 化感作用的生物测定挑选颗粒饱满、大小均一的玉米种子,用0.5%KMnO4浸泡10 min消毒,蒸馏水清洗6次以上.种子胚朝上均匀摆放于垫有双层滤纸的培养瓶(外径8 cm,高9 cm)中,加蒸馏水浸没种子2/3.共设置4个处理组:挥发油处理组(V)、对伞花素处理组(C)、α-萜品烯处理组(AT),对伞花素+α-萜品烯混合处理组(M).由预实验确定土荆芥挥发油处理剂量,再根据挥发油中α-萜品烯和对伞花素的含量确定二者的处理剂量,每组设置5个处理梯度(表1).准确取土荆芥挥发油、对伞花素、α-萜品烯滴入瓶内,立即旋紧瓶盖,置于25℃培养箱暗培养.每个处理50粒种子,重复3次,以蒸馏水为对照.
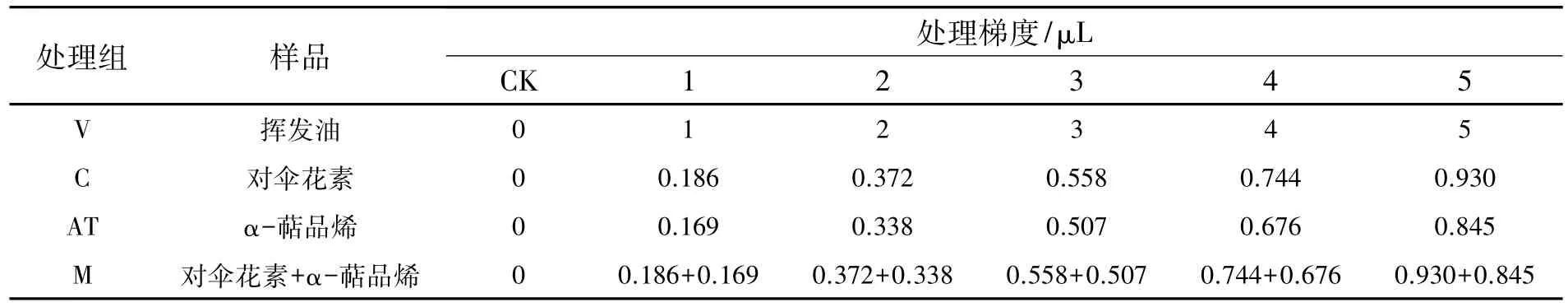
表1 土荆芥挥发油和两个主要成分的处理剂量Table 1The treatment doses of the volatile oil from Chenopodium ambrosioides L.and two main components
参照文献[12]方法,每天定时观察发芽情况并计数,视胚根突破种皮为发芽,连续3 d发芽种子数无增加视为发芽完全.3 d时测定幼苗高度,5 d后切取主根根端后1 cm左右根段,在体式显微镜(上海XTZ-E)下观察根毛形态并拍照,用显微测量软件测量根毛长度.每组处理测量5个根段,每根段上测量10根根毛,计算根毛的平均长度,重复3次.
1.3数据统计与分析根据文献[12]计算玉米种子的发芽率(GR)和发芽势(GP):
GR=(发芽种子数/供试种子数)×100%,GP=(试验天数发芽种子数/供试种子数)×100%.
在该实验条件下,玉米种子的萌发十分迅速,在暗培养2 d时达到发芽高峰期,培养至3 d后不再萌发,故在发芽势公式中,本实验规定天数为2.参考文献[13-14],计算玉米种子简易活力指数(SVI):
SVI=发芽率×幼苗长度×100%.
化感效应敏感指数(RI)可表示化感作用强度大小,其绝对值大小反映了化感作用的强弱,计算方法参照文献[15]:

式中,C为对照值,T为处理值.
按照文献[16]计算挥发油、对伞花素、α-萜品烯及其混合物的化感综合指数(SE).SE是供体对同一受体多个测试项目的化感效应敏感指数的算术平均值.
采用SPSS 17.0软件进行相关性分析、方差分析和多重比较检验.
2 结果与分析
2.1土荆芥挥发油及其2种主要成分对玉米种子活力的影响种子活力与种子萌发过程中的种子发育情况有关,因此,常采用发芽率、发芽势、简易活力指数等指标来衡量不同因子对玉米种子活力的影响.
表2的数据显示,随着土荆芥挥发油处理剂量的增加,玉米种子的发芽率和发芽势均呈下降趋势,表明土荆芥挥发油对玉米种子的萌发具有较为强烈的抑制作用,且抑制效应随处理剂量的升高而显著增强(P<0.01).当挥发油剂量大于3 μL时,发芽率和发芽势均比对照显著降低(P<0.05);对伞花素、α-萜品烯以及二者联合作用则对玉米种子的发芽率和发芽势无显著影响(P>0.05).
在V组中,玉米种子简易活力指数与挥发油处理剂量呈显著负相关(Pearson系数=-0.954,P<0.01),随着处理剂量增大,简易活力指数急剧下降,其中5 μL处理简易活力指数只有对照组的13.93%;对伞花素对种子活力的影响与挥发油相似,也表现出显著的抑制效应,但下降幅度较为平缓,与剂量无明显相关性(Pearson系数=-0.410,P>0.05);AT组和M组的简易活力指数均大于对照,其中AT组简易活力指数具有剂量依赖性(Pearson系数=0.759,P<0.01),梯度5的简易活力指数为对照的166.73%.M组则与剂量无明显关系,在各处理梯度中,梯度2和3的简易活力指数升高较大,与对照具有显著差异(P<0.05).
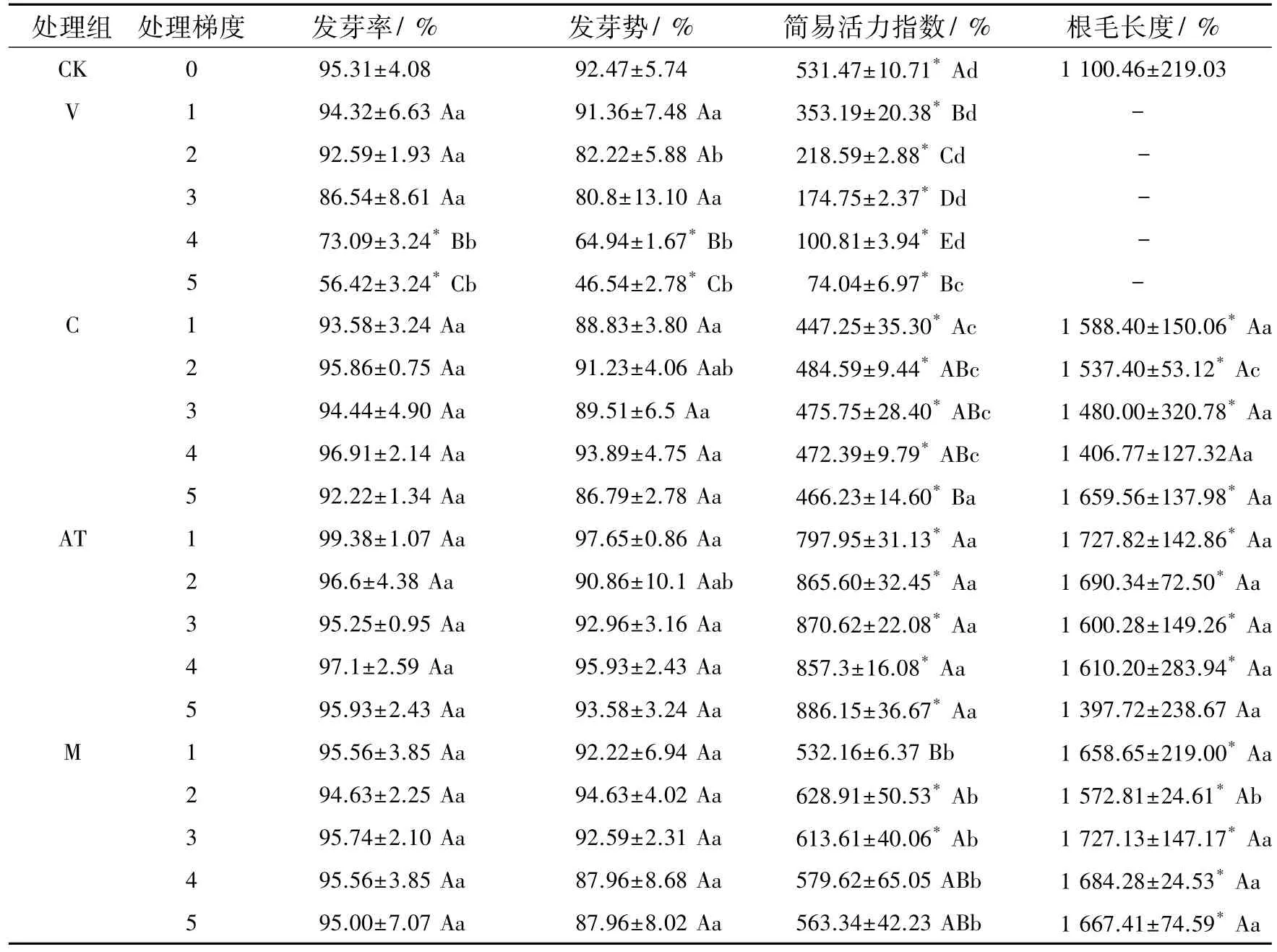
表2 土荆芥挥发油及其两种主要成分对玉米种子活力和根毛发育的影响Table 2The effects of volatile oil from Chenopodium ambrosioides L.and its main components on maize seed germinationand root hair development
2.2土荆芥挥发油及其2种主要成分对玉米根毛发育的影响形态学观察表明,V组玉米根毛生长明显受到抑制,较低剂量(1 μL)处理时根毛变短变细,数量减少并出现弯曲、缠结现象,随着处理剂量增加,这种现象更较明显,在5 μL处理时,根毛几乎完全消失;对照相比,其他3个处理组根毛发育较好,根毛数量有所增加,根毛长度增长,直径增大,不同成分处理和不同处理梯度之间的根毛形态无显著变化.
由于V组玉米根根毛生长受到严重抑制,根毛缠结,无法准确测定其长度,故本研究仅对C组、AT组和M组的根毛长度进行了统计分析(表2).与对照相比,对伞花素、α-萜品烯以及二者联合作用均显著促进了玉米根毛生长(P<0.05),但不同梯度之间无显著差异(P>0.05).3组处理对根毛长度的促进效应依次是M组,AT组和C组.
2.3挥发油、对伞花素和α-萜品烯的化感综合效应与挥发油相比,对伞花素和α-萜品烯的化感作用强度相对较弱(表3).在种子萌发阶段,尽管挥发油具有较强的化感效应,这种抑制在处理剂量较大时方能显现出来.一旦胚根和胚芽突破种皮后,玉米幼苗对土荆芥挥发油及其2种主要成分化感作用的敏感性增强,挥发油抑制了幼苗的生长过程(SE=0.653),对伞花素对土荆芥挥发油的这种化感抑制效应具有一定的贡献率,大约占挥发油化感抑制效应的17.92%,但是α-萜品烯对幼苗的生长则表现出明显的化感促进效应.当二者联合作用时,α-萜品烯的促进效应被对伞花素削弱,化感综合效应只有α-萜品烯单独作用时的22.74%;挥发油对玉米根毛的发育具有较大的抑制效应,而2种主要成分则表现为促进作用.综合分析可知,α-萜品烯对玉米种子活力和根毛发育的化感效应大于对伞花素的化感效应.
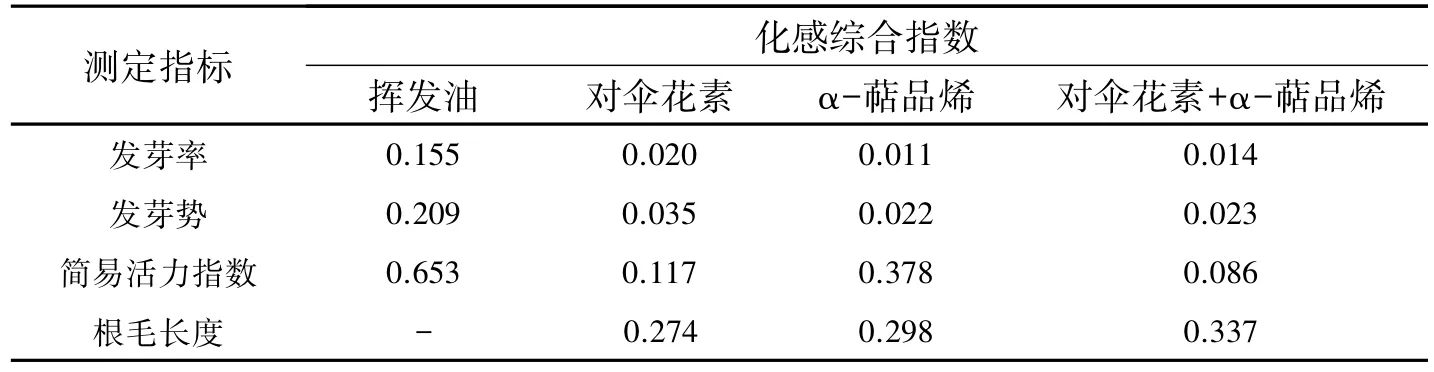
表3 土荆芥挥发油及其2种主要成分化感效应的比较Table 3The comparison of allelopathic effects of volatile oil from Chenopodium ambrosioides L.and its main components on maize
3 讨论
不论何种途径释放的植物化感物质最终都将进入土壤中,其中挥发性化感物质可直接进入或经雨雾淋溶进入附近土壤,使得邻近植物种子难以萌发[17].王晶蓉等[7]研究表明,土荆芥挥发油对小麦(Triticum aestivum L.)、油菜(Brassica campestris L.)、莴苣(Lactuca sativa L.)的种子萌发具有延迟效应和抑制效应.本研究结果表明,土荆芥挥发油显著抑制了玉米种子的发芽率和发芽势,并表现出剂量依赖效应,与上述实验结果相似.但是,挥发油的主要成分对伞花素和α-萜品烯对玉米种子萌发的化感效应较弱,与对照无显著差异.由此可见,对伞花素和α-萜品烯在土荆芥挥发油抑制玉米种子萌发中所起的作用甚微.种子活力是一个综合性状,受遗传和环境的影响[18],土荆芥挥发油主要成分对伞花素和α-萜品烯虽然对玉米种子萌发影响较小,但是对玉米的种子活力具有明显的影响.其中对伞花素的影响与挥发油的作用效应一致,均表现为抑制效应,并弱于挥发油(对伞花素的抑制效应约为挥发油的17.92%);α-萜品烯及其与对伞花素的混合物对玉米种子活力均表现为促进效应.因此,α-萜品烯和对伞花素在对玉米种子活力的化感效应相反,α-萜品烯的化感效应为对伞花素的3.23倍,二者联合作用时,对伞花素削弱了α-萜品烯的促进效应.
根毛是植物根尖成熟区表皮细胞外壁形成的突起,是植株吸收水分和营养物质的重要部位,对外界环境中影响因子的响应十分敏感.当外界环境中水分[19]、矿质元素[20]、植物激素[21-22]、CO2浓度[23]等发生变化时,根毛生长明显受到影响.化感物质也会影响到根毛的发育,如化感物质8-G甲氧基二氢血根碱对莴苣幼苗根毛的长度和数量有显著的抑制作用[24],黄花蒿水浸提液对小麦根毛的生长具有抑制作用[25].本研究中,土荆芥挥发油对玉米根毛发育具有显著的抑制效应,而α-萜品烯和对伞花素以及二者的混合物都表现为促进效应.
土荆芥挥发油是一种成分相当复杂的混合物,其化感抑制效应可能是其中一种或多种化学成分与受体植物复杂互作的结果.在本研究中,其主要成分对伞花素、α-萜品烯以及二者的混合物表现出的化感作用与挥发油并不一致,仅对伞花素在对种子活力的抑制效应中具有一定的贡献.因此,尚需进一步筛查挥发油中对玉米种子萌发和根毛生长化感作用的主效化感物质.
[1]徐海根,强胜.中国外来入侵物种编目[M].北京:中国环境科学出版社,2004:91-92.
[2]JIMENEZ-OSORNIO FMVZJ,KUMAMOTO J,WASSER C.Allelopathic activity of Chenopodium ambrosioides L.[J].Biochemical Systematics and Ecology,1998,24(3):195-205.
[3]刘长坤,邓洪平,尹灿,等.入侵植物土荆芥不同器官化感作用的差异研究[J].北方园艺,2010,6:41-44.
[4]许桂芳,周修任,王鸿升,等.外来植物土荆芥的化感作用潜力[J].江苏农业学报,2011,27(1):223-225.
[5]胡琬君,马丹炜,王亚男,等.土荆芥挥发油对蚕豆根尖细胞的氧化损伤[J].应用生态学报,2012,23(4):1077-1082.
[6]胡琬君,马丹炜,王亚男,等.土荆芥挥发油对蚕豆根尖细胞的化感潜力[J].生态学报,2011,31(13):3684-3690.
[7]王晶蓉,马丹炜,唐林.土荆芥挥发油化感作用的初步研究[J].西南农业学报,2009,22(3):777-780.
[8]李安奇,王亚男,张红,等.大豆根边缘细胞对土荆芥组培根分泌物的响应[J].生态环境学报,2012,21(1):84-87.
[9]张红,王亚男,廖颖,等.土荆芥去精油残渣腐解液化感作用的初步研究[J].西南农业学报,2010,23(2):547-550.
[10]魏辉,李兵,田厚军,等.福建省不同产地及不同生育期土荆芥精油化学成分的比较[J].植物资源与环境学报,2010,19(3):62-67.
[11]杨再波,毛海立,康文艺,等.土荆芥果实挥发油成分及抗氧化能力[J].光谱实验室,2010,27(5):1760-1763.
[12]程红炎,龙春林.种子生物学研究指南[M].北京:科学出版社,2005:57-58.
[13]屈长荣.种子检验技术[M].天津:天津大学出版社,2011:129.
[14]袁瑞玲,向振勇,杨文忠,等.云南蓝果树种子休眠与萌发特性[J].林业科学研究,2013,26(3):384-388.
[15]WILLIAMSON G B,RICHARDSON D.Bioassays for allelopathy[J].J Chem Ecology,1998,14(1):181-187.
[16]沈慧敏,郭鸿儒,黄高宝.不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J].应用生态学报,2005,16(4): 740-743.
[17]王朋,王莹,孔垂华.植物挥发性单萜经土壤载体的化感作用:以三裂叶豚草(Ambrosia trifida L.)为例[J].生态学报,2008,28(1):62-68.
[18]佟汉文,刘易科,朱展望,等.基因型和环境对小麦种子活力的影响[J].麦类作物学报,2012,32(6):1167-1170.
[19]胡田田,康绍忠,原丽娜,等.不同灌溉方式对玉米根毛生长发育的影响[J].应用生态学报,2008,19(6):1289-1295.
[20]曹秀,夏仁学,张德健,等.水培条件下营养元素对枳幼苗根毛发育及根生长的影响[J].应用生态学报,2013,24(6): 1525-1530.
[21]JONES A R,KRAMER E M,KNOX K,et al.Auxin transport through non-hair cells sustains root-hair development[J].Nature Cell Biology,2008,11(1):78-84.
[22]RAHMAN A,HOSOKAWA S,OONO Y,et al.Auxin and ethylene response interactions during Arabidopsis root hair development dissected by auxin influx modulators[J].Plant Physiology,2002,130(4):1908-1917.
[23]NIU Y F,JIN G L,CHAI R S,et al.Responses of root hair development to elevated CO2[J].Plant Signaling and Behavior,2011,6(9):1414-1417.
[24]丁兰,张丽,李静,等.8-G甲氧基二氢血根碱化感潜能的评估[J].广西植物,2014,34(1):84-88.
[25]王硕,慕小倩,杨超,等.黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J].西北农林科技大学学报(自然科学版),2006,34(6):108-111.
Allelopathy of Chenopodiumam brosioides L.Volatile Oil and Its Main Components on Seed Viabitity and Root Hair Growth of Maize
WANG Yu1,2,WANG Yanan1,2,GOU Xun1,ZHANG Hong1,2,MA Danwei1,2
(1.College of Life Science,Sichuan Normal University,Chengdu 610101,Sichuan; 2.Cell Biology Laboratory,Sichuan Normal University,Chengdu 610101,Sichuan)
Allelopathy of seed vigour and root hair growth of maize induced by volatile oil from Chenopodium ambrosioides was studied by filter paper culture method.The results show that:1)Chenopodium ambrosioides volatile oil had dose dependent inhibition effect on germination rate and germination potential of maize seed(P<0.05)while cymene and α-terpinene had no significant effect compared in control(P>0.05);2)Volatile oil and cymene had decreased the seed viabitity of maize(P<0.05).The inhibitory effect of cymene was 17.92%of that of volatile oil;α-terpinene had a promoting effect on the seed vigor,but the effect was weaken in cymene+α-terpinene group;3)The volatile oil had obvious inhibition effect on maize root hair growth such as bending maize root hair tangles,decline or even vanishing.Both cymene and α-terpinene had significantly increased the root hair length(P<0.05).In conclusion,the result shows that the allelopathy of cymene and α-terpinene were relatively weaker than that of Chenopodium ambrosioides volatile oil in maize seed germination and root hair development;cymene had a certain contribution in the inhibition of volatile oil on seed viabitity.
Chenopodium ambrosioides volatile oil;cymene;α-terpinene;allelopathy
S513
A
1001-8395(2016)03-0403-05
10.3969/j.issn.1001-8395.2016.03.018
(编辑陶志宁)
2014-12-23
国家自然科学基金(31370549)、四川省教育厅重点项目(13ZA0143和13ZA0144)和四川省教育厅一般项目(15ZB0025)
*通信作者简介:马丹炜(1963—),女,教授,主要从事细胞生物学和植物化感作用的研究,Email:danwei10ma@163.com

