铝碳酸镁对实验性胃溃疡大鼠血管内皮生长因子及前列腺素的影响
雷浩强,岳 辉
1.中山市黄圃人民医院消化内科,广东 中山 528429; 2.南方医科大学附属第三医院消化内科
其他论著
铝碳酸镁对实验性胃溃疡大鼠血管内皮生长因子及前列腺素的影响
雷浩强1,岳 辉2
1.中山市黄圃人民医院消化内科,广东 中山 528429; 2.南方医科大学附属第三医院消化内科
目的 研究铝碳酸镁对实验性胃溃疡大鼠血管内皮生长因子(VEGF)及前列腺素(PG)的影响。方法 选择SD大鼠40只作为实验动物,随机分为假手术组、模型组、铝碳酸镁低剂量干预组、铝碳酸镁高剂量干预组,模型组和干预组均采用醋酸腐蚀法建立胃溃疡模型,低剂量铝碳酸镁干预组给予1 ml (80 mg·kg-1·d-1) 铝碳酸镁混悬液灌胃,高剂量铝碳酸镁干预组给予1ml 120 mg·kg-1·d-1)铝碳酸镁混悬液灌胃。治疗后14 d,观察溃疡面积、溃疡抑制率、血清和胃黏膜组织VEGF(120 mg·kg-1·d-1),表皮生长因子(EGF)、前列腺素E2(PGE2)、环氧化酶2 (COX-2)的含量。结果 干预组大鼠溃疡面积、溃疡指数均值均明显低于模型组(P<0.05);铝碳酸镁高剂量组溃疡面积、溃疡指数均值明显低于铝碳酸镁低剂量组,抑制率明显高于铝碳酸镁低剂量组(t=9.066、 12.846,P<0.05);模型组大鼠的血清VEGF、EGF、PGE2含量显著低于假手术组(P<0.05),干预组大鼠的血清VEGF、EGF、PGE2含量显著高于模型组(P<0.05),铝碳酸镁高剂量组血清VEGF、EGF、PGE2明显高于铝碳酸镁低剂量组(P<0.05);模型组大鼠的胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量显著低于假手术组(P<0.05),干预组大鼠的胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量显著高于模型组(P<0.05),铝碳酸镁高剂量组胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量明显高于铝碳酸镁低剂量组(P<0.05)。结论 铝碳酸镁能够缩小实验性胃溃疡大鼠的溃疡面积,增加VEGF、EGF、PG的生成是铝碳酸镁发挥治疗作用的分子途径,且高剂量铝碳酸镁干预效果更好。
铝碳酸镁;胃溃疡;血管内皮生长因子;前列腺素
胃溃疡是消化系统常见疾病,以上腹部疼痛为主要临床症状,病情严重者可引起消化道穿孔或消化道出血等严重并发症。胃溃疡的发病机制是胃酸分泌过多、幽门螺旋杆菌(H.pylori)感染及胃黏膜屏障作用减弱,质子泵抑制剂抑酸联合胃黏膜保护剂是临床治疗该病的主要方法。铝碳酸镁是新型的胃黏膜保护剂,被广泛用于胃溃疡的治疗,能够增强胃黏膜的屏障功能,但是关于铝碳酸镁增强胃黏膜屏障功能的分子机制尚未明确[1]。由环氧化酶2 (Cyclooxygenase-2, COX-2)催化合成的前列腺素(PG)是构成胃黏膜局部屏障的重要分子,而血管内皮生长因子(vascular endothelial growth factor, VEGF)、表皮生长因子(epithelial growth factor, EGF)则是溃疡局部自我修复的重要分子[2]。本文通过建立实验性胃溃疡大鼠模型的方法,探讨铝碳酸镁对实验性胃溃疡大鼠VEGF及PG的影响。
1 材料与方法
1.1 实验材料 选择清洁级雄性SD大鼠40只作为实验动物,体质量240~280 g,由大学实验动物中心代为采购和饲养(动物许可证20151215);全自动生化分析仪:日本日立7600型;微量离心机:美国Thermo Scientific公司Heraeus Fresco 21型;光学显微镜:日本Nikon公司 Eclipse 80I型;铝碳酸镁:拜耳医药公司保健有限公司,批准文号:国药准字H20013410,规格0.5 g×20粒;VEGF、EGF、前列腺素E2(PGE2)试剂盒均购自北京晶美生物工程有限公司;RNA抽提及PCR检测试剂盒购自Promega公司。
1.2 实验方法
1.2.1 实验分组及模型制作方法:实验动物随机分为假手术组、模型组、铝碳酸镁低剂量干预组、铝碳酸镁高剂量干预组,随机选择10只大鼠作为假手术组,剩余30只大鼠全部用于胃溃疡大鼠模型制作,方法如下:大鼠禁食24 h后按3 ml/kg腹腔注射10%水合氯醛,麻醉后将大鼠摆放为仰卧位,做腹正中切口后显露胃,在胃前壁近幽门处用浸润有100%冰醋酸、直径5 mm圆形滤纸接触2次,每次30 s,接触时应避开血管,而后用棉签吸尽冰醋酸、生理盐水冲洗后逐层缝合切口。制模后3 d,取出模型组大鼠麻醉后切开腹腔,沿胃大弯剪开,见胃小弯后壁有典型的黏膜缺损,周围黏膜水肿,表面覆白苔,则提示实验性大鼠胃溃疡模型构建成功。假手术组仅做腹正中切口和显露胃,在胃前壁近幽门处用浸润有生理盐水的圆形滤纸接触2次,每次30 s。
1.2.2 治疗方法:造模后3 d,模型组给予1 ml生理盐水灌胃,铝碳酸镁低剂量干预组给予1 ml (80 mg·kg-1·d-1)铝碳酸镁混悬液灌胃,铝碳酸镁高剂量干预组给予1ml (120 mg·kg-1·d-1)铝碳酸镁混悬液灌胃。上午、下午分别给药1次,连续治疗14 d。
1.2.3 溃疡面积测定:最后一次灌胃治疗后禁食24 h,断头处死大鼠并打开腹腔,解剖得到胃后沿胃大弯剪开,生理盐水漂洗后将胃黏膜展平并铺在平板上,滤纸吸干后肉眼观察冰醋酸腐蚀处的形态、范围,用游标卡尺测量溃疡的最大长径以及与之相垂直的最大宽径,计算溃疡面积=长径×宽径,溃疡抑制率(%)=(1-干预组溃疡指数均值/模型组溃疡指数均值)×100%[3]。
1.2.4 血清标本采集及指标检测方法:断头法处死大鼠后立即收集大鼠腹主动脉血6 ml,3 000 r/min离心10 min,分离得到血清标本后保存在低温冰箱。检测时,取出血清标本在室温解冻,采用酶联免疫吸附试剂盒测定VEGF、EGF、PGE2的含量。
1.2.5 胃黏膜标本采集及指标检测方法:测定胃黏膜溃疡的面积后,将胃黏膜组织剪成大小相当的组织块,在液氮中迅速冷冻后保存在低温冰箱。检测时,取出胃黏膜标本,采用RNA抽提试剂盒提取组织中的RNA,反转录得到cDNA后采用PCR检测试剂盒测定VEGF、EGF、COX-2、PGE2 mRNA含量。
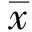
2 结果
2.1 溃疡面积及溃疡抑制率 干预组大鼠溃疡面积、溃疡指数均值均明显低于模型组(P<0.05);铝碳酸镁高剂量组溃疡面积、溃疡指数均值明显低于铝碳酸镁低剂量组,抑制率明显高于铝碳酸镁低剂量组(P<0.05,见表1)。
2.2 血清指标 4组大鼠的血清VEGF、EGF、PGE2含量比较差异有统计学意义(P<0.05);模型组大鼠的血清VEGF、EGF、PGE2含量显著低于假手术组,干预组大鼠的血清VEGF、EGF、PGE2含量显著高于模型组(P<0.05),铝碳酸镁高剂量组血清VEGF、EGF、PGE2明显高于铝碳酸镁低剂量组(P<0.05,见表2)。
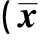


组别例数溃疡面积(mm2)溃疡指数均值抑制率(%)模型组1018.49±2.1813.21±2.36-低剂量组1010.28±1.96①10.32±1.24①21.88±3.24高剂量组104.36±0.65①②4.58±0.67①②65.33±7.15统计值 12.84213.12517.504P值 0.0000.0000.000
注:与模型组比较,t=4.668、3.428、19.642、18.001, ①P<0.05;与铝碳酸镁低剂量组比较,t=9.066、12.846, ②P<0.05。
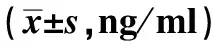

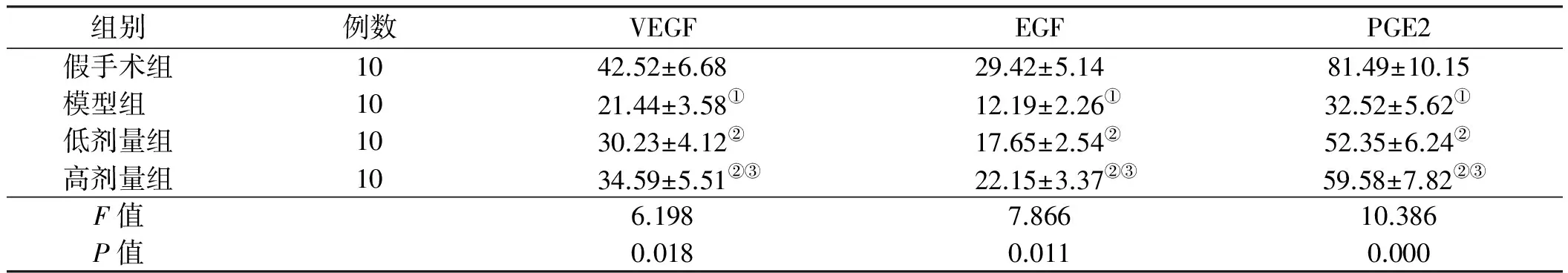
组别例数VEGFEGFPGE2假手术组1042.52±6.6829.42±5.1481.49±10.15模型组1021.44±3.58①12.19±2.26①32.52±5.62①低剂量组1030.23±4.12②17.65±2.54②52.35±6.24②高剂量组1034.59±5.51②③22.15±3.37②③ 59.58±7.82②③F值 6.1987.86610.386P值 0.0180.0110.000
注:与假手术组比较,t=8.796、9.704、13.347, ①P<0.05;与模型组比较,t=5.093,、5.078、7.467、6.329、7.762、8.886, ②P<0.05;与铝碳酸镁低剂量组比较,t=2.004、3.372、2.285, ③P<0.05。
2.3 胃黏膜指标 4组大鼠的胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量差异有统计学意义(P<0.05);模型组大鼠的胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量显著低于假手术组(P<0.05),干预组大鼠的胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量显著高于模型组(P<0.05),铝碳酸镁高剂量组胃黏膜中VEGF、EGF、PGE2、COX-2 mRNA含量明显高于铝碳酸镁低剂量组(P<0.05,见表3)。
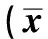


组别例数VEGFmRNAEGFmRNA PGE2mRNA COX⁃2mRNA假手术组101.00±0.261.00±0.241.00±0.211.00±0.12模型组 100.35±0.08①0.41±0.06①0.36±0.09①0.33±0.07①低剂量组100.61±0.12②0.62±0.11②0.54±0.12②0.50±0.12②高剂量组100.75±0.16②③0.78±0.14②③0.68±0.15②③0.64±0.15②③F值5.9447.1826.96810.338P值0.0210.0090.0160.000
注:与假手术组比较,t=7.556、7.542、8.858、15.251, ①P<0.05;与模型组比较,t=5.701、7.826、3.795、3.870、7.701、9.338、5.785、5.992, ②P<0.05;与铝碳酸镁低剂量组比较,t=2.214、3.352、2.305、2.305, ③P<0.05。
3 讨论
胃溃疡是消化系统常见的疾病之一,近年来发病率呈升高趋势。该病的发病原因是胃酸、H.pylori等攻击因素增强,而胃黏膜屏障等保护因素减弱[4]。在临床实践中,治疗胃溃疡的主要思路是通过质子泵抑制剂减少胃酸分泌、抗生素联合使用根除H.pylori以及胃黏膜保护剂增强黏膜屏障功能。铝碳酸镁是一类新型的胃黏膜保护药物和抗酸药物,能够中和胃酸、吸附胃蛋白酶并增强胃黏膜屏障的保护功能[5]。本研究中,我们通过醋酸腐蚀法建立胃溃疡实验大鼠模型,干预后14 d能够观察到明显的溃疡病灶,而在给予铝碳酸镁治疗后的溃疡面积显著缩小,提示铝碳酸镁对胃溃疡病灶具有保护作用,能够促进溃疡创面的修复。
目前,关于铝碳酸镁治疗胃溃疡的分子机制尚未完全明确,胃溃疡局部受到铝碳酸镁调节的分子也未阐明。PGE2是胃黏膜局部中的保护因素,具有多种生物学功能。一方面,PGE2能够增加胃黏膜的血流量、增加血管通透性及腺体黏液的分泌,进而增强局部黏膜屏障功能[6];另一方面,PGE2能够促进胃黏膜上皮细胞再生、诱导黏膜基底细胞向表面移行,进而促进溃疡面的自身修复[7]。此外,新近的研究还证实PGE2对胃酸的分泌具有抑制作用,对氧自由基和炎症介质等攻击因素具有清除作用[8]。本研究中,模型组大鼠血清中PGE2的含量显著低于假手术组,干预组大鼠血清中PGE2的含量显著高于模型组,铝碳酸镁高剂量组大鼠血清中PGE2的含量明显高于铝碳酸镁低剂量组。COX-2是催化花生四烯酸合称为前列腺素的限速酶,胃黏膜局部的COX-2是催化PGE2合成的关键酶[9],本研究中,模型组大鼠胃黏膜组织中COX-2及PGE2 mRNA含量显著低于假手术组,干预组大鼠胃黏膜组织中COX-2及PGE2 mRNA含量显著高于模型组,铝碳酸镁高剂量组大鼠胃黏膜组织中COX-2及PGE2 mRNA含量明显高于低剂量组。提示COX-2表达减少以及PGE2合成不足与胃溃疡的发生有关,铝碳酸镁能够增加胃黏膜内COX-2的表达以及PGE2的合成,进而通过PGE2所介导的生物学作用来保护胃黏膜、促进溃疡修复,而且表现出与剂量依赖性关系。
胃溃疡的修复和愈合过程是多种细胞因子与细胞外基质相互作用的复杂过程。VEGF是体内促新生血管生成功能最强大的细胞因子,在溃疡愈合和修复的过程中,局部黏膜组织中表达的VEGF能够增加新生血管数据并促进溃疡愈合[10];表皮生长因子是具有多种促生长效应的细胞因子,与EGFR结合后能够促进胃黏膜上皮细胞的生长并完成对溃疡面的修复[11]。当VEGF、EGF表达不足时,会影响溃疡愈合并造成难治性溃疡的发生。我们对大鼠血清和胃黏膜组织中VEGF、EGF含量的分析证实:模型组大鼠血清及胃黏膜组织中VEGF、EGF的含量显著低于假手术组,干预组大鼠血清及胃黏膜组织中VEGF、EGF的含量显著高于模型组,铝碳酸镁高剂量组大鼠血清及胃黏膜组织中VEGF、EGF的含量铝碳酸镁低剂量组,国内外学者也有类似的文献报道[12-13],提示VEGF、EGF的表达减少与胃溃疡的发生有关,铝碳酸镁能够增加胃黏膜内VEGF、EGF的合成,进而通过VEGF、EGF所介导的生物学作用来促进溃疡修复,且呈现出与剂量相关性。
本研究表明,铝碳酸镁能够缩小实验性胃溃疡大鼠的溃疡面积,抑制溃疡发生,增加VEGF、EGF、前列腺素的生成是铝碳酸镁发挥治疗作用的分子途径,且高剂量干预效果明显好于低剂量。需要指出的是,本文仅仅是动物实验研究,临床是否有类似的效果还有待于进一步的探索与验证。
[1]Safaeian L, Sajjadi SE, Javanmard SH, et al. Antihypertensive and antioxidant effects of hydroalcoholic extract from the aerial parts of Kelussia odoratissima Mozaff. in dexamethasone-induced hypertensive rats [J]. Adv Biomed Res, 2016, 5: 25.
[2]陈璐, 杨春敏. 持续正加速度暴露对实验性胃溃疡大鼠胃黏膜EGF及EGFR的影响[J]. 胃肠病学和肝病学杂志, 2014, 23(3): 266-269. Chen L, Yang CM. The effect of repeated positive acceleration exposures on the EGFR and EGF in rats experimental gastric ulcer [J]. Chin J Gastroenterol Hepatol, 2014, 23(3): 266-269.
[3]魏娜, 谭银丰, 魏睛, 等. 高良姜不同提取部位对实验性胃溃疡的影响及作用机理研究[J]. 海南医学院学报, 2015, 21(2): 158-160. Wei N, Tan YF, Wei J, et al. Effect of different extraction parts of galangal on experimental gastric ulcer [J]. Journal of Hainan Medical College, 2015, 21(2): 158-160.
[4]Bastaki SM, Al Ahmed MM, Al Zaabi A, et al. Effect of turmeric on colon histology, body weight, ulcer, IL-23, MPO and glutathione in acetic-acid-induced inflammatory bowel disease in rats [J]. BMC Complement Altern Med, 2016, 16: 72.
[5]刘兆远, 胡靖雪. 铝碳酸镁联合奥美拉唑治疗胃溃疡48例临床观察[J]. 中国实用内科杂志, 2015, 35(S1): 156-157. Liu ZY, Hu JX. Clinical observation of 48 cases of hydrotalcite combined with omeprazole in treatment of gastric ulcer [J]. Chinese Journal of Practical Internal Medicine, 2015, 35 (Suppl 1): 156-157.
[6]向华. 铝碳酸镁对大鼠胃黏膜前列腺素E2水平及环氧合酶-2表达的影响研究[J]. 中国药物与临床, 2013, 13(6): 733-735. Xiang H. Effect of Aluminum magnesium carbonate on the prostaglandin E2 level and an enzyme called cyclooxygenase 2 expression in rat gastric mucosa [J]. Chinese Remedies & Clinics, 2013, 13 (6): 733-735.
[7]Takeuchi K, Araki H, Umeda M, et al. Adaptive gastric cytoprotection is mediated by prostaglandin EP1 receptors: a study using rats and knockout mice[J]. J Pharmacol Exp Ther, 2011, 297(3): 1160-1165. [8]于文涛, 方朝义, 李强, 等. 胃炎饮对胃溃疡大鼠胃黏膜前列腺素E2表达的影响[J]. 中国老年学杂志, 2015, 35(21): 6043-6044. Yu WT, Fang CY, Li Q, et al. Effect of gastritis drinking on the expression of prostaglandin E2 in gastric mucosa of gastric ulcer rats [J]. Chinese Journal of Gerontology, 2015, 35(21): 6043-6044.
[9]李英荃. 幽门螺杆菌、环氧化酶-2及微量元素与胃黏膜疾病的相关性研究[J]. 海南医学院学报, 2014, 20(7): 908-912. Li YQ. Relationships of gastric cancer with serum trace elements, helicobacter pylori and COX-2 in gastric mucosal lesions [J]. Journal of Hainan Medical University, 2014, 20(7): 908-912.
[10]江德龙, 燕善军. 表皮生长因子与胃肠道疾病[J]. 胃肠病学和肝病学杂志, 2010, 19(3): 278-279. Jiang DL, Yan SJ. Epidermal growth factor and gastrointestinal diseases [J]. Chin J Gastroenterol Hepatol, 2010, 19(3): 278-279.
[11]于文涛, 杨牧祥, 方朝义, 等. 胃炎饮对胃溃疡模型大鼠溃疡组织生长因子表达的影响[J]. 中医杂志, 2015, 56(1): 63-67. Yu WT, Yang MX, Fang CY, et al. Influence of Weiyan Yin on the expression of ulcer tissue growth factor in fastric ulcer model rats [J]. Journal of Traditional Chinese Medicine, 2015, 56(1): 63-67.
[12]杨书亚, 陈丹. 铝碳酸镁对消化性溃疡临床疗效及作用机制研究[J].中国基层医药, 2013, 20(17): 2664-2665. Yang SY, Chen D. Clinical curative effect and mechanism of hydrotalcite on peptic ulcer [J]. Chin J Primary Med Pharm, 2013, 20(17): 2664-2665.
[13]Antonisamy P, Arasu MV, Dhanasekaran M, et al. Protective effects of trigonelline against indomethacin-induced gastric ulcer in rats and potential underlying mechanisms [J]. Food Funct, 2016, 7(1): 398-408.
(责任编辑:王豪勋)
Effect of hydrotalcid on vascular endothelial growth factor and prostaglandin of experimental gastric ulcer rats
LEI Haoqiang1, YUE Hui2
1.Department of Gastroenterology, the People’s Hospital of Zhongshan, Zhongshan 528429; 2.Department of Gastroenterology, the Third Affiliated Hospital of Southern Medical University, China
Objective To study the effect of hydrotalcid on vascular endothelial growth factor(VEGF) and prostaglandin(PG) of experimental gastric ulcer rats. Methods Forty SD rats were selected as the experimental animals and randomly divided into sham operation group, model group and intervention group, gastric ulcer model was established in model group and intervention group by acetic acid corrosion, intervention group was given hydrotalcid treatment. After 14 days treatment, the ulcer area, ulcer inhibition rate, serum and gastric mucosa VEGF, EGF, PGE2, COX-2 were compared.Results Ulcer area, ulcer indexs were significantly lower in intervention group than those in model group (P<0.05); ulcer area, the ulcer index were significantly lower in hydrotalcite high dose group than those in low dose group, ulcer inhibition rate was significantly higher than that in low dose group (P<0.05); serum VEGF, EGF, PGE2 were significantly lower in the model group than those in the sham operation group (P<0.05), serum VEGF, EGF, PGE2 were significantly higher in the intervention group than those in the model group (P<0.05). Serum VEGF, EGF, PGE2 were significantly higher in hydrotalcite high dose group than those in the low dose group (P<0.05); gastric mucosa VEGF, EGF, PGE2, COX-2 mRNA were significantly higher in the model group than those in low dose group (P<0.05); gastric mucosa VEGF, EGF, PGE2, COX-2 mRNA were significantly higher in the intervention group than those in the model group (P<0.05); gastric mucosa VEGF, EGF, PGE2, COX-2 mRNA were significantly higher in hydrotalcite high dose group than those in the low dose group (P<0.05).Conclusion Hydrotalcite can reduce the ulcer area of experimental gastric ulcer rats, increasing the production of VEGF, EGF, PG are molecular pathways by which hydrotalcite play therapeutic effect, and high dose of hydrotalcite intervention effect is better.
Hydrotalcite; Gastric ulcer; Vascular endothelial growth factor; Prostaglandin
雷浩强,本科,主治医师,研究方向:消化性溃疡。E-mail:wang78822@126.com
10.3969/j.issn.1006-5709.2016.11.021
R573.1
A
1006-5709(2016)11-1289-04
2016-06-14

