下调PRR11表达抑制胃癌HGC-27细胞增殖和侵袭
宋宗昌, 郭长升, 赵鹏飞, 唐家宏, 韩怀忠, 张立新, 沈利群, 郭春亮, 岳荣喜
解放军第一五五中心医院血液肿瘤科/开封市血液病学重点实验室, 河南 开封 475003
下调PRR11表达抑制胃癌HGC-27细胞增殖和侵袭
宋宗昌, 郭长升, 赵鹏飞, 唐家宏, 韩怀忠, 张立新, 沈利群, 郭春亮, 岳荣喜
解放军第一五五中心医院血液肿瘤科/开封市血液病学重点实验室, 河南 开封 475003
目的 研究富含脯氨酸蛋白11(Proline-rich protein 11,PRR11)表达对胃癌HGC-27细胞增殖和侵袭能力的影响,并初步探讨相关分子机制。方法 利用载有PRR11 shRNA的慢病毒及空载体慢病毒转染胃癌HGC-27细胞系,建立PRR11蛋白低表达细胞系及阴性对照细胞系。Western blotting方法检测转染后HGC-27细胞中PRR11蛋白表达;采用CCK-8和Transwell小室分别研究两组细胞增殖与侵袭能力的差异。采用Western blotting检测胃癌细胞中cyclin D1和MMP-2蛋白的表达。结果 PRR11蛋白低表达HGC-27细胞较对照组HGC-27细胞的增殖和侵袭能力减弱,PRR11蛋白低表达细胞中cyclinD1和MMP-2蛋白表达较少。结论 PRR11低表达介导的胃癌细胞增殖和侵袭能力减弱,可能与cyclinD1和MMP-2表达减少密切相关。
胃癌;PRR11;细胞增殖;细胞侵袭
胃癌是世界上第四大常见的恶性肿瘤,是引起肿瘤性死亡的第二大病因[1-2]。我国胃癌发病率居恶性肿瘤第3位,仅次于肺癌、肝癌。2014年,我国新增胃癌患者约32.5万,其中男性约22.1万,女性约10.4万,并有逐年增加的趋势。由于胃癌的筛查工作尚未在我国广泛开展,得到早期诊断的患者较少,有效的治疗手段有限,虽然近年来胃癌的治疗效果有所提高,但整体状况还不令人满意。手术仍是胃癌根治的唯一方法,由于大多数胃癌在诊断时往往处于中晚期,失去手术根治的时机,只有选择放、化疗及靶向药物等治疗方法,效果很不理想,中位存活时间多在7~10个月[3-4]。因此寻找影响胃癌发生、发展的关键性生物大分子,对于胃癌的筛查、早期诊断、有效治疗及准确判断预后具有十分重要的意义。
富含脯氨酸蛋白11(Proline-rich protein 11, PRR11)基因位于人类染色体17q22,PRR11是一个富含脯氨酸的蛋白质,相对分子量为40 085 Da[5-6]。最初研究发现PRR11在肺癌组织中高表达,与肺癌的发生及进展密切相关,是肺癌患者的不良预后因素。进一步研究发现PRR11大量表达于细胞质,参与调节细胞周期进程,在细胞周期调节中具有非常重要的作用[7]。目前越来越多的研究显示,PRR11在多种恶性肿瘤中高表达,如食管癌、乳腺癌、胰腺癌、肺癌、结肠癌、胆管癌等,而在相应正常组织中低表达,并且具有显著差异;研究结果还表明PRR11高表达是这些肿瘤预后不良的重要因素之一[8]。 但在胃癌中的研究尚局限于其表达状况与临床病理特征的相关性分析方面,但其作用机制尚不清楚,本研究利用RNA干扰技术下调胃癌HGC-27细胞中PRR11基因表达,研究其表达下调对胃癌细胞增殖和侵袭的影响,并探讨其可能的分子机制。
1 材料与方法
1.1 细胞株与试剂 胃癌HGC-27细胞株购自中国科学院上海细胞生物学研究所。RPMI-1640培养基购自Gibco公司;胎牛血清和胰蛋白酶购自杭州四季青生物工程材料有限公司;兔抗人PRR11、β-actin、cyclin D1和MMP-2抗体购自abcam公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;细胞裂解液购自大连宝生物工程有限公司;transwell小室购自北京优尼康生物科技有限公司。含PRR11 shRNA 慢病毒及空载体慢病毒由上海GENECHEM公司提供。shRNA慢病毒中含有靶向PRR11 mRNA的siRNA(5′-ACGCAGGCCUUAAGGAGAATT-3′),空载体慢病毒中含有一段无意义错配序列作为阴性对照。
1.2 细胞培养和siRNA慢病毒转染 胃癌HGC-27细胞培养于含10%胎牛血清的RPMI-1640培养液中,细胞覆盖率为85%左右时,按说明书将含PRR11 shRNA的慢病毒及空载体慢病毒转染胃癌HGC-27细胞。实验细胞分为两组:PRR11表达敲低组细胞(PRR11-KD细胞)、阴性对照组细胞(PRR11-NC细胞)。转染后48 h Western blotting方法检验干扰效果。
1.3 细胞增殖分析 选择转染成功且生长状态良好的PRR11-KD细胞及PRR11-NC细胞,以每孔1×104个细胞接种于96孔板内,每组设复孔3个,37 ℃、5%CO2孵箱培养48 h;更换等量新鲜培养液后,向每孔中加入10 μl CCK-8溶液,继续培养2 h左右,然后用酶标仪检测波长为450 nm的吸光度值。
1.4 Transwell小室实验 将两组细胞分别悬浮于含有0.2%胎牛血清的培养基中,以1×104个细胞/100 μl的规格依次接种于铺好matrigel胶的transwell小室的上室中,每组细胞重复3个小室。下室中加入500 μl含5%胎牛血清的培养基,37 ℃培养20 h,取出Transwell小室,PBS冲洗2遍,5%戊二醛固定,加入0.1%结晶紫室温下染色0.5 h,PBS冲洗2遍,棉球擦去上表面细胞,显微镜下观察细胞数量,通过计算滤膜下层的细胞数评估其侵袭的细胞数量(每个小室选择10个视野,100×)。
1.5 Western blotting 建立稳定的PRR11-KD细胞系及PRR11-NC细胞系后,收集选择生长状态良好、覆盖率约85%的细胞,利用蛋白裂解液分别提取两组细胞的总蛋白,BCA法测定蛋白浓度,将两种蛋白溶液分别稀释至浓度近似,进行SDS-聚丙烯酰氨凝胶电泳,转移至PVDF膜上,5%脱脂牛奶封闭液,完全覆盖PVDF膜,置摇床上震荡封闭1 h,加入兔抗人Ⅰ抗(PRR11、β-actin、cyclinD1和MMP-2)(1∶5 000),4 ℃ 冰箱过夜。次日,加入山羊抗兔IgGⅡ抗(1∶5 000),室温下摇床上反应1 h。将PVDF膜置于凝胶成像仪内,取化学发光显色液试剂A和试剂B,按照1∶1比例混匀,滴加至PVDF膜上,至完全覆盖,成像。利用Gene Tools软件分析蛋白表达的灰度值,蛋白相对表达量为待测蛋白与β-actin蛋白的比值。
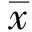
2 结果
2.1 PRR11 shRNA导致胃癌HGC-27细胞中PRR11表达下降 Western blotting结果显示,PRR11-KD细胞和PRR11-NC细胞中PRR11均有表达,PRR11-KD细胞中PRR11表达量显著低于PRR11-NC细胞(P<0.05),PRR11-KD细胞中PRR11表达量仅为PRR11-NC细胞中PRR11表达量21%(见图1)。
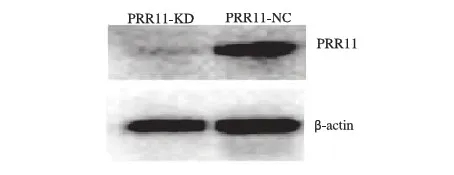
图1 病毒转染后两组HGC-27细胞中PRR11表达
Fig 1 PRR11 expression of HGC-27 cells after viral transfection
2.2 PRR11表达下调导致胃癌HGC-27细胞增殖能力下降 在96孔板中,以每孔1×104个细胞同时培养PRR11-KD细胞及PRR11-NC细胞,24 h、48 h、72 h及96 h后利用CCK-8进行活细胞量检测,结果显示,与PRR11-NC细胞相比,PRR11-KD细胞增殖受到明显抑制,差异具有统计学意义(P<0.05, 见图2)。
2.3 PRR11表达下调导致胃癌HGC-27细胞侵袭能力下降 Transwell小室实验结果显示,与PRR11-NC细胞相比(细胞穿膜数为179.00±27.06),PRR11-KD细胞(细胞穿膜数为73.67±13.61)的穿膜数量显著减少(P=0.000),提示PRR11-KD细胞侵袭能力下降。
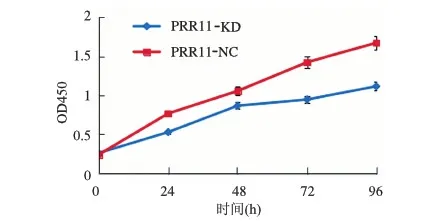
图2 PRR11表达下调抑制胃癌HGC-27细胞增殖
Fig 2 Down-regulation of PRR11 expression inhibited proliferation of HGC-27 cells
2.4 PRR11表达下调导致胃癌HGC-27细胞中cyclinD1和MMP-2表达下降 Western blotting检测结果显示,PRR11-KD细胞中cyclinD1和MMP-2相对表达量分别为0.15±0.04、0.31±0.09,PRR11-NC细胞中cyclinD1和MMP-2相对表达量分别为0.61±0.13、0.73±0.11。PRR11-KD细胞中cyclinD1 和MMP-2表达量显著低于PRR11-NC细胞中的表达量(P<0.05, 见图3)。
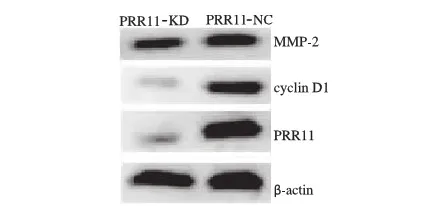
图3 PRR11表达下调对胃癌HGC-27细胞中cyclinD1和MMP-2蛋白表达的影响
Fig 3 Down-regulation of PRR11 expression impacted the expressions of cyclinD1 and MMP-2 of HGC-27 cells
3 讨论
PRR11基因是美国国家健康机构哺乳动物基因收集项目通过全部测序的方法,首次从人类全长cDNA中鉴定出来的一个蛋白质编码基因[9-10]。人类基因命名委员会将其系统命名为HGNC:25619。该基因位于人类染色体17q22,包含51 211个碱基,含有10个外显子及9个内含子[11-13]。PRR11基因位于17q23扩增区,该区拷贝数在乳腺癌、肺癌、脑瘤及卵巢癌等多种肿瘤细胞中显著增加,且其扩增程度与上述肿瘤的发展、扩散及预后相关[14-15]。目前发现多个肿瘤相关基因也位于该区域,如RPS6KB1、BRIP1、TRIM37、PPM1D等[16-17]。
PRR11基因编码蛋白PRR11是一个富含脯氨酸的蛋白,由360个氨基酸构成,相对分子量为40 085 Da。该蛋白分布于细胞质、细胞核及细胞骨架[18]。该蛋白的作用靶标可能为膜蛋白、胞质蛋白、转录因子、启动子等与肿瘤产生、增殖、侵袭及转移密切相关的蛋白及基因位点。
PRR11在多种恶性肿瘤的细胞增殖、周期进程、肿瘤浸润和转移中扮演着重要角色,为了初步阐明PRR11表达下调对胃癌细胞增殖和侵袭的影响,我们利用PRR11 shRNA慢病毒转染胃癌HGC-27细胞,采用Western blotting技术测定转染后PRR11表达差异,结果发现PRR11-KD细胞组中PRR11表达显著低于PRR11-NC细胞组,提示PRR11 shRNA显著下调HGC-27细胞中PRR11表达,为深入研究PRR11在HGC-27细胞中的作用奠定基础。我们采用CCK-8试剂盒检测PRR11-KD细胞与PRR11-NC细胞增殖的差异,结果显示,PRR11-KD细胞增殖能力受到显著抑制,提示下调PRR11表达导致HGC-27细胞增殖能力下降。Transwell小室实验结果显示,PRR11-KD细胞穿膜数量显著低于PRR11-NC细胞(P<0.05),提示PRR11表达下调导致HGC-27细胞侵袭能力下降。为进一步探讨上述变化的分子机制,我们采用Western blotting技术检测了PRR11-KD细胞及PRR11-NC细胞中增殖及侵袭相关蛋白(cyclinD1和MMP-2)表达的状况,结果显示,PRR11表达下调导致cyclinD1蛋白及MMP-2蛋白表达降低,提示PRR11表达下调介导的HGC-27细胞侵袭能力下降可能与cyclinD1和MMP-2蛋白表达下降相关。
综上所述,PRR11表达下调显著抑制HGC-27细胞的增殖和侵袭能力,其介导的增殖与侵袭能力下降可能与cyclin D1和MMP-2表达下降密切相关,深入研究PRR11的作用机制,有望为解释胃癌的发生与发展提供理论依据。
[1]Hohenberger P, Gretschel S. Gastric cancer [J]. Lancet, 2003, 362(9380): 305-315.
[2]El-Omar EM, Carrington M, Chow WH, et al. Interleukin-1 polymorphisms associated with increased risk of gastric cancer [J]. Nature, 2000, 404(6776): 398-402.
[3]Ohtsu A, Yoshida S, Saijo N. Disparities in gastric cancer chemotherapy between the East and West [J]. J Clin Oncol, 2006, 24(14): 2188-2196.
[4] 朱信强, 张明, 丁闯, 等. 胃癌临床综合治疗模式初探[J]. 胃肠病学和肝病学杂志, 2012, 21(11): 1027-1029. Zhu XQ, Zhang M, Ding C, et al. Model of comprehensive treatment of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2012, 21(11): 1027-1029.
[5]Olsen JV, Blagoev B, Gnad F, et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks [J]. Cell, 2006, 127(3): 635-648.
[6]Olsen JV, Vermeulen M, Santamaria A, et al. Quantitative phosphoproteomics reveals widespread full phosphorylation site occupancy during mitosis [J]. Sci Signal, 2010, 3(104): ra3.
[7]Ji Y, Xie M, Lan H, et al. PRR11 is a novel gene implicated in cell cycle progression and lung cancer [J]. Int J Biochem Cell Biol, 2013, 45(3): 645-656.
[8]Wang Y, Zhang Y, Zhang C, et al. The gene pair PRR11 and SKA2 shares a NF-Y-regulated bidirectional promoter and contributes to lung cancer development [J]. Biochim Biophys Acta, 2015, 1849(9): 1133-1144.
[9]Strausberg RL, Feingold EA, Grouse LH, et al. Generation and initial analysis of more than 15,000 full-length human and mouse cDNA sequences [J]. Proc Nalt Acad Sci U S A, 2002, 99(26): 16899-16903.
[10]Gerhard DS, Wagner L, Feingold EA, et al. The status, quality, and expansion of the NIH full-length Cdna project: the Mammalian Gene Collecion (MGC) [J]. Genome Res, 2004, 14(10B): 2121-2127.
[11]Ai Q, Bu YQ, Liu Z, et al. Structural and functional analysis of human PRR11 promoter [J]. Chin J Biochem Mol Biol, 2011, 27(4): 356-363.
[12]Ota T, Suzuki Y, Nishikawa T, et al. Complete sequencing and characterization of 21,243 full-length human cDNAs [J]. Nat Genet, 2004, 36(1): 40-45.
[13]Kimura K, Wakamatsu A, Suzuki Y, et al. Diversification of transcriptional modulation: large-scale identification and characterization of putative alternative promoters of human genes [J]. Genome Res, 2006, 16(1): 55-65.
[14]Nilsson R, Pea JM, Bjrkegren J , et al. Detecting multivariate differentially expressed genes [J]. BMC Bioinformatics, 2007, 8: 150.
[15] Spira A, Beane JE, Shah V, et al. Airway epithelial gene expression in the diagnostic evaluation of smokers with suspect lung cancer [J]. Nature Medicin, 2007, 13(3): 361-366.
[16] Andersen CL, Monni Q, Wagner U, et al. Highthroughput copy number analysis of 17q23 in 3520 tissue specimens by fluorescence in situ hybridization to tissue microarrays [J]. Am J Pathol, 2002, 161(1): 73-79.
[17] Parssinen J, Kuukasjrvi T, Karhu R, et al. High level amplification at 17q23 leads to coordinated overexpression of multiple adjacent genes in breast cancer [J]. Br J Cancer, 2007, 96(8): 1258-1264.
[18] Larance M, Ahmad Y, Kirkwood KJ, et al. Global subcellular characterisatiion of protein degradation using quantitative proteomics [J]. Mol Cell Proteomics, 2013, 12: 638-650.
(责任编辑:马军)
Knockdown of PRR11 expression inhibits proliferation and invasion in gastric cancer HGC-27 cells
SONG Zongchang, GUO Changsheng, ZHAO Pengfei, TANG Jiahong, HAN Huaizhong, ZHANG Lixin, SHEN Liqun, GUO Chunliang, YUE Rongxi
Department of Oncology, the 155th Central Hospital of PLA/The Key Laboratory for Hematology of Kaifeng, Kaifeng 475003, China
Objective To investigate the influence of PRR11 expression on proliferation and invasion in gastric cancer HGC-27 cells, and to investigate its possible molecular mechanisms.Methods PRR11 shRNA and empty vector lentivirus were transfected into gastric cancer HGC-27 cells, which was divided into two groups. Expression of PRR11 in gastric cancer HGC-27 cells was detected by Western blotting after transfection. Subsequently, cell proliferation and cell invasion were detected by CCK-8 kit and transwell chambers, respectively. Finally, Western blotting was used to study expressions of cyclin D1 and MMP-2 proteins in two gastric cancer cells. Results PRR11 shRNA effectively down-regulated the expression of PRR11 in gastric cancer HGC-27 cells. Additionally, knockdown the expression of PRR11 led to the proliferation inhibition and the decrease of invasion in gastric cancer HGC-27 cells, accompanied by the down-regulation of cyclinD1 and MMP-2 proteins.Conclusion Knockdown of PRR11 expression results in proliferation and invasion inhibition in gastric cancer cells may be closely related to the decrease of expressions of cyclinD1 and MMP-2 proteins.
Gastric cancer; PRR11; Cell proliferation; Cell invasion
河南省开封市科技创新人才项目(1407009)
宋宗昌,博士,主治医师,研究方向:胃癌诊断与治疗。E-mail: szc122@163.com
岳荣喜,硕士,主任医师,院长,研究方向:消化道肿瘤诊断与治疗。E-mail: szc_155@163.com
10.3969/j.issn.1006-5709.2016.11.004
R735.2
A
1006-5709(2016)11-1221-04
2016-08-01

