金樱根化学成分研究(Ⅰ)*
汪玉梅, 苏贤君, 符 崖, 王志芳, 张翠仙
(广州中医药大学中药学院,广东 广州 510006)
金樱根化学成分研究(Ⅰ)*
汪玉梅, 苏贤君, 符 崖, 王志芳, 张翠仙
(广州中医药大学中药学院,广东 广州 510006)
前期研究表明广东凉茶颗粒中三萜皂苷主要来源于岗梅和金樱根。而目前对于金樱根化学成分研究主要集中在金樱子叶和果实,对其根化学成分研究鲜见报道。基于此,该实验在前期基础上采用正反相硅胶、凝胶等多种分离手段对金樱根甲醇提取物的乙酸乙酯相化学成分进行研究,从中分离得到了6个化合物,采用现代波谱分析和文献对照等方法鉴定其结构分别为:2α, 3α, 19α-三羟基乌苏-12-烯-28-酸28-O-β-D-吡喃葡萄糖苷(1)、2α, 3β, 19α-三羟基乌苏-12-烯-28-酸 28-O-β-D-吡喃葡萄糖苷(2)、2α, 3β, 19α, 23-四羟基乌苏-12-烯-28-酸 28-O-β-D-吡喃葡萄糖苷(3)、齐墩果酸(4)、熊果酸(5)、(+)-儿茶素(6)。化合物1,2,3为首次从金樱根中分离得到,且为广东凉茶颗粒中三萜皂苷类成分。
金樱根;化学成分;三萜及其苷类;结构鉴定
金樱根为蔷薇科蔷薇属植物金樱子RosalaevigataMichx.的根或根茎,其性平,味酸、涩,归脾、肝、肾经。具有收敛固涩、止血敛疮、祛风活血、止痛、杀虫等作用[1]。现今金樱根是国家非物质文化遗产——广东凉茶颗粒(王老吉)的主要原料之一,前期研究表明广东凉茶颗粒中三萜皂苷主要来源于岗梅和金樱根[2-4],岗梅中三萜皂苷类成分主要含有磺酸基,而金樱根则以熊果烷及齐墩果烷型的五环三萜为主。对于金樱根的文献调研表明[5],目前主要集中在金樱子叶和果实的化学成分[6-8],而对其根化学成分的研究主要是鞣质类成分[9]。基于此,本实验在前期基础[10-12]上采用正反相硅胶、凝胶等多种分离技术对金樱根甲醇提取物的乙酸乙酯相进行了系统研究,从中分离得到了6个化合物,采用文献对照以及现代波谱分析方法确定其结构分别为:2α, 3α, 19α-三羟基乌苏-12-烯-28-酸28-O-β-D-吡喃葡萄糖苷(1)、2α, 3β, 19α-三羟基乌苏-12-烯-28-酸 28-O-β-D-吡喃葡萄糖苷(2)、2α, 3β, 19α, 23-四羟基乌苏-12-烯-28-酸28-O-β-D-吡喃葡萄糖苷(3)、齐墩果酸(4)、熊果酸(5)、(+)-儿茶素(6)。化合物1,2,3为首次从金樱根中分离得到,且为广东凉茶颗粒中三萜皂苷类成分。
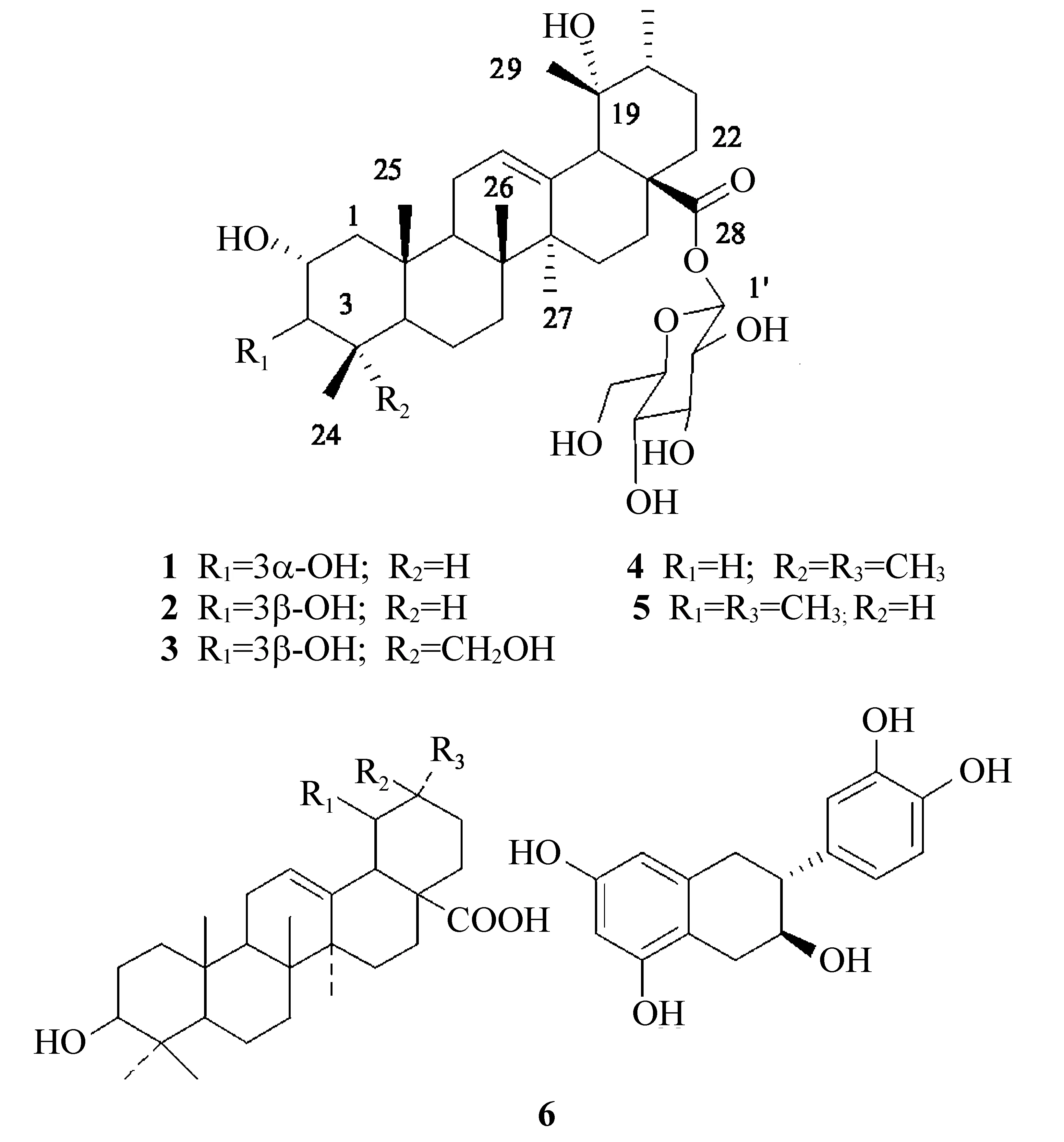
图1 从金樱根乙酸乙酯相中分离得到的6个化合物结构式Fig.1 Six structures of compounds 1,2,3,4,5,6 from the roots of Rosa laevigata Michx
1 实验部分
1.1 仪器与材料
仪器:北京泰克光学仪器厂X-6型熔点仪(熔点未矫正);旋光由德国POLARTRONIC H H W5 polarimeter (SCHMIDT+ HAENSCH,Germany) 测定;AVANCE AV 600 MHz、400 MHz超导核磁共振仪(瑞士Bruker公司);高效液相色谱-质谱联用仪(美国Finnigan公司LCQDECAXP);旋转薄膜蒸发器RE-5299(巩义市予华仪器有限责任公司);SHD-Ⅲ循环水式真空泵(巩义市予华仪器有限责任公司);MODEL NH1006超声仪(中国华南超声设备厂);电子分析天平(AUY120,广州湘仪机电设备有限公司);ODS为日本YMC公司产品(50 μm);凝胶为Sephadex LH-20(日本YMC);柱层析硅胶(200~300目)为青岛海洋化工有限公司生产。
HPLC-MSn用试剂:甲醇、水为色谱纯(美国Sigma公司)实验用水为超纯水,由超纯水设备制备(美国Milipore公司);分离用溶剂:石油醚、乙酸乙酯、甲醇、氯仿等试剂均为广州化学试剂厂产品(分析纯)。
材料:金樱根(产地:湖南;生产批号:110801;广州致信中药饮片有限公司)。
1.2 提取与分离
金樱根(15 kg),经φ=80%甲醇/水浸漉提取,减压回收甲醇,浓缩后得浸膏(2.306 kg)。浸膏用蒸馏水捏溶,依次用石油醚(PE)、乙酸乙酯(EtOAc)、正丁醇(n-BuOH)萃取,萃取液减压浓缩得PE相(2 g),EtOAc相(621.3 g),n-BuOH相(682.0 g)和 H2O相(500 g)。
乙酸乙酯部位(621.3 g)进行硅胶(200~300目)柱层析,先以石油醚-乙酸乙酯溶剂体系(V(PE)∶V(EtOAc)=9∶1,7∶3,5∶5,3∶7)洗脱,后以乙酸乙酯-甲醇溶剂体系(V(EtOAc)∶V(MeOH)=9∶1, 8∶2,7∶3,5∶5, 3∶7, 0∶1)洗脱,TLC跟踪,得到16个流分(RL1至RL16)。流分RL-10经硅胶(200~300目)柱层析(V(CHCl3)∶V(MeOH)=10∶1)和反相C18柱层析(V(MeOH)∶V(H2O)=4∶1)得到化合物1(20 mg);流分RL-10经硅胶(200~300目)柱层析(V(CHCl3)∶V(MeOH)=10∶1),Sephadex LH-20(V(MeOH)∶V(H2O)=9∶1)和硅胶柱层析(V(CHCl3)∶V(EtOAc)∶V(Acetone)=5∶1∶2)得到化合物2(40 mg);流分RL-13经硅胶(200~300目)柱层析(V(CHCl3)∶V(MeOH)=11∶1) 和反相C18柱层析(V(MeOH)∶V(H2O)=1∶4)得到化合物3(24 mg);流分RL-9经硅胶(200~300目)柱层析(V(CHCl3)∶V(MeOH)=15∶1),硅胶(200~300目)柱层析(V(CHCl3)∶V(MeOH)=10∶1)和Sephadex LH-20(V(MeOH)∶V(H2O)=9∶1)得到化合物4(5.5 mg);流分RL-5经硅胶(200~300目)柱层析(V(PE)∶V(EtOAc)=8∶2)和反相C18柱层析(V(MeOH)∶V(H2O)=3∶2)得到化合物5(30 mg);流分RL-6经硅胶(200~300目)柱层析(V(PE)∶V(EtOAc)=9∶1)和反相C18柱层析(V(MeOH)∶V(H2O)=3∶2)得到化合物6(15 mg)。
1.3 化合物物理常数和波谱数据



化合物4:白色无定型粉末(MeOH),θmp307~309 ℃, ESI-MSm/z935[2M+Na]+, 479[M+Na]+; NMR(600 MHz, CD3OD)见表1和表2。
化合物5:白色无定型粉末(MeOH),θmp282~284 ℃, ESI-MSm/z935[2M+Na]+, 479[M+Na]+; NMR(600 MHz, CD3OD)见表1和表2。

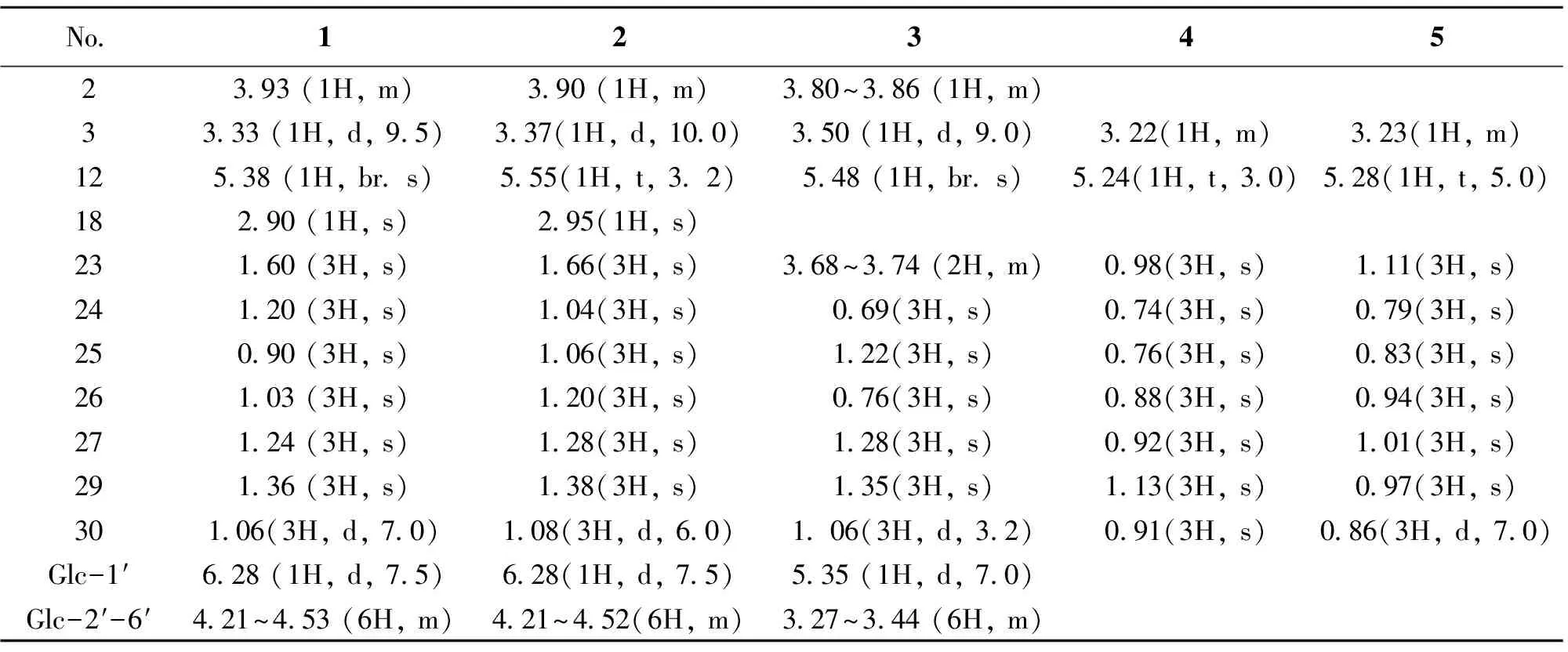
表1 化合物1,2,3,4,5关键位置1H NMR数据
2 结果与讨论
化合物1:白色针状结晶(CHCl3-MeOH),θmp230~232 ℃;φ=5%硫酸乙醇溶液显蓝色斑点,Libermann- Burchard和Molish反应均为阳性,暗示结构为皂苷类成分。ESI-MSm/z673 [M+Na]+,结合1H NMR、13C NMR和DEPT谱( 7个-CH3,9个-CH2,12个-CH和8个-C )确定化合物1分子式为C36H58O10,不饱和度为8。1H NMR共显示7个-CH3信号峰,分别为δH0.90、1.03、1.20、1.24、1.36、1.60 (各 3H, s)和1.06 (3H, d,J=7.0 Hz)。另外δH5.38 (1H, br. s)及δC138.9(s)和128.0(d)说明化合物1存在1个双键。δC177.5 (s)提示含有羰基碳,除此外无任何不饱和度信息,提示该化合物可能为熊果烷型三萜。δH6.28 (1H, d,J=7.5 Hz)和δC95.7 (d)为一典型酯苷键中糖的端基信息,说明1为含有1个糖的皂苷类化合物。同时C-28化学位移值为δC177.5 (s)也暗示其为酯苷键。将1进行酸水解,糖的GLC分析结果表明该化合物所含的糖为β-D-葡萄糖[19]。将1的NMR数据(表1和表2)与文献[10,13]对照基本一致,确定1为2α, 3α, 19α-三羟基乌苏-12-烯-28-酸28-O-β-D-吡喃葡萄糖苷。同时采用HPLC-MSn技术与广东凉茶颗粒的化学成分进行对比研究,发现此成分为广东凉茶颗粒中含有,确定其来源为金樱根[2-4,10]。
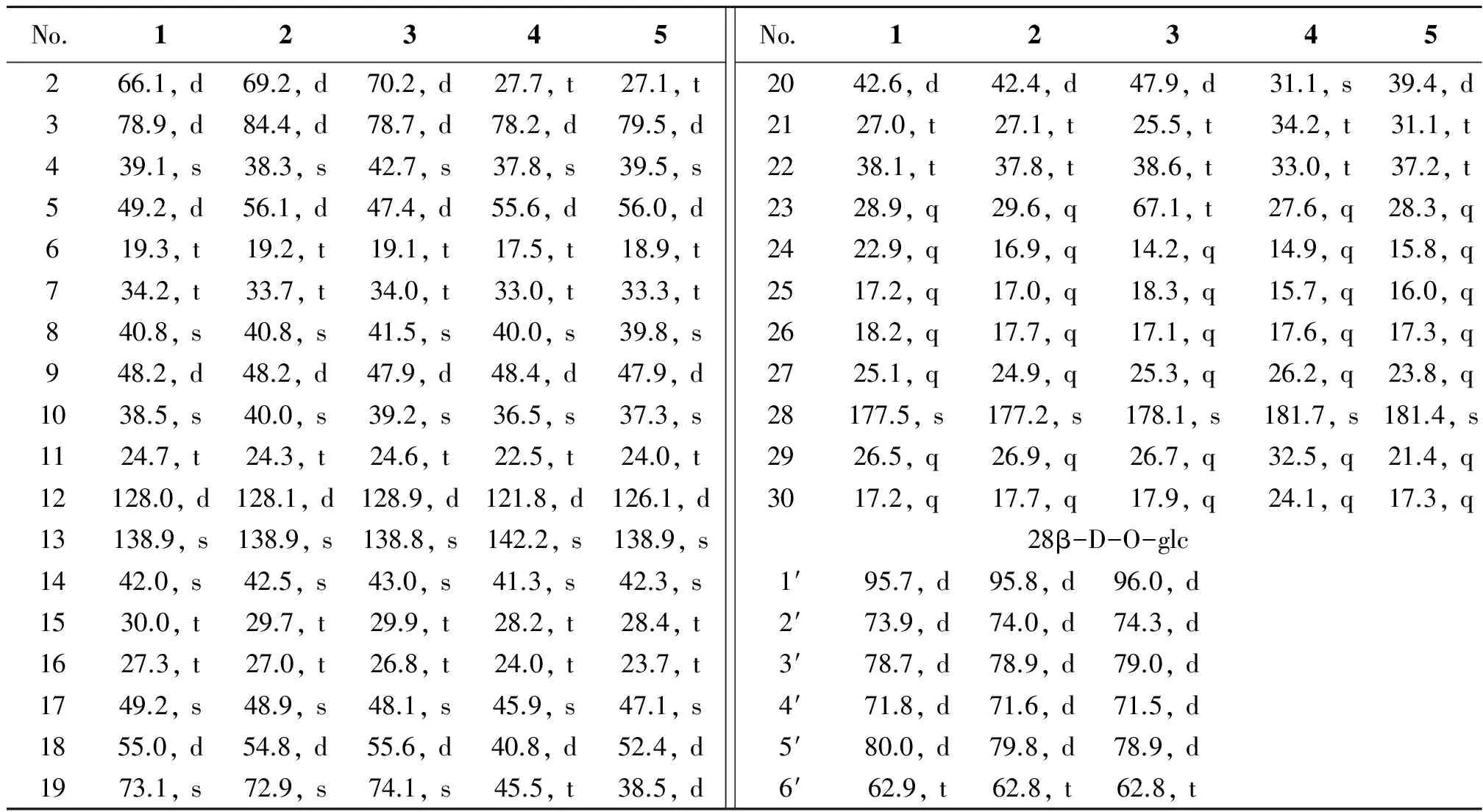
表2 化合物1,2,3,4,5的13C NMR数据
化合物2:白色针状结晶(MeOH),θmp219~221 ℃;φ=5%硫酸乙醇溶液显蓝色斑点,Libermann-Burchard和Molish 反应均为阳性,暗示结构为皂苷类成分。比较化合物2与1的MS和NMR 数据发现二者基本一致。仅C-3的化学位移值明显向低场移动5.5外 [2:δC84.4 (d, C-3);1:δC78.9 (d, C-3)]不同,说明二者为C-3位差异的一对异构体。将2的NMR数据(表1和2)与文献[10, 14]对照基本一致,故确定2为2α, 3β, 19α-三羟基乌苏-12-烯-28-酸28-O-β-D-吡喃葡萄糖苷。同时采用HPLC-MSn技术与广东凉茶颗粒的化学成分进行对比研究,发现此成分为广东凉茶颗粒中含有,确定其来源为金樱根[2-4,10]。
化合物3:白色粉末(CHCl3-MeOH),θmp271~272 ℃,φ=5%硫酸乙醇溶液显蓝色斑点,Libermann-Burchard和Molish 反应均为阳性,暗示结构亦为皂苷类成分。ESI-MSm/z: 689 [M+Na]+;结合NMR(6个-CH3,10个-CH2,12个-CH和8个-C) 确定3分子式为C36H58O11,不饱和度为8。NMR中给出典型熊果烷甲基质子信息(δH0.69, 0.76, 1.22, 1.28, 1.35 (各 3H, s)和1.06 (3H, d,J=3.2 Hz))和12,13位三取代双键(δH5.48 (1H, br. s)及δC138.8 (s)和128.9 (d))。同时δH5.35 (1H, d,J=7.0 Hz)和δC96.0 (d)为一典型酯苷键中糖的端基信息,说明3也为含有1个糖的三萜皂苷。将3的NMR数据与2对照,二者数据基本一致,只是少了一个甲基信息[δC29.6 (q, C-23)]而增加了一个羟甲基信息[δC67.1(t, C-23)]。将3的NMR数据(表1和2)与文献[10,13]对照基本一致,故确定3为2α,3β,19α,23-四羟基乌苏-12-烯-28-酸 28-O-β-D-吡喃葡萄糖苷。同时采用HPLC-MSn技术与广东凉茶颗粒的化学成分进行对比研究,发现此成分为广东凉茶颗粒中含有,确定其来源为金樱根[3-4,6]。
化合物4:白色无定型粉末(MeOH),θmp307~309 ℃,Liebermann-Burchard反应阳性,提示该化合物可能为三萜或甾体类化合物。ESI-MS 给出m/z935[2M+Na]+,479[M+Na]+,13C NMR谱可见30个碳信号,结合相对分子质量可推出化合物4的分子式为C30H48O3,不饱和度为7。1H NMR谱高场区可观察到7个-CH3信号峰,分别为δH0.74,0.76,0.88,0.91,0.92,0.98,1.13 (均为3H, s),都为单峰,故推测4为齐墩果烷型母核。NMR中给出4结构中还含有一个三取代双键(δH5.24(1H, t,J=3 Hz);δC142.2(s), 121.8(d))、一个连氧次甲基(δH3.22(1H, m);δC78.2(s))和一个羧基(δC181.7(s))。将4的NMR数据(表1和2)与齐墩果酸对照基本一致[15-16],故确定4为齐墩果酸。
化合物5:白色无定型粉末(MeOH),θmp282~284 ℃,Liebermann-Burchard反应阳性,提示该化合物可能为三萜或甾体类化合物。ESI-MS 给出m/z935[2M+Na]+,479[M+Na]+,13C NMR谱可见30个碳信号,结合相对分子质量得出5的分子式为C30H48O3,不饱和度为7。1H NMR谱高场区可观察到7个-CH3信号峰,分别为δH0.79,0.83,0.94,0.97,1.01,1.11 (均为3H, s)和0.88(3H, d,J=7 Hz),提示化合物5亦为三萜类化合物,由于存在一个双重峰的甲基信号,推测是熊果烷型母核。NMR信息提示结构中还存在一个三取代双键(δH5.28(1H, t,J=5 Hz);δC138.9(s), 126.1(d)),一个连氧次甲基(δH3.23(1H, m);δC79.5(d))和一个羧基(δC181.4(s))。将其NMR数据(表1和2)与熊果酸对照基本一致[17],故鉴定5为熊果酸。
化合物6:黄色无定型粉末(MeOH),θmp94~95 ℃,FeCl3显色反应和浓硫酸-香草醛均为阳性说明结构中既含有酚羟基又含有饱和醇羟基。结合ESI-MSm/z289[M-H]-和NMR谱(15个碳:1个-CH2,7个-CH和7个-C)信息,确定6的分子式为C15H14O6,不饱和度为9。1H NMR谱中δH6.84 (1H, d,J=2.0 Hz),6.72 (1H, dd,J=8.0, 1.6 Hz)和6.76 (1H, d,J=8.0 Hz)显示其为芳香结构中ABX偶合系统质子信息。δH5.93 (1H, d,J=2.0 Hz)和5.86 (1H, d,J=2.0 Hz)为苯环上间位偶合质子信号。δH4.57 (1H, d,J=7.2 Hz)和3.98 (1H, m)为2个饱和连氧碳上的质子信号。另外高场区有一对偕偶质子信号:δH2.85 (1H, dd,J=16.0, 5.2 Hz)和2.51 (1H, dd,J=16.0, 8.0 Hz),说明6为二氢黄酮类化合物。将6的NMR数据与(+)-儿茶素对比[18],二者基本一致,故鉴定化合物6为(+)-儿茶素。
致谢:感谢中山大学分析测试中心关山越、李玮、姚俊华、陈晓红老师等在结构鉴定中给予的支持。
[1] 江苏新医学院. 中药大辞典(上册)[M]. 上海:人民卫生出版社, 1977:1407.
[2] 杨运云, 邓洁薇, 余彦海, 等. 王老吉广东凉茶颗粒的超高相液相色谱指纹图谱研究[J]. 分析测试学报, 2012, 31(5):613-617.
[3] DENG J W, FAN C L, JIANG Z G, et al. Quality assessment and origin tracing ofGuangdongLiangchagranules using direct mass spectrometry finger printing [J]. Analytical Methods, 2012, 4: 3638-3645.
[4] 王志芳. 广东凉茶颗粒物质基础及指纹图谱研究[D]. 广东:广州中医药大学, 2013.
[5] 刘佩沂, 田素英, 黄文英. 金樱根研究进展[J]. 海峡药学, 2010, 22(1): 98-100.
[6] ZHANG Na, SHEN Yang, LI Lingzhi, et al. Anti-inflammatory triterpenes from the leaves ofRosalaevigata[J]. J Nat Prod, 2011, 74: 732-738.
[7] GAO Pingyi, LI Lingzhi, PENG Ying, et al. Triterpenes from fruits fromRosalaevigata[J]. Biochemical Systematics and Ecology, 2010, 38: 457-459.
[8] LI Xi, CAO Wei, SHEN Ying, et al. Antioxidant compounds fromRosalaevigatafruits[J]. Food Chemistry, 2012, 130: 575-580.
[9] YOSHIDA Takashi, TANAKA Katsumi, CHEN Xinmin, et al. Tannins of rosaceous medicinal plants. Ⅴ. hydrolyzable tannins with dehydrodigalloyl group fromRosalaevigataMichx. [J]. Chem Pharm Bull, 1989, 34(4): 920-924.
[10] 王志芳, 符崖, 向俊, 等. 广东凉茶颗粒苷类化学成分研究[J]. 中山大学学报(自然科学版), 2013, 52(2):79-83.
[11] 孙彩云, 王志芳, 苏贤君, 等. 广东凉茶颗粒中芳香酚酸类化学成分研究[J]. 中山大学学报(自然科学版), 2014, 53(4):88-93.
[12] 苏贤君, 王志芳, 雷玲芳, 等. 广东凉茶颗粒中苷类成分的化学研究Ⅱ[J]. 中药材, 2015, 38(1):160-162.
[13] TAKASHI S, TAKASHI T, OSAMU T, et al. β-Glucosyl esters of 19α-hydroxyursolic acid derivatives in leaves ofRubusspecies [J]. Phytochemistry, 1984, 23 (12):2829-2834.
[14] ZHOU X H, KASAI R, OHTANI K, et al. Oleanane and ursane glucosides fromRubusspecies[J]. Phytochemistry, 1992, 31 (10):3642-3644.
[15] 叶苹, 茅青, 郭永红, 等. 中药金樱子三萜类化合物的分离鉴定[J]. 贵阳中医药学院学报, 1993, 15(4):62-64.
[16] 董涛. 中药金樱叶的化学成分研究[D]. 上海:第二军医大学, 2009.
[17] 高迎, 李强, 龚卫红, 等. 金樱子化学成分的研究[J]. 北京中医药大学学报, 2008, 31(2):110-111.
[18] 朱向东, 徐波, 王飞. 沙针的化学成分研究[J]. 天然产物研究与开发, 2009, 21:956-959.
[19] ZHANG Cuixian, ZHANG Dongmei, CHEN Minfeng, et al. Antiproliferative triterpenoid saponins from the stem ofPsychotriasp.[J]. Planta Medica, 2013, 79:978-986.
The chemical constituents from the roots ofRosalaevigataMichx. (Ⅰ)
WANGYumei,SUXianjun,FUYa,WANGZhifang,ZHANGCuixian
(School of Chinese Material Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
Previous experiments showed that triterpenoid saponins ofGuangdongLiangchawere mainly from the roots ofilexasprellaandRosalaevigataMichx.. However, chemical constituents mainly focus on leaves and fruits ofRosalaevigataMichx., and the secondary metabolites from the roots ofRosalaevigataMichx. were very few published. So, on the basis of previous study, six compounds were isolated from the roots ofRosalaevigataMichx. by various chromatographic techniques and their structures were identified by spectroscopic analysis and literature confrontation method, such as 2α, 3α, 19α-trihydroxyurs-12-en-28-oic acid β-D- glucopyranosyl ester(1), 2α, 3β, 19α-trihydroxyurs-12-en-28-oic acid β-D-glucopyranosyl ester (2), 2α, 3β, 19α, 23-tetrahydroxyurs-12-en-28-oic acid β-D-glucopyranosyl ester(3), oleanolic acid(4), ursolic acid(5), (+)-catechin(6). Compounds 1,2,3 as triterpenoid saponins in Guangdong Liangcha have been firstly obtained from the roots ofRosalaevigataMichx..
RosalaevigataMichx.; chemical constituents; triterpenoid saponins; structural identification
10.13471/j.cnki.acta.snus.2016.02.014
2015-10-05
广东省科技计划重点资助项目(2010A03010003); 广东省分析测试技术公共实验室开放课题资助项目(001);2015年高水平大学建设专项资金资助项目(2050205)
汪玉梅(1978年生),女; 研究方向:方剂配伍规律;通讯作者: 张翠仙;E-mail:zhangcuixian@aliyun.com
O629.7;R284.2
A
0529-6579(2016)02-0076-06

