siRNA靶向抑制MACC1对结直肠癌细胞增殖和侵袭能力的影响
西安市中心医院(西安710003) 农晰婷 杨 光 张 昱
siRNA靶向抑制MACC1对结直肠癌细胞增殖和侵袭能力的影响
西安市中心医院(西安710003)农晰婷杨光△张昱▽
摘要目的:采用小干扰RNA(siRNA)靶向抑制结直肠癌细胞中MACC1的表达,观察其对肿瘤细胞增殖和侵袭能力的影响。方法: Real time-PCR检测MACC1在结直肠癌组织和细胞株中的表达水平;利用Lipofectmin2000将MACC1特异性siRNA转染进入结直肠癌细胞株LoVo和SW620;利用Real time-PCR和Western blot法明确细胞中MACC1在mRNA和蛋白水平上的表达变化;通过CCK-8法检测肿瘤细胞增殖水平的变化,并利用Transwell系统检测肿瘤细胞体外迁移和侵袭能力的变化。结果:MACC1在结直肠癌中表达较正常肠黏膜显著升高;与阴性对照比较,MACC1 siRNA能够特异性抑制LoVo和SW620细胞中MACC1基因的表达,并引起肿瘤细胞的增殖水平降低,迁移和侵袭能力减弱。结论: 利用siRNA特异性抑制MACC1的表达,可以降低结直肠癌细胞的增殖水平和侵袭能力。MACC1是抗肿瘤转移治疗的重要潜在靶点。
主题词结直肠肿瘤/病理生理学基因/代谢肿瘤转移@MACC1
肿瘤转移播散及其引起的并发症是致患者死亡的最主要原因。目前针对转移性结直肠癌的治疗是以奥沙利铂、5-FU等为基础的联合化疗为主,辅以贝伐单抗等生物抗体治疗。即便如此,其中位生存期仍不足2年[1]。因此,深入探索结直肠癌转移的分子机制,寻找新的治疗靶点和药物,是未来研究的重要方向。
癌转移相关基因(Metastasis-associated in colon cancer-1,MACC1)是一个新近被鉴定的结直肠癌转移相关基因。体内实验发现,MACC1通过激活与肿瘤转移关系密切的HGF/Met信号途径,从而促进结直肠癌的生长、侵袭和转移[2]。除结直肠癌外,有研究也发现:MACC1的表达水平在胃癌、肺癌和肝癌中与肿瘤的侵袭转移程度密切相关,可以作为独立的肿瘤转移预测指标[3~5]。这些研究均提示MACC1是一个治疗肿瘤转移的潜在靶点。本研究利用siRNA技术靶向抑制结直肠癌细胞中MACC1的表达,观察肿瘤细胞增殖、迁移和侵袭能力的变化,以期为结直肠癌基因治疗提供新靶点和新方法。
材料与方法
1细胞株和试剂结直肠癌细胞株LoVo、SW620、SW480、HT29和HCT116购于中科院上海细胞库。MACC1特异性siRNA由上海吉玛生物合成。MACC1多克隆兔抗购于美国Abcam公司。其他试剂材料:Lipofectamine2000、Trizol reagent、cDNA first chain kit(美国Invitrogen公司);SYBR green qPCR kit(大连宝生物公司);CCK-8细胞增殖kit(杭州碧云天公司);Transwell细胞培养系统(美国Corning公司);ECM基质胶(美国BD公司)。
2细胞培养和转染5种结直肠癌细胞株均培养于含10%FBS的RPMI-1640培养基中。根据Lipofectamine2000说明书进行siRNA转染。细胞分为阴性对照组(NC siRNA)和干扰组(MACC1siRNA)。转染后24h或48h收集细胞分别用于提取总RNA和蛋白用于下一步实验。
3荧光定量PCR检测MACC1mRNA表达水平收集细胞,Trizol法提取总RNA,逆转录(cDNA first chain kit)合成cDNA后,运用SYBR green 染料法定量PCR检测MACC1mRNA水平,内参使用GAPDH。引物序列:MACC1forward 5’-GGTCAGGAAGAATTGCACAAAG-3’,reverse 5’-GGTCCTGGCATT-CTGTAATATTGC-3’;GAPDH forward 5’-AGACAGCCGCATCTTCTTGT-3’,reverse 5’-TTGAATTTGCCATGAGTGGA-3’;MACC1siRNA sense 5’-GCCCGU-UGUUGGAAAUCAUTT-3’,antisense 5’-AUGAUUUCCAACAACGGGCTT-3’。
4Western blot检测MACC1表达水平收集细胞,RIPA法提取总蛋白。SDS-PAGE垂直电泳每孔上样40μg,转移至PVDF膜后,兔抗人MACC1多克隆抗体(1∶1000)孵育4℃过夜,HRP标记羊抗兔二抗(1∶5000)孵育1h,ECL法发光。内参使用β-actin。
5CCK-8法检测细胞增殖水平变化细胞消化制成悬液后种于96孔板中,每孔0.5×104个。培养贴壁24h后进行siRNA转染。转染后继续培养24h、48h和96h。培养终止前2h每孔加入10μl CCK-8溶液,孵育2h,利用酶标仪读取OD450nm波长下的吸光度值。
6Transwell细胞迁移和侵袭实验细胞转染24h后,用胰酶消化并重悬于无血清的RPMI-1640培养基中制成细胞悬液。迁移实验中,Transwell系统上室加入2×105个细胞,下室加入500μl含10%FBS的培养基,继续培养48h。培养终止后,用棉签轻擦去碳酸酯膜上表面的细胞,位于下表面的迁移细胞用4%多聚甲醛固定,1%结晶紫染色,风干。倒置显微镜下拍照,100×下任意选取6个视野计算细胞数。侵袭实验中,在上室预铺ECM基质胶(1∶7稀释),待凝固后加入3×105个细胞。其余步骤与迁移实验一致。
结果
1 MACC1在结直肠癌中表达显著升高在纳入研究的18对结直肠癌及对应癌旁组织中,有13例癌组织中MACC1mRNA表达水平显著高于其对应的癌旁正常黏膜(图1A)(P< 0.05)。进一步检测了5种结直肠癌细胞株中MACC1mRNA的表达,发现5种细胞中MACC1mRNA表达均显著高于作为对照的正常肠黏膜(图1B)(P <0.05)。
2siRNA特异性抑制MACC1的表达首先利用Western blot方法检测5种结直肠癌细胞株中MACC1mRNA和蛋白的表达水平,结果显示5种细胞中均有MACC1不同程度表达,而转移性较强的LoVo和SW620细胞中,MACC1的表达水平相对更高(见图2A)。因此我们选择LoVo和SW620细胞进行后续的siRNA干扰和细胞功能学实验。图2B可见转染siRNA后的LoVo和SW620细胞较转染前,其MACC1的表达水平明显受到抑制。
3下调MACC1的表达抑制结直肠癌细胞的增殖、迁移和侵袭通过siRNA干扰下调MACC1表达后,利用CCK-8法检测了LoVo和SW620细胞增殖能力的变化。如图3A所示:转染48h后,转染组LoVo细胞的增殖水平与阴性对照相比显著下降(P<0.05),而SW620细胞则在转染72h后,其增殖水平相比阴性对照有显著下降(P<0.05)。在Transwell实验中,MACC1表达下调后,LoVo和SW620细胞与阴性对照组相比,其运动迁移(LoVo: 85.34±9.66 vs 140.20±13.82; SW620: 105.00±9.38 vs79.33±4.76)和侵袭通过基质胶的能力(LoVo: 52.81±11.47 vs115.36±10.94; SW620: 90.33±10.26 vs 64.50±6.28)也明显减弱(见图3B和3C)(P <0.05)。
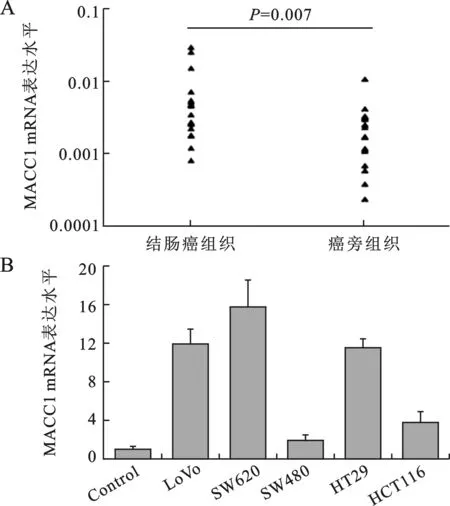
图1MACC1在结直肠癌中表达异常升高(A:18对结直肠癌及对应癌旁组织中MACC1mRNA的表达;B: 5种结直肠癌细胞株中MACC1mRNA的表达)

图2siRNA靶向抑制结直肠癌细胞中MACC1蛋白表达(A:MACC1在5种结直肠癌细胞株中的表达情况;B:siRNA抑制LoVo和SW620细胞中MACC1蛋白表达)
讨论
近年来,我国结直肠癌发病率呈明显上升趋势,发病率和死亡率居所有恶性肿瘤第四位。随着诊疗水平和治疗手段的提高,一些早期发生的结直肠癌能够被治愈或取得不错的治疗效果。但对于更多进展期的,尤其是发生了远处转移的肿瘤,仍缺乏有效的治疗手段。目前,抗肿瘤转移治疗的策略正从传统的联合化疗转变为化疗结合基因生物治疗。多种针对促转移基因的生物抗体药物,如西妥昔单抗(抗EGFR)、贝伐单抗(抗VEGF)等相继进入临床。在分子机制研究方面,许多肿瘤转移相关基因被鉴定并报道,为肿瘤治疗提供了理论依据和新的治疗靶点。
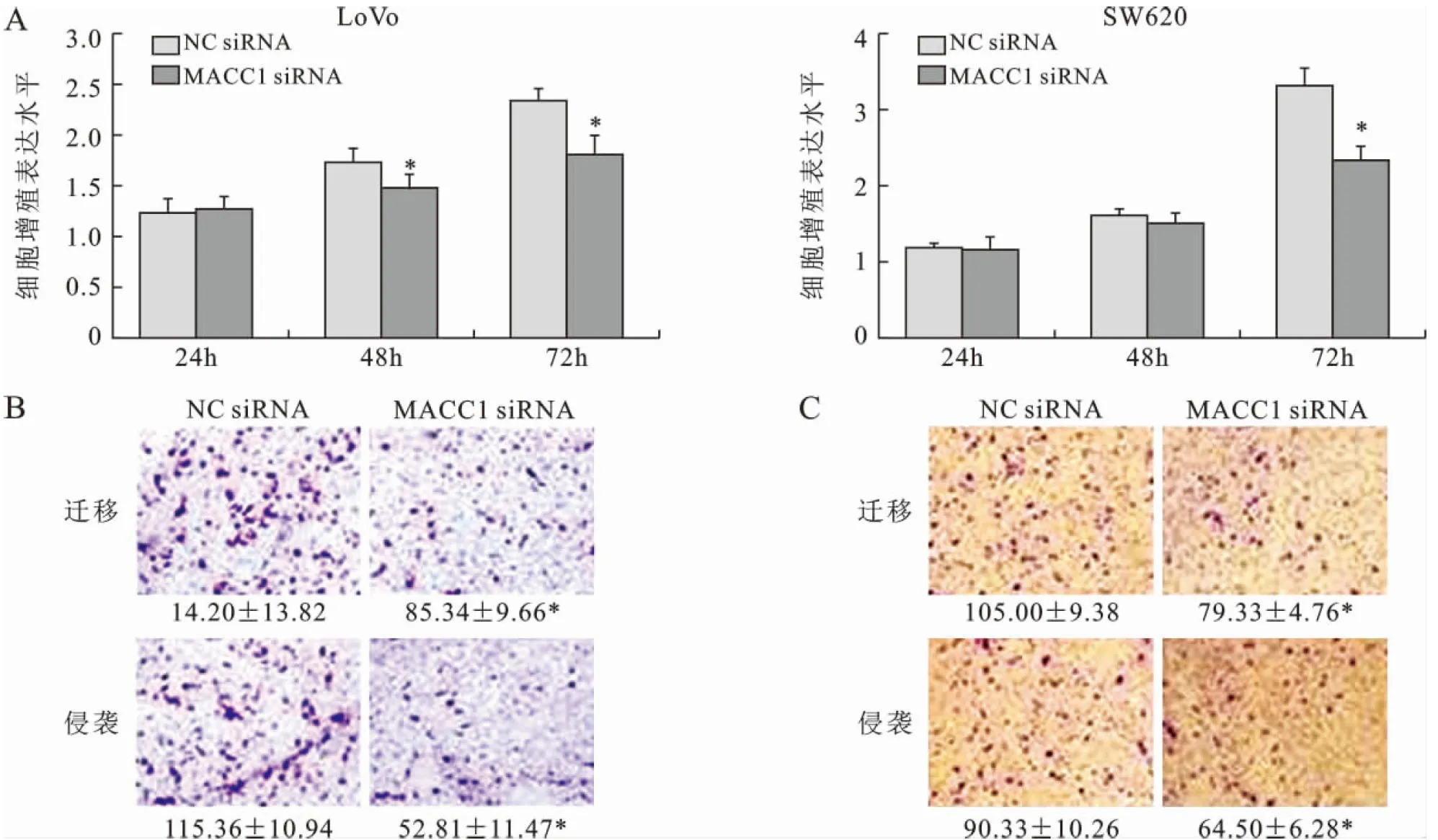
图3下调MACC1的表达抑制结直肠癌细胞的增殖、迁移和侵袭能力(A: 下调MACC1抑制癌细胞增殖;B: 下调MACC1抑制LoVo细胞迁移和侵袭;C: 下调MACC1抑制SW620细胞迁移和侵袭)
HGF/Met 信号途径是一个明确的促肿瘤生长转移的信号途径。它的激活可以引起细胞发生多种恶性转化,如上皮-间质转化(EMT)、肿瘤血管生成、细胞运动性增加、侵袭力增强,最终引起肿瘤转移[1]。Stein等[2]利用裸鼠模型研究发现,MACC1通过与HGF/Met途径形成正反馈关系参与到结直肠癌的转移过程中,促进肿瘤的原位生长以及肝转移。具体机制为,HGF与肿瘤细胞膜上表达的Met结合可以促进MACC1转位进入胞核,转录激活Met表达,进一步刺激HGF/Met途径的活性。MACC1的表达水平与胃癌、肺癌和肝癌的转移侵润程度呈显著正相关性,提示MACC1——HGF/Met正反馈机制可能普遍存在于固体肿瘤转移过程中。近期,Pichorner等[6]运用非侵入性的影像技术观察发现,在使用MACC1shRNA处理后,裸鼠结直肠癌模型中的原位瘤生长明显减慢,转移灶形成减少,提示MACC1是抗肿瘤转移治疗的重要潜在靶点。
本研究利用siRNA靶向抑制MACC1的表达,通过细胞学实验证实下调MACC1可以抑制结直肠癌细胞的增殖、迁移和侵袭,补充和巩固了已有研究成果,为将来以MACC1作为靶点的抗结直肠癌转移治疗提供了一定理论依据。
参考文献
[1]Arlt F, Stein U. Colon cancer metastasis: MACC1and Met as metastatic pacemakers [J]. Int J Biochem Cell Biol, 2009, 41(12): 2356-2359.
[2] Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF/Met signaling, predicts colon cancer metastasis [J]. Nat Med, 2009, 15(1): 59-67.
[3] Shirahata A, Sakata M, Kitamura Y, et al. MACC1as a marker for peritoneal-disseminated gastric carcinoma [J]. Anticancer Res, 2010, 30(9): 3441-3444.
[4] Shimokawa H, Uramoto H, Onitsuka T, et al. Overexpression of MACC1mRNA in lung adenocarcinoma is associated with postoperative recurrence [J]. J Thorac Cardiovasc Surg, 2011, 141(4): 895-898.
[5] Shirahata A, Fan W, Sakuraba K, et al. MACC1as a marker for vascular invasive hepatocellular carcinoma [J]. Anticancer Res, 2011, 31(3): 777-780.
[6] Pichorner A, Sack U, Kobelt D, et al. In vivo imaging of colorectal cancer growth and metastasis by targeting MACC1with shRNA in xenografted mice [J]. Clin Exp Metastasis, 2012, 29(6): 573-583.
(收稿:2015-01-15)
【中图分类号】R735.3
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.01.003
△ 陕西省人民医院心内二科
▽云南省人民医院消化内科

