芽孢杆菌Pb-4菌株鉴定及其抑菌活性的研究
郭 珺,武爱莲,闫 敏 ,李 娓,池秀蓉,丁玉川 ,焦晓燕
(1.山西省农业科学院 农业环境与资源研究所,山西省土壤环境与养分资源重点实验室,山西 太原 030031;2.北京市种子管理站,北京 100088)
芽孢杆菌Pb-4菌株鉴定及其抑菌活性的研究
郭珺1,武爱莲1,闫敏1,李娓1,池秀蓉2,丁玉川1,焦晓燕1
(1.山西省农业科学院农业环境与资源研究所,山西省土壤环境与养分资源重点实验室,山西 太原030031;2.北京市种子管理站,北京100088)
摘要:拮抗菌Pb-4是一株对多种植物病原菌有较强抑制作用的菌株。为了明确拮抗菌Pb-4的分类地位和抑菌机理,通过形态观察、生理生化特征和16S rRNA 基因序列同源性比对及系统发育树分析,对Pb-4菌株进行鉴定。并采用平板对峙培养法测定Pb-4菌株的抑菌谱,显微观察其抑菌作用,采用硫酸铵沉淀和乙醚、苯提取得到抑菌活性物。通过加热处理,明确高温对Pb-4菌株抑菌活性的影响。结果表明,Pb-4菌株鉴定为解淀粉芽孢杆菌;Pb-4菌株对番茄枯萎病菌、黄瓜枯萎病菌、西瓜枯萎病菌、青椒枯萎病菌、辣椒疫霉病菌、苹果腐烂病菌均有抑制作用,其抑菌活性具有广谱性。该菌菌液能明显抑制枯萎病菌孢子的萌发,并对病菌菌丝有致畸作用;对番茄枯萎病菌的抑制生长率达93%,经100,121 ℃高温处理后的抑菌活性分别是未处理菌液的98.9%和80.1%。从菌液中提取的蛋白、酶、抗生素类活性物质对枯萎病菌的生长繁殖均有很强的抑制效果。为Pb-4菌株在病原菌防治中的广泛应用提供强有力的理论依据。
关键词:解淀粉芽孢杆菌;枯萎病;拮抗菌;抑菌活性
枯萎病菌属于尖孢镰刀菌属(FusariumOxysporumon),是真菌中一个庞大的家族,它们普遍存在于土壤及动植物体内,常常导致蔬菜、瓜类、花卉等植物幼苗及成株枯萎与死亡,给农业生产带来巨大的经济损失[1]。目前,防治枯萎病的方法主要有抗病品种选育、轮作、土壤消毒(物理防治)以及化学防治和生物防治等[2]。其中,抗病品种选育周期长,且抗病性与农艺性状很难兼顾;由于农户的耕作和栽培习惯,轮作在实际生产中也很难实现;土壤消毒这一物理防治措施在实施过程中,将病原菌杀灭的同时也将土壤中的有益微生物菌群一同杀灭,而未取得有效的防治效果;使用化学农药防治会使病原菌对化学药剂产生抗药性,且农药残留则会引起土壤和地下水的污染以及对有益微生物种群的破坏;而随着人们环保意识的加强,生物防治因其具有对环境、生态和人类健康安全的优势,在世界各国得到了广泛的重视,并在发挥着越来越重要的作用[3]。
利用有益微生物防治植物病害始于1921年,90多年来可防治植物病害的微生物已涉及真菌、放线菌、细菌乃至病毒(噬菌体)等很多种群[4-5]。目前,应用广泛的有苏云金杆菌、枯草芽孢杆菌等产芽孢的杆状细菌。芽孢杆菌是土壤和植物微生态的优势微生物种群,能产生多种抑制植物病原真菌的抗菌物质,且其极易繁殖,适应环境能力强,具有很强的抗逆能力和抗菌防病作用,对人畜无害,不污染环境,因而,在生物防治植物病害中起着重要的作用[6-7]。许多性状优良的天然分离菌株已被成功地应用于植物病害的生物防治[4],但由于番茄、黄瓜等设施蔬菜枯萎病的专一性,目前研究的还较少。高芬等[8]研究了蜡质芽孢杆菌对黄瓜枯萎病菌的抑菌作用,闫敏[9]研究了木霉对黄瓜枯萎病菌的抑菌活性。经多年试验研究,山西省农业科学院农业环境与资源研究所设施土壤生态活性调理剂研制课题组成功地分离得到一株对多种枯萎病菌有极强抑制作用的芽孢杆菌Pb-4菌株,通过鉴定为解淀粉芽孢杆菌,而目前利用解淀粉芽孢杆菌抑制番茄枯萎病菌的研究尚未见报道。
本试验研究了Pb-4菌株发酵液与抑菌粗提物对番茄枯萎病菌的抑菌特性,旨在为有效防治蔬菜枯萎病提供理论依据。
1材料和方法
1.1试验材料
拮抗菌:芽孢杆菌Pb-4由山西省农业科学院农业环境与资源研究所设施土壤生态活性调理剂研制课题组分离保存。病原菌:番茄枯萎病菌fq由本课题组从日光温室自然发病株分离并经回接鉴定;西瓜枯萎病菌、青椒枯萎病菌由山西省农业科学院农产品质量安全与检测研究所提供;黄瓜枯萎病菌、辣椒疫霉病菌由中国农业科学院农业菌种保藏中心提供;苹果腐烂病菌由山西省农业科学院植物保护研究所提供;培养基[10]:NA 培养基;PDA 培养基;NB 液体培养基;PYG 液体培养基;β-1,3-葡聚糖培养基。
1.2试验方法
1.2.1拮抗菌株鉴定菌株的形态及生理生化特性:对菌株进行形态观察和生理生化鉴定[11-12]。
菌株16S rRNA 分析及系统发育树的构建:16S rRNA 的PCR 扩增[13],采用SDS加溶菌酶裂解法提取Pb-4菌株的基因组DNA;选用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGT TACCTTGTTACGACTT-3′)进行PCR扩增[14],委托上海生工生物工程有限公司进行测序。将所得序列在NCBI的GenBank数据库中进行同源性分析和多序列比对,根据比对结果应用MEGA软件、Neighbor-Jionig法构建系统发育树。
1.2.2拮抗菌Pb-4抑菌谱的测定利用平板对峙培养法测定Pb-4菌株对植物病原菌的抑菌活性[15-16]。
1.2.3拮抗菌Pb-4菌液对番茄枯萎病菌fq孢子及菌丝的抑制[17-21]将番茄枯萎病菌fq在PDA液体培养基中摇瓶培养72 h,菌液用灭菌的4层纱布过滤,制成孢子悬浮液,稀释至孢子含量为1×106个/mL,按1∶1的体积比加入到菌含量为1×108个/mL的Pb-4菌菌液中,28 ℃静置培养,48 h及72 h后镜检,400倍显微镜下观察Pb-4菌对fq孢子萌发及菌丝生长的影响,对照为不加Pb-4菌菌液的fq孢子悬浮液。
1.2.4拮抗菌Pb-4不同处理菌液对番茄枯萎病菌fq的抑菌活性研究[20-25]Pb-4菌活体培养液的制备:将活化24 h的拮抗菌Pb-4菌液接种于NB液体培养基中,接种量为3%,置28 ℃,150 r/min摇床振荡培养24 h,编号为0号菌液。
Pb-4菌上清液的制备:将Pb-4菌活体培养液置于灭菌的离心管中,在4 ℃条件下转速为10 000 r/min离心10 min,将上清液收集在无菌三角瓶中备用,编号为1号菌液。
拮抗菌热处理培养液的制备:将Pb-4菌活体培养液分别置于100 ℃水浴和121 ℃高压灭菌处理20 min,编号分别为2号菌液和3号菌液。
平板制备:在无菌培养皿中分别加入1,2 mL以上4种菌液,随后将冷却至约45 ℃熔融态的PDA固体培养基倒平板,摇匀。同时以不接种Pb-4菌的液体培养基与PDA固体培养基混合倒成的平板为对照,各设3次重复。
抑制生长率测定:待上述平板冷凝后接入预先培养5 d的直径为0.6 cm的fq菌块,倒置28 ℃温箱中培养,分别在1,3,5,7 d观察并记录fq菌落大小(以cm计)。采用生长速率法计算不同处理的抑制生长率。
抑制生长率(R1)=((对照菌落直径-0.6)-(处理菌落直径-0.6))/(对照菌落直径-0.6)×100%。
相对抑菌活性测定:在灭菌后的培养皿中加入1 mL的fq菌液,随后将冷却至约45 ℃熔融态的PDA固体培养基倒入平板,摇匀,待凝固后将蘸有0,1,2,3号菌液20 μL的滤纸片以对角线方向贴于fq平板上,同时将蘸有无菌培养液的滤纸片贴于平板中心作为空白对照,28 ℃培养。然后,在1,3,5,7 d 观察并记录抑菌圈直径,检测其对fq的抑菌活性,以未经热处理的0号菌液为对照,计算1,2,3号菌液的相对抑菌活性。将0号活体培养液的抑菌活性定为100%。
相对抑菌活性(R2)=处理抑菌圈直径/0号活体培养液抑菌圈直径×100%。
1.2.5拮抗菌Pb-4抗菌蛋白粗提液的制备及抗菌活性鉴定[26-31]采用硫酸铵沉淀法提取拮抗菌Pb-4菌的拮抗物质。将斜面活化的Pb-4菌接种到装有50 mL NB培养基的250 mL三角瓶中,28 ℃培养48 h,15 000 r/min离心15 min,得上清液;在上清液中加入粉状硫酸铵,使硫酸铵饱和度达到80%,4 ℃冰箱过夜。次日,10 000 r/min离心15 min,弃上清,用适量的Tris-HCl缓冲液(20 mmol/L,pH值7.5)溶解沉淀。然后用同一缓冲液4 ℃条件下透析48 h,PEG 6000浓缩,制得蛋白粗提液;将蛋白粗提液经100,121 ℃处理后,对fq的抑菌活性进行测定;并将蛋白粗提液进行SDS-PAGE凝胶电泳,初步确定抗菌蛋白分子量。
1.2.6拮抗菌Pb-4非蛋白性拮抗物的提取及抑菌活性研究[9]按3%的接种量将Pb-4菌加入NB培养基中,28 ℃摇瓶培养48 h后,10 000 r/min离心10 min,取上清液分别加入等体积的乙醚、苯,封闭并剧烈振荡,静置。取有机相于三角瓶中,重复2~3次,待有机物挥发干净后,取残留物用无水乙醇溶解,进行活性检测。对应地将无水乙醇、乙醚、苯作为对照,与提取的活性物质采用琼脂平板扩散法观察抑菌活性。
1.2.7拮抗菌Pb-4 β-1,3-葡聚糖酶活性的确定[32]β-1,3-葡聚糖酶可以分解病原菌菌丝体中的葡聚糖,从而达到抑制病原菌生长的目的。将拮抗菌Pb-4接种于β-1,3-葡聚糖培养基上,观察菌株生长及培养基水解情况;并将Pb-4菌连接引物,进行β-1,3-葡聚糖酶基因的PCR扩增,通过SDS-PAGE凝胶电泳,初步确定Pb-4菌β-1,3-葡聚糖的酶活性。
引物序列为:正向5′-AATTCCATGGATGTTTT ATCGTATGAAACG-3′,反向5′-AATTGGATCCTTATT TTTTTGTATAGCGCAC-3′。
PCR 条件为:96 ℃预变性50 s;94 ℃变性50 s,56 ℃退火2 min,72 ℃延伸1.5 min,30个循环。
2结果与分析
2.1Pb-4菌株的分类鉴定
2.1.1Pb-4菌株的形态特征菌体呈杆状,长为3.0~3.3 μm,宽为1.0~1.2 μm,革兰氏染色阳性,好氧,内生芽孢;在NA培养基上形成乳白色不透明菌落,生长初期表面平滑凸起、湿润饱满,后期干燥有褶皱,表面粗糙,菌落边缘不整齐;在液体培养基中静止培养时,表面形成白色菌膜。
2.1.2Pb-4菌株的生理生化特征Pb-4菌株葡萄糖发酵、淀粉水解、明胶液化、V.P反应、接触酶反应、甲基红反应、硝酸盐还原等试验均为阳性,可在pH值6.0~9.0条件下生长,适宜生长温度为25~39 ℃。
2.1.316S rRNA 序列测定及分析Pb-4菌株的16S rRNA 长度为1 450 bp,在GenBank数据库中比对结果显示,其属芽孢杆菌属,与解淀粉芽孢杆菌聚为一群,具有99%的相似性;根据比对结果,用MEGA软件、Neighbor-Jionig法构建系统发育树(图1),结合形态特征和生理生化特征,鉴定Pb-4菌株为解淀粉芽孢杆菌。
2.2Pb-4菌株的抑菌广谱性
采用对峙培养方法确定抑菌广谱的结果如表1所示。由表1可知,Pb-4菌株对番茄枯萎病菌、黄瓜枯萎病菌、西瓜枯萎病菌、青椒枯萎病菌、辣椒疫霉病菌、苹果腐烂病菌均有抑制作用,其抑菌活性具有广谱性。

图1 Pb-4菌株 16S rRNA 序列的系统发育树

病原菌Pathogens抑菌圈直径/mmThediameterofinhibitionzone番茄枯萎病菌F.oxysporumtomato38.14±0.96黄瓜枯萎病菌F.oxysporumcucumber33.40±0.90西瓜枯萎病菌F.oxysporumwatermelon37.20±0.70青椒枯萎病菌F.oxysporumgreenpepper32.54±0.97辣椒疫霉病菌PhytophthoracapsiciLeo-nian36.80±0.60苹果腐烂病菌Valsaceratosperma30.25±0.91
2.3Pb-4菌对番茄枯萎病菌孢子及菌丝的抑制作用
在400×光学显微镜下观察显示,对照孢子萌发正常,形成大量菌丝,菌丝修长、光滑(图2-A);Pb-4菌处理枯萎病菌孢子48 h后,孢子及菌丝产生了明显变化,孢子数量较对照明显减少,萌发的芽管变畸形,细胞顶端或中部膨大,形成圆形或不规则大泡囊,有的孢子被溶解,视野中有孢子破损痕迹和孢子残存物,菌丝扭曲老化,提早产生厚垣孢子、菌丝断裂(图2-B)。
2.4Pb-4菌不同处理后菌液对番茄枯萎病菌的平皿抑菌活性测定结果
通过观察并记录番茄枯萎病菌菌落大小及不同菌液贴片抑菌圈的大小,从表2,3可以看出,随着拮抗菌Pb-4菌与枯萎病菌相互作用时间的延长,抑制效果逐步提高;抑制生长率随着Pb-4菌添加量的增加而提高,其中,当菌液量为2 mL时,Pb-4菌的活体培养液的抑制生长率最高,达93%;100 ℃热处理菌液抑制生长率仅次于活体培养液,为91.1%,其相对抑菌活性达98.9%;121 ℃热处理菌液抑制生长率也在80%以上,相对抑菌活性达80.1%;而离心后上清液的抑制生长率较低,其相对抑菌活性为66.4%。根据表2,3结果可以初步认为,Pb-4菌对番茄枯萎病菌有极强的抑制作用,且抑菌物质对高温高压不敏感,100 ℃热处理后抑菌活性基本没有降低,而121 ℃高温高压处理后抑菌活性仍在80%以上。
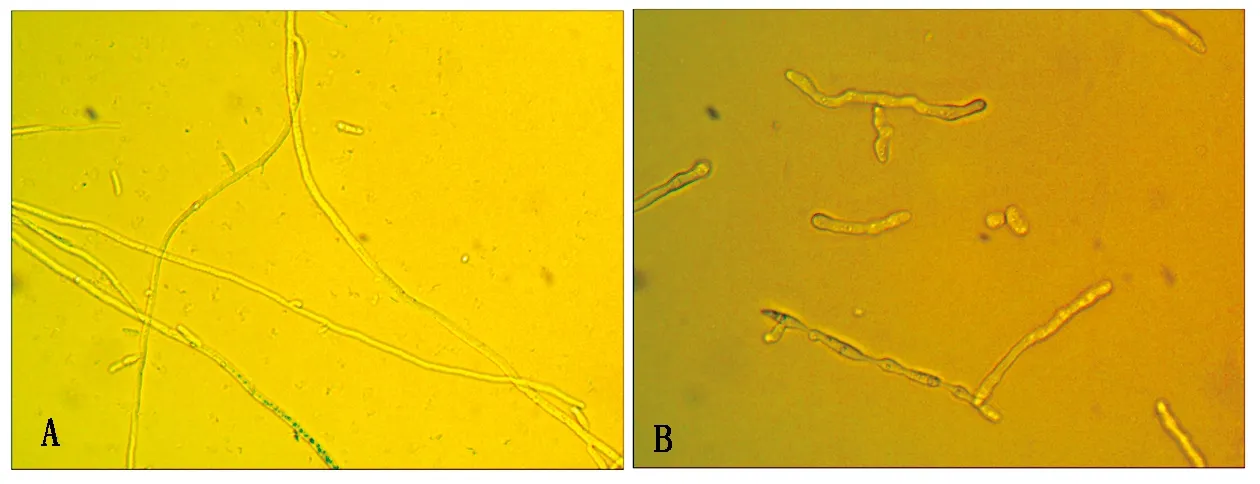
A.对照番茄枯萎病菌正常孢子及菌丝;B.加入Pb-4
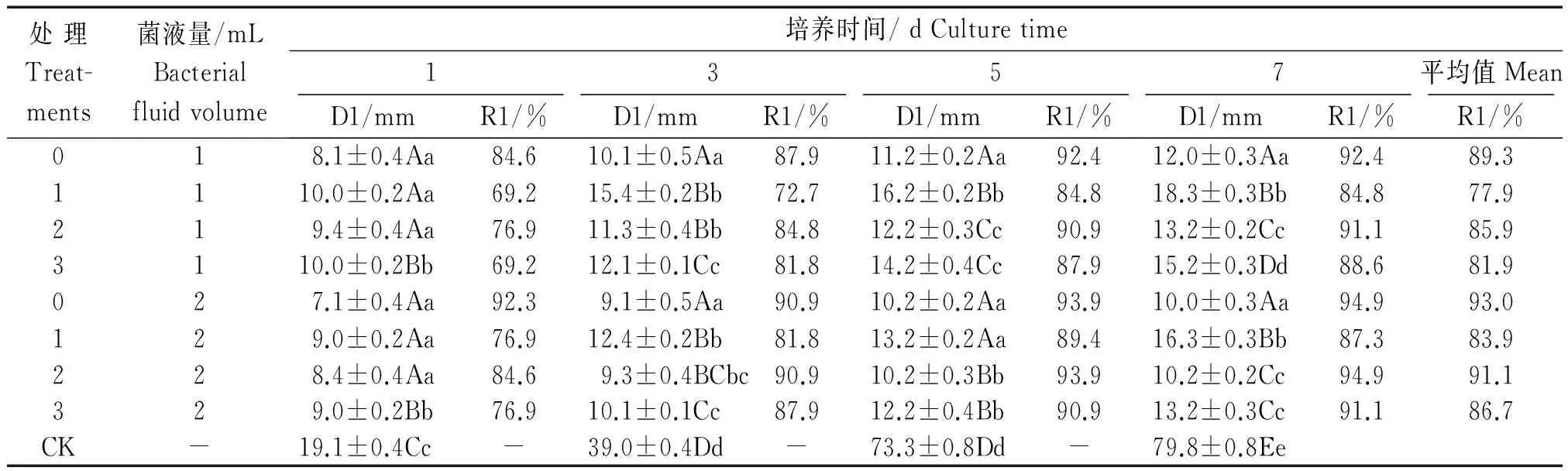
处理Treat-ments菌液量/mLBacterialfluidvolume培养时间/dCulturetime1357平均值MeanD1/mmR1/%D1/mmR1/%D1/mmR1/%D1/mmR1/%R1/%018.1±0.4Aa84.610.1±0.5Aa87.911.2±0.2Aa92.412.0±0.3Aa92.489.31110.0±0.2Aa69.215.4±0.2Bb72.716.2±0.2Bb84.818.3±0.3Bb84.877.9219.4±0.4Aa76.911.3±0.4Bb84.812.2±0.3Cc90.913.2±0.2Cc91.185.93110.0±0.2Bb69.212.1±0.1Cc81.814.2±0.4Cc87.915.2±0.3Dd88.681.9027.1±0.4Aa92.39.1±0.5Aa90.910.2±0.2Aa93.910.0±0.3Aa94.993.0129.0±0.2Aa76.912.4±0.2Bb81.813.2±0.2Aa89.416.3±0.3Bb87.383.9228.4±0.4Aa84.69.3±0.4BCbc90.910.2±0.3Bb93.910.2±0.2Cc94.991.1329.0±0.2Bb76.910.1±0.1Cc87.912.2±0.4Bb90.913.2±0.3Cc91.186.7CK-19.1±0.4Cc-39.0±0.4Dd-73.3±0.8Dd-79.8±0.8Ee
注:D1为菌落直径/mm;同列数据后不同大小写字母分别表示在P<0.01和P<0.05水平下差异显著。表3同。
Note:D1.Colony diameter;In the same column the data following different letters mean significant difference atP<0.01 andP<0.05 levels.The same as Tab.3.

表3 Pb-4菌培养液对番茄枯萎病菌的相对抑菌活性
注:表中D2为抑菌圈直径/mm。
Note:D2.Inhibitionzone diameter.
2.5Pb-4菌抗菌蛋白粗提液的抗菌活性鉴定
取培养48 h的Pb-4菌液,15 000 r/min离心15 min,得上清液;在上清液中加入粉状硫酸铵,使硫酸铵饱和度达到80%,4 ℃冰箱过夜。次日,10 000 r/min离心15 min,弃上清,用适量的Tris-HCl缓冲液(20 mmol/L,pH值7.5)溶解沉淀。然后用同一缓冲液透析48 h(4 ℃),PEG6000浓缩,制得粗提蛋白液(4-1);将粗提蛋白在沸水100 ℃保温15 min(4-2);粗提蛋白在121 ℃高温高压处理15 min(4-3)。分别将上清液、蛋白粗提液(4-1)、100 ℃处理的蛋白液(4-2)和121 ℃处理蛋白液(4-3),进行抑制病原菌活性检测(图3)。结果表明,抑菌圈直径分别是10.53,19.89,17.55,15.32 mm,高温100,121 ℃处理后的抑菌活性分别是未处理蛋白的88.2%和77.0%。蛋白粗提液进行SDS-PAGE凝胶电泳,初步确定抗菌蛋白分子量为 14.4,45.0 kDa(图4)。

图3 Pb-4菌不同处理蛋白粗提液的抗菌活性鉴定

图4 Pb-4菌抑菌蛋白凝胶电泳图
2.6Pb-4菌非蛋白拮抗物(抗菌素)的提取及活性检测结果
用乙醚、苯提取的活性物质,自然风干后为灰白色结晶。通过琼脂平板扩散法检测抑菌活性,结果显示,无水乙醇、乙醚和苯对番茄枯萎病菌没有影响,而用乙醚和苯提取的活性物质K1,K2的拮抗活性较高,抑菌圈较大,抑菌效果明显(图5)。

图5 Pb-4菌乙醚、苯提取物的抑菌活性检测
2.7Pb-4菌β-1,3-葡聚糖酶的确定
Pb-4菌株接种于β-1,3-葡聚糖培养基上3 d后,菌株将培养基茯苓粉中的β-1,3-葡聚糖与苯胺蓝结合生成蓝色,催化水解,呈现无色的水解圈,使蓝色变浅逐渐消失(图6)。此外,从图7的β-1,3-葡聚糖酶凝胶电泳图中可以看到,电泳条带清晰,可以初步确认,该菌株具有β-1,3-葡聚糖酶活性。

图6 Pb-4菌产β-1,3-葡聚糖酶的确定
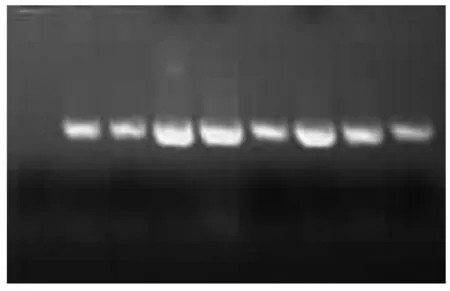
图7 Pb-4菌产β-1,3-葡聚糖酶凝胶电泳
3结果与讨论
芽孢杆菌内生芽孢,繁殖能力强,有利于工业化生产,又是自然界中广泛存在的非致病细菌,对人畜无害,不污染环境。因此,自1945年Johnson等报道枯草芽孢杆菌产生抗菌物质后[33],半个多世纪以来各国的研究工作者对它可望成为一种生物控制因素而寄予极大的希望和关注。芽孢杆菌产生的抗菌活性物质大多为低分子抗生素以及蛋白或多肽类化合物[34]。本课题组分离保存的芽孢杆菌Pb-4能够抑制多种植物病原真菌,经鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。其发酵液中至少含有2种以上的抗菌活性物质,分离得到的活性物质具有极强的抑菌活性,所产生的抑菌圈大于有关文献报道的拮抗菌种,而且具有很多优良的特性,含有抗菌蛋白、抗生素类活性物质和β-1,3-葡聚糖酶等多种可抑制真菌病原菌生长的抗菌物质,其中,抗菌蛋白分子量为 14.4,45.0 kDa,这与张宝俊等[31](20.3 kDa)、田祖光[35](35 kDa)、王纳贤[36](13 kDa),刘莲娜等[37](50 kDa)的报道均有不同,可能是由于不同的菌株其产生抗菌物质的基因不同,或由于试验条件、材料、测试方法等不同引起的,且目前均未对这些抗菌蛋白的分子结构进行深入的研究,今后将对其进行进一步的研究。此外,Pb-4菌发酵液还具有很好的热稳定性,经100,121 ℃热处理后的抑菌活性仍可达到98.9%和80.1%,其热稳定性较文献报道的要高,热处理后所含抑菌物质成分还有待于进一步研究确定。
我国近几年才开始进行解淀粉芽孢杆菌在抑制病原菌方面的研究,武翠红[38]、冉晓潇[39]、杨娜[40]、曲春鹤[41]、雷白时[42]等,分别研究了解淀粉芽孢杆菌对棉花黄萎病、山茶灰斑病、白菊枯萎病、辣椒根腐病、西瓜枯萎病等病菌的拮抗作用,而就本课题组分离的具有多种抗菌物质、可抑制多种病原菌的耐热型解淀粉芽孢杆菌在防治番茄枯萎病的应用上还未见报道。有关Pb-4菌株的定殖、田间防病应用目前也已进行了深入研究;此外,在田间试验中发现,Pb-4菌株不仅对病菌有抑制作用,而且对植株的生长有促进作用,因此,对Pb-4菌株的促生长作用也将进行进一步研究。本研究结果将为Pb-4菌的扩大生产和在农业病原菌防治中的广泛应用提供强有力的理论依据。
参考文献:
[1]Baker K F.Evolving concepts of biological control of plant pathogens[J].Ann Rev Phytopathol,1987,25:67-85.
[2]Utkhede R S,Smith E M.Promotion of apple tree growth and fruit production by the EBW-4 strain ofBacillussubtilisin apple replant disease soil[J].Can J Microbial,1992,38:1270-1273.
[3]Anthony Arguelles-Arias,Marc Ongena,Badre Halimi,et al.BacillusamyloliquefaciensGA1 as a source of potent antibiotics and other secondary metabolites for biocontrol of plant pathogens[J].Microbial Cell Factories,2009,8:63.
[4]王英国,王军华,权春善,等.解淀粉芽孢杆菌抗菌活性物质的分离纯化及抑菌活性研究[J].中国生物工程杂志,2007,27(12):41-45.
[5]陈中义,张杰,黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报,2003,33(2):97-103.
[6]刘静,王军,姚建铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物学报,2004,44(4):511-513.
[7]喻子牛.微生物农药及其产业化[M].北京:科学出版社,2000:1-11.
[8]高芬,马利平,乔雄梧,等.蜡质芽孢杆菌BC98-Ⅰ发酵液与抑菌粗提物对黄瓜枯萎病菌的抑菌特性研究[J].中国生态农业学报,2006,14(1):189-192.
[9]闫敏.黄瓜枯萎病的生物防治研究[D].雅安:四川农业大学,2003.
[10]范秀容,李广武,沈萍.微生物学实验[M].北京:高等教育出版社,1995:260-262.
[11]布坎南 R E,吉本斯 N E.伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1984:729-797.
[12]东秀珠,蔡妙英.一般细菌分类手册[M].北京:科学出版社,2001:145-155.
[13]陈力,王中康,黄冠军,等.柑橘溃疡病生防菌株CQBS03 的鉴定及其培养特性研究[J].中国农业科学,2008,41(8):2537-2545.
[14]曲田丽,张淑颖,金玉兰.合欢内生菌H8 的分离、鉴定及其抗菌代谢物质研究[J].华北农学报,2015,30(1):54-60.
[15]齐爱勇,魏东盛,刘大群,等.番茄灰霉病菌拮抗细菌B21的鉴定[J].植物保护科学,2006,22(9):360-363.
[16]郭珺,梁改梅,池秀蓉,等.适宜组合的饲用复合酶高产优势菌群的筛选[J].饲料研究,2011,33(2):30-32.
[17]方中达.植病研究方法[M].北京:农业出版社,1982:143.
[18]李芳,史怀,刘波,等.淡紫拟青霉对尖孢镰刀菌的拮抗作用与机制分析[J].植物保护学报,2005,32(4):373-378.
[19]马利平,郝变青,秦曙,等.芽孢杆菌B96-Ⅱ对芦笋茎枯病的防治及机制研究[J].华北农学报,2008,23(2):180-184
[20]马利平,乔雄梧,高芬,等.B96-Ⅱ对3种枯萎病的防治效果及拮抗物质初步分析[J].华北农学报,2006,21(4):99-102.
[21]郝变青,马利平,乔雄梧,等.拮抗菌对黄瓜枯萎病菌的室内生物活性[J].应用与环境生物学报,2001,7(2):155-157.
[22]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1990:161-168.
[23]马利平,郝变青,秦曙,等.芦笋茎枯病的生物防治及机理研究[J].中国生态农业学报,2009,17(6):1229-1233.
[24]Liu C H,Chen X,Liu T,et al.Study of the antifungal activity ofAcinetobacterbaumanniiLCH001invitroand identification of its antifungal components[J].Appl Microbiol Biotechnol,2007,76:459-466.
[25]王彩霞,张清明,李桂舫,等.苹果树腐烂病拮抗细菌菌株BJ1的鉴定及其抑菌作用[J].植物保护学报,2012,39(5):431-437.
[26]Lisianne Brittes Benitez,Renata Voltolini Velho,Marcia Pagno Lisboa,et al.Isolation and characterization of antifungal peptides produced byBacillusamyloliquefaciensLBM5006[J].The Journal of Microbiology,2010,48(6):791-797.
[27]裴炎,李先碧,彭红卫,等.抗真菌多肽APS-1的分离纯化与特性[J].微生物学报,1999,39(4):441-447.
[28]郝变青,马利平,乔雄梧,等.芽孢杆菌BC98-Ⅰ拮抗蛋白性质及其对黄瓜枯萎病菌的抑菌作用[J].石河子大学学报,2004,22(增刊):91-94.
[29]高芬,马利平,乔雄梧,等.抗黄瓜枯萎病的芽孢杆菌BC98-I抗真菌物质的初步分离研究[J].石河子大学学报,2004,22(增刊):88-90.
[30]中山大学生物系生化微生物学教研室.生化技术论[M].北京:人民教育出版社,1978.
[31]张宝俊,张家榕,韩巨才,等.内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性[J].植物保护学报,2010,37(2):143-146.
[32]陈玉娟,沈微,陈献忠,等.解淀粉芽孢杆菌β-1,3-1,4-葡聚糖酶的高效表达[J].生物技术,2011,21(2):22-26.
[33]谢栋,彭憬,王津红,等.枯草芽孢杆菌抗菌蛋白X98III的纯化与性质[J].微生物学报,1998,38(1):13-19.
[34]权春善,王军华,徐洪涛,等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].2006,46(1):7-12.
[35]田祖光.棉花黄萎病拮抗细菌12-34 菌株的分离鉴定及抗菌蛋白纯化[D].保定:河北农业大学,2009.
[36]王纳贤.尖孢镰刀菌拮抗细菌的筛选与抗菌蛋白的分离[D].保定:河北大学,2010.
[37]刘莲娜,孙伟明,郭巍,等.一株新的拮抗细菌SL19 及其抑菌活性物质[J].微生物学通报,2011,38(8):1199-1206.
[38]武翠红.大丽轮枝菌拮抗细菌RS-25菌株的分离鉴定、发酵及抗菌多肽的纯化[D].保定:河北农业大学,2008.
[39]冉晓潇.解淀粉芽孢杆菌对山茶灰斑病生物防治的研究[D].雅安:四川农业大学,2011.
[40]杨娜.一株抗药用白菊枯萎病生防菌的分离与生防效应研究[D].南京:南京农业大学,2011.
[41]曲春鹤.辣椒根腐病拮抗细菌的筛选鉴定及其作用效果的初步研究[D].长春:东北农业大学,2011.
[42]雷白时.西瓜枯萎病拮抗芽孢杆菌HD-5菌株的筛选与发酵工艺[D].保定:河北农业大学,2012.
Identification ofBacillussp. Pb-4 and Its Unitilization for Antimicrobial Activity
GUO Jun1,WU Ailian1,YAN Min1,LI Wei1,CHI Xiurong2,DING Yuchuan1,JIAO Xiaoyan1
(1.Institute of Agricultural Environment & Resource,Shanxi Academy of Agricultural Sciences,Key Laboratory of Soil Environment & Nutrient Resources,Taiyuan030031,China;2.Beijing Seed Administration Station,Beijing100088,China)
Abstract:A bacillus strain,named as Pb-4,which showed significant antagonistic activity against to many plant pathogenic fungi.The study was in order to determine the taxonomic status and antimicrobial mechanism of Pb-4.The strain was identified as Bacillus amyloliquefaciens based on its morphological and physiological properties and its 16S rRNA sequence.The antibacterial activity was characterized by plate two-way cultivation.Antibacterial compound from the identified strain was separated and purified by ammonium sulfate precipitation,diethyl ether and benzene abstract.Bacillus amyloliquefaciens was isolated that not only has antibacterial activity against F.oxysporum tomato,F.oxysporum cucumber, F.oxysporum watermelon and F.oxysporum green pepper;but also against Phytophthora capsici Leonian and Valsa ceratosperma.The bacteria liquid of the Pb-4 strain showed that strong antifungal activity against spore germination and hyphal growth of tomato wilt pathogen.The bacteria fluid to fusarium wilt diseases of tomato inhibition of growth rate was 93%.The antimicrobial activity of 100,121 ℃ high temperature treatment of untreated bacteria liquid of 98.9% and 80.1%.From the bacteria liquid extract of proteins,enzymes,and antibiotic active substances,had strong growth inhibition effect for Fusarium oxysporum.The results can provide a strong theoretical basis for the wide application of Pb-4 in the prevention and control of agricultural pathogenic bacteria.
Key words:Bacillus amyloliquefaciens;Fusarium wilt;Antagonistic bacteria;Antimicrobial activity
doi:10.7668/hbnxb.2016.02.036
中图分类号:S432
文献标识码:A
文章编号:1000-7091(2016)02-0224-07
作者简介:郭珺(1974-),女,山西原平人,副研究员,硕士,主要从事农业微生物资源利用研究。通讯作者:焦晓燕(1964-),女,山西临猗人,研究员,博士,主要从事植物营养研究。
基金项目:山西省科技攻关项目(20120311009-2);山西省财政支农项目(2014NYST-01);山西省农业科学院重点科研项目(YZD0907)
收稿日期:2016-02-02

