SPF鸡胚St3galⅠ基因的克隆及其在MDCK细胞中的表达
陆玉建,吴信明,管 宇,张松林,李树芳,韩文瑜,沈志强1,
(1.山东省滨州畜牧兽医研究院 博士后科研工作站,山东 滨州 256600;2.吉林大学 博士后科研流动站,吉林 长春 130062;3.滨州学院 生命科学系,山东 滨州 256603;4.山东省滨州畜牧兽医研究院,山东 滨州 256600;5.郑州大学 生命科学院,河南 郑州 450001)
SPF鸡胚St3galⅠ基因的克隆及其在MDCK细胞中的表达
陆玉建1,2,3,吴信明4,管宇4,张松林4,李树芳5,韩文瑜2,沈志强1,4
(1.山东省滨州畜牧兽医研究院 博士后科研工作站,山东 滨州256600;2.吉林大学 博士后科研流动站,吉林 长春130062;3.滨州学院 生命科学系,山东 滨州256603;4.山东省滨州畜牧兽医研究院,山东 滨州256600;5.郑州大学 生命科学院,河南 郑州450001)
摘要:为了提高MDCK细胞表面禽流感病毒(AIV)受体的水平,以12日龄的SPF鸡胚为试材,通过反转录PCR扩增唾液酸转移酶Ⅰ基因(St3galⅠ),并将回收的片段插入到pMD18-T载体中。酶切pMD18-T-St3galⅠ和pCI-neo质粒,将目的片段进行连接,构建含有St3galⅠ基因的真核表达载体。利用脂质体介导法转染MDCK细胞,在G418的筛选下,获得具有抗性的转基因细胞系。通过细胞克隆化培养和PCR检测,筛选可稳定表达St3galⅠ基因的细胞株。结果表明,从鸡胚中克隆的St3galⅠ基因成功的插入到pCI-neo质粒,从而实现真核表达载体pCI-neo-St3galⅠ的构建。在G418选择压力下,初步获得了稳转目的基因的MDCK细胞系。将抗性细胞混合克隆进行稀释,经选择后挑选出30个单克隆抗性细胞株。分别以转染细胞基因组DNA和总RNA为模板,经PCR检测显示,目的基因已整合入MDCK细胞的基因组中并可稳定的进行表达。
关键词:唾液酸;St3galⅠ基因;MDCK;转染;G418;PCR
据统计,每年有3 000~5 000万人感染流感病毒而引起严重的呼吸道疾病,在流感爆发的季节,则可造成数百万人死亡[1]。流感病毒属于正粘病毒科,具有分节的负链基因组,包括A、B、C3个属,其中A型流感病毒可感染人、猪、马等哺乳类和多种鸟类,在冬季较易发生[2]。禽流感(Avianinfluenza,AI)是由A型流感病毒引起的一种禽类感染病,自1871年首次在意大利报道以来,世界各地多次出现AI的暴发和流行,不但给养禽业造成巨大的经济损失,还对人类公共卫生安全构成严重的威胁[3-6]。禽流感病毒(Avianinfluenzavirus,AIV)如何感染宿主,相关的分子机制还不清楚。目前,人们普遍认为AIV颗粒表面的血凝素(Hemagglutinin,HA)和宿主细胞表面受体起到了关键的作用[7]。HA是流感病毒最主要的糖蛋白,具有凝集红细胞的能力和较强的免疫原性,能够刺激机体产生保护性抗体,是流感疫苗研究的首选抗原,它可以识别靶细胞受体并与之结合,是AIV产生致病力和决定宿主特异性的重要蛋白[6,8]。病毒的增殖一般要经历吸附、侵入、增殖、裂解和释放等过程,AIV能够吸附于宿主细胞,与细胞表面的唾液酸(Sialicacid,SA)具有密切的关系[3,9-10]。SA是指一系列含9个碳原子的羧基化单糖衍生物的总称,在自然界分布广泛,为构成糖类复合物结构和功能的重要单位[11-12]。SA常位于细胞表面糖蛋白、糖脂分子或其他多糖中糖链的最外侧加帽位置,携带负电荷,对于细胞之间的识别及细胞和细胞外基质的相互作用有重要影响,可作为流感病毒的受体,流感病毒通过HA与宿主细胞SA特异性结合而感染宿主[13-15]。在唾液酸转移酶(Sialyltransferases,STs)的作用下,SA可转移到细胞表面的糖脂或糖蛋白末端[11,14-16]。SA常与糖链N末端的半乳糖(Galactoside,Gal)以α2,3或α2,6糖苷键连接[12,17-18]。流感病毒受体主要有2种:一种为唾液酸α-2,3半乳糖(SAα-2,3Gal);另一种为唾液酸α-2,6半乳糖(SAα-2,6Gal)[11,15]。大多数AIV优先结合于SAα-2,3Gal受体,人流感病毒则优先结合于SAα-2,6Gal受体[10,19]。生物体内的STs分为两类:介导SA以α2,6糖苷键形式连接到Gal上的是ST6Gal转移酶;介导SA以α2,3糖苷键形式连接到Gal上的是ST3Gal转移酶,编码该酶的基因有6种(St3galⅠ~Ⅵ),其中ST3GalⅠ和Ⅱ能使Ⅲ型糖链(Galβ1,3GalNAc-R)唾液酸化[18,20]。ST3GalⅠ催化完成AIV α2,3糖苷键连接结构的合成,负责把胞苷一磷酸-β-N-乙酰神经氨酸(CMP-Neu5AC)底物中的SA以α2,3连键的方式转移到Galβ1-3(4)GlcNAc糖链上,从而形成AIV的完整受体[13,21]。传统方法制备禽流感疫苗,通常采用鸡胚培养法,该方法存在周期过长,成本较高等诸多不足之处,而以细胞作为基质培养AIV则不存在上述问题。但通过细胞生产AIV,现阶段产率还较低。已有的研究表明,宿主细胞表面SA的含量与AIV的增殖具有密切的关系,STs在此过程中发挥重要作用。因此,通过基因工程技术提高细胞中STs的含量,对于细胞培养法生产AIV疫苗具有重要的意义。本试验以12日龄的SPF鸡胚为试材,利用RT-PCR扩增St3galⅠ基因,通过脂质体介导法转染MDCK细胞,在G418选择压力下,经克隆化培养和分子检测,成功获得了可稳定表达St3galⅠ基因的细胞株。试验结果对于增加宿主细胞表面唾液酸化水平,促进AIV在细胞基质中的有效增殖具有重要的现实意义。
1材料和方法
1.1试验材料
SPF鸡胚和MDCK细胞由山东绿都生物科技有限公司提供;pMD18-T载体、T4DNA连接酶和限制性内切核酸酶购自TaKaRa公司;pCI-neo载体和DH5α菌株由山东省滨州畜牧兽医研究院保存;反转录试剂盒、TaqDNA聚合酶和DNA Marker3购自兰州鹏程生物公司;质粒提取试剂盒和胶回收试剂盒购自北京天根生化科技有限公司;DNA提取试剂盒、RNA提取试剂盒、G418(新霉素)、DMEM培养基、胰蛋白酶、转染试剂Lipofectamine 2000 Regeant购自Invitrogen公司;胎牛血清(FBS)购自GIBCO公司;引物由上海生工生物工程股份有限公司合成。
1.2试验方法
1.2.1引物的设计根据NCBI数据库鸡唾液酸转移酶Ⅰ(ST3Gal Ⅰ)和β-actin基因序列信息,利用引物设计软件Primer Premier 5设计引物(下划线为添加的酶切位点)。St3galⅠ LP:5′-GGGGAATTC ATGGTCACCGTCAGGAAA-3′(EcoRⅠ),St3galⅠ RP:5′-GGGGTCGACTCATCTGCCCTTGAAAAAT-3′(SalⅠ);β-actinLP:5′-CCTCTATGCCAACACAGT-3′,β-actinRP:5′-GTACTCC TGCTTGCTGAT-3′。
1.2.2目的基因的克隆以12日龄的SPF鸡胚为试材,提取RNA,反转录为cDNA,用高保真Taq酶扩增St3galⅠ基因。PCR反应体系如下:5×phusion10μL,10mmol/LdNTP4μL,St3gal Ⅰ LP 2 μL,St3galⅠ RP 2 μL,DMSO 1.5 μL,Template cDNA 2 μL,Nuclease-free water 28 μL,Phusion DNA polymerase 0.5 μL,总体积为50 μL。反应程序为:98 ℃预变性30 s;98 ℃变性10 s,60 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸10 min;4 ℃保存。产物用1%的琼脂糖凝胶电泳检测,回收目的片段并与pMD18-T载体进行连接。连接产物转化大肠杆菌DH5α感受态细胞。通过菌落PCR鉴定阳性克隆。反应程序如下:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸10 min。挑取阳性克隆,摇菌,提质粒,用EcoRⅠ-SalⅠ进行酶切鉴定。将含目的片段的质粒pMD18-T-St3galⅠ进行测序。1.2.3真核表达载体的构建分别用Sal Ⅰ-EcoRⅠ酶切pMD18-T-St3galⅠ(图1-A)和pCI-neo质粒(图1-B),将回收的目的片段连接,转化,通过PCR和酶切筛选阳性重组克隆,从而实现真核表达载体pCI-neo-St3galⅠ的构建(图1-C)。
图1 pCI-neo-St3galⅠ载体构建策略
1.2.4G418敏感性试验将MDCK 细胞接种 24 孔细胞培养板,待细胞汇合度达到80%左右时加入含G418的DMEM培养基,使其浓度分别为0,100,300,500,700,900 μg/mL,置于37 ℃、5%CO2培养箱中培养,每3~5 d更换一次筛选培养基。每日观察细胞生长状况,培养2周后绘制细胞生长曲线,确定G418的筛选浓度。
1.2.5MDCK细胞的转染用无内毒素质粒提取试剂盒提取质粒,测定浓度。将MDCK细胞平铺到24孔板,第2天细胞汇合度达到80%~90%时转染。用无血清的DMEM稀释质粒使其浓度达到2 μg/100 μL。在离心管中混合如下成分。溶液A:稀释4 μg质粒DNA,溶于250 μL无血清DMEM中,混匀,在室温下孵育约5 min。溶液B:取10~20 μL Lipofectamine 2000至250 μL无血清DMEM中,混匀,室温下静置约5 min。将溶液A与溶液B混合均匀,室温孵育约20~25 min,使之形成DNA-脂质体复合物。将此复合物逐滴加到细胞表面,补加无血清DMEM培养基。培养4~6 h之后,除去培养物,更换含10% FBS的DMEM培养基。1.2.6细胞的克隆化培养稀释转基因细胞,调整细胞密度约为50个/100 μL。取2 μL细胞悬液加入96孔板,补加含G418的DMEM培养基100 μL。单细胞经10 d培养后可形成克隆群,将细胞消化后继续培养,当汇合度达到90%时接入24孔板扩大培养。
1.2.7转染细胞的分子检测采用DNA提取试剂盒提取转染细胞的基因组DNA,进行PCR鉴定;通过RNA提取试剂盒提取转基因细胞总RNA,利用反转录试剂盒合成cDNA,以鸡β-actin基因作为内参照,经RT-PCR检测转基因细胞中St3galⅠ的表达情况。
2结果与分析
2.1真核表达载体pCI-neo-St3galⅠ的构建
提取SPF鸡胚总RNA,反转录为cDNA,用高保真PCR扩增St3galⅠ(图2-A)。回收PCR扩增产物,连入pMD18-T载体,转化大肠杆菌。菌落PCR鉴定结果显示,扩增条带和St3galⅠ基因大小一致(图2-B)。挑取大肠杆菌阳性重组克隆,摇菌,提质粒。用EcoRⅠ-SalⅠ进行酶切,电泳后检测发现,含目的基因的质粒可以切出2条合适大小的条带(图2-C),表明St3galⅠ基因已插入pMD18-T载体。用EcoRⅠ-SalⅠ酶切pMD18-T-St3galⅠ和pCI-neo质粒,回收相应的目的片段,利用T4连接酶进行连接,然后将连接产物转化大肠杆菌。通过对重组克隆进行PCR和酶切鉴定,表明St3galⅠ基因已插入pCI-neo质粒,从而实现真核表达载体pCI-neo-St3galⅠ的构建(图2-D、E)。

A.RT-PCR扩增St3galⅠ基因的结果;B.菌落PCR筛选阳性克隆pMD18-T-St3galⅠ;C.EcoRⅠ-SalⅠ双酶切鉴定
2.2MDCK稳转细胞系的建立
2.2.1G418筛选浓度的确定G418(新霉素)是一种氨基糖苷类抗生素,通过抑制部分转座子基因,干扰核糖体功能而阻断蛋白质合成,当neo基因被整合进真核细胞DNA后,通过氨基糖苷磷酸转移酶的高效表达,使细胞获得抗性,从而能在含有G418的选择性培养基中生长。由于不同细胞对G418的选择压不同,因此需要进行抗生素敏感性试验。在24孔板中接种MDCK细胞,加入不同浓度的G418,观察细胞的生长状态并绘制细胞生长曲线,从而确定G418的筛选浓度。根据细胞生长曲线(图3),G418 浓度达到500 μg/mL时,MDCK细胞于10~14 d全部死亡,高于此浓度,细胞在培养的早期大量死亡;低于此浓度,细胞在培养2周后仍有大量的细胞存活。因此选择500 μg/mL为试验中MDCK细胞压力筛选培养基中G418的浓度。图4为G418筛选14 d时细胞的生长状态,可以发现,培养基中不添加G418时,细胞的生长基本正常,没有明显的细胞脱落(图4-A);当G418的浓度达到100 μg/mL时,细胞已开始脱落,但贴壁细胞仍占优势(图4-B);当G418的浓度达到300 μg/mL时,细胞脱落已十分明显,但仍有少量细胞贴壁生长(图4-C);当G418的浓度达到500 μg/mL时,细胞几乎全部脱落死亡,漂浮于培养基中(图4-D);而当G418的浓度达到700~900 μg/mL时,培养基中几乎观察不到明显的细胞(图4-E、F)。

图3 G418耐受细胞生长曲线
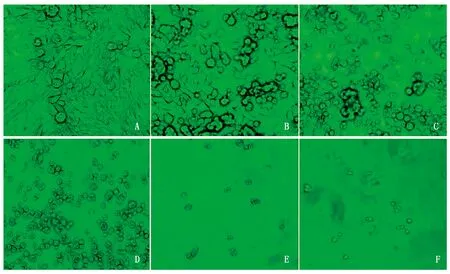
A~F.DMEM培养基中依次添加0,100,300,500,700,900 μg/mL G418第14 天时细胞的生长状态。
2.2.2稳转细胞系的建立纯化pCI-neo和重组质粒pCI-neo-St3galⅠ,利用脂质体Lipofectamine2000转染贴壁MDCK细胞,使用含500μg/mLG418的DMEM培养液进行筛选。在含G418的培养液中,未转染质粒的细胞死亡,而转染成功的细胞由于获得G418抗性而存活。从图5可以观察到,在筛选培养基中生长12d的对照细胞全部死亡(图5-A);而转染pCI-neo和pCI-neo-St3galⅠ质粒的MDCK细胞成簇排列,生长旺盛(图5-B、C)。试验结果表明,通过G418筛选,初步获得了稳转目的基因的MDCK细胞系。

A.未转染的MDCK细胞;B.转染pCI-neo质粒的MDCK细胞;C.转染pCI-neo-St3galⅠ质粒的MDCK细胞。
2.3单克隆抗性细胞株的筛选及分子检测
将获得的抗性细胞混合克隆进行稀释,经选择后挑选出30个单克隆抗性细胞株。连续筛选培养多代以后,单克隆细胞株生长状态依然良好。显微观察发现,正常的MDCK细胞(野生型,WT)和空转细胞的形态呈梭形(图6-A、B);而部分转染细胞近似棱形,排列更紧密,但形态差异并不太明显(图6-C)。提取转染细胞基因组DNA,通过PCR检测显示,WT对照和转入空载体的细胞均无扩增出合适的条带,而转入目的基因的细胞株则可扩增出1 kb左右的条带,与St3galⅠ基因的大小一致(图6-D);提取细胞的总RNA,RT-PCR鉴定后看出,稳转细胞株均可扩增出合适大小的条带,而对照组正常和空转的MDCK细胞未见有扩增条带(图6-E)。上述分子检测结果说明目的基因已成功整合入MDCK细胞的基因组中并可稳定的进行表达。

A.正常的MDCK细胞(WT);B.转染pCI-neo质粒的MDCK细胞;C.转染pCI-neo-St3galⅠ质粒的细胞;
3讨论
以细胞作为基质培养流感病毒,具有均质性,保持流感病毒的抗原性不变及可操作性强等优点[22]。但目前这种方法生产流感病毒还存在产率低、流感病毒不适应宿主细胞或适应慢等缺点,这已成为制约细胞培养法生产流感病毒的瓶颈。因此,如何在细胞培养体系中有效地增殖流感病毒,已成为疫苗生产中亟待解决的关键问题。已有的研究表明,宿主细胞表面SA的含量与流感病毒的增殖具有密切的关系[13,19]。SA可以作为流感病毒的受体,与流感病毒HA蛋白结合,介导流感病毒侵入宿主细胞[1,7]。唾液酸转移酶ST3GalⅠ能够以胞苷一磷酸-β-N-乙酰神经氨酸(CMP-Neu5Ac)为底物将SA残基转移至新的糖基受体上形成唾液酸糖苷化合物[14]。本试验从SPF鸡胚中克隆出St3galⅠ基因,构建了pCI-neo-St3galⅠ真核表达载体。通过脂质体介导法转染MDCK细胞,利用G418筛选转基因细胞。由于不同种类的细胞或来源不同的同类细胞对G418的耐受性可能存在差异,因此,在筛选转基因细胞之前,必须进行抗生素敏感性试验[23]。根据试验结果,最终确定转染的MDCK细胞合适的G418筛选浓度为500μg/mL。在拟转染的pCI-neo质粒上带有抗性筛选标记,其表达的产物氨基糖苷磷酸转移酶能够抑制G418的活性,因此,转染成功的细胞在含有G418的培养基中可以生长。此外,需要注意的是,细胞转染后需经历一段时间之后才会表达出蛋白质,一般要在转染24h后方可加入G418进行筛选;G418添加过早,细胞难以存活,难以筛选到转基因细胞;添加过晚,又会导致未转染细胞大量增殖,从而抑制转染细胞的生长。通过G418筛选获得的具有抗性的转基因MDCK细胞具有异质性,因此需要进行克隆化培养,进而筛选到性状稳定的St3galⅠ基因高表达细胞株。由于1次克隆化培养获得的细胞往往不纯,所以需要将获得的单克隆细胞再次进行克隆化。通过观察获得的细胞克隆,发现和正常的MDCK细胞形态差异并不明显,由此可以推测,St3galⅠ基因在受体细胞基因组中整合的位点比较合适,几乎没有破坏细胞中原有基因的功能。本研究中,选取的表达载体中缺少荧光蛋白报告基因,虽然增加了对转染细胞筛选的难度,但对于将来基因工程疫苗的开发却极为有利,可以避免荧光蛋白对疫苗效果产生不良的影响。通过PCR检测转染细胞目的基因整合和转录情况,发现获得的大部分克隆化细胞均可有效地表达St3galⅠ基因。并且,转染细胞持续传代后,St3galⅠ基因的表达情况并没有发生明显的变化。这些试验结果说明,筛选的转基因细胞性状稳定,外源基因可以持续有效地表达。
目前,MDCK细胞被认为是培养甲型和乙型流感病毒最合适的细胞系,转染成功的MDCK细胞内ST3GalⅠ的含量升高,可以增加宿主细胞表面的受体丰度,促进AIV与细胞的吸附,从而提高AIV在细胞基质中的产量。因此,在高质量、快速流感疫苗生产上有着广阔的应用前景,特别是对于减少养禽业的经济损失和降低人类感染AIV的风险具有更重要的意义。
参考文献:
[1]江经纬,潘德敏.流感病毒受体识别以及流感病毒跨宿主感染的分子机理[J].广东畜牧兽医科技,2006,31(1):24-27.
[2]Webster R G,Bean W J,Gorman O T,et al.Evolution and ecology of influenza A viruses[J].Microbiological Reviews,1992,56(1):152-179.
[3]陈俊霞,孙鹏,许书珍,等.H9N2亚型禽流感病毒HA基因的表达及其单因子血清的制备[J].中国畜牧兽医,2015,42(11):2888-2894.
[4]杨婧,刘宇卓,赵冬敏,等.2013年苏皖地区4株H9N2亚型禽流感病毒HA,NA基因的遗传演化分析[J].浙江农业学报,2015,27(11):1896-1902.
[5]王光锋,李舫,王洪利.山东部分地区H9N2亚型禽流感病毒分离鉴定及HA和NA基因的遗传进化分析[J].动物医学进展,2015,36(6):13-18.
[6]王善辉,汪鹏旭,吕颜枝,等.H9N2亚型禽流感病毒HA-M2融合基因的真核表达及免疫原性研究[J].中国家禽,2015,37(13):18-21.
[7]Blanco J C,Pletneva L M,Wan H A,et al.Receptor characterization and susceptibility of cotton rats to avian and 2009 pandemic influenza virus strains[J].Journal of Virology,2013,87(4):2036-2045.
[8]陈瑞玲,钟颖,邓颖琦,等.表达H9N2亚型禽流感病毒HA蛋白重组乳酸杆菌的构建[J].中国兽医学报,2015,35(12):1917-1920.
[9]Resa-Infante P,Jorba N,Coloma R,et al.The influenza RNA synthesis machine advances in its structure and function[J].RNA Biology,2011,8(2):207-215.
[10]戈胜强,王志亮.禽流感病毒受体研究历程[J].中国兽医学报,2013,33(10):1615-2622.
[11]Ito T,Kawaoka Y.Host-range barrier of influenza A viruses[J].Veterinary Microbiology,2000,74(1/2):71-75.
[12]魏冬旭,江连洲,王辰,等.唾液酸生物活性及其应用的研究进展[J].中国食物与营养,2011,17(7):64-68.
[13]刘媛媛,王俊亚,张晓娟,等.鸡α-2,3-唾液酸转移酶Ⅰ基因的克隆和真核表达载体的构建[J].中国畜牧兽医,2013,40(1):21-24.
[14]吴亚丽,徐倩,武志丹,等.真核表达质粒pIRES-ST3GAL I的构建及其在大肠杆菌中的初步表达[J].西南农业学报,2015,31(1):2284-2289.
[15]Harduin-Lepers A,Mollicone R,Delannoy P,et al.The animal sialyltransferases and sialyl tranferase-related genes:a phylogenetic approach[J].Glycobiology,2005,15:805-817.
[16]白荣德,沈志强,王长江,等.禽流感病毒研究的进展[M].北京:科学出版社,2007.
[17]刘志东,王荫榆,郭本恒,等.唾液酸的研究进展[J].食品工业科技,2010,31(4):368-373.
[18]Ferreira S A,Vasconcelos J L,Silva R C,et al.Expression patterns of α2,3-sialyltransferase I and α2,6-sialyltransferase I in human cutaneous epithelial lesions[J].European Journal of Histochemistry,2013,57(1):e7.
[19]Russell R J,Stevens D J,Haire L F,et al.Avian and human receptor binding by hemagglutinins of influenza A viruses[J].Glycoconjugate Journal,2006,23(1/2):85-92.
[20]钱进,章雄文,丁健.唾液酸转移酶对肿瘤中唾液酸化结构的影响[J].生命科学,2006,18(3):227-232.
[21]马汝海,钟连生,潘忠诚,等.α-2,3-唾液酸糖基转移酶ST3家族分子序列生物信息学分析[J].中国医科大学学报,2011,40(6):497-511.
[22]史爱华,张建伟,沈佳,等.H9N2亚型禽流感病毒在MDCK细胞中增殖最佳条件研究[J].动物医学进展,2011,32(11):42-45.
[23]弗雷谢尼.动物细胞培养[M].章静波,译.北京:科学出版社,2008.
TheCloningofSt3galⅠGeneofSPFChickenEmbryoandItsExpressioninMDCKCells
LU Yujian1,2,3,WU Xinming4,GUAN Yu4,ZHANG Songlin4,LI Shufang5,HAN Wenyu2,SHEN Zhiqiang1,4
(1.Postdoctoral Programme,Binzhou Animal Science & Veterinary Medicine Academy,Binzhou256600,China;2.Postdoctoral Programme,Jilin University,Changchun130062,China;3.Department of Life Sciences,Binzhou University,Binzhou256603,China;4.Binzhou Animal Science & Veterinary Medicine Academy,Binzhou256600,China;5.School of Life Sciences,Zhengzhou University,Zhengzhou450001,China)
Abstract:In order to improve the abundance of avian influenza virus(AIV)receptor on the surface of MDCK cells,12-day-old SPF chicken embryos was as material and St3galⅠgene was cloned by RT-PCR.Next,the target fragment was inserted to the pMD18-T vector.Subsequently,the pMD18-T-St3galⅠ and pCI-neo plasmids were digested and connected.Thus,the eukaryotic expression vector containing St3galⅠgene was constructed.Afterwards,the pCI-neo-St3galⅠ plasmid was purified and transfected into MDCK cell by liposome-mediated method.The transgenic cell lines were screened by G418.The cell strains expressing St3gal Ⅰ gene stably were initially obtained by cell cloning culture and PCR assay.The results showed that St3galⅠgene from chicken embryo was successfully inserted into pCI-neo plasmid,leading to the construction of the eukaryotic expression vector pCI-neo-St3galⅠ.In the G418 selection pressure,MDCK cells stably transfected target gene were initially obtained.The resistant cells were diluted,and 30 selected monoclonal resistant cell lines were selected.With genomic DNA and total RNA of transfected cells as a template,PCR analysis showed that the target gene had been integrated into the genome of MDCK cells and stably expressed.
Key words:Sialic acid;St3galⅠgene;MDCK;Transfection;G418;PCR
doi:10.7668/hbnxb.2016.02.009
中图分类号:Q78
文献标识码:A
文章编号:1000-7091(2016)02-0045-07
作者简介:陆玉建(1979-),男,河南南阳人,讲师,博士,主要从事细胞工程及分子生物学研究。通讯作者:沈志强(1963-),男,山东荣成人,研究员,博士,主要从事预防兽医学研究。
基金项目:山东省自然科学基金项目(ZR2012CL14);山东省滨州畜牧兽医研究院博士后科研基金项目(BSH2014001)
收稿日期:2016-02-03

