花期前后稻穗水分含量与水通道蛋白基因家族表达关系研究
赵亚波,李培纲,陈泽恺,潘伟槐,莫亿伟
(1.绍兴文理学院 生命科学学院,浙江 绍兴 312000;2.宁波大学 海洋学院,浙江 宁波 315211 )
花期前后稻穗水分含量与水通道蛋白基因家族表达关系研究
赵亚波1,2,李培纲1,陈泽恺1,潘伟槐1,莫亿伟1
(1.绍兴文理学院 生命科学学院,浙江 绍兴312000;2.宁波大学 海洋学院,浙江 宁波315211 )
摘要:水稻开花期对水分胁迫非常敏感直接影响到结实率,水分供应主要通过水通道蛋白来完成,为了研究花期稻穗的相对含水量与水通道蛋白基因家族表达关系,探讨了花期前后6 d 内稻穗相对含水量和水通道蛋白基因家族表达变化情况。结果表明:稻穗相对含水量呈现出花前最高、开花期当天最低、花后则再出现增加的规律;OsPIPs基因家族中各个基因表达的水平各有不同,其中OsPIP1-1、OsPIP1-2、OsPIP2-1、OsPIP2-4和OsPIP2-7的表达水平较高,而OsPIP2-2、OsPIP2-3和OsPIP2-8这3个基因在花期前后6 d内均没有表达;所有OsTIPs基因均表达,但不同OsTIPs基因表达水平在不同时间点也不同,除了OsTIP1-2 和OsTIP3-2的表达量比较低外,其他基因的表达量都非常高;OsNIPs基因家族表达量相对较低,如OsNIP1-2、OsNIP1-4、OsNIP3-2及OsNIP3-3在花期前后均不表达,而OsNIP1-1和OsNIP2-1在开花前后均有表达,并在开花当天表达量较高;OsNIP2-2和OsNIP3-1只在开花当天表达,其他时间点均不表达;OsSIP1-1、OsSIP1-2在花前3 d 表达量最大,而OsSIP2-1在开花当天表达量最大,其他时间点略有下降。结果说明,花期前后稻穗内OsTIPs基因家族表达量最大,然后是OsPIPs基因家族,再次是OsSIPs和OsNIPs基因家族,但不同水通道蛋白家族各基因间的表达模式也不同,可能与对水分运输分工差异有关,其中液泡膜水通道蛋白在水稻花期水分运输中的作用可能最大。
关键词:水稻;稻穗;水通道蛋白;相对含水量;基因表达
随着全球气候变暖,农田干旱缺水问题变得更加严重,有专家预测到2030年水稻产量至少需要增加50%,才能满足以稻米为主食国家的粮食需求,但目前水稻产量已受制于水资源短缺和环境退化等因素的影响[1]。有研究表明,在稻穗生长发育及花期前后的缺水胁迫对水稻籽粒形态性状、产量构成的影响最大[2]。植物体内水分的运输主要通过水通道蛋白(Aquaporin)来完成,高等植物的细胞质膜和液泡膜上均存在种类丰富的水通道蛋白,分布广泛且具组织特异性,水通道蛋白转运水的效率也是其他转运蛋白所无法比拟的[3],水通道蛋白在细胞膜上组成“孔道”,可控制水分进出细胞的过程。植物水通道蛋白主要有4类,即质膜嵌入蛋白(Plasma membrane intrinsicprotein,PIP)、液泡膜嵌入蛋白(Tonoplast intrinsicprotein,TIP)、类Nod26嵌入蛋白(Nudolin 26-like intrinsic protein,NIP)和膜嵌入小分子碱性蛋白(Small basic intrinsic protein,SIP),正是这些蛋白家族的存在,使得水分子可以快速地跨膜运输[4]。水通道蛋白是细胞间和细胞内水分运输的主要通道,其运输和调控对于植物细胞水分稳定和胁迫的响应均具重要作用[5]。如在干旱条件下,水通道蛋白可通过阻止水分丢失,为降低干旱胁迫赢得了时间[6]。有研究表明,玉米根系的PIP2-5基因,在水分亏缺条件下其表达量明显增加,有利于根系对水分吸收[7],李仁等[8]发现番茄(Solanumlycopersicum)水通道蛋白SIAQP表达水平受逆境条件的调控,并影响到水分的供应。超表达OsPIP2-6或OsPIP1-1能显著提高水稻抗旱和抗盐的能力[9-10],同时在淹水条件下OsPIP2-6还能发挥其水分外排的功能,将水分快速排出体外,以此来保证植物体水分平衡。
水稻幼穗分化和花期前后对水分最为敏感,此时受高温胁迫对水稻的籽粒充实影响很大[11],水分亏缺胁迫导致水稻产量下降超过其他所有非生物胁迫影响的总和[12],高温胁迫通常会引起植物水分胁迫[13],因为在水分胁迫下,籽粒灌浆过程中多种淀粉合成酶活性降低,导致籽粒生长和灌浆速率降低[14]。所以,花期前后水分供应是否充足是影响受精和充实的关键因素之一,而单个颖花的水分供应来源于稻穗的水分供应能力,稻穗内水分的供应可能与水通道蛋白基因表达及活性有关,有研究表明,水稻的4个类型共有33种水通道蛋白,不同的水通道蛋白的功能可能也不尽相同[15],而且随着全球温度的上升加速,通过基因工程的方法提高粮食作物对干旱的耐性将是未来研究的热点[16]。作为稻穗水分运输的主要途径,水通道蛋白基因家族表达与稻穗水分供应关系却鲜有报道,本研究探讨花期前后稻穗的水分供应与水通道蛋白基因家族表达关系,为逆境条件下水稻花期稻穗的水分供应提供新的指导。
1材料和方法
1.1试验材料与处理
供试水稻(OryzasativaL.)为粳稻品种中花11,于2014年4月20日在绍兴文理学院生物实验基地盆栽(直径45 cm、高25 cm),每个盆内装过筛并充分拌匀的沙壤土10 kg,按常规方式管理,水稻开花期在2014年7月初到8月中旬,根据陈义芳等[17]研究发现,水稻在花后0~12 d是颖果发育最快的时期,之后则趋于平稳,所以参照冯九焕等[18]的方法当稻株主茎和次二茎处于幼穗分化第7期(即花粉粒内容物充实期,开花前6 d左右)时开始,每个处理选取穗型大小基本一致的40~50个稻穗挂牌标记发育时期,水稻盛花当天标记为开花时期,在花前6 d至花后6 d内每隔3 d 取样1 次(分别称前6、前3、0、后3、后6),分别用于测定稻穗相对含水量并提取RNA。相对含水量的测定方法是每次取新鲜稻穗5~6个,先称鲜质量(FW1),再用清水浸泡12 h 后,吸水纸吸干表面水分,称重(FW2),再用105 ℃杀青10 min,在75 ℃烘24 h至恒重,称取干质量(FW3),按公式:(FW1-FW3)/(FW2-FW3)×100% 计算稻穗相对含水量。
1.2根尖根毛区的水通道蛋白相关基因表达的检测
为了检测花期不同时间内稻穗内水通道蛋白基因家族表达的差异,取花期前后不同时期的稻穗,使用RNA plant Regeant(TIANGEN,北京)提取植物总RNA,cDNA第一链合成使用Reverse Transcriptase M-MLV(RNAase H)反转录酶(TIANGEN,北京),具体方法参照试剂盒说明书。采用半定量RT-PCR方法检测不同基因在稻穗开花前后的表达,利用水通道蛋白基因RT-PCR引物(表1),以cDNA第一链为模板进行PCR扩增,反应体系(25 μL)(TIANGEN,北京):2×MasterMix 12.5 μL,Primer F(10 μmol/L)1.0 μL,Primer R(10 μmol/L)1.0 μL,cDNA第一链0.7~1.1 μL(根据Actin扩增的电泳结果进行调整)、加适量的ddH2O μL补足到25 μL。

表1 水通道蛋白基因家族表达半定量PCR检测引物表
PCR反应条件是:94 ℃变性5 min;94 ℃变性30 s,59.5 ℃退火45 s,72 ℃延伸45 s,32个循环;72 ℃保温5 min;内参基因β-actin上游引物5′-CAGCACATTCCAGCAGATGT-3′,β-actin下游引物 5′-TAGGCCGGTTGAAAACTTTG-3′,内参基因β-actin的PCR反应条件是:94 ℃变性5 min;94 ℃变性30 s,56.5 ℃退火45 s,72 ℃延伸45 s,30个循环;72 ℃保温10 min,PCR 扩增产物以1.2%的琼脂糖凝胶电泳检测。以上所有试验重复取样3次分别进行试验,取代表性的图片表示试验结果,其中相对含水量的试验结果用平均值±标准差表示。
2结果与分析
2.1花期前后稻穗相对含水量变化
从图1可知,在花前6,3 d 稻穗的含水量都很高,基本都保持在97%左右。在盛花期当天,稻穗相对含水量下降到70.52%左右;在花后3 d及灌浆过程中,稻穗相对含水量又明显增加,到花后第6天又恢复达到84.29%左右。因此,开花前稻穗的相对含水量都表现出由高到低,然后再增加的变化规律,而盛花当天稻穗相对含水量最低,可能是因为开花所以大量的颖壳张开,颖果内的水分过度散失所致,从而使相对含水量下降。

图1 花期前后稻穗相对含水量的变化
2.2花期前后水通道蛋白OsPIPs基因家族表达分析
由图2可知,OsPIPs基因家族成员在花期前后6 d内,对于OsPIP1基因家族来说,OsPIP1-1在花期前后表达均比较高,但在开花当天的表达量略有下降,花后表达量又明显增加,在花后第6天达到最高水平;OsPIP1-2在花期前后的表达量均比较高,并在开花当天表达量最高;OsPIP1-3在花期前后均处于较低的表达水平,其中在花前、花后6 d及开花当天的表达量都很低,花前3 d及花后3 d表达量略有增加。而OsPIP2基因家族的8个基因中,OsPIP2-1从花前6 d表达量逐渐下降,在花后3 d达到最低值,花后第6天时又再明显增加;OsPIP2-4在花前3 d和开花当天的表达量最高,花后3 d则出现下降的情况,花后6 d表达量又明显增加;OsPIP2-5在花前6 d没有表达,但从花前3 d开始至花后6 d表达量逐渐升高;OsPIP2-6在开花前表达量均处于较低的水平,开花当天表达量明显增加并达最高水平,然后花后3 d又明显降低到花前表达水平,在花后6 d又明显增加;OsPIP2-7在花前6,3 d的表达水平都比较高,在开花当天则表达量最低,花后3 d表达量又在增加。而OsPIP2-2、OsPIP2-3和OsPIP2-8这3个基因在花期前后6 d内均没有表达。结果说明,在花期前后6 d内,OsPIPs基因家族中11个基因表达的水平各有不同,其中OsPIP1-1、OsPIP1-2、OsPIP2-1、OsPIP2-4、OsPIP2-7的表达水平相对较高,有些基因则在整个过程中完全没有表达。

图2 花期前后OsPIPs基因家族的相对表达水平
从图3可知,在OsTIP1基因家族的2个基因中,OsTIP1-1在水稻花期前后均保持很高的表达水平,从花前6 d开始表达量不断增加,在开花当天明显增加,并在花后第6天达到最大表达量;OsTIP1-2只有在开花当天及花后3 d有微量的表达,其他时期均不表达。OsTIP2基因家族的2个基因中,OsTIP2-1在花前6 d表达水平非常低,然后花前3 d开始增加,但开花当天的表达量则又降低,花后3 d增加到最大的表达量,然后又开始下降;OsTIP2-2的表达量在整个时期都非常高,并在开花当天表达量达最高水平。
OsTIP3-1在开花前期表达量逐渐增加,开花当天的表达量达到最大的峰值,花后表达量又逐渐下降;OsTIP3-2只在开花当天和花后6 d有较低的表达,其他时期均不表达;OsTIP4-1只有在花后3 d的表达量相对较低,其他各时期的表达量非常高;OsTIP4-2从花前6 d开始表达量不断增加,在开花当天达到最大值,然后表达水平开始下降;OsTIP4-3在花前6 d到花前3 d时略有下降,然后在开花当天明显增加,花后3 d又开始下降,最后在花后6 d又明显增加达最高的表达水平。OsTIP5-1在开花前6 d及花前3 d的表达量很高,而开花当天及花后3 d表达量下降,花后6 d又开始增加。结果说明了OsTIPs家族的10个水通道蛋白基因中,在花期前后6 d内每个基因均有表达,但是表达量的大小和出现的时间顺序却是不同的。

图3 花期前后水通道蛋白OsTIPs基因家族表达水平
2.4花期前后水通道蛋白OsNIPs基因家族表达的分析
从图4可知,OsNIPs基因家族在花期前后6 d内整体的表达水平相对最低,其中OsNIP1-1从花前6 d到花前3 d表达量出现下降的现象,在开花当天表达量又明显增加,花后3 d又明显下降,而花后6 d又出现明显增加的现象;OsNIP2-1从花前6 d开始表达量增加,到花前3 d及开花当天表达量明显提高,之后表达量逐渐下降;OsNIP2-2、OsNIP3-1只在开花当天表达,花期前后的其他时期均不表达;OsNIP4-1只在花后6 d才表现出较高的水平,而其他时期不表达。OsNIP1-2、OsNIP1-4、OsNIP3-2以及OsNIP3-3在水稻的花期前后6 d内均无表达。结果说明OsNIPs家族的9个水通道蛋白基因中,在花期前后6 d内只有5个基因在某个时期有表达,其他基因均不表达,其中在开花当天集中表达的有OsNIP1-1、OsNIP2-1、OsNIP2-2和OsNIP3-1,说明这几个基因的开花当天可能对稻穗的水分运输有着一定的作用,其他的时间点内表达很少。
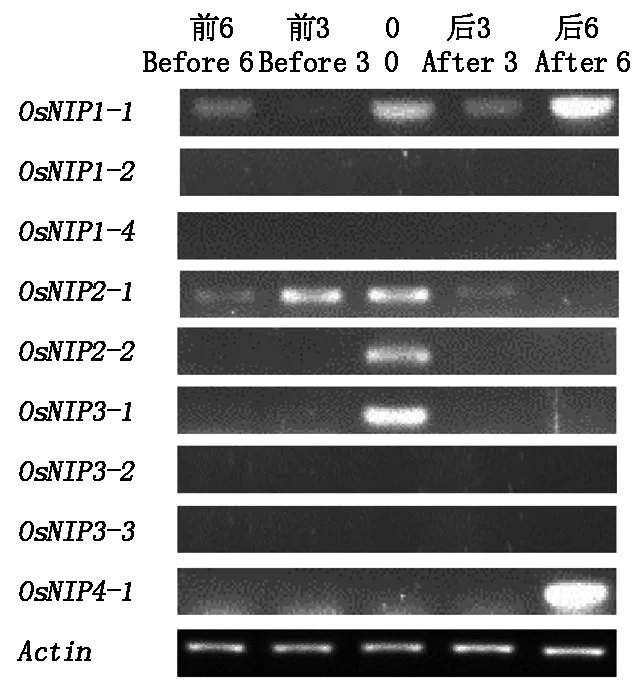
图4 花期前后OsNIPs基因家族的相对表达量
从图5可知,OsSIP1-1在花前6 d到花前3 d,表达量略有增加,随后就开始下降,OsSIP1-2与OsSIP1-1类似,但是在开花前期的表达量较低,在花后表达量则非常低;而OsSIP2-1在开花前期表达量逐渐增加,开花当天表达量达到最大值,之后表达量逐渐降低。在OsSIPs基因家族中,OsSIP2-1的表达量最大,并在开花当天表达量最高,可能在水分运输的过程中起着关键的作用,其他的2个基因在花后的表达则比较低。

图5 花期前后OsSIPs基因家族的相对表达量
3讨论与结论
3.1花期前后稻穗水分含量的变化与水通道蛋白基因的关系
本研究发现,在盛花期当天,稻穗的相对含水量下降到最低水平,可能与颖壳均处于开张状态有关,水分过度散失所致,这与我们前期研究发现,不同年份的温度下,开花当天的稻穗的水分含量是最低的相一致。因为有研究表明,相对含水量下降过大可能是整个稻穗的蒸腾强度增强所致,而在高温胁迫下,颖花开颖时间长开张角度变大,水分散失就更多[19],正是由于水分过度散失,使水稻开花当天对高温、干旱等逆境胁迫更为敏感,从而使受精率和结实率下降[20-21]。而花前和花后颖壳处于关闭状态,水分散失机率相对较少,所以花后稻穗内的相对含水量重新增加,再加上花后随着胚乳发育和灌浆物质积累也促进水分向籽粒运输,相应地提高了稻穗的相对含水量。因此,开花当天稻穗相对含水量很低,更易受逆境条件引起的水分胁迫影响,因此,水稻花期必须保证充足水分供应以利于受精过程正常进行。
稻穗内水分向颖果供应需要水通道蛋白的参与,因为有研究表明,在根系内流经根细胞的水约70%~90%都要通过水通道蛋白运输作用,水通道蛋白还控制着气孔开关等生理生化的过程[4-5],前人研究表明,干旱胁迫条件下,超表达后PIP1能促进气孔的关闭,并能显著提高转基因植株的耐旱能力[22],并且发现玉米的ZmPIPs蛋白主要分布在气孔的复合物内[23],因此,水通道蛋白对维持细胞的水势平衡起着重要作用。本研究发现,在水稻花期需要多种水通道蛋白基因的表达,如在开花当天有很多个水通道蛋白表达量明显提高或者表达量明显的下调,这可能是与不同的基因对此时的水分运输有不同的分工有关,因为有研究发现超表达OsPIP1-1后显著增强水稻水分的运输能力[10],这与本研究发现OsPIP1-1表达量在开花当天明显下降与稻穗相对含水量降低的结果类似,但也有研究发现,过量表达OsPIP2-1还能抑制过多的水分进入水稻根细胞的现象,或超表达某些水通道蛋白基因后,反而促进了转基因植株对水分胁迫更为敏感,加促植株的死亡的现象[24]。因此,稻穗内水通道蛋白可能也有着双重的作用,一方面保证水分通过水通道蛋白的调控进入稻穗的细胞,另一方面,还可能同时具有将水分排到细胞外的能力,如何维持水稻开花当天的稻穗内水分的动态平衡,对提高稻穗的相对含水量则显得非常重要,但水通道蛋白基因家族通过何种途径调控稻穗水分供应机制还需进行深入研究。
3.2花期前后水通道蛋白基因家族间不同基因的表达差异
本研究发现,在水稻花期前后6 d内,不同类型的水通道蛋白基因家族的表达模式是不同的,相同类型的水通道蛋白不同基因间的表达模式也不尽相同。其中整体表达水平最高的是OsTIPs,在OsTIPs的10个基因中全部表达,其次是OsPIPs,在OsPIPs基因家族的11个基因中,有8个表达水平比较高,只有3个基因在此时期内没有表达;再次是OsSIPs,在OsSIPs的3个基因全部表达;表达最低的是OsNIPs基因家族,可能是OsNIPs基因家族的水稻的花器官内的整体表达水平较低,这与前人在叶片和根系及花药中研究发现,OsNIPs基因家族在花药中的表达量明显低于叶片和根系的结果类似[15]。所以基于本研究结果可知,不同类型的水通道蛋白基因家族的表达模式可能有组织特异性。其中,OsTIPs基因家族表达水平最高,整个基因家族在不同时间点内均有表达,说明花期前后液泡膜上的水通道蛋白可能在水分运输的过程中起着非常重要的调控作用。因为有类似研究表明,种子在发育和成熟过程中通常伴随着细胞质渗透势的协同变化,而渗透势改变则通过水通道蛋白快速的调节水分的供给水平从而达到渗透平衡,为种子发育提供最佳条件[25],此外,人参(Panaxginsengy)水通道蛋白基因PgTIP1在拟南芥中超表达时,显著促进了拟南芥种子发育速度,种子体积和重量均显著高于野生型[26],所以稻穗内液泡水通道蛋白OsTIPs基因家族的表达量增加,可能更利于通过液泡的渗透调节对水分的吸收,促进花器官细胞体积的膨大,以便利于开花和籽粒的充实。
OsPIPs基因家族中的OsPIP1-1和OsPIP1-2在整个开花期间的表达量一直很高,OsPIP2-4、OsPIP2-6在开花当天的表达量升高,这与前人发现超表达OsPIP2-6或OsPIP1-1均能提高水稻抗旱和抗盐能力结果相似[9-10],说明这些基因在维持稻穗内的水分平衡可能发挥着重要作用。前人研究还发现,在OsPIP2-1表达的前提下,超表达OsPIP1-1后显著增强水的运输能力[10],说明水通道蛋白基因家族间还有相互协作的过程[27]。本研究发现,虽然OsPIP1-1的表达水平保持很高,但是开花当天OsPIP1-1、OsPIP1-3和OsPIP2-7表达量却有一定程度的下降,其下降的原因可能是可以抑制水分从稻穗内的输出,这与前人发现在水分胁迫下,有些基因表达上调,有些基因表达下降类似[28]。其中OsPIP2-3表达很低,这与Liu等[25]在水稻种子萌发过程中得到的结果一致。
在OsNIPs的9个基因中,有OsNIP1-1、OsNIP2-1、OsNIP2-2、OsNIP3-1等5个基因只在某个不同的时间点有表达,在另外的时间点则不表达。这5个基因在开花期的增加可能更有利于水分从稻穗内的运输,而其他的4个基因在稻穗内根本不表达,这种表达差异可能是OsNIPs基因家族对稻穗水分运输作用不大,或这些基因本身就在水稻花器官内的表达较低。此外,这一类基因可能还有其他的功能,如在拟南芥(Arabidopsisthaliala)芽中超表达OsNIP3-1后,明显减少了芽对砷的吸收,说明OsNIPs基因家族对砷的运输具有一定的抑制作用[29]。而在OsSIPs的3个基因中,在开花期间也均有表达,但是表达量相对较低,在叶片、根尖和花药内也是OsSIPs基因家族表达显著低于其他的基因家族[15],相对于其他基因家族来说,OsSIPs的作用可能更为基础[30],有研究发现超表达PgTIP1后,明显提高拟南芥耐旱和耐盐能力[31],同时Ma等[32]则发现,反义干涉拟南芥的AtTIP1:1后,却极易引起植株的死亡,说明OsSIPs基因也是不可替代的。
综上所述,OsPIP2-1、OsPIP2-2、OsPIP2-4、OsPIP2-6、OsNIP1-1、OsTIP3-1、OsTIP3-2、OsTIP4-2、OsTIP4-3和OsSIP2-1在水稻开花当天的表达量都明显增加,这些基因表达增加可能利于促进水分从植株其他部分向稻穗运输,从而有利于水稻盛花期大量水分散失的补充。在水分最需要的时期,并不是所有的水通道蛋白基因表达量都增加。而且,相同类型基因家族间的不同基因表达也有明显差异,可能是各基因间分工不同所致。
本研究表明,在盛花期当天稻穗的相对含水量下降到最低水平,可能是水分过度散失所致,稻穗内不同的水通道蛋白基因家族的表达模式在花期前后的表达模式也不同,有些基因在开花期当天明显提高表达量,有些明显下降甚至不表达,说明不同的水通道蛋白对稻穗水分的运输作用也不同,将来应该在基因表达水平与水通道蛋白活性的方面进行深入研究,才能更好理解相关的水通道蛋白基因家族在稻穗的水分供应上的作用机制。
参考文献:
[1]AhmadiN,AudebertA,BennettMJ,etal.Therootsoffuturericeharvests[J].Rice,2014,7(29):1-9.
[2]张卫星,朱德峰,徐一成,等.不同水分条件下水稻籽粒形态及其与粒重的关系[J].作物学报,2008,34(10):1826-1835.
[3]朱美君,康蕴,陈珈,等.植物水通道蛋白及其活性调节[J].植物学通报,1999,16(1):44.
[4]尤真真,高蓉,田珊,等.植物水通道蛋白结构与功能及其识别与转导水稻黄单胞菌Hpa1信号的机制[J].植物病理学报,2013,43(3):232-248.
[5]李军,乙引.植物水通道蛋白的运输和调节[J].植物生理学通讯,2010(5):493-498.
[6]杨淑慎,山仑,郭蔼光,等.水通道蛋白与植物的抗旱性[J].干旱地区农业研究,2005,23(6):214-218.
[7]吴安慧,张岁岐,邓西平,等.水分亏缺条件下玉米根系PIP2-5基因的表达(简报)[J].植物生理学通讯,2006,42(3):457-460.
[8]李仁,吴新新,李蔚,等.番茄水通道蛋白基因SlAQP的克隆与序列分析[J].中国农业科学,2012,45(2):302-310.
[9]李嵘,牛向丽,苗雁文,等.水通道蛋白基因OsPIP2;6的功能分析[J].中国农业科学,2013,46(15):3079-3086.
[10]Liu C,Fukkumoto T,Matumoto T,etal.Aquaporin OsPIP1;1 promotes rice salt resistance and seed germination[J].Plant Physiology and Biochemistry,2013,63(4):151-158.
[11]周建霞,张玉屏,朱德峰,等.高温下水稻开花习性对受精率的影响[J].中国水稻科学,2014,28(3):297-303.
[12]Mitra J.Genetics and genetic improvement of drought resistance in crop plants [J].Current Science,2001,80:758-763.
[13]Mo Y W,Liang G B,Shi W Q,etal.Metabolic responses of alfalfa(MedicagoSativaL.)leaves to low and high temperature induced stresses[J].African Journal of Biotechnology,2011,10(7):1117-1124.
[14]王贺正,马均,李旭毅,等.水分胁迫对水稻籽粒灌浆及淀粉合成有关酶活性的影响[J].中国农业科学,2009,42(5):1550-1558.
[15]Sakurai J,Ishikawa F,Yamaguchi T,et al.Identification of 33 rice aquaporin genes and analysis of their expression and function[J].Plant & Cell Physiology,2005,46(9):1568-1577.
[16]Jarzyniak K M,Jasinsk M.Membrane transporters and drought resistance-a complex issue[J].Frontiers in Plant scicence,2014,5(12):1-15.
[17]陈义芳,顾蕴洁,王忠.四个不同粒重水稻品种颖果发育的比较[J].中国水稻科学,2009,23(4):405-413.
[18]冯九焕,卢永根,刘向东,等.水稻花粉发育过程及其分期[J].中国水稻科学,2001,15(1):21-28.
[19]冯芳玖,李静婷,郭丹凤,等.年份气温差异对野生型和转OsPIN1a基因水稻胚乳发育及种子萌发的影响[J].核农学报,2015,29(11):2198-2207.
[20]张彬,芮雯奕,郑建初,等.水稻开花期花粉活力和结实率对高温的响应特征[J].作物学报,2007,33(7):1177-1181.
[21]李贤勇,李顺武,何永歆,等.穗层自然高温对杂交水稻结实的影响[J].西南农业学报,2008,21(1):44-47.
[22]Cui X,Hao F,Chen H,et al.Expression of theViciafabaVfPIP1 gene inArabidopsisthalianaplants improves their drought resistance[J].Journal of Plant Research,2008,12(12):207-214.
[23]Heinen R B,Bienertg P,Cohen D,etal.Expression and characterization of plasma embrane aqua-porins in stomatal complexes ofZeamays[J].Plant Molecular Biology,2014,86(3):335-350.
[24]Gao Z,He X,Zhao B,et al.Over expressing a putative aquaporin gene from wheat,TaNIP,enhances salt tolerance in transgenicArabidopsis[J].Plant & Cell Physiology,2010,51(5):767-775.
[25]Liu H Y,Yu X,Cui D Y,et al.The role of water channel proteins and nitric oxide signaling in rice seed germination[J].Cell Research,2007,17(7):638-649.
[26]Lin W,Peng Y,Lig,et al.Isolation and functional characterization of PgTIP1,ahormone-autotrophic cells-specific tonoplast aquaporins in ginseng[J].Journal of Experimental Botany,2007,58(5):947-956.
[27]Mahdieh M,Mostajeran A,Horie T,et al.Drought stress alters water relations and expression of PIP-type aquaporin genes inNicotianatabacumplants[J].Plant and Cell Physiology,2008,49(5):801-813.
[28]Lian H L,Yu X,Lane D,etal.Upland rice and lowland rice exhibited different PIP expression under water deficit and ABA treatment[J].Cell Research,2006,16(7):651-660.
[29]Xu W,Dai W,Yan H,et al.ArabidopsisNIP3;1 plays an important role in Arsenic uptake and Root-to-shoot translocation under arsenite stress conditions[J].Molecular Plant,2015,8(5):722-733.
[30]Chaumont F,Barrieu F,Wojcik E,et al.Aquaporins constitute a large and highly divergent protein family in maize[J].Plant Physiology,2001,125(3):1206-1215.
[31]Peng Y H,Lin W L,Cai W M,et al.Overexpression of a panax ginseng tonoplast aquaporin alters salt tolerance,drought tolerance and cold acclimation ability in transgenicArabidopsisplants[J].Planta,2007,226(3):729-740.
[32]Ma S,Quist T M,Ulanov A,et al.Loss of TIP1;1 aquaporin inArabidopsisleads to cell and plant death[J].Plant Journal,2004,40(6):845-859.
The Variation of Relative Water Content and Expression of Aquaporins Genes in Rice Panicle During before and after Flowering
ZHAO Yabo1,2,LI Peigang1,CHEN Zekai1,PAN Weihuai1,MO Yiwei1
(1.College of Life Science,Shaoxing University,Shaoxing312000,China;2.School of >Marine Sciences,Ningbo University,Ningbo315211,China)
Abstract:Rice flowering period is very sensitive to water stress and directly effect on setting rate;water supplies are affected by aquaporin genes expression and its activities.In order to investigate relationship between the relative water content and the aquaporin genes expression in rice panicle,the genes expression level of aquaporin and the relative water content in rice panicle were studied during the time before and after flowering for 6 days.The results showed that:The relative water content in pancile of rice was highest before flowering,and then lowest in the day of flowering,but after flowering the relative water content increased to highest value;Different OsPIPs showed at different expressional patterns,for example,OsPIP1-1,OsPIP1-2,OsPIP2-1,OsPIP2-4 and OsPIP2-7 displayed high level during these time.However,OsPIP2-2,OsPIP2-3 and OsPIP2-8 did not show any expression throughout the flowering period;All OsTIPs were expressed throughout the flowering period,but there were some differences in the expression level in different time,compared to high expression of others OsTIPs,OsTIP1-2 and OsTIP3-2 kept very lower expression level during these time;The expression of OsNIPs displayed very lower level during these time,for example OsNP1-2,OsNIP1-4,OsNIP3-2 and OsNIP3-3 were not expressed throughout the flowering period, OsNIP1-1 and OsNIP2-1 could express in the whole time,However,OsNIP2-2 and OsNIP3-1 could have a certain amount of expression only in flowering day,rather than in the other times;OsSIP1-1,OsSIP1-2 showed at the high value before the flowering day,while OsSIP2-1 reached its maximum during the flowering day.This experiment results showed that,the highest expression level was OsTIPs,followed by OsPIPs,then were OsSIPs and OsNIPs,but different water channel protein genes showed at different expression pattern during these time,and OsTIPs that displayed high expression level might be need more tonoplast intrinsic protein activities to keep water supply during the flower time of rice panicle.
Key words:Rice;Rice panicle;Aquaporin;Relative water content;Gene expression
doi:10.7668/hbnxb.2016.02.008
中图分类号:Q78;S511.03
文献标识码:A
文章编号:1000-7091(2016)02-0038-07
作者简介:赵亚波(1992-),男,河北保定人,在读硕士,主要从事植物分子生物学研究。通讯作者:莫亿伟(1971-),男,广西融安人,副教授,博士,主要从事植物生理生化与分子生物学研究。
基金项目:浙江省自然科学基金项目(LY16C130004);国家自然科学基金项目(31071353)
收稿日期:2016-01-10

