Maresin 1通过调控miR-340增强巨噬细胞吞噬功能
谢海青,张俊丽,谢翔,金胜威(温州医科大学附属第二医院 麻醉科,浙江 温州 325027)
Maresin 1通过调控miR-340增强巨噬细胞吞噬功能
谢海青,张俊丽,谢翔,金胜威
(温州医科大学附属第二医院 麻醉科,浙江 温州 325027)
[摘 要]目的:研究促消退介质Maresin 1(MaR1)在脓毒症模型中促进巨噬细胞吞噬功能的机制。方法:通过检测F4/80表达情况评估小鼠原代巨噬细胞纯度。体内外脓毒症模型验证脂多糖(LPS)和/或MaR1对miR-340表达的影响。骨髓巨噬细胞转染miR-340模拟物(mimic)或抑制剂(inhibitor)后,qRT-PCR检测miR-340的表达量,评估转染效率。荧光显微镜及流式细胞仪检测小鼠原代巨噬细胞转染miR-340 mimic后巨噬细胞吞噬荧光微球能力的变化。最后收集临床样本检测脓毒症患者血浆中miR-340的表达与健康志愿者的区别。结果:经荧光显微镜和流式细胞仪鉴定小鼠原代巨噬细胞纯度达90%以上。体内外脓毒症模型均显示miR-340的表达明显升高(P<0.05)。脓毒症患者与健康志愿者相比血液中miR-340的表达也显著增强(P<0.05)。荧光显微镜及流式细胞仪检测小鼠原代巨噬细胞转染miR-340 mimic后,巨噬细胞吞噬荧光微球的能力降低(P<0.05)。在体内外脓毒症模型中,MaR1均明显降低miR-340的表达水平(P<0.05)。结论:MaR1通过抑制miR-340的表达,增强巨噬细胞吞噬功能,在脓毒症病理生理过程中发挥抗炎促消退作用。
[关键词]Maresin 1;脂多糖;miR-340;脓毒症;巨噬细胞;吞噬作用;小鼠
脓毒症是感染引起的有害的复杂临床综合征[1],以系统性炎症反应综合征(systemic inflammatory response syndrome,SIRS)和菌血症为特征,严重者可发展至多器官衰竭,甚至死亡[2]。临床治疗脓毒症的方法主要为抗炎,常使用高剂量糖皮质激素[3]、白介素-1受体拮抗剂[4]、Toll样受体拮抗剂[5]等。然而这些方法并不能降低脓毒症的病死率。近年越来越多的研究者认为脓毒症后期处于免疫抑制状态,并提出促炎症消退新策略—提高自身免疫,促进炎症消退。证据显示炎症消退是一个主动的调节过程,依赖机体产生一系列的内源性抗炎促消退介质(specialized pro-resolving mediators,SPMs),及时减少和限制组织过度损伤,促进炎症消退,恢复机体内稳态[6]。Maresin 1(MaR1)系最近发现的促炎症消退新介质[7],能减轻酵母多糖诱导的腹膜炎[7],抑制中性粒细胞浸润,增强巨噬细胞吞噬能力,具有强大的抗炎促消退作用[8]。本研究主要探讨MaR1促进巨噬细胞吞噬功能的具体机制。
1 材料和方法
1.1实验动物 SPF级健康C57BL/6J雄性小鼠,体质量18~25 g,来自上海SLAC实验动物公司(动物合格证号:XI304239,已通过动物实验伦理学批准),饲养于温州医科大学实验动物中心。所有进入实验室的人、动物均需经严格的微生物控制,所有饲料、水、铺垫物等所需物均经高温灭菌处理。
1.2实验试剂 DMEM高糖培养基、胎牛血清(FBS)购自Gibco公司;巯基乙酸肉汤、台盼蓝、EDTA· 2Na、大肠杆菌脂多糖(LPS,055:B5)、荧光微球(L3030)购自Sigma公司;MaR1购自Cayman公司;巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)由R&D公司提供;所有micro-RNA相关试剂均来自广州市锐博生物科技有限公司;APC anti-Mouse F4/80抗体、Cell stain buffer购自BioLegend公司。
1.3小鼠腹腔巨噬细胞分离 提前5 d向小鼠腹腔注入3%巯基乙酸肉汤,当天脱颈处死小鼠,暴露腹膜,向腹腔内注入5 mL 3% FBS-PBS,充分按摩小鼠腹部,抽取腹腔液,离心弃上清液,加入10% FBS-DMEM完全培养基重悬;用0.4%台盼蓝染色,当活细胞数达到95%以上时调整细胞浓度2×106cells/mL,接板,置于5% CO2、37 ℃细胞培养箱中培养;1 h后,弃培养基,去除未贴壁的细胞,加入10% FBS-DMEM完全培养基,置于细胞培养箱,次日用于实验。
1.4小鼠骨髓巨噬细胞培养 实验当天脱颈处死小鼠,暴露后肢皮肤,分离出完整的股骨和胫骨,移至超净台;用剪刀剪断股骨和胫骨的两端,用PBS进行骨髓腔灌洗,收集灌洗液;离心弃上清液,加入红细胞裂解液,静置5 min;离心弃上清液,用含有M-CSF(浓度为20 ng/mL)的10% FBS-DMEM完全培养基重悬,计数调整为4×106cells/mL,接75 cm2培养瓶,置于细胞培养箱中;第3天更换含有M-CSF的完全培养基继续培养;第5天弃培养基,PBS清洗2次,加入提前预热的5 mmol/L EDTA-PBS消化10 min,再用细胞刮刀消化细胞并收集;4 ℃离心弃上清液,加入完全培养基重悬;0.4%台盼蓝染色计数接板,置于细胞培养箱中培养,次日用于实验。
1.5小鼠盲肠结扎穿孔(cecal ligation and puncture,CLP)模型的建立及样本收集
1.5.1中度CLP模型建立:腹腔注射戊巴比妥钠(80 mg/kg)并监测麻醉深度;对腹部皮肤进行备皮及消毒;沿腹中线作正中切口,暴露腹白线并剪开腹膜,找到盲肠置于小鼠腹部左侧;在盲肠基底部和游离端中间处结扎;将盲肠内容物向远端轻轻挤压,于结扎处和游离端中间用21 G穿刺针从肠系膜侧刺向游离侧;拔出穿刺针后,挤压盲肠,见肠内容物从肠系膜侧孔和游离侧孔处挤出;将盲肠放回腹腔内,连续缝合腹膜,间断缝合皮肤;皮下注射氯化钠注射液(50 mL/kg)进行补液,在保温毯内进行复苏,每6 h观察动物的情况和存活率,24 h收集样本。
1.5.2实验分组:①假手术(Sham)组:暴露盲肠后,不结扎不穿刺,将其放回,缝合腹膜及皮肤。②中度脓毒症(CLP)组:参照1.5.1步骤建立CLP模型。③中度脓毒症治疗(CLP+MaR1)组:CLP模型造好后15 min,腹腔注射MaR1(每只小鼠注射100 ng MaR1)。
1.5.3收集样本:24 h后存活的小鼠用戊巴比妥钠(80 mg/kg)进行麻醉,腹腔注射肝素(100 U/100 g),固定在操作台上,剪开颈部皮肤,分离肌肉和筋膜,暴露颈动脉,剪破颈动脉,并用注射器收集血液于离心管中。4 ℃离心5 min,吸取上清液,即血浆,-80 ℃保存待用。
1.6临床样本的选择及处理
1.6.1研究对象入选标准:选取2015年3月至9月于温州医科大学附属第二医院重症监护室、温州中西医结合医院重症监护室、瑞安市人民医院重症监护室住院治疗的脓毒症患者8例为脓毒症组,年龄25~75岁,均符合美国重症医学会(SCCM)联合欧洲危重病医学会(ESICM)2012年提出的脓毒症诊断标准。选取同期门诊健康体检者5例为健康志愿组,年龄25~75岁,2周内未服用任何药物。
本研究符合赫尔辛基宣言并通过温州医科大学伦理委员会审批,同时所有患者和健康志愿者均签署知情同意书。
1.6.2排除标准:不符合入选标准;怀孕或哺乳期妇女;长期使用抗凝药物者;长期服用免疫抑制药物或长期处于免疫抑制状态,如HIV阳性患者;严重心律失常患者。
1.6.3剔除标准:纳入后不符合诊断标准者;有其他干扰因素影响数据真实性者。
1.6.4样本收集及处理:脓毒症患者入选后在达到诊断标准24 h内,应用抗生素前,取2 mL新鲜外周血于去酶抗凝管中,4 ℃离心5 min,吸取上清液,即血浆,-80 ℃保存待用。
1.7细胞转染技术 按照riboFECTTMCP转染试剂使用说明对腹腔巨噬细胞和骨髓巨噬细胞进行转染,采用定量PCR方法检测转染效率,选择最佳转染剂量和时间。
1.8细胞免疫荧光技术 取出细胞后PBS清洗3遍,加入4%多聚甲醛-PBS固定液,4 ℃固定30 min;PBS冲洗后加入相应抗体,4 ℃避光染色30 min;再次进行PBS清洗,加入DAPI,室温避光染色10 min即可。荧光显微镜下观察,拍片,计数。
1.9流式细胞技术 ①设门:首先设立FSC-A/ FSC-H二维散点图,选定细胞群P1,最大限度地排除细胞碎片;FSC-A/SSC-A二维散点图中调节FSC和SSC电压值,在P1门中圈出细胞群P2,即为目标细胞。②获取结果:在目标荧光通路上检测样本的荧光强度。每份样本检测10 000个细胞,数据可用直
1.11统计学处理方法 采用SPSS19.0统计软件进行统计分析,所有数据都以±s来表示,组间比较采用t检验或单因素方差分析,两两比较采用Newman-keuls检验。P<0.05为差异有统计学意义。方图或二维散点图表示。所有数据用CytExpert或FlowJo 7.6软件进行处理分析。
1.10PCR技术 ①引物序列:miR-340上游引物5’-GCGCTAGGTAGTTTCCTGTT-3’,下游引物5’-GTGCAGGGTC CGAGGT-3’。②反应程序:95 ℃预变性2 min进入循环;95 ℃ 15 s,60 ℃ l min,40个循环;进入融解曲线阶段,60 ℃ l min,95 ℃ 15 s。③结果分析:将PCR得到的目的基因CT值与其对应的内参CT值相减进行第1次校正,得到目的基因的校正CT值(∆CT),再以对照组中的∆CT作为本底参数进行第2次校正,则目的基因的量为:2-∆∆CT。④每次实验重复3次,结果取平均值;每次扩增的同时设置无cDNA的阴性对照,当阴性对照的CT值小于35时,该次扩增数据弃去。
2 结果
2.1小鼠腹腔巨噬细胞和骨髓巨噬细胞纯度鉴定
2.1.1荧光显微镜法:结果显示小鼠腹腔巨噬细胞(见图1A-C)和骨髓巨噬细胞(见图1D-F)占所有细胞的90%以上,可用于实验。

图1 荧光显微镜鉴定小鼠原代巨噬细胞(×200)
2.1.2流式细胞术法:结果显示骨髓巨噬细胞占所有细胞95%以上,可用于实验(见图2)。
2.2脓毒症模型miR-340表达增高,而MaR1能抑制miR-340的诱导表达
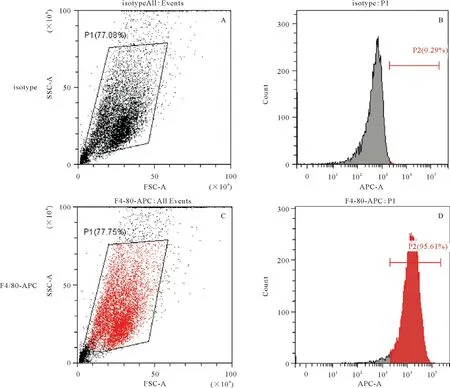
图2 流式细胞术鉴定小鼠骨髓巨噬细胞纯度
2.2.1在体实验:不同处理后收集血浆样本,检测miR-340表达情况(n=6)。与Sham组比较,CLP组miR-340表达明显升高(P<0.05);与CLP组比较,CLP+ MaR1组miR-340表达显著降低(P<0.05),见图3A。
2.2.2体外实验:不同处理后收集细胞样本,检测miR-340表达量(n=7)。与control组相比,LPS 组miR-340表达升高(P<0.05);与LPS组比较,LPS+MaR1组miR-340表达降低(P<0.05),见图3B。
2.3小鼠骨髓巨噬细胞转染miR-340 mimic可增强miR-340的表达
2.3.1转染mimic实验:骨髓巨噬细胞转染miR-340 mimic后收集样本,检测miR-340表达情况(n= 6)。选取最佳转染剂量50 nmol/L(P<0.05)和最佳转染时间48 h(P<0.05),见图4。
2.3.2转染inhibitor实验:骨髓巨噬细胞转染miR-340 inhibitor后收集样本,检测miR-340表达情况(n=6)。结果显示miR-340的表达量并没有显著下降(P>0.05),见图5。
2.4腹腔巨噬细胞和骨髓巨噬细胞转染miR-340 mimic后,巨噬细胞吞噬能力下降
2.4.1荧光显微镜法:小鼠腹腔巨噬细胞转染miR-340 mimic后收集样本,用吞噬率或吞噬指数表示巨噬细胞吞噬能力。结果显示miR-340能降低巨噬细胞的吞噬率和吞噬指数(P<0.05),见图6。
2.4.2流式细胞术法:小鼠骨髓巨噬细胞转染miR-340 mimic后收集样本,用吞噬率或平均荧光强度表示巨噬细胞吞噬能力。
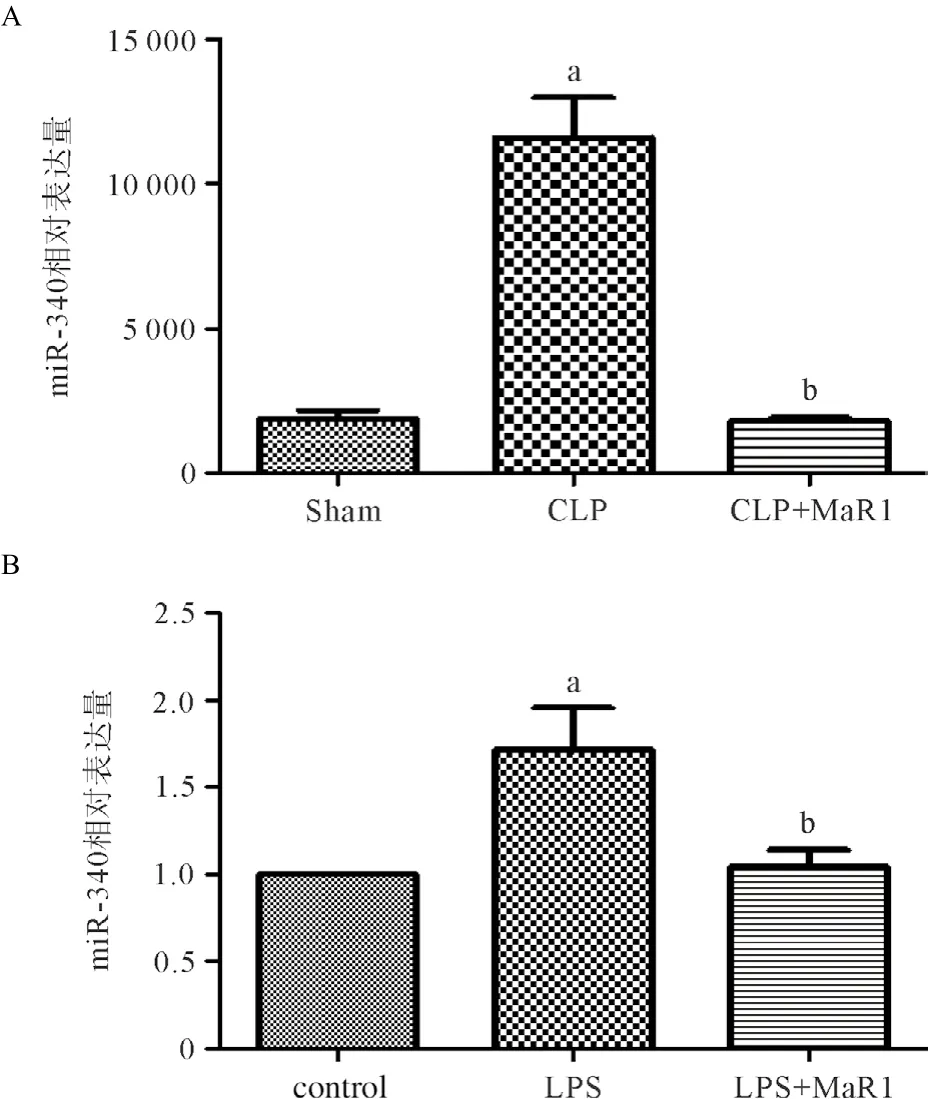
图3 脓毒症模型miR-340表达增高,而MaR1能降低miR-340的表达

图4 小鼠骨髓巨噬细胞转染miR-340 mimic的量效(A)与时效(B)

图5 小鼠骨髓巨噬细胞转染miR-340 inhibitor量效
FSC-A/FSC-H二维散点图,选定细胞群P1(见图7A);FSC-A/SSC-A二维散点图,圈出细胞群P2(见图7B);在荧光微球发射光的荧光通路(ECD)上检测样本的荧光强度,首先测定微球样本,确定单个荧光微球在ECD-A/Count直方图上的位置,即荧光强度(见图7C),再检测巨噬细胞样本。数据可用直方图(见图7D)或二维散点图(见图7E)表示。结果显示miR-340能降低巨噬细胞的吞噬率和平均荧光强度(P<0.05),见图7F-G。多样本直方图能直观显示出该结果(见图7H)。
2.5临床样本血浆检测,脓毒症患者miR-340表达增强 脓毒症患者入住重症监护室(接受治疗前,尤其是抗生素治疗)收集外周血样本,检测miR-340表达量(n=6)。结果显示,与健康志愿者相比,脓毒症患者的miR-340表达升高(P<0.05),见图8。
3 讨论
本研究发现MaR1在CLP和LPS诱导的脓毒症模型中通过调节miR-340发挥对巨噬细胞吞噬功能的调控作用。在体实验(小鼠CLP模型)和体外实验(LPS诱导的细胞脓毒症模型)证实脓毒症miR-340的表达量明显增加,MaR1可以降低其表达;而且临床脓毒症患者血浆miR-340的水平也较健康志愿者明显增高。同时,对小鼠原代巨噬细胞进行miR-340 mimic转染,荧光显微镜和流式细胞仪的检测结果均显示miR-340能抑制巨噬细胞的吞噬功能。以往研究表明脓毒症患者巨噬细胞功能受到抑制[9],而MaR1能增强巨噬细胞的吞噬功能[7]。因此我们认为脓毒症通过诱导miR-340的表达,抑制巨噬细胞的吞噬功能,进而引起脓毒症的一系列病理生理改变,而MaR1可以逆转这个过程,故我们认为MaR1对脓毒症的治疗及预后有一定的临床意义。
脓毒症的发病机制涉及病原微生物与宿主免疫、炎症和凝血反应之间复杂的相互作用[10]。在脓毒症的早期阶段,产生过量的促炎介质,如TNF-α和IL-1β,引起自身损伤和多器官功能障碍。一直以来我们的治疗策略为抗炎,但脓毒症的病死率仍居高不下使得我们不得不反思脓毒症的发生机制到底是什么。目前的观点是机体产生代偿性的抗炎反应来对抗过度的炎症反应,构成了脓毒症的晚期阶段—免疫抑制[1]。而在免疫抑制阶段中最重要的就是单核-巨噬细胞的功能受到抑制。有研究证实对免疫抑制状态的脓毒症患者使用干扰素-γ,可增强单核细胞的免疫功能,提高脓毒症患者的生存率[11]。

图6 荧光显微镜下检测小鼠腹腔巨噬细胞吞噬荧光微球能力(×200)
Maresin是DHA经人巨噬细胞上12-LOX合成的脂质介质家族,在组织稳态、炎症消退、伤口愈合和机体防御方面具有重要作用。MaR1是该家族的第一位成员,与其他omega-3脂肪酸来源的介质(如保护素D1和消退素E1)相比,具有显著的抗炎特性,如在酵母多糖诱导的腹膜炎模型中调节中性粒细胞浸润和巨噬细胞吞噬功能[7]。MaR1还能通过调节巨噬细胞表型的转化促进炎症消退[12]。越来越多的文献报道MaR1在各种疾病进程中的治疗作用,如能通过抑制中性粒细胞的黏附和减少促炎因子的释放减轻LPS诱导的小鼠急性肺损伤[13],又能通过抑制上皮间质转化(epithelial-mesenchymal transition,EMT)改善博来霉素引起的肺纤维化[14],以及减轻四氯化碳诱导的小鼠肝损伤[15]。我们前期研究发现MaR1能降低小鼠中度CLP模型的24 h死亡率,对脓毒症的预后有一定的指导意义。因此MaR1有望应用于临床,成为治疗脓毒症的有效药物。
MiRNAs是小的非编码单链RNA,通过与靶mRNA 3’UTR完全或不完全配对,抑制靶mRNA的翻译或者直接将其降解,于转录后水平对靶基因的蛋白表达进行调控。人类生物信息学预测miRNAs的靶基因非常广泛,可以调控人类基因的30%以上,参与调节多种细胞过程,如细胞周期、凋亡、造血干细胞分化、新陈代谢及肿瘤转移[16]。分析各类疾病及其不同病程中miRNAs的表达量,结果显示在不同疾病或同种疾病的不同进程中,miRNAs表达量是有变化的,其中有显著变化的miRNAs可能成为各种疾病诊断的生物学标记物以及治疗的靶点。已有研究证实miR-25、miR-146、miR-150、miR-133a和miR-223可能作为脓毒症的生物标记物[17]。我们的数据显示脓毒症miR-340的表达量显著增高,证明miR-340也可作为脓毒症的生物标志物及治疗靶点;而MaR1能降低体内/体外脓毒症模型中miR-340的诱导表达,说明MaR1可能通过调节miR-340的表达,改善脓毒症的预后。

图7 流式细胞术检测小鼠骨髓巨噬细胞吞噬荧光微球能力
大量文献证实miR-340可作为多种肿瘤的抑制物,与肿瘤的发生及转移过程密切相关,也与细胞侵袭和转移能力、细胞骨架重建相关。恶性组织与正常/良性组织相比miR-340的表达受到抑制,而降低miR-340的水平可导致肿瘤发生和转移,如miR-340能抑制结肠直肠癌细胞的生长[18],而骨髓中miR-340的低表达与结肠直肠癌的肝转移有关[19]。miR-340可直接抑制靶基因ROCK1的表达来抑制骨肉瘤的增长和转移[20],又可以抑制靶基因RhoA参与紫外辐射诱导的树突形成[21];而ROCK1是RhoA小GTP酶的重要下游效应器,当ROCK1选择性结合Rho GTP活性形式时被激活,而激活的ROCK1与肌动蛋白细胞骨架相互作用以促进肌动蛋白重组和细胞收缩[22]。因此我们推测miR-340能通过抑制RhoA/ROCK1的表达,抑制细胞的收缩,促进细胞伸出伪足进行吞噬。我们的结果显示miR-340能抑制巨噬细胞吞噬荧光微球,补充实验却证实miR-340并不影响巨噬细胞吞噬细菌。这与巨噬细胞吞噬机制的复杂性密切相关。吞噬不同物质时,颗粒的性质不同,结合的受体各异,以及吞噬过程中启动的信号通路也不尽相同[23]。巨噬细胞通过多病原相关分子模式(以Toll样受体家族为成员)直接识别病原体,而对调理过的病原体则通过补体受体和Fc受体介导的识别模式。所以我们认为miR-340可能只影响补体受体或Fc受体介导的信号通路,从而影响巨噬细胞吞噬荧光微球。
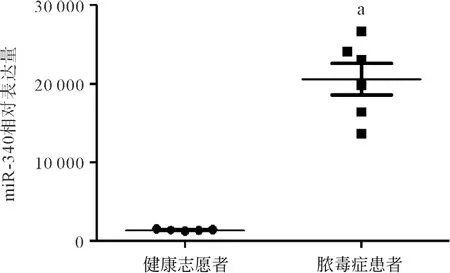
图8 脓毒症患者血浆中miR-340表达明显增加
最后,我们研究了增强miR-340的表达是否可以减弱MaR1对巨噬细胞吞噬功能的促进作用。小鼠骨髓巨噬细胞转染miR-340 mimic(50 nmol/L 48 h)后,加入LPS(1 μg/mL)和/或MaR1(100 nmol/L)8 h,采用流式细胞技术检测巨噬细胞吞噬荧光微球能力的变化。结果显示,miR-340并不能降低MaR1对巨噬细胞吞噬功能的促进作用。我们认为MaR1可以通过很多途径增强巨噬细胞的吞噬功能,而对miR-340的调节只是其中的一条途径,各种通路之间进行交互作用,最终表现出整体效应。
总之,MaR1可逆转CLP/LPS诱导脓毒症中巨噬细胞吞噬功能的抑制,其作用可能与调节miR-340的表达有关。MaR1有可能成为脓毒症的有效治疗药物,而miR-340则可能成为脓毒症的生物标记物之一。
参考文献:
[1]COHEN J. The immunopathogenesis of sepsis[J]. Nature,2002,420(6917): 885-891.
[2]ANGUS D C,VANDER P T. Severe sepsis and septic shock [J]. N Engl J Med,2013,369(21): 2063.
[3]VANDENBERG J W,VANDERZEE M,DEBRUIN R W,et al. Mild versus strong anti-inflammatory therapy during early sepsis in mice: a matter of life and death[J]. Crit Care Med,2011,39(6): 1275-1281.
[4]FISHER C J,DHAINAUT J F,OPAL S M,et al. Recombinant human interleukin 1 receptor antagonist in the treatment of patients with sepsis syndrome. Results from a randomized,double-blind,placebo-controlled trial. Phase III rhIL-1ra Sepsis Syndrome Study Group[J]. JAMA,1994,271(23): 1836-1843.
[5]OPAL S M,LATERRE P F,FRANCOIS B,et al. Effect of eritoran,an antagonist of MD2-TLR4,on mortality in patients with severe sepsis: the ACCESS randomized trial[J]. JAMA,2013,309(11): 1154-1162.
[6]SERHAN C N. Resolution phase of inflammation: novel endogenous anti-inflammatory and proresolving lipid mediators and pathways[J]. Annu Rev Immunol,2007,25: 101-137.
[7]SERHAN C N,YANG R,MARTINOD K,et al. Maresins: novel macro-phage mediators with potent anti-inflammatory and proresolving actions[J]. J Exp Med,2009,206(1): 15-23.
[8]SERHAN C N,DALLI J,KARAMNOV S,et al. Macrophage proresolving mediator maresin 1 stimulates tissue regeneration and controls pain[J]. FASEB J,2012,26 (4): 1755-1765.
[9]DONNELLY L E,BARNES P J. Defective phagocytosis in air-ways disease[J]. Chest,2012,141 (4): 1055-1062.
[10]RUSSELL J A. Management of sepsis[J]. N Engl J Med,2006,355(16): 1699-1713.
[11]LOLIS E,BUCALA R. Therapeutic approaches to innate immunity: severe sepsis and septic shock[J]. Nat Rev Drug Discov,2003,2(8): 635-645.
[12]DALLI J,ZHU M,VLASENKO N A,et al. The novel 13S,14S-epoxy-maresin is converted by human macrophages to maresin 1 (MaR1),inhibits leukotriene A4 hydrolase (LTA4H),and shifts macrophage phenotype[J]. FASEB J,2013,27(7): 2573-2583.
[13]GONG J,WU Z Y,QI H,et al. Maresin 1 mitigates LPS-induced acute lung injury in mice[J]. Br J Pharmacol,2014,171(14): 3539-3550.
[14]WANG Y,LI R,CHEN L,et al. Maresin 1 inhibits epithelialto-mesenchymal transition in vitro and attenuates bleomycin induced lung fibrosis in vivo[J]. Shock,2015,44(5): 496-502.
[15]LI R,WANG Y,ZHAO E,et al. Maresin 1,a proresolving lipid mediator,mitigates carbon tetrachloride-induced liver injury in mice[J]. Oxid Med Cell Longev,2016,2016: 9203716.
[16]AMISL J,DEPONTUAL L,HENRION C A. miRNA,development and disease[J]. Adv Genet,2012,80: 1-36.
[17]BENZ F,ROY S,TRAUTWEIN C,et al. Circulating mi-
croRNAs as biomarkers for sepsis[J]. Int J Mol Sci,2016,17(1): 299-307.
[18]SUN Y,ZHAO X,ZHOU Y,et al. miR-124,miR-137 and miR-340 regulate colorectal cancer growth via inhibition of the Warburg effect [J]. Oncol Rep,2012,28 (4): 1346-1352.
[19]TAKEYAMA H,YAMAMOTO H,YAMASHITA S,et al. Decreased miR-340 expression in bone marrow is associated with liver metastasis of colorectal cancer[J]. Mol Cancer Ther,2014,13 (4): 976-985.
[20]ZHOU X,WEI M,WANG W. MicroRNA-340 suppresses osteosarcoma tumor growth and metastasis by directly targeting ROCK1[J]. Biochem Biophys Res Commun,2013,437(4): 653-658.
[21]JIAN Q,AN Q,ZHU D,et al. MicroRNA 340 is involved in UVB-induced dendrite forma-tion through the regulation of RhoA expression in melanocytes[J]. Mol Cell Biol,2014,34(18): 3407-3420.
[22]LI F,JIANG Q,SHI K J,et al. RhoA modulates functional and physical interaction between ROCK1 and Erk1/2 in selenite-induced apoptosis of leukaemia cells[J]. Cell Death Dis,2013,4: e708.
[23]ADEREM A,UNDERHILL D M. Mechanisms of phagocytosis in macrophages[J]. Annu Rev Immunol,1999,17: 593-623.
(本文编辑:丁敏娇)
Maresin 1 strengthen macrophages phagocytosis via miR-340
XIE Haiqing,ZHANG Junli,XIE Xiang,JIN Shengwei. Department of Anesthesiology,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou,325027
Abstract:Objective: To investigate whether Maresin 1 (MaR1) could strengthen macrophage phagocytosis in sepsis model,and to explore the underlying mechanisms. Methods: Mouse peritoneal macrophages and bone marrow-derived macrophages (BMDMs) were assessed through detection of F4/80 expression by fluorescence microscopy and flow cytometry. MiR-340 expression was investigated under the treatment of MaR1 in CLP-induced and LPS-induced sepsis model in vivo and in vitro. MiR-340 expression in BMDMs transfected with miR-340 mimic or inhibitor was detected by quantificational real-time polymerase chain reaction (qRTPCR). And then,the effect of miR-340 on phagocytosis of macrophage was investigated with fluorescence microscopy and flow cytometry. Finally,miR-340 serum concentration in sepsis patients and in healthy volunteers was measured. Results: Mouse peritoneal macrophages and BMDMs were consisted of approximately 90% as assessed by F4/80 expression. MiR-340 expression was up-regulated in LPS challenging and down-regulated with MaR1 administration in vivo and in vitro (P<0.05). MiR-340 expression was up-regulated in BMDMs transfected with miR-340 mimic,however dose not down-regulated in BMDMs transfected with miR-340 inhibitor. The phagocytosis of mouse peritoneal macrophages transfected with miR-340 mimic was suppressed by fluorescence microscopy (P<0.05); Similarly,the function of BMDMs transfected with miR-340 mimic was refrained by flow cytometry (P<0.05). MiR-340 serum concentration was elevated in sepsis patients (P<0.05). Conclusion: MaR1 can strengthen macrophage phagocytosis via miR-340 in sepsis.
Key words:Maresin 1; LPS; miR-340; sepsis; macrophages; phagocytosis; mice
通信作者:金胜威,教授,博士生导师,Email:jinshengwei69@ 163.com。
作者简介:谢海青(1991-),女,浙江温州人,硕士生。
基金项目:国家自然科学基金资助项目(81570076)。
收稿日期:2016-03-23
[中图分类号]R4
[文献标志码]A
DOI:10.3969/j.issn.2095-9400.2016.05.001

