H3N2亚型SIV血凝蛋白单克隆抗体的制备
周云飞,朱春平,李 燕,常婧竹,崔保安,李新生
(河南农业大学 牧医工程学院,河南 郑州450002)
H3N2亚型SIV血凝蛋白单克隆抗体的制备
周云飞,朱春平,李燕,常婧竹,崔保安,李新生
(河南农业大学 牧医工程学院,河南 郑州450002)
[摘要]【目的】 制备H3N2亚型猪流感病毒(SIV)的单克隆抗体,为SIV的鉴别诊断奠定基础。【方法】 将A/swine/Henan/1/2010(H3N2)猪流感病毒初步浓缩后,免疫6周龄的BALB/c小鼠,取小鼠脾细胞与瘤细胞NS0融合,采用间接ELISA方法筛选杂交瘤细胞,对杂交瘤细胞分泌的单克隆抗体进行Western blot检验和抗原结合活性检测。【结果】 经过3次有限稀释法克隆纯化,最终得到1株能稳定分泌单克隆抗体的阳性细胞株,命名为1C10,经检测其腹水抗体效价为1∶51 200。单克隆抗体亚型鉴定结果表明,1C10为IgG1亚型,轻链类型为κ链。Western blot检测结果表明,这株单克隆抗体能与H3N2特异性结合,而且能特异性识别血凝素蛋白(HA),而不与H1N1亚型猪流感病毒、伪狂犬病毒、猪圆环病毒2型、猪细小病毒发生交叉反应。【结论】 制备获得1株抗猪流感H3N2病毒HA蛋白的单克隆抗体,可用于猪流感病毒鉴别诊断方法的建立。
[关键词]H3N2;猪流感病毒;单克隆抗体
猪流感病毒(Swine influenza virus,SIV)是单股负链RNA病毒,属正黏病毒科A型流感病毒,可引起猪急性高度接触传染性呼吸道疾病。目前世界各地流行的SIV主要有3种血清型,即古典H1N1、类禽H1N1和类人H3N2[1-2]。由于猪呼吸道上皮具有唾液酸α-2,6半乳糖苷(SAα-2,6-Gal)和唾液酸α-2,3半乳糖苷(SAα-2,3-Gal),是猪流感、禽流感和人流感病毒共同的易感宿主,也是流感病毒基因重组或重配的“混合器”和流感病毒新流行毒株的孵育器[3-4]。因此对于猪流感病毒的研究不仅具有兽医学方面的意义,更具有人类公共卫生学意义[5]。
近年来,张云[6]在河南地区发现1株四源重组猪流感病毒,进一步证实猪是流感病毒发生基因重排的“混合器”,也证明猪群中的SIV日趋复杂,迫切需要建立有效的监测体系。基于此,本研究将H3N2猪流感病毒初步浓缩后,免疫6周龄的BALB/c小鼠,取小鼠脾细胞与瘤细胞NS0在PEG2000的诱导下进行细胞融合,并采用间接ELISA方法筛选杂交瘤细胞,再对杂交瘤细胞分泌的单克隆抗体进行Western blot检验和抗原结合活性检测,最终制备得到了1株H3N2亚型SIV的单克隆抗体,可为SIV的鉴别诊断奠定理论基础。
1材料与方法
1.1材料
6周龄雌性BALB/c小鼠购自郑州大学动物中心;SPF鸡胚购自北京梅里亚维通公司。
猪流感病毒A/swine/Henan/1/2010(H3N2)和SW/HN/405/10(H1N1)及原核表达后复性的A/swine/Henan/1/2010株HA蛋白,均由河南农业大学河南省动物性食品安全重点实验室保存;猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)和NS0细胞,均由河南农业大学河南省动物性食品安全重点实验室保存;MDCK细胞由河南农业大学河南省动物性食品安全重点实验室保存。
弗氏完全佐剂、弗氏不完全佐剂、PEG2000、HAT培养基、HT培养基购自Sigma公司,DMEM低糖培养基、胎牛血清购自Hyclone,MILLIPORE超滤管购自Millipore公司,单克隆抗体亚型鉴定试纸盒购自罗氏公司,羊抗鼠IgG-HRP标签二抗购自康为世纪有限公司,羊抗鼠IgG-FITC标签二抗购自博奥森生物有限公司,底物TMB单组分显色液购自索莱宝公司。
1.2方法
1.2.1SIV抗原的制备与浓缩将SIV A/swine/Henan/1/2010(H3N2)稀释后,接种9~11日龄的SPF鸡胚,72 h后收取鸡胚尿囊液,测其血凝试验效价,取效价较高的尿囊液混合均匀,反复冻融3次后,4 ℃、8 000 r/min离心30 min,弃沉淀[7],将上清液加入可截留分子质量为100 ku分子的MILLIPORE超滤管,4 000g离心30 min,收集滤膜上方液体。采用病毒血凝试验测定浓缩后病毒效价,采用分光光度计测定病毒蛋白含量,于-30 ℃保存。
1.2.2间接ELISA方法的初步建立(1)包被抗原最佳质量浓度和阴、阳性对照血清最佳稀释倍数的确定。参考文献[8]中的方法建立间接ELISA方法。抗原的质量浓度分别为35.4,17.7,8.9和4.4 μg/mL,阳性血清分别稀释800,1 600,3 200和6 400倍,阴性血清稀释800倍作为阴性对照,试验结果用OD450值表示。OD450值最接近1.0时,包被抗原的质量浓度为最佳质量浓度,阳性血清的稀释倍数为最佳稀释倍数,取阴性血清的最佳稀释倍数与阳性血清相同。
(2)阴阳性血清临界值的确定。取小鼠SIV阴性血清,在包被抗原最佳质量浓度和阴阳性对照血清最佳稀释倍数下进行间接ELISA试验,计算阴阳性血清临界值(阴阳性血清临界值=阴性样本OD450平均值+3×标准差)。
(3)结果判定。待测样品OD450值大于阴阳性血清临界值,并且P/N≥2.1(P=待测样品的OD450值;N=阴性血清OD450值的平均值)者判为阳性[9]。
1.2.3动物免疫先将10只BALB/c小鼠断尾采集阴性血清,然后按照参考文献[10]的方法进行免疫,首免剂量200 μg/只,将SIV与等体积弗氏完全佐剂乳化后,皮下注射6周龄BALB/c小鼠;2周后进行第2次免疫,剂量同上,将SIV与等体积弗氏不完全佐剂充分乳化后皮下注射;再2周后,第3次免疫,剂量同上。从第3次免疫起,每隔7 d断尾采血,制备阳性血清,用1.2.2节中建立的间接ELISA方法,测定小鼠血清抗体效价。
选取抗体效价最高的3只小鼠,在细胞融合前3 d,腹腔注射浓缩病毒400 μg/只加强免疫1次。融合前采血,血清稀释1 600,3 200,6 400,12 800,25 600,51 200和102 400倍,以PBS为空白对照,采用间接ELISA方法测定血清抗体水平,取抗体水平最高的小鼠脾细胞与瘤细胞进行融合。
1.2.4细胞融合及阳性杂交瘤细胞的筛选与克隆培养NS0瘤细胞至对数生长期,收获免疫小鼠脾细胞,将脾细胞与NS0细胞按照5∶1至2∶1的数量比混合,然后在PEG2000诱导下进行细胞融合。融合后的细胞使用配制好的HAT选择培养基吹打均匀,加入到10块铺好饲养细胞的96孔板中,在37 ℃、体积分数5% CO2培养箱内培养。第4天和第7天使用HAT选择培养基半量换液,第10天和第14天,改用HT选择培养基半量换液,以后逐步改为完全DMEM培养基换液。待细胞融合7~10 d后,开始密切观察细胞生长情况,待杂交瘤细胞铺满96孔板孔底1/8以上时,取96孔板中的杂交瘤细胞上清液,用间接ELISA方法检测其单克隆抗体效价。第1次检测为阳性的孔,3 d后再取上清检测第2次。第2次筛选结果仍为阳性的孔,取其中的杂交瘤细胞用有限稀释法连续克隆纯化3次。取第3次克隆纯化后的杂交瘤细胞定株的培养上清液,从100倍开始,连续倍比稀释,用间接ELISA法测定其效价。
1.2.5腹水的制备取12周龄以上雌性BALB/c小鼠,腹腔注射无菌石蜡油0.5 mL/只,7 d后腹腔注射杂交瘤细胞1×106只-1,注射7 d后经常观察小鼠,待小鼠腹腔膨胀到一定程度时,无菌条件下收集腹水,1 500 r/min离心10 min,取上清液-70 ℃保存。将少量上清液用间接ELISA法测定单克隆抗体效价。取腹水上清从100倍开始,连续倍比稀释,用间接ELISA法测定其效价。
1.2.6抗HA单克隆抗体亚型及其特异性鉴定按照单克隆抗体亚型鉴定试剂盒操作说明鉴定单克隆亚型。
分别用H1N1亚型猪流感病毒、猪圆环病毒2型(PCV2)、猪伪狂犬病毒(PRV)、猪细小病毒(PPV)及复性HA蛋白为抗原(均稀释至8.9 μg/mL)包被ELISA板子,以800倍稀释的腹水作为一抗,测定与这株单克隆抗体的细胞上清液有无反应。以H3N2亚型猪流感病毒为阳性对照。
1.2.7HA抗体的Western blot分析取浓缩的H3N2亚型猪流感病毒40 μL,加入10 μL 5×SDS-Loading buffer,沸水煮10 min并进行SDS-PAGE电泳后,转印到聚偏二氟乙烯膜(PVDF膜),以腹水单抗作为一抗(1∶500),37 ℃作用2 h,以羊抗鼠IgG-HRP为二抗,37 ℃作用1 h,DAB显色液作用10 min,漂洗干净,然后观察[11]。
1.2.8抗HA单克隆抗体抗原结合活性检测以H3N2亚型猪流感病毒感染MDCK细胞,当细胞出现明显病变时,利用间接免疫荧光试验的方法测定HA单克隆抗体的抗原结合活性,具体方法见参考文献[12]。
2结果与分析
2.1SIV抗原的制备与浓缩
浓缩前混合病毒血凝效价为27,经8 000 r/min 除杂质,再通过MILLIPORE超滤管除去小分子质量(分子质量<100 ku)的杂质蛋白后,滤膜上方病毒液体血凝效价为213,用分光光度计测量浓缩后的抗原质量浓度为19.513 mg/mL,-30 ℃保存。
2.2间接ELISA方法的初步建立
2.2.1包被抗原最佳质量浓度和对照血清最佳稀释倍数的确定由表1可知,当包被抗原质量浓度为8.9 μg/mL,阳性血清稀释1 600倍时,其OD450值最接近1.0,因此包被抗原最佳质量浓度为8.9 μg/mL,阳性对照血清最佳稀释倍数为1 600倍。同时取1 600倍为阴性对照血清最佳稀释倍数。
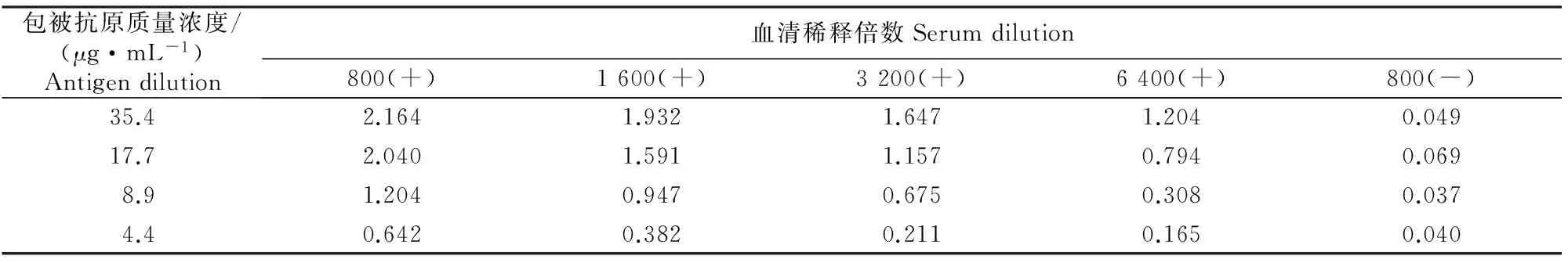
表 1 间接ELISA方法中包被抗原最佳质量浓度和血清最佳稀释倍数的确定(OD450)
注:(+)表示阳性血清;(-)表示阴性血清。
Note:(+)means positive serum;(-)means negative serum.
2.2.2阴阳性血清临界值的确定在包被抗原最佳质量浓度和对照血清最佳稀释倍数下进行试验,结果10份阴性血清的OD450值分别为0.049,0.046,0.057,0.057,0.047,0.058,0.047,0.050,0.046和0.045,其平均值为0.050 2,标准差为 0.065 4,因此阴阳性血清临界值为0.246。
2.3动物免疫的抗体水平
按照免疫程序,最后得到3只高抗体水平的小鼠。免疫后小鼠血清抗体水平的间接ELISA测定结果(OD450)见表2。由表2可知,在小鼠血清按 1∶102 400 倍稀释时,3只小鼠血清的OD450值(P)均大于阴阳性血清临界值0.246,而阴性血清OD450值的平均值(N)为0.050 2,计算其P/N值均大于2.1。取P/N值最大的3号小鼠的脾细胞与瘤细胞进行融合。

表 2 免疫后小鼠血清抗体水平的间接ELISA测定结果(OD450)
2.4杂交瘤细胞的筛选
第1次筛选获得了OD450值大于阴阳性血清临界值且P/N>2.1的8株阳性杂交瘤细胞,根据其所在96孔板的位置分别命名为1C10、4A11、4C6、4E5、5D4、6B3、8E5、9A9;经过2次筛选后,仅有1C10的单克隆抗体为阳性(表3),将其有限稀释。同时,为了挽救其他可能存在的单克隆抗体,对其他7孔也进行了有限稀释,但仍然没有得到阳性孔。将命名为1C10的杂交瘤细胞经过3次亚克隆,得到1株能够稳定分泌单克隆抗体的杂交瘤细胞株。
2.5抗HA单克隆抗体效价的测定
使用间接ELISA方法测定杂交瘤细胞上清液抗HA单克隆抗体效价为1∶1 600,腹水单抗效价为1∶51 200。

表 3 分泌抗HA单克隆抗体的杂交瘤细胞的筛选
2.6抗HA单克隆抗体亚型和特异性的鉴定
图1结果显示,1C10为IgG1亚型,轻链类型为κ链。表4结果表明,1C10株单克隆抗体与复性HA蛋白呈阳性反应(OD450值>0.246),而与H1N1亚型猪流感病毒、PRV、PCV2、PPV都不反应。

图 1 鼠源抗HA单克隆抗体亚型的鉴定结果

抗原Antigen复性HA蛋白RefoldedHAproteinH1N1PRVPCV2PPVH3N2OD4500.4470.0350.0690.0390.0411.129
2.7抗HA单克隆抗体的Western blot检验
Western blot检验结果(图2)显示,1C10株单克隆抗体在62 ku处出现特异性反应,与HA蛋白分子质量大小相符。结合表4中单抗与复性HA蛋白呈阳性反应的结果可知,1C10株单克隆抗体可识别H3N2亚型猪流感病毒,并特异性识别HA蛋白[13]。
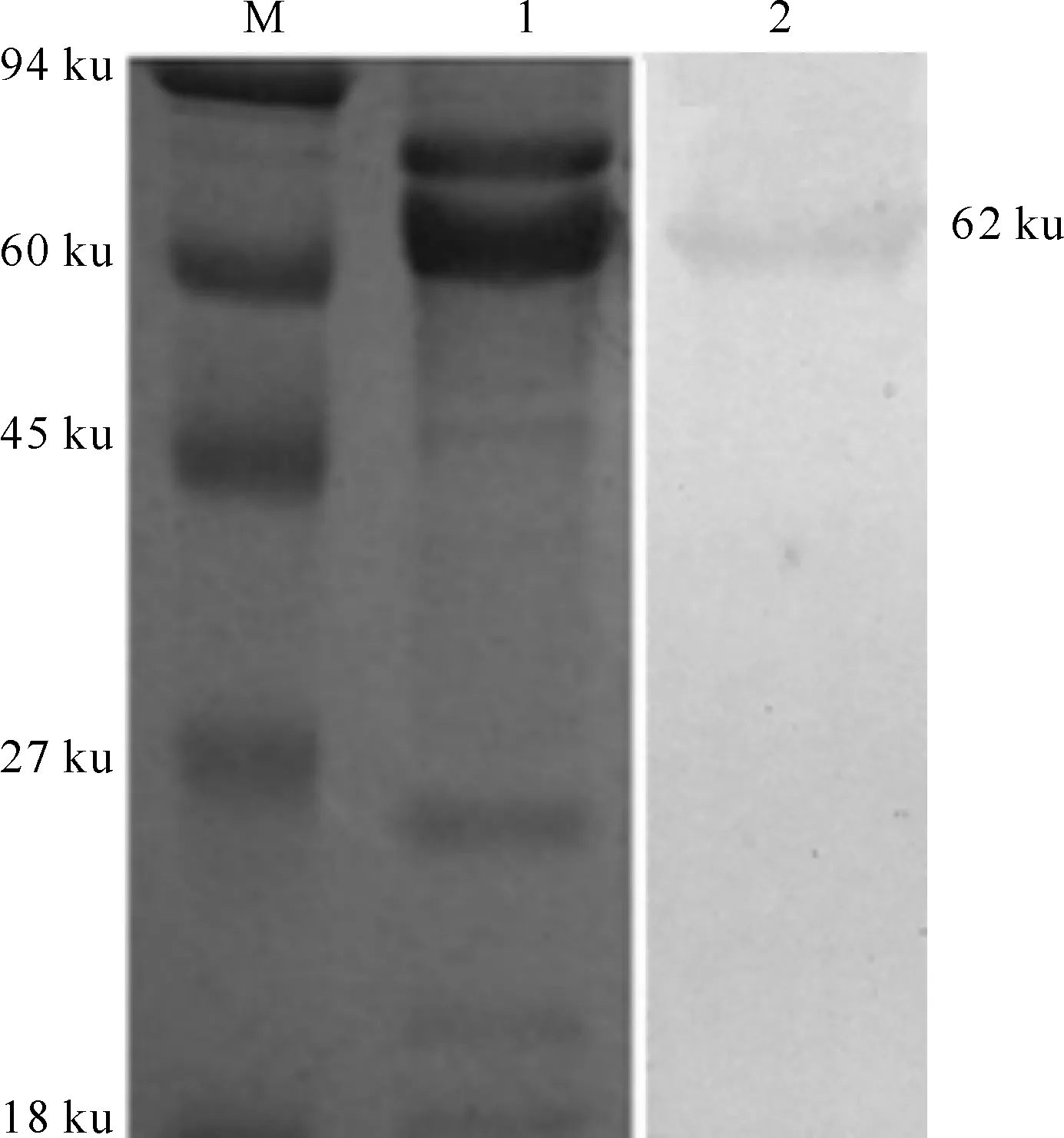
图 2 抗HA单克隆抗体的Western blot鉴定
2.8抗HA单克隆抗体的抗原活性
检测结果显示,阴性对照未接毒的MDCK细胞无荧光(图3-A);接种H3N2亚型猪流感病毒的MDCK细胞出现病变,可以与1C10单克隆抗体特异性反应,出现明显荧光(图3-B)。

图 3 抗HA单克隆抗体抗原结合活性的检测(10×)
3讨论
抗原的制备与处理是单克隆抗体制备的第一步,通过鸡胚接种获得的H3N2亚型SIV中含有大量的尿囊液杂蛋白,用其诱导小鼠会产生大量的非特异性抗体,因而会增大单克隆抗体的筛选难度[14]。本试验对收获的病毒尿囊液先8 000 r/min 离心30 min,再经过超滤管过滤,这样得到的H3N2亚型猪流感病毒去除了鸡胚尿囊液中的大部分杂蛋白,从而可以取得较好的免疫效果。本试验曾尝试使用超高速离心的方法来沉淀病毒,但是该方法对病毒的损耗较大,且超高速离心机操作复杂,因而并不实用。
用病毒免疫小鼠的方法制备单克隆抗体,与使用特定蛋白免疫小鼠的方法相比,其优点是可以一次制备针对多种蛋白的单克隆抗体,缺点是难以得到针对特定蛋白、特定位点的单克隆抗体。为了更加深入地研究H3N2亚型猪流感病毒的HA蛋白,使用原核表达的HA蛋白免疫小鼠,制备抗HA蛋白单克隆抗体将是下一步的工作。
本试验采用全病毒免疫动物,并以全病毒包被ELISA反应板来筛选单克隆阳性杂交瘤细胞株,目的是为了获得更为丰富的分泌抗猪流感病毒的杂交瘤细胞株。最终得到了1株针对H3N2猪流感病毒HA蛋白的单克隆抗体1C10。这株抗猪流感H3N2病毒HA蛋白的单克隆抗体的制备,为H3N2亚型猪流感病毒快速准确检测方法的建立奠定了基础。
[参考文献]
[1]Ma W,Gramer M,Rossow K,et al.Isolation and genetic characterization of new reassortant H3N1 swine influenza virus from pigs in the Midwestern United States [J].J Virol,2006,80:5092-5096.
[2]陈敬贤.2010-2011年流感病毒流行状况回顾 [J].中华结核和呼吸杂志,2012,35(1):61-62.
Chen J X.Review of the 2010-2011 influenza [J].Chinese Journal of Tuberculosis and Respiratory Diseases,2012,35(1):61-62.(in Chinese)
[3]李海燕,于康震,杨焕良,等.中国猪源H5N1和H9N2亚型流感病毒的分离鉴定 [J].中国预防兽医学报,2004,26(1):1-6.
Li H Y,Yu K Z,Yang H L,et al.Isolation and identification of Chinese swine H5N1 and H9N2 subtype of influenza virus [J].Chinese Journal of Preventive Veterinary Medicine,2004,26(1):1-6.(in Chinese)
[4]周伦江,王隆柏,俞玉鸿,等.人源H3N2亚型猪流感重组病毒的分离鉴定及全基因序列分析 [J].中国预防兽医学报,2011,33(9):675-680.
Zhou L J,Wang L B,Yu Y H,et al.Isolation and identification of human H3N2 subtype swine influenza viruses and sequence analysis of recombinant genome [J].Chinese Journal of Preventive Veterinary Medicine,2011,33(9):675-680.(in Chinese)
[5]Scotch M,Mei C.Phylogeography of swine influenza H3N2 in the United States:Translational public health for zoonotic disease surveillance [J].Infection,Genetics & Evolution,2013,13(1):224-229.
[6]张云.河南省H1N2亚型猪流感病毒分离株基因组演化特征和生物学特性研究 [D].郑州:河南农业大学,2012.
Zhang Y.Research and biological characteristics of Henan H1N2 subtype swine influenza virus isolate genomic evolution [D].Zhengzhou:Henan Agricultural University,2012.(in Chinese)
[7]杨建民,秦卓明.禽脑脊髓炎病毒单克隆抗体的制备及鉴定 [J].畜牧兽医学报,2003,34(2):191-194.
Yang J M,Qin Z M.Preparation and characterization of avian encephalomyelitis virus monoclonal antibody [J].Acta Veterinaria et Zootechnica Sinica,2003,34(2):191-194.(in Chinese)
[8]Crowther J R.The ELISA guidebook [M].2nd ed.USA:Humana Press,2009:79-111.
[9]陈艳,辛晓光,杨焕良,等.猪流感抗体间接ELISA检测方法的建立 [J].中国预防兽医学报,2007,29(4):308-311.
Chen Y,Xin X G,Yang H L,et al.Swine flu establish an indirect ELISA detection method [J].Chinese Journal of Preventive Veterinary Medicine,2007,29(4):308-311.(in Chinese)
[10]郭利敏,乔传玲,陈艳,等.利用真核表达的猪流感病毒NP蛋白制备其特异性的单克隆抗体 [J].畜牧兽医学报,2010,32(6):460-463.
Guo L M,Qiao C L,Chen Y,et al.The use of eukaryotic expression swine influenza virus NP protein specificity monoclonal antibody preparation [J].Acta Veterinaria et Zootechnica Sinica,2010,32(6):460-463.(in Chinese)
[11]李慧昕,刘胜旺,韩宗玺,等.鸭肠炎病毒VP5蛋白单克隆抗体的制备及鉴定 [J].中国兽医杂志,2013,29(1):9-12.
Li H X,Liu S W,Han Z X,et al.Preparation and characterization of duck enteritis virus VP5 protein monoclonal antibodies [J].Chinese Journal of Veterinary Medicine,2013,29(1):9-12.(in Chinese)
[12]汪招雄,何启盖,黄红亮,等.抗伪狂犬病毒Ea株单克隆抗体的制备及鉴定 [J].华中农业大学学报,2005,24(3):222-225.
Wang Z X,He Q G,Huang H L,et al.Preparation and characterization of anti-pseudorabies virus Ea monoclonal antibodies [J].Huazhong Agricultural University,2005,24(3):222-225.(in Chinese)
[13]肖成蕊,宋战昀,杨立英,等.H3N8亚型马流感病毒单克隆抗体的制备及鉴定 [J].动物医学进展,2011,32(6):1-4.
Xiao C R,Song Z Y,Yang L Y,et al.Preparation and characterization of equine influenza virus subtype H3N8 monoclonal antibodies [J].Progress in Veterinary Medicine,2011,32(6):1-4.(in Chinese)
[14]李引乾,郝志明,段清学,等.鸡胚尿囊液对小鼠免疫功能与抗应激作用的影响 [J].中国兽医科技,2003,33(11):46-48.
Li Y Q,Hao Z M,Duan Q X,et al.Allantoic fluid impact on immune function and anti-stress effects in mice [J].Chinese Journal of Veterinary Science and Technology,2003,33(11):46-48.(in Chinese)
Preparation of monoclonal antibody for H3N2 subtype swine influenza virus hemagglutinin protein
ZHOU Yun-fei,ZHU Chun-ping,LI Yan,CHANG Jing-zhu,CUI Bao-an,LI Xin-sheng
(CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou,Henan450002,China)
Abstract:【Objective】 To identify different swine influenza virus (SIV) and antibodies against SIV,monoclonal antibodies (Mabs) secreted by hybridoma cell lines against SIV H3 subtype were prepared.【Method】 Concentrated swine influenza A/swine/Henan/1/2010(H3N2) viruses were injected subcutaneously or intraperitoneally into 6-week-old BALB/c mice with the rate of 0.2 mL per mouse according to the immunization protocol.For fusion,spleen cells and partner cells were washed,harvested,and mixed.Hybridomas cells were screened using indirect ELISA method.Then,the monocolonal antibodies from hybridomas were tested by Western blot.【Result】 One candidate hybridoma named 1C10 was identified after clone and purification by limiting dilution for three times.The titre of ascitic fluids of 1C10 was up to 1∶51 200.Monoclonal antibody 1C10 was IgG1 subtype and its light chain was kappa-type.Western blot showed that the MAb was specifically bounded to SIV H3N2 virus.1C10 can be captured by hemagglutinin protein (HA) protein of SIV H3N2 in indirect ELISA and Western blot tests.There was no crossing reaction between 1C10,SIV H1N1 subtype,PRRSV,PCV2,and PPV.【Conclusion】 The obtained monoclonal antibody 1C10 could be a useful reagent for diagnosing SIV infection and analyzing the epitopes of HA protein of SIV H3N2 virus.
Key words:H3N2;swine influenza virus;monoclonal antibody
[文章编号]1671-9387(2016)01-0031-06
[中图分类号]S852.65+9.5
[文献标志码]A
[通信作者]李新生(1968-),男,河南荥阳人,副教授,博士,主要从事畜禽疫病分子病原学及免疫学研究。
[作者简介]周云飞(1989-),男,河南鹤壁人,在读硕士,主要从事畜禽疫病分子病原学及免疫学研究。
[基金项目]国家农业科技成果转化资金项目(2012GB2D000273);河南省科技成果转化计划项目(122201110027)
[收稿日期]2014-04-04
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.006
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.012.html
E-mail:cnglish2005@163.com
E-mail:harmony69@163.com

