308nm准分子激光对斑块型银屑病患者皮损中IL-17、CD4表达的影响
陈福娟,丁杨峰,于宁,陆家睛,易雪梅(上海市皮肤病医院,上海200443)
308nm准分子激光对斑块型银屑病患者皮损中IL-17、CD4表达的影响
陈福娟,丁杨峰,于宁,陆家睛,易雪梅
(上海市皮肤病医院,上海200443)
摘要:目的采用308nm准分子激光治疗斑块型银屑病,治疗前后用免疫组化法检测组织中IL-17、CD4的表达,为阐明308nm准分子激光治疗斑块型银屑病的机制提供理论依据。方法取20例斑块型银屑病患者皮损和10例正常人对照者皮肤,308nm准分子激光照射治疗前后用免疫组化法检测组织中IL-17、CD4表达。结果银屑病患者皮损中可见IL-17、CD4+T细胞浸润,主要集中在真皮浅层血管周围;而正常皮肤组织仅有微量CD4+T、IL-17细胞表达。采用308nm准分子激光照射治疗后患者皮损IL-17、CD4阳性水平均显著下降(P<0.001)。结论银屑病患者皮损内IL-17、CD4细胞数目增多,表示其可能与银屑病的发生有一定的相关性。显著降低皮损中IL-17、CD4阳性水平可能是308nm准分子激光治疗作用机制之一。
关键词:银屑病;308nm准分子激光;CD4+T淋巴细胞;白细胞介素17
Th17是近年来发现的一种不同于Th1、Th2的CD4+T细胞,其不产生IL-4或IFN-γ,而特征性地产生IL-17、IL-22等。Th17具有独立的分化和发育调节机制,在自身免疫性疾病和感染性疾病中发挥重要调节作用。笔者取20例斑块型银屑病患者皮损和10例正常人对照者皮肤,采用308nm准分子激光照射治疗前后免疫组化法检测组织中IL-17、CD4表达,探讨308nm准分子激光治疗斑块型银屑病的机制。
1 病例与方法
1.1临床资料入选病例为2012年12月—2014年7月在本中心门诊确诊的银屑病患者20例,男15例,女5例,平均年龄(50.75±14.78)岁,平均病程(6.65±4.09)年,所选病例近1个月未作局部治疗,2个月内未作任何免疫抑制剂治疗,无其他免疫性皮肤病及系统性疾病。10例正常皮肤组织标本来源于我院皮肤外科的健康人,男8例,女2例,平均年龄(49.30±15.76)岁,观察前1个月内无细菌、真菌、病毒感染,既往无银屑病等免疫相关皮肤疾病。2组在性别、年龄上差异无统计学意义(P>0.05)。本研究通过医院伦理委员会批准,患者签署知情同意书。
1.2试剂和仪器308nm准分子激光仪(重庆德马光电技术有限公司,型号:XECL-308),70℃烤箱(上海成顺仪器仪表有限公司),石蜡切片机(日本PIKASEIKO LID),医用高压锅(北京中杉金桥生物技术有限公司),电子显微镜(日本O1ympus公司),PBS缓冲液(福州迈新生物技术开发有限公司,货号PBS-0060),Anti-CD4 antibody(福州迈新生物技术开发有限公司,货号RMA -0620),Anti -IL17 antibody(福州迈新生物技术开发有限公司,货号MAB-0021),DAB显色试剂盒(福州迈新生物技术开发有限公司,货号DAB-2031),中性树胶(北京康为,CW0136),即用型免疫组化E1ivision p1us试剂盒(福州迈新生物技术开发有限公司,货号:KIT-9901)。
1.3方法
1.3.1308nm准分子激光照射试验组给予308nm准分子激光局部照射2次/周,照射前测定MED,患者初始剂量为1倍的MED,每次剂量均在前次照射剂量的基础上增加10%~25%,如果局部出现明显红斑,则减少前次照射剂量的10%;如出现痛性红斑或水疱则停止照射1次或2次。疗程为10次,如照射部位痊愈则停止照射308nm准分子激光。观察时间为每周1次,随访5次。
1.3.2治疗前后免疫组化法检测组织中IL-17、CD4表达308nm准分子激光对寻常型银屑病患者外周血和皮损中Th17细胞及相关因子的影响研究①石蜡切片4μm厚,用防脱片剂多聚赖氨酸处理过的载玻片捞片,置烤箱65℃,6h。②脱蜡:二甲苯Ⅰ、Ⅱ、Ⅲ、Ⅳ各8min。③水化:100%乙醇5min,95%乙醇5min,85%乙醇5min,75%乙醇5min,蒸馏水烧杯中泡2min。磷酸盐缓冲溶液(PBS)洗3次×3min。④高温高压抗原修复:取足量PH6.0柠檬酸缓冲液于压力锅中,加热至沸腾,将切片置入已沸腾的缓冲液中,盖上锅盖,扣上压力阀,继续加热到喷气阀开始喷气。1.5min后压力锅离开热源,1min后自来水轻淋锅体冷却至室温(约20min),取出切片,PBS洗3次×3min。⑤滴加一抗,以PBS代替一抗作空白对照,4℃冰箱孵育过夜。PBS洗3次×3min。⑥滴加聚合物增强剂,室温孵育20min。PBS洗3次×3min。⑦滴加酶标抗鼠聚合物,室温孵育30min。PBS洗3次×3min。⑧DAB显色:蒸馏水1mL,加显色试剂盒内A、B试剂各1滴,充分混匀,室温下避光显色5min,自来水冲洗10min。⑨苏木素复染5min,自来水返蓝10min。逾梯度乙醇逐级脱水,75%乙醇5min,85%乙醇5min,95%乙醇5min,100%乙醇5min。11○烘干,中性树胶封片。
1.3.3免疫组化染色结果判定IL-17表达阳性为细胞核内发现淡黄或棕黄色颗粒,CD4表达阳性为表皮,真皮乳头及真皮浅层T淋巴细胞胞膜出现淡黄色或棕黄色颗粒。结果分析每张切片随机选取5个高倍视野(×100),计数IL-17+、CD4+免疫反应阳性细胞数量,每种阳性细胞数量以每个高倍视野中均数±标准差(x±s)来表示。
1.4统计学方法应用SPSS13.0软件进行统计分析,光疗前斑块型银屑病与正常对照组,斑块型银屑病光疗前和光疗后IL-17、CD4阳性表达细胞数比较用t检验。
2 结果
正常皮肤组织仅有微量CD4+、IL-17表达,见图1、2,银屑病患者皮损中可见IL-17、CD4+T细胞表达,主要集中在真皮浅层血管周围,见图3、4,采用308nm准分子激光照射治疗后患者皮损IL-17、CD4+水平均显著下降(P<0.001),见图5、6,见表1。
3 讨论

表1 光疗前、光疗后IL-17、CD4的表达 (?±s)

图1 健康对照组CD4细胞阳性表达(SP染色×100)
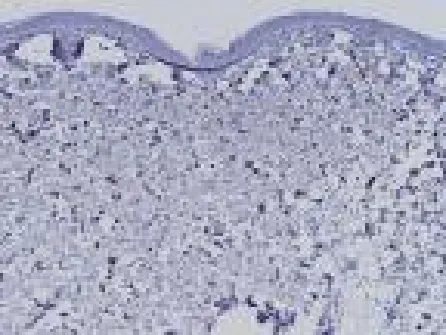
图2 健康对照组IL-17细胞阳性表达(SP染色×100)
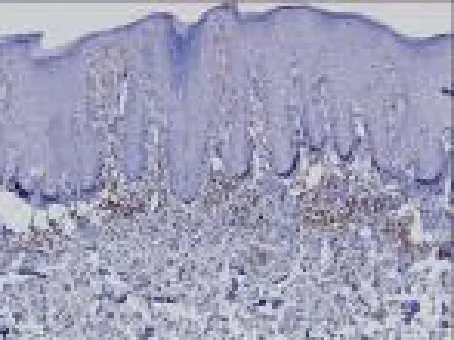
图3 光疗前银屑病皮损CD4细胞阳性表达(SP染色×100)

图4 光疗前银屑病皮损IL-17阳性表达(SP染色×100)

图5 光疗后银屑病皮损CD4细胞阳性表达(SP染色×100)
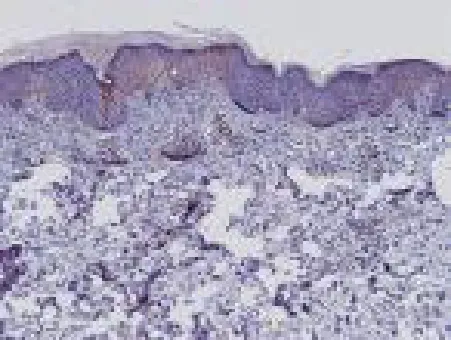
图6 光疗后银屑病皮损IL-17表达(SP染色×100)
长久以来,认为银屑病发病是Th1和Th2细胞的比例失调,导致自身反应性T细胞过度活化从而引起银屑病发病是中心环节。过去的5年,银屑病发病机制研究热点主要聚焦于Th17细胞及相关因子[1]。目前研究认为,银屑病是多基因遗传背景下T细胞异常表达的免疫性疾病,T细胞活化是银屑病细胞免疫发病的重要机制,多种免疫相关细胞、细胞因子及炎症介质形成免疫炎症致病网络[2]。传统上将Th细胞分为Th1细胞、Th2细胞及调节性T(Treg)细胞3个亚群,分别分泌IL-2、IFN-γ和IL-4、IL-5,参与机体的细胞免疫和体液免疫应答[3]。Th17细胞是近年来研究发现的两种不同于Th1、Th2的CD4+细胞[4-5]。介导炎症反应的Th17细胞与介导免疫耐受的Treg细胞都来源于初始T细胞,Th17是产生IL-17的T细胞亚群,Th17细胞能特异性地分泌以IL-17为主的细胞因子[6],在多种自身免疫性疾病和炎症性疾病中介导免疫损伤。Lowes等[7]发现,Th17细胞主要存在于银屑病患者皮损处的真皮层,并且其mRNA表达与疾病活动程度相关。2012年3月,Craig和Kim等[8-9]发表在《新英格兰杂志》上的2项研究成果显示,中/重度银屑病新的靶向治疗IL-17阻断剂ixekizumab改善了约77%的患者(最低剂量)和82%的患者(最高剂量)75%的银屑病斑块;IL-17受体抑制剂broda1umab改善了77%和82%的患者至少75%的病损。Th17细胞在银屑病的发病中的作用受到越来越多的实验研究所证实。
308nm准分子激光在1997年首次用于局限性银屑病治疗,与Nb-UVB大面积暴露在紫外光下相比更加安全有效[10]。但其具体治疗机制尚不清楚,目前认为T淋巴细胞是308nm准分子激光作用的靶细胞。通过诱导T细胞的凋亡和抑制细胞因子的产生而发挥作用。James等[11]应用UVB治疗9例银屑病患者,经过4~5周照射后照射部位组织行免疫组化染色,结果显示表皮部位90%的T淋巴细胞被清除。杨慧兰等[12]应用308nm准分子激光照射角质形成细胞和体外分离的活动期白癜风患者外周血T淋巴细胞,结果显示308nm准分子激光可直接和间接诱导T淋巴细胞凋亡。
本实验结果显示,银屑病患者皮损中可见IL-17、CD4+T细胞浸润,主要集中在真皮浅层血管周围;而正常皮肤组织仅有微量CD4+T、IL-17细胞表达。采用308nm准分子激光照射治疗后患者皮损IL-17、CD4阳性水平均显著下降。提示308nm准分子激光照射可能通过下调皮损IL-17、CD4阳性水平的表达减轻炎症细胞的浸润程度,从而发挥良好的治疗作用。UVB能诱导银屑病患者外周血T淋巴细胞凋亡,与传统UVB相比较,308nm准分子激光产生的UVB引起T细胞凋亡的能力显著增强。另外,308nm准分子激光能抑制细胞因子的产生。本研究中发现308nm准分子激光可能通过同时降低皮损中IL-17、CD4的表达,从而抑制角质形成细胞过度增殖,减少T淋巴细胞的浸润,减少局部的炎症反应,在银屑病治疗中发挥重要作用。
参考文献:
[1]Nogra1es KE,Davidovici B,Krueger JC. New insight in the immuno-1ogicbasisofpsoriasis[J]. Semin Cutan Med Surg,2010,29:3-9.
[2]Anna MS,A1dona P,Jacek CS,et a1. Cytokine network in psoriasis revisited[J]. Eur Cytokine Netw,2011,21:160-168.
[3]Murphy KM,Reiner SL. The 1ineage decisions of he1per T ce11s[J]. Nat Rev Immuno1,2002,2:933-944.
[4]Li J,Chen X,Liu Z,et a1. Expression of Th17 cytokines in skin 1esion of patients with psoriasis[J]. J Huazhong Univ Sci Techno1ogy Med Sci,2007,27:330-332.
[5]Kagami S,Rizzo HL,Lee JJ,et a1. Circu1ating Th17,Th22,and Th1 ce11 are increased in psoriasis[J]. J Invest Dermato1,2010,130:1373-1383.
[6]Miossec P,Korn T,Kuchroo VK. Inter1eukin -17 and type 17 he1per T ce11s[J]. N Eng1 J Med,2009,361:888-898.
[7]Lowes MA,Kikuchi T,Fuentes-Ducu1an J,et a1. Psoriasis vu1garis 1esions contain discrete popu1ations of Th1 and Th17 T ce11s[J]. J Invest Dermato1,2008,128:1207-1211.
[8]Craig L,Robert M,C1aus Z,et a1. Anti-Inter1eukin-17 Monoc1ona1 Antibody Ixekizumab in Chronic P1aque Psoriasis[J]. N Eng1 J Med,2012,366:1190-1199.
[9]Kim AP,Craig L,A1an M,et a1. Broda1umab,an Anti-Inter1eukin-17- recptor Antibody for Psoriasis[J]. N Eng1 J Med,2012,366:1181-1189.
[10]Mudigonda T,Dabade TS,Fe1dman SR. A review of protoco1s for 308 nm excimer 1aser phototherapy in psoriasis[J]. J Drugs Dermato1,2012,11:92-97.
[11]James G,Krueger,Jonathan T,et a1. Successfu1 u1travio1et B treatment of psoriasis is accompanied by a reversa1 of keratinocyte patho1ogy and by se1ective dep1etion of intraepiderma1 T ce11s[J]. J Exp Med,1995,182:2057-2068.
[12]杨慧兰,黄小晏. 308 nm准分子激光诱导T细胞凋亡的研究[J].临床皮肤科杂志,2008,37(10):639-641.
资助项目:上海市科委课题(12411951702);上海市卫生局课题(20124126)
收稿日期:(2015-06-04)
中图分类号:R758.63
文献标识码:B
文章编号:1672-0709(2016)02-0111-03

