慢性肾脏病患者铁剂应用的争议:来自改善全球肾脏病预后组织(KDIGO)会议的结论
Iain C. Macdougall, Andreas J. Bircher, Kai-Uwe Eckardt, Gregorio T. Obrador, Carol A. Pollock,Peter Stenvinkel, Dorine W. Swinkels, Christoph Wanner, Gü nter Weiss0, and Glenn M. Chertow; for Conference Participants[原文发表在Kidney Int,06,():-]
·医学继续教育·
慢性肾脏病患者铁剂应用的争议:来自改善全球肾脏病预后组织(KDIGO)会议的结论
Iain C. Macdougall1, Andreas J. Bircher2, Kai-Uwe Eckardt3, Gregorio T. Obrador4, Carol A. Pollock5,6,Peter Stenvinkel7, Dorine W. Swinkels8, Christoph Wanner9, Gü nter Weiss10, and Glenn M. Chertow11; for Conference Participants[原文发表在Kidney Int,2016,89(1):28-39]
慢性肾脏病和终末期肾病患者常需补铁治疗。但近年来铁剂的使用逐年增加,带来了铁超载、氧化应激和超敏反应等新问题,并可能促进感染的发生,其使用的安全性受到关注。为此,改善全球肾脏病预后组织(KDIGO)召开专家组会议,全面评估铁剂使用的利和弊,并且提供合理使用方案以减轻急性反应及其他毒副作用。
慢性肾脏病 超敏反应 感染 铁超载 氧化应激
铁是参与机体多种功能的重要元素,其最主要作用是作为血红蛋白(Hb)的基本成分。正常情况下机体铁平衡处于稳定状态,每日肠道丢失的少量铁可通过食物摄取来弥补。但晚期慢性肾脏病(CKD)患者常由于进食减少、胃肠道吸收障碍及铁丢失增加导致铁的负平衡,这种情况在血液透析(HD)患者中尤为突出,并需通过补充铁剂来弥补铁的丢失及满足红细胞生成的需求。
静脉铁剂(IVI)是纠正铁缺乏的高效方法,可促进红细胞生成,降低红细胞生成刺激因子(ESAs)需求量,但近来发现ESAs可能带来中风、静脉血栓栓塞性疾病及血管通路血栓等系列后果,因此减少ESAs剂量有较大意义。但铁剂的益处主要体现在对实验室指标的影响,尚缺乏数据证实其能改善临床预后,特别是对死亡、主要健康事件等临床硬终点的影响;已有一些实验室、动物及观察性研究的数据显示了其不利影响,包括增加氧化应激反应,促进动脉粥样硬化,具有心血管毒性,增加感染风险及引起超敏反应。
为此,改善全球肾脏病预后组织(KDIGO)召开了专家组会议,旨在评估关于铁剂使用的现有证据基础及尚存在的认知不足,以期为今后的临床研究指明方向。本次会议主要围绕四个主题进行讨论:铁超载、氧化应激、感染及超敏反应。
达到平衡:铁缺乏vs铁超载
铁缺乏的原因、定义及诊断 CKD患者易出现铁缺乏,与多种因素有关。铁缺乏可分为两类:绝对缺乏,即铁总储存量不足(表1);功能性缺乏,即铁的总储存量并不少甚或增多,但多数铁滞留在网状内皮系统(RES)无法供给红细胞生成所需。

表1 铁绝对缺乏的原因
功能性铁缺乏是由于铁在RES滞留所致,始动因素为炎症。转铁蛋白是一种负急性时相蛋白,通常CKD患者血清水平降低,并导致总铁结合力降低。同样CKD患者循环中转铁蛋白结合铁(即能供红细胞生成所需铁)的绝对量低于或接近肾功能正常人群,故转铁蛋白饱和度正常或降低。ESAs对红细胞生成的刺激增加了对铁的需求量,从而暴露和(或)加剧了铁供应不足。
铁丢失主要缘于失血。失血量和铁丢失量之间的关系取决于Hb水平:Hb 120 g/L时每ml血液中含铁0.4 mg,Hb 100 g/L时每ml血液中含铁0.36 mg。非透析CKD患者胃肠道平均失血量(约3.2 ml/d,失铁0.4 g/年)高于正常人群(约0.83 ml/d,失铁0.1 g/年)。有数据表明,HD患者胃肠道失血量更大(平均5 ml/d),HD过程及实验室检测所致失血量约2~5 L/年,当然这些数据受个体差异、不同时段、抗凝剂及抗血小板药物等因素的影响而变异较大。一般而言,HD患者失铁量约1~2 g/年,亦或多至4~5 g/年。
铁蛋白及转铁蛋白饱和度对于判断CKD患者铁负荷状态及指导补铁治疗价值有限。绝对铁缺乏主要反映机体铁储存量不足,通常依据低血清铁蛋白浓度(<20~30 μg/L)来诊断。CKD患者由于炎症的存在,诊断绝对铁缺乏时血清铁蛋白浓度界值要较非肾脏病者高,一般为100 μg/L(非透析)或200 μg/L(透析)。尽管缺乏证据,但通常认为转铁蛋白饱和度<20%亦代表绝对铁缺乏,当然高于这一水平并不能否定绝对铁缺乏诊断。
即使铁储存和循环铁含量充足,仍可能存在红细胞生成所需铁供给不足的情况,如大剂量ESAs刺激下红细胞生成需求量增加或炎症状态下巨噬细胞铁释放障碍。低色素红细胞比例和网织红细胞Hb含量曾被用来作为诊断铁供应不足的指标,但由于检测设备不普及以及检测需在采血后立即进行,阻碍了其在临床实践中广泛应用。血清铁调素水平亦可用作判断是否需增加ESAs或IVI剂量的指标,但其临床作用并未得到证实,且缺乏统一或标准化检测方法。
纠正铁缺乏所需补铁剂量 由于不同个体及患者群体的具体失铁量差异较大,因此难以确定精确的补铁剂量。IVI剂量超过失铁量所带来的铁正平衡对临床预后的影响尚不清楚。一般而言,IVI剂量大于3g/年即可能超过失铁量、导致铁正平衡。规律性接受IVI的患者如需增加剂量才能保证Hb达标或保持其昔日水平,提示可能存在失铁量增加,应积极寻找原因,尤其胃肠道丢失情况。
铁超载对器官功能及预后的影响 目前尚无检测机体总铁含量的可行方法,因此铁缺乏及铁超载的现有定义仍有缺陷,临床只能推测铁贮存量增加或降低所带来的功能性变化及依赖一些替代指标来判断。铁超载表示机体铁含量增加及可能存在时间依赖性器官功能损害的风险,病理性铁超载则表示机体铁含量增加及已存在可能由于铁超载所致的器官功能损害表现。
铁过量的后果取决于多种因素,包括铁在实质细胞和RES细胞中的分布情况,与患者预期寿命、铁过量持续时间及患者合并症等。目前并不清楚,铁含量增加到何种程度会导致临床不良影响及其具体表现。来自遗传性血色素沉着病患者的数据显示,实质细胞中的铁及不稳定铁过量是有害的,RES细胞中的贮存铁则害处相对较小,而肝内铁可能通过铁介导的间质细胞激活而引起肝损伤。
血清铁蛋白增高并不都代表肝内铁含量增加,高铁蛋白血症也并不代表铁超载;此外,血清铁蛋白水平并不能区分铁是储存在实质细胞还是RES细胞中。来自遗传性血色素沉着病及输血所致铁超载患者的经验显示,高转铁蛋白饱和度可促进实质细胞铁沉积,因此临床需特别注意转铁蛋白饱和度及血清铁蛋白均很高的情况。
磁共振显像(MRI)是评估非CKD人群组织铁含量的可靠方法。此外,MRI检测显示普通HD患者肝脏铁含量高于参考值。但这种不伴肝酶升高的肝脏铁含量增加其临床意义不明。目前尚无足够证据支持应用肝脏MRI来指导临床铁剂使用。
血液病铁超载所致器官毒性取决于铁蓄积程度及速度,主要累及肝脏、心肌、内分泌腺及关节。CKD时铁蓄积的程度、分布及持续时间可能不足以产生与血色素沉着病类似的器官损伤。由于近几年IVI的使用才得以普及,暴露于大剂量铁剂的时间尚不足以产生临床可观察到的毒性,肾脏疾病患者IVI与器官损害之间的关系尚不明确,目前不能排除反复大剂量IVI对CKD患者的潜在毒性。
尿毒症的氧化应激
由于活性氧/氮产生过多或细胞抗氧化酶活性受损引起一些大分子如蛋白质、碳水化合物、脂质和DNA的氧化而导致的损伤称为氧化应激。尿毒症患者血清氧化应激标志物水平升高,表明体内氧化应激反应增加(图1)。
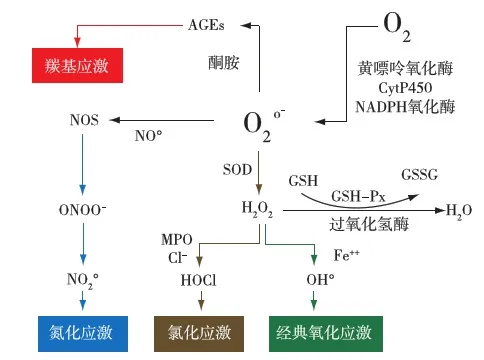
图1 慢性肾脏病中氧化和抗氧化途径示意图AGEs:糖基化终末产物;CytP450:细胞色素C P450;GSH:还原性谷胱甘肽;GSH-Px:谷胱甘肽过氧化物酶;GSSG:氧化型谷胱甘肽;MPO:髓过氧化物;NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸;NOS:一氧化氮合成酶;ONOO-:过亚硝酸盐;SOD:超氧化物歧化酶
肾脏功能受损的早期即可出现氧化应激,常提示预后不佳,与持续存在的炎症相关。有许多标志物可用来评价氧化应激状态,但因种种原因并未在临床推广,如无确切参考值范围,检测技术不一,以及标志物与肾功能受损程度、相关并发症之间的关系不清等。因此,目前尚无监测氧化应激的金标准,用于指导临床进行风险或预后评估。
临床研究显示,IVI可促进CKD患者外周血淋巴细胞DNA和蛋白质氧化损伤,以及脂质过氧化;除直接促氧化效应外,IVI还可促细胞凋亡、加重内皮功能障碍、增强单核细胞黏附作用。
铁介导的氧化应激及心血管风险
现有的基础及临床研究无法回答使用铁剂是否会促进动脉粥样硬化及动脉重塑。在人动脉粥样硬化斑块中可检测到铁的存在,但并不清楚是否有害及是否促进心血管风险的进展。近期一项研究采用ApoE敲除小鼠和ApoE/ffe小鼠饲以高脂食物,发现巨噬细胞铁水平升高的小鼠动脉粥样硬化斑块并未增大。与之相反,一项基于大鼠残肾模型的研究显示,蔗糖铁通过增加单核细胞-内皮细胞黏附性以及产生超氧化物加剧了早期动脉粥样硬化。一项队列研究纳入了58 058例HD患者,显示IVI剂量>400 mg/月对应更高心血管死亡率。还有观察性研究证实铁蓄积与内膜厚度及心血管事件之间存在显著关联,但可能存在诸多混杂因素,结果难有定论。近期一项回顾性研究纳入117 050例HD患者,发现大剂量铁剂和短期心血管事件发生率及死亡率之间并无关联。
铁调素:增加心血管风险的重要介质 铁调素是肝脏合成的一种关键性铁调节蛋白,不仅对铁缺乏敏感,也会因循环及储存铁水平升高、炎症及感染而反应性表达上调,及受铁调素抑制剂如睾酮、雌激素及erythroferrone影响而下调。一些研究显示,铁调素增加可抑制巨噬细胞的铁动员及增加心血管风险。在红细胞被吞噬过程中,铁调素通过下调铁泵蛋白Fpn1而抑制巨噬细胞铁释放及增加铁储存。巨噬细胞内的铁滞留,导致细胞内脂质聚积并增加氧化应激、炎症反应及细胞凋亡。因此,铁调素在Ox-LDL介导的荷载铁的巨噬细胞表型转变并导致动脉粥样硬化斑块不稳定的过程中起重要作用(图2)。在代谢性疾病中铁调素及巨噬细胞铁与单核细胞趋化蛋白1的释放及血管损伤相关。一项研究纳入766例无肾脏疾病女性患者,发现血清铁调素水平与动脉粥样硬化斑块相关。另一项研究显示通过药物抑制铁调素可增加巨噬细胞胆固醇的逆转运及抑制动脉粥样硬化,间接证实了铁调素促进动脉粥样硬化。目前还缺乏CKD患者铁调素增高与心血管疾病相关的充足证据。一项研究显示了铁调素水平升高和动脉硬度的相关性;CONTRAST研究纳入405例HD患者,发现即使在校正了炎症因素后,血清铁调素25和心血管事件之间仍存在关联。
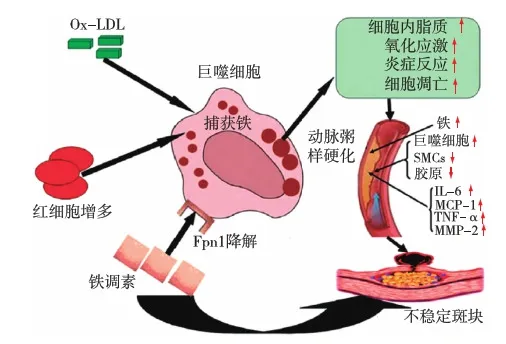
图2 铁调素导致动脉粥样硬化斑块不稳定可能的机制FPn1:膜铁转运蛋白1;IL-6:白细胞介素6;MCP-1:单核细胞趋化蛋白1;MMP-2:基质金属蛋白酶2;Ox-LDL:氧化低密度脂蛋白;SMCs:平滑肌细胞;TNF- α:肿瘤坏死因子α
高铁蛋白血症:是替代标志物抑或本身即为危险因素 CKD患者血清铁蛋白常增高。与铁调素一样,铁蛋白在急性时相反应中表达上调,在低血清铁、转铁蛋白、转铁蛋白饱和度时更明显;此时并不反映铁贮存量,而是反映了一种炎性状态。普通人群中高血清铁蛋白水平和心肌梗塞风险增加及颈动脉斑块相关。在CKD患者中,众多混杂因素影响了铁指标与预后的相关性判断。有研究报道,在校正了铁蛋白和炎症指标C反应蛋白(CRP)后,低血清铁水平仍提示临床预后不良。与之相反,另一项纳入了58 058例HD患者的观察性研究显示,高水平血清铁蛋白(>800 ng/ml)和死亡相关,而在纠正了营养不良和炎症相关指标后两者之间关联性显著下降。去除炎症指标的影响后高铁蛋白血症相关危险度明显降低,目前尚需前瞻性对比研究来评估高铁蛋白血症与心血管风险关系,究竟只是一种危险度标志物还是其本身就是危险因素。
抗氧化剂能否减轻补充铁剂带来的促氧化效应 尽管有研究显示单剂量维生素E或者短期使用N-乙酰半胱氨酸可改善脂质过氧化,但还不足以推荐在补充铁剂前使用抗氧化剂。一项包括13例HD患者的研究发现,活性氧产生增加与IVI联合维生素C相关。推测可能由于存在未被结合的铁,使一些在正常情况下起抗氧化作用的分子通过催化三价铁成活性二价铁而起促氧化作用。近期一项包括353例HD患者的随机对照试验(RCT)发现,6个月抗氧化治疗(生育酚和a硫辛酸)并未能影响炎症及氧化应激的生物标记物水平。因此,目前尚不清楚抗氧化治疗对尿毒症高氧化应激水平是否有效。
铁剂与感染的风险 铁在宿主与病原菌相互作用中起到重要作用,在线粒体呼吸及DNA合成等生化过程中都发挥着关键性作用。诸多微生物如细菌、病毒、寄生虫、蠕虫及真菌的增殖和致病性,均依赖铁的存在。铁对宿主免疫功能亦有影响,作用包括调节免疫细胞的增殖及分化,直接调节细胞因子的合成及调节抗菌免疫效应细胞。因此,铁的内稳态失衡会影响感染的风险及最终结局。
来自HD患者的数据 Ishida及Johansen对HD患者铁和感染的关系进行了综述,分析了血清铁蛋白、铁剂使用与感染风险的关系。13项有关血清铁蛋白水平与感染风险相关性的研究中,9项结果阳性而4项阴性;阳性结果显示,铁蛋白水平高者细菌感染率及感染相关死亡率增高达1.5~3.1倍,换言之,血清铁蛋白高的患者每100人·年细菌感染的发生将增加16~50次。有关铁剂使用与感染相关性的24项研究,总体结果模棱两可,12项观察性研究为阳性结果而10项为阴性,另2项RCT的研究目的并非评价感染风险,未发现铁剂使用与感染的相关性。阳性结果的12项研究中,来自基于USRDS数据的报告显示IVI使用频率高及剂量大的患者感染相关死亡风险增加14%~45%;Dialysis Clinics Inc.的数据则显示,每次透析IVI平均剂量高的患者随访6个月时死亡风险高于剂量低或未使用者,且与高剂量独立相关。
有2项研究观察不同品种IVI与感染风险的关系:其中1项纳入63例HD患者,发现校正后蔗糖铁及葡萄糖酸铁发生菌血症的相对风险分别为2.92(95%CI 1.01~8.5)及2.84(95%CI 1.32~6.09);另一项研究纳入559例患者,发现出现导管相关感染的患者,无论是蔗糖铁还是右旋糖酐铁的平均剂量高于无导管感染者。
一项研究比较117 050例患者IVI不同给药方案间死亡率的差异,发现与小剂量维持给药方式比,短期内大剂量给药感染相关住院风险增加,有导管和近期感染史的患者风险最高,短期内大剂量给药亦与感染相关死亡率存在相关性。而维持给药或者低剂量给药感染相关住院或死亡的风险并不高于未使用铁剂者。
一项来自日本的多中心前瞻性研究纳入1 086例HD患者,评估血清铁蛋白、IVI及其副反应与死亡率的关系。该研究发现血清铁蛋白水平高者感染风险显著增高,而不论IVI剂量高低都增高感染风险。与之相反,一项研究分析了12个国家32 435例接受IVI患者预后,剂量300~399 mg/月或≥400 mg/月的患者全因死亡率高于100~199 mg/月患者,但感染相关死亡率无差异。另一项起始队列研究纳入9 544例美国透析患者,显示IVI累计剂量高者感染相关住院率并未增加。而一项前瞻性观察性研究纳入了235例初始透析患者,发现IVI治疗者全因死亡率显著降低,而脓毒症相关死亡率略降低。一项荟萃分析评估功能性铁缺乏患者使用IVI的安全性及有效性,未发现IVI与感染风险的相关性,但其结论的效力有限,因其仅有2项研究359例患者。相反,最近一项系统性综述对关于HD及非HD的CKD患者使用IVI安全性及有效性的RCT进行了荟萃分析,结果显示IVI比口服或未使用铁剂者感染风险显著升高。对其结论仍需谨慎对待,因其纳入分析的很多研究预设终点并不是感染,无法排除由此产生偏倚的可能性。
来自腹膜透析和非透析CKD患者的数据 有关腹膜透析及非透析CKD患者IVI与感染风险相关性的研究较少。一项研究纳入379例腹膜透析患者,发现IVI后的6个月腹膜炎发生次数(15次)较使用前的6个月(8次)增加,尤其是使用右旋糖酐铁时,但无统计学意义。近期Agarwal等报道一项旨在比较非透析CKD患者口服铁剂及IVI差异的RCT研究,发现IVI组严重不良事件发生率高,包括心血管事件和感染相关住院率均增加。但这只是一项单中心研究,只有一个研究者来判定所有严重不良事件,且只有99例患者完成了试验。而另一项大型研究FIND-CKD结果与该研究结果差异较大,FIND-CKD是一项世界范围的多中心研究,纳入了626例非透析CKD患者,随访时间相对较长。此研究中即使IVI(羧基麦芽糖铁)剂量很大的患者,安全性指标与其他患者亦无差异;而3组(IVI高铁蛋白目标组,IVI低铁蛋白目标组,口服铁剂组)间感染发生率(一般事件 33.1%vs34.0%vs30.4%;严重事件 3.9%vs3.3%vs3.8%)及心脏事件发生率(6.5%vs4.7%vs4.5%)无差异。
总之,目前关于铁剂使用和感染风险的证据大部分来自于HD患者的观察性研究,可能存在很多混杂因素。仅有的少部分RCT,样本量小,随访时间短,且其设计目的不是为了评估IVI感染风险。迄今为止的系统性综述和荟萃分析都无法得到结论性意见。尽管现有的关于IVI与感染风险相关性的证据相互矛盾,KDIGO慎重推荐认为,临床需平衡IVI的潜在益处及风险,同时建议有活动性系统感染患者不使用IVI。
超敏反应
右旋糖酐铁及其他一些老剂型IVI存在致死性不良反应的风险已广为人知。尽管目前认为右旋糖酐成分可能是这些IVI出现不良反应的主要原因,但是经胃肠外途径补充铁剂的风险仍需警惕,特别是已面市的一些新型制剂,可在15~60 mins内快速给药,已提出的一些新补铁途径如通过透析液补铁及含铁磷结合剂补铁。尽管这些不良反应的发生相对罕见,但是与会专家们认为仍应优先评估IVI不良反应特点以便提出处理这些不良反应的方法。
IVI的不良反应 60%患者口服铁剂可出现不良反应,以便秘及恶心最常见,导致患者服药依从性差。口服铁剂的过敏反应鲜有报道。IVI最初剂型为氧化铁,毒副反应高,其毒性很大程度上是由于不稳定铁所致,故对铁进行相应预处理,即用碳水化合物组成的壳将铁盐包裹,常用物质包括右旋糖酐聚合物、蔗糖、葡萄糖酸等。复合物的分子大小决定了其降解动力学特性,右旋糖酐铁释放铁的速度慢于其他小分子剂型。基于此,建议蔗糖铁及葡萄糖酸铁单次输注剂量要小,避免不稳定铁水平过高及潜在不良反应。除外大分子的右旋糖酐铁,其他不同剂型铁剂在不良反应的差异因其发生率太低难以定量分析及达到统计学显著性。KDIGO强烈建议不使用大分子右旋糖酐铁,可选择现有其他不良反应绝对风险低的剂型。
对于透析及非透析CKD患者而言,不管ESAs使用与否,可快速输注的铁剂[如低分子右旋糖酐铁、羧基麦芽糖铁(FCM)、iron isomaltoside 1000、纳米氧化铁]增加了临床使用便捷性,可很好替代口服铁剂,虽然药物费用相对较高,但在某些情况下效价比也可能更好。
IVI产生不良反应的原因尚不明确,KDIGO建议对不良反应严重程度进行分级,并以此为基础来提出即时及长期的处理措施(表2)。

表2 药物超敏反应分类
外渗的铁剂可导致局部皮肤反应。在评估任何不良反应时也需考虑输注过程相关的危险因素,包括剂量大,输注速度过快。仿制药是否更易导致不稳定铁带来的反应目前还不清楚。
速发型(危及生命的)超敏反应 目前已明确大分子右旋糖酐铁致命性超敏反应的发生率(11.3/百万人)较小分子右旋糖酐铁(3.3/百万人)高3~4倍,而葡萄糖酸铁及蔗糖铁则分别为0.9/百万人,0.6/百万人。除了目前市面已无销售的大分子右旋糖酐铁,其他铁剂速发型超敏反应发生率极低(<1∶ 200 000)。美国FDA近期发布一项关于纳米氧化铁严重超敏反应的法规性更新,同时建议减慢输注速度。
迄今为止,现在资料并无透析中使用可溶性焦磷酸铁、口服枸橼酸铁或血红素铁多肽(目前仍在研发中的铁制剂)产生速发型超敏反应的报道。鉴于每种剂型铁剂的超敏反应发生率本就很低,因此还不能认为口服或者透析中使用铁剂就没有风险。
目前还没有可预测或诊断超敏反应的有效检查方法(如皮肤试验或者体外试验)。将来如有此类方法,也应能帮助确定一些目前还未确证的可能危险因素,如哮喘,肥大细胞增生症,合并用药(如β受体阻断剂,血管紧张素转化酶抑制剂)及变应性状态。
轻微输液反应 轻微输液反应并不少见,一般表现为皮肤潮红,轻度胸部不适,头晕,恶心,瘙痒等。偶也会有无症状性低血压,但通常认为是非特异性反应而非过敏反应,除非既往已明确铁剂是过敏原。部分患者会出现肌痛或者关节痛(也称Fishbane反应),但通常为自限性,不需要抗组胺或者肾上腺素治疗。如果上述症状在暂停输注或减慢输注速度后得到缓解,即可判定为轻微输液反应,一般不需中止IVI的继续使用。
IVI超敏反应的处理 对IVI曾出现过超敏反应者,如反应严重至危及生命,不应再继续IVI治疗;如反应轻微,可停用一段时间后在适当监测下试着给予其他剂型的铁剂治疗。IVI不良反应的处理流程的共识见图3,临床处理实用小技巧见表3。
出现严重速发型超敏反应的处理措施包括:首先肌注0.5mg 1∶ 1 000肾上腺素,必要时5~10 min后重复;吸氧支持需通过面罩方式且要高流量(>15 L/min);容量支持采用1 000 ml晶体,同时采用抗阻胺药(H1受体阻滞剂)+类固醇激素以防止超敏反应的延迟或双相效应。对于非特异性反应:至少停药15min并监测临床反应(如脉搏、血压、呼吸、氧饱和度);若症状改善,可在监测下以原速的25%~50%继续输注。对于轻微输液反应:如重新开始输注,需考虑静注H1受体阻滞剂+类固醇激素,并在治疗开始1h内持续监测;若停止输注后症状消失,再次使用同样或其他品种铁剂需在有条件进行监测的环境下进行;再次使用铁剂应小剂量、慢速输注,因为此种输液反应可能与剂量相关并与不稳定铁的释放有关。
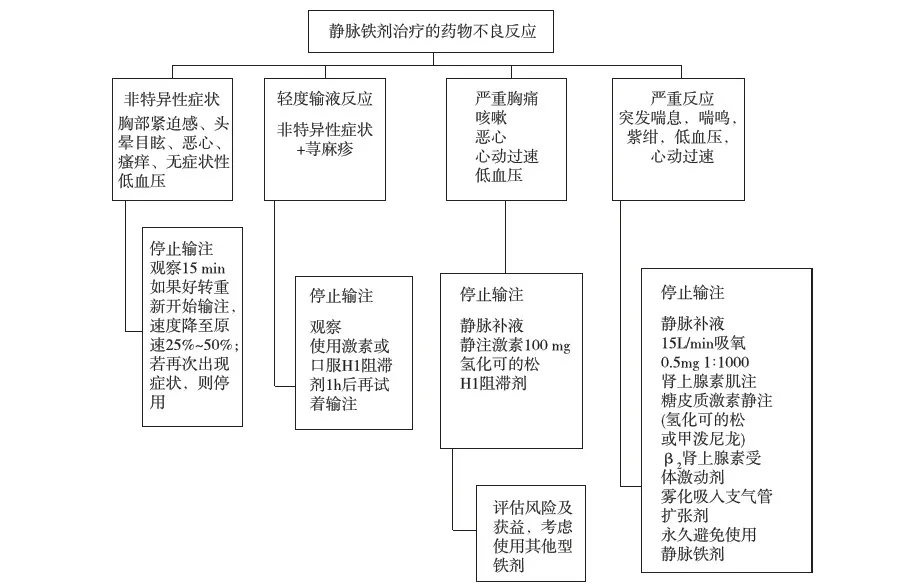
图3 静脉注射铁剂不良反应处理方法

· 第一次使用铁剂(不论是慢性肾脏病还是透析患者)应在临床机构进行· 虽并无证据表明足量铁剂输注会增加风险,但仍建议单次透析静脉输注葡萄糖酸铁或蔗糖铁剂量分别不超过125mg或200mg,因可能存在未与转铁蛋白迅速结合的铁及不稳定铁所致不良反应的风险· 目前并无生理学依据建议患者铁剂输注完后再观察30min,因为并未发现铁剂有类似于疫苗接种或变应原免疫治疗时皮下抗原注射中所出现的严重延迟反应· 没有证据表明预先使用类固醇激素或抗阻胺药可降低发生严重不良反应的风险。相反,静注抗组胺药可能出现不良反应,特别是快速输注时出现的嗜睡或皮肤潮红。因此对于确认存在超敏反应风险的患者,不建议预先使用类固醇激素或抗组胺药。目前尚无确切减轻超敏反应的脱敏治疗方案,因此也不推荐使用· 关于静脉铁剂使用的法规不同地区要求不尽相同,需严格遵守。如2013年欧洲药品管理局(EMA)依据3例孕妇使用低分子右旋糖酐铁后出现超敏反应虽最终痊愈的报告作出了一些建议。这些建议被扩大至使用任何剂型静脉铁剂的患者。尽管目前关于静脉铁剂所致严重超敏反应的报道总的来说还是少的,本次会议同意EMA关于所有静脉铁剂都可能偶尔导致超敏反应的观点。目前的数据表明铁剂和超敏反应发生之间存在明显的相关性,但这些数据不能区分不同剂型之间安全性方面的差异。本次会议与会代表同意妊娠前3月内不应使用静脉铁剂,并且认为测试剂量对预测静脉铁剂的超敏反应完全无用
结 论
现有数据并不足以支持对使用大剂量铁剂及高铁蛋白水平的潜在风险做出任何结论性声明,但本次会议阐述了目前认知存在的不足之处,为确立今后研究方向提供了帮助(表4),同时认为目前迫切需要RCT来充实欠缺的证据。现正在进行的PIVOTAL试验,需从英国55个中心募集2 080例HD患者,并随机分配至低和高剂量IVI治疗组,计划随访2~4年,研究硬终点包括死亡、心肌梗死、中风、心衰及感染。与此同时,肾科同仁们正致力于全面评估IVI治疗的利与弊,以期获得更多可靠的科学性证据。

表4 研究建议
从略
陈佩玲 翻译 龚德华 审校【译者单位】 南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
(本文编辑 律 舟)
10.3969/cndt.j.issn.1006-298X.2016.04.014
1Department of Renal Medicine, King’s College Hospital, London, UK;2Allergy Unit, Dermatology Clinic, University Hospital Basel, Basel, Switzerland;3Department of Nephrology and Hypertension, Friedrich-Alexander-Universität Erlangen-Nürnberg, Erlangen, Germany;4Universidad Panamericana School of Medicine, Mexico City, Mexico;5University of Sydney, Sydney, Australia;6Royal North Shore Hospital, Sydney, Australia;7Division of Renal Medicine, Department of Clinical Science, Intervention and Technology, Karolinska University Hospital, Stockholm, Sweden;8Department of Laboratory Medicine, Translational Metabolic Laboratory, Radboud University Medical Center, Nijmegen, the Netherlands;9Renal Division, University Hospital of Würzburg, Würzburg, Germany;10Department of Internal Medicine VI, Infectious Disease, Immunology, Rheumatology, Pneumology, Medical University of Innsbruck, Innsbruck, Austria;11Division of Nephrology, Stanford University School of Medicine, Palo Alto, California, USA
2016-07-15
编者按 肾性贫血是晚期慢性肾脏病(CKD)及透析患者的重要并发症之一,随着红细胞生成刺激因子的广泛应用,为增加血红蛋白反应性,已认识应用铁剂的必要性。目前补充铁剂包括口服和静脉两种方法,一般认为静脉途径比口服途径效果好。近年来随着铁剂的使用越来越多,由此可能带来的铁超载、氧化应激、超敏反应及增加感染风险等不利影响,铁剂治疗的安全性也逐渐受到重视。因此,改善全球肾脏病预后组织(KDIGO)召开专家组会议,评估铁剂使用的利与弊,提出合理使用铁剂以减轻急性不良反应等副作用,阐述目前认知的不足之处,对今后研究方向提出建议。为增进对此会议内容的认识,现将其译为中文供大家学习参考。
——忌食

