紫花地丁止痒复方提取工艺的优化
曾海荣, 赵 振, 梁美云, 姚雅绮, 王 冰, 张伟荣
(上海中医药大学,上海201203)
紫花地丁止痒复方提取工艺的优化
曾海荣, 赵振, 梁美云, 姚雅绮, 王冰*, 张伟荣*
(上海中医药大学,上海201203)
摘要:目的 优化紫花地丁止痒复方的提取工艺。方法 采用L9(34)正交试验,考察浸泡时间、加水量、提取时间3个因素对提取工艺的影响,HPLC法测定秦皮乙素含有量,以秦皮乙素转移率和干膏得率为指标进行综合评价。结果 最优工艺为浸泡30 min,加入10倍量水,提取2次,每次1 h,秦皮乙素含有量为5.90 mg/g,转移率为58.60%。结论 该提取工艺合理,操作简单,样品质量稳定,对紫花地丁止痒复方质量控制具有参考意义。
关键词:紫花地丁止痒复方;提取工艺;秦皮乙素;正交试验;HPLC法
紫花地丁止痒复方由紫花地丁、苦参、白鲜皮3味中药组成,是本校经多年使用证明疗效确切的临床验方,该组方简单,疗效显著,主要用于湿疹、荨麻疹和皮肤瘙痒症等临床皮肤病的治疗。方中紫花地丁性味苦寒,归心、肝经,功效清热解毒,消痈散疖,为君药,其主要含有香豆素类成分[1],而秦皮乙素为其有效成分和特征成分[2],具有抗炎[3]、抗氧化[4]、抗菌、抗病毒等药理作用[5];臣以苦参,因其性味苦寒,善祛风、杀虫止痒,为诸多皮肤病所常用;白鲜皮性味苦寒,善清热燥湿、解毒、祛风止痒,为治疗皮肤湿疹、湿疮、疥癣等疾病的常用药。本实验参考文献[6-10],采用正交试验方法,考察浸泡时间、加水量、提取时间对复方中秦皮乙素转移率和干膏得率的影响,优选最佳提取工艺,为紫花地丁止痒复方的提取、质量控制及开发利用提供参考。
1 仪器与试剂
1.1 实验仪器 Agilent 1100高效液相色谱仪,配有四元恒流泵、在线脱气机、VWD检测器(美国Agilent公司);AT201型电子天平(十万分之一,瑞士梅特勒-托利多公司);TC-6K型电子天平(美国双杰兄弟有限公司);Milli-Q型纯水器(美国Millipore公司);KQ-250E型超声波清洗器(昆山超声仪器有限公司);调温电热器(通州市申通电热器厂);Rotavapor旋转蒸发仪(瑞士Buchi公司);SHB-IIIA型循环水式多用真空泵(南京科尔仪器设备有限公司)。
1.2 药品与试剂 紫花地丁(批号141118-201411)、苦参(批号141006-201410)、白鲜皮(批号140821-201408)药材购自上海康桥中药饮片有限公司;秦皮乙素(批号GR-133-140408)对照品购自上海伊洪生物化学有限公司。甲醇、乙腈均为色谱纯(沃凯公司);磷酸为分析纯(国药集团化学试剂有限公司)。
2 方法与结果
2.1 HPLC法分析提取物中的秦皮乙素
2.1.1 溶液的制备
2.1.1.1 对照品溶液 精密称取秦皮乙素对照品4.54 mg,置于10 mL量瓶中,甲醇溶解并定容,配成454 μg/mL贮备液。然后,将其依次稀释成227.0、113.5、56.75、28.36、14.19、7.090、3.550 μg/mL系列对照品溶液。
2.1.1.2 供试品溶液 精密称取干燥提取物粉末0.02 g,加甲醇溶解,称定质量,超声溶解15 min,甲醇补足减失质量,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.2 测定波长的选择 将秦皮乙素贮备液稀释5倍,紫外分光光度计进行全波长扫描(200~600 nm),最终选择最大吸收波长为348 nm。
2.1.3 方法学考察
2.1.3.1 色谱条件[11-16]Ultimate XB-C18色谱柱(5 μm,4.6 mm×250 mm);流动相乙腈-0.1%磷酸水(18∶82),等度洗脱;检测波长348 nm;体积流量1 mL/min;柱温25℃;进样量10 μL,色谱图见图1。
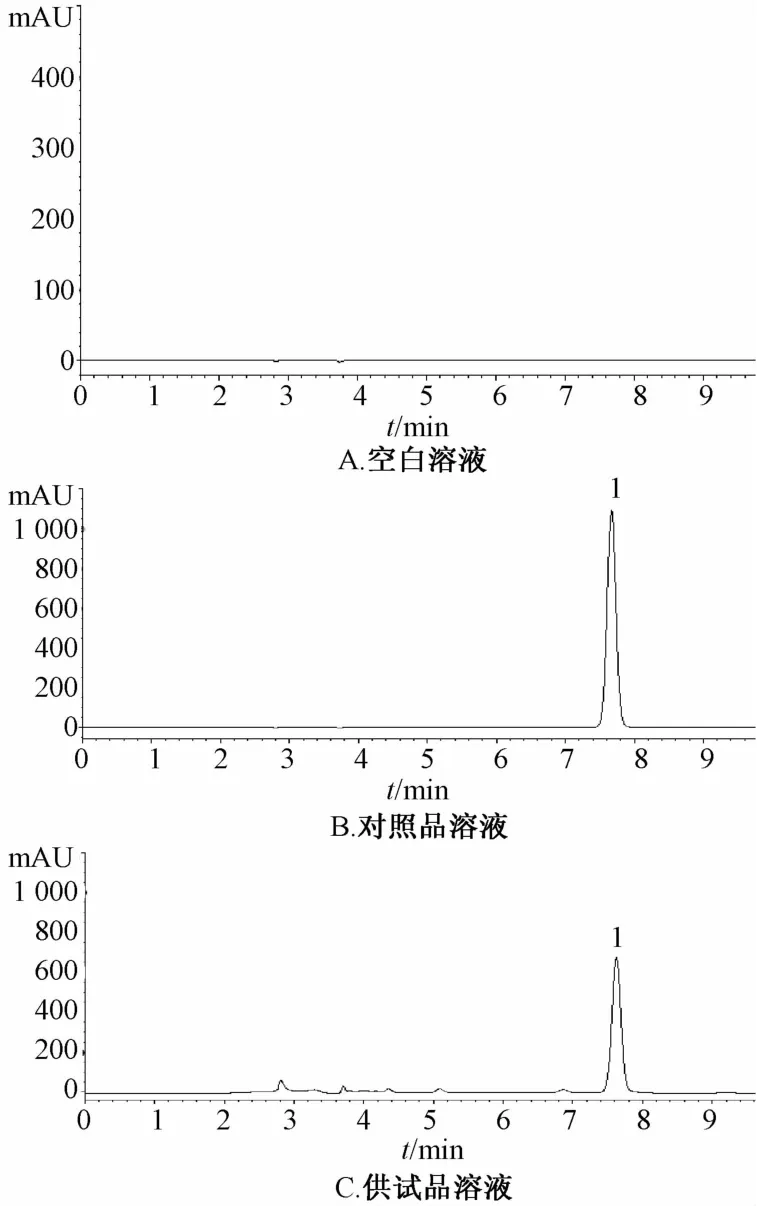
1.秦皮乙素图1 HPLC色谱图
2.1.3.2 标准曲线的制备 取“2.1.1.1”项下对照品溶液,在“2.1.3.1”项色谱条件下测定。以峰面积平均值为纵坐标(Y),对照品质量浓度(μg/mL)为横坐标(X)进行回归,得到线性方程Y=44.287X+61.492,r=0.999 9,表明秦皮乙素在3.55~227 μg范围内线性关系良好。
2.1.3.3 精密度与稳定性试验 在“2.1.3.1”项色谱条件下,精密吸取“2.1.1.1”项下对照品溶液10 μL,连续进样5次,测得峰面积RSD为0.76%,表明仪器精密度良好。然后,分别于0、2、4、6、8、12、24 h精密吸取“2.1.1.2”项下供试品溶液10 μL,测得峰面积RSD为0.97%,表明供试品溶液在24 h内稳定性良好。
2.1.3.4 重复性试验 取同一提取物适量,按“2.1.1.2”项下方法平行制备5份供试品溶液,在“2.1.3.1”项色谱条件下测定。结果,秦皮乙素含有量为5.55 mg/g,RSD为0.18%,表明该方法重复性良好。
2.1.3.5 加样回收率试验 精密称取秦皮乙素含有量已知(5.55 mg/g)的提取物粉末9份,精密加入对照品溶液(0.454 mg/mL)适量,按“2.1.1.2”项下方法制备供试品溶液,在“2.1.3.1”项色谱条件下测定,结果见表1。
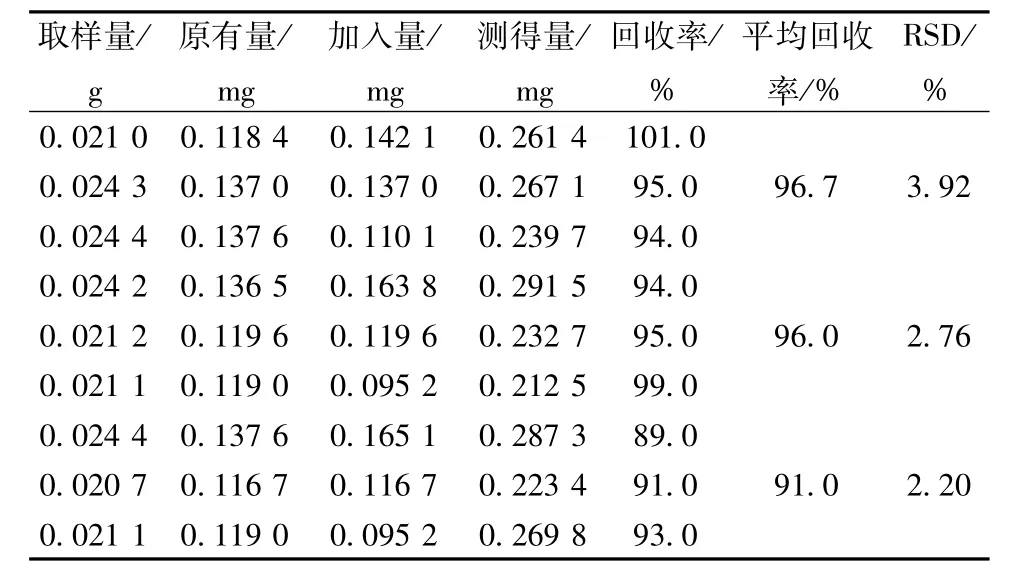
表1 加样回收率试验结果
2.2 正交试验 按照处方,分别称取紫花地丁30 g、白鲜皮15 g、苦参15 g,加适量水浸泡一段时间,煎煮提取,浓缩,冷冻干燥,即得提取物。
2.2.1 试验设计因素水平安排 根据预实验单因素考察结果,发现提取2次的效果较佳,故采用L9(34)正交试验设计表对复方提取工艺进行优选,以浸泡时间(A)、加水量(B)、提取时间(C)为考察因素,每个因素选取3个水平,结果见表2。

表2 因素水平
2.2.2 提取方法与结果分析 按处方称取紫花地丁、苦参、白鲜皮药材适量,根据正交设计条件提取2次,合并提取液,旋转蒸发仪浓缩,冷冻干燥,按“2.1.1.2”项下方法制备供试品溶液,在“2.1.3.1”项色谱条件下测定,计算秦皮乙素转移率和干膏得率[17],结果见表3,方差分析见表4。
直观分析显示,3个因素的影响程度依次为B>A>C,最佳工艺条件为A2B2C1。由于因素C的离差平方和小于误差项因素D,故将其并入误差项计算。方差分析表明,加水量(B)影响最显著(p<0.05),选择B2,而浸泡时间(A)和提取时间(C)均无显著性影响(p>0.05),故可根据生产实际情况作适当调整。最终,优选的工艺条件为浸泡30 min,加10倍量水,提取2次,每次1 h。
2.2.3 验证试验 称取紫花地丁30 g、白鲜皮15 g、苦参15 g,共3份,按最佳工艺条件进行验证试验,在“2.1.3.1”项色谱条件下测定。结果,秦皮乙素含有量为5.90 mg/g,RSD为1.35%,转移率为58.60%,表明该工艺稳定可靠。
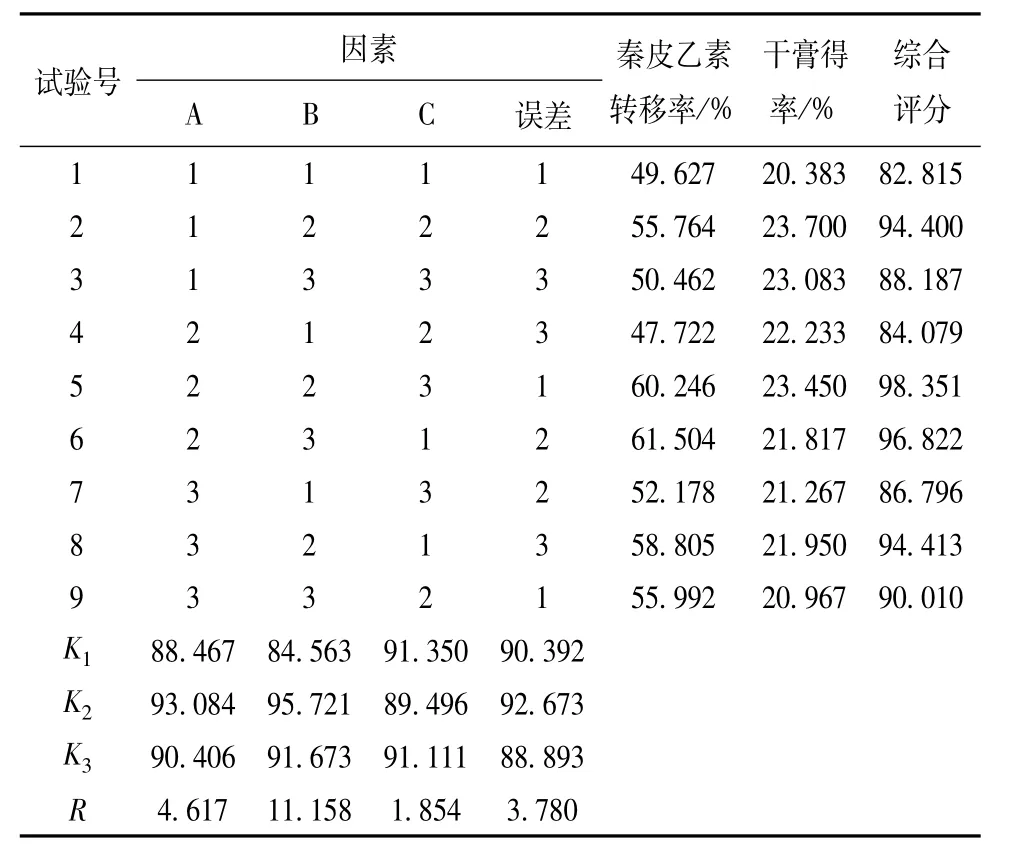
表3 L9(34)正交设计结果
3 讨论
单因素试验表明,2次提取比1次提取可转移出更多的秦皮乙素,故从实验需要及节约能源角度考虑,选择2次提取;正交试验显示,加水量为影响最显著的因素。紫花地丁为叶类药材,易吸收水分,在预实验中发现,第一次加8倍量水时,紫花地丁容易黏壁,不利于提取;加10倍量水时,提取效果较好,与正交试验的优选结果一致。
现代药理研究表明,紫花地丁的主要有效成分为黄酮类和香豆素类化合物,具有抗炎、抗菌、抗氧化、抗肿瘤等作用[18-20],而香豆素类成分秦皮乙素是其有效成分和特征成分之一。由于该成分转移率和干膏得率是评价水提工艺的关键指标,故本实验以两者综合评分来优选复方水提工艺,表明其合理可行,可为紫花地丁止痒复方的临床应用及开发提供参考。
参考文献:
[1] 陈胡兰,董小萍,张 梅,等.紫花地丁化学成分研究[J].中草药,2010,41(6):874-877.
[2] 梁承远,张诗韵,毛跟年,等.秦皮乙素及其衍生物的合成与药理学研究进展[J].陕西科技大学学报,2015,33 (2):126-133.
[3] 李艳丽,胡彦武.紫花地丁抗炎作用及机制研究[J].中国实验方剂学杂志,2012,18(24):244-247.
[4] 曹 捷,秦 艳,尹成乐,等.紫花地丁化学成分及抗氧化活性[J].中国实验方剂学杂志,2013,19(21):77-81.
[5] 李永生,何希瑞,杨 燕,等.紫花地丁化学成分与药理活性研究新进展[J].环球中医药,2013,6(4):313-318.
[6] 王艳平,夏新华,王杰英.正交试验法优选紫蒲颗粒提取工艺的研究[J].中成药,2009,31(1):133-134.
[7] 蔡 皓,庄延双,刘 晓,等.正交优选小柴胡汤的提取工艺[J].中药材,2012,35(12):2036-2039.
[8] 徐静静,艾训儒,李 琴,等.正交试验优选延龄草多糖提取工艺研究[J].中药材,2013,36(2):305-307.
[9] 刘惠英.正交试验优化香砂养胃片处方的研究[J].中药材,2012,35(3):491-493.
[10] 巨建云,赵海霞.水提取法制备苦参配方颗粒的工艺研究[J].中药材,2009,32(10):1625-1627.
[11] 宁火华,艾其茂,罗跃华.HPLC测定紫花地丁中秦皮乙素的含量[J].中国药品标准,2007,8(3):68-69.
[12] 王甫成,夏成凯,栗进才,等.HPLC同时测定紫菀中5种黄酮类成分[J].中成药,2012,34(2):306-309.
[13] 陈胡兰,汤沛然,张 梅,等.不同产地紫花地丁中秦皮乙素的含量比较[J].成都中医药大学学报,2010,33 (3):72-96.
[14] 涂瑶生,胥爱丽,江洁怡,等.紫花地丁配方颗粒的HPLC指纹图谱研究[J].广东药学院学报,2013,29(4):388-391.
[15] 林夏楠,林巧之.紫花地丁中秦皮乙素含量测定研究[J].海峡药学,2008,20(9):60-62.
[16] 陈胡兰,汤沛然,张 梅,等.紫花地丁药材及其混淆品的HPLC指纹图谱研究[J].中国药学杂志,2010,45 (18):1372-1375.
[17] 王 宁,陈晓斌,刘志辉,等.热痹消颗粒提取纯化工艺研究[J].中成药,2011,33(11):2003-2005.
[18] 李艳丽,胡彦武.紫花地丁抗炎作用及机制研究[J].中国实验方剂学杂志,2012,18(24):244-247.
[19] 孙艺方,杜利利,周 乐,等.紫花地丁抗菌活性成分研究[J].中国中药杂志,2011,36(19):2666-2670.
[20] 徐金钟,曾珊珊,瞿海斌.紫花地丁化学成分研究[J].中草药,2010,41(9):1423-1425.
*通信作者:王 冰(1974—),女,博士,副教授,从事中药纳米制剂研究。E-mail:annabel_ cn@163.com张伟荣(1953—),男,硕士,教授,从事中医临床与教学研究。E-mail:zwr885@126.com
作者简介:曾海荣(1990—),男,硕士生,从事心血管药理与炎症医学研究。E-mail:hr2323631@126.com
基金项目:国家自然科学基金(81303233)
收稿日期:2015-08-03
doi:10.3969/j.issn.1001-1528.2016.05.047
中图分类号:R284.2
文献标志码:B
文章编号:1001-1528(2016)05-1174-03

