红曲中洛伐他汀的分离鉴定和稳定性评价
缑三虎, 刘 杰, 何 苗, 倪京满*
(1.兰州大学药学院药物制剂研究所,甘肃兰州730000;2.甘肃省人民医院药剂科,甘肃兰州730000)
红曲中洛伐他汀的分离鉴定和稳定性评价
缑三虎1, 刘杰2, 何苗1, 倪京满1*
(1.兰州大学药学院药物制剂研究所,甘肃兰州730000;2.甘肃省人民医院药剂科,甘肃兰州730000)
摘要:目的 建立一种从红曲中分离洛伐他汀以及稳定性评价的方法。方法 乙醇提取干燥红曲后经硅胶分离,得到单体结晶,薄层色谱和高效液相色谱法对其进行结构鉴定(洛伐他汀)。然后,在相对湿度75%、温度60℃和光照4 500 lx的条件下,峰面积归一化法研究其总含有量变化和2种构型(酸型和内酯型)转化,差重法计算吸湿率。结果 红曲中内酯型洛伐他汀易被分离,吸湿性强,高温或强光照下可使其酸型结构向内酯型结构转化,其中高温时更为明显,而强光下红曲颜色变浅。结论 高温对红曲药用功能性的影响较大。
关键词:红曲;洛伐他汀;分离鉴定;稳定性
红曲是由红曲霉Monascus PurPureus接种于大米发酵后精制而成,由于所含的monaconlin类物质可降低胆固醇,故被用作天然膳食补充剂[1],其具有强身健体、健脾消食和活血化瘀之功效[2],可用于治疗高脂血症、冠心病、糖尿病、骨质疏松、癌症、非酒精性脂肪肝、疲劳症和中枢神经退行性疾病,而且在治疗高脂血症时的耐受性和适用性优于他汀类药物[3]。它可显著降低血清胆总固醇、三酰甘油和低密度脂蛋白胆固醇水平,同时增加血清高密度脂蛋白胆固醇水平,明显降低心血管疾病的发病率[4-6]。另外,红曲还是一种天然着色剂,含有大量天然色素,其中脂溶性色素的含有量是水溶性的3倍,目前已确定结构者有8种,用于食品和药品的着色[7-9]。现代研究发现,红曲霉不仅可接种于大米,还可接种于其他药材,扩展了其应用前景[10],但由于红曲副产物毒性大,稳定性不理想,故其应用受到了限制。桔霉素是其主要副产物之一,有肾毒性,但可通过现代工艺将其含有量控制在限度以内,近年来对红曲色素稳定性的研究较多,但鲜有其药用功能稳定性的报道。
红曲中富含他汀类物质,其中含有量最高的是洛伐他汀,在红曲中以酸型和内酯型2种结构存在,是合成许多他汀类药物的中间体,有着非常高的药用价值。目前,其工业生产主要有柱层析法、结晶法和半合成法,但步骤多,操作复杂,成本较高[11]。本实验采用一种简单易行,分离率高的方法,从红曲中成功分离得到了纯度较高的内酯型洛伐他汀,同时还进行红曲的影响因素试验,研究在激烈的单因素条件下,其洛伐他汀构型的转化和总含有量的变化,可为红曲的药用功能稳定性,以及相关制剂生产工艺、贮存、包装和运输条件的选择提供科学的参考。
1 仪器与材料
1.1 仪器 Waters 2998高效液相色谱仪(美国Waters公司);EYELA N-1100旋转蒸发仪(东京理化器械独资工厂);WD-A药物稳定性检查仪(天津药典标准仪器厂);KQ5200DA数控超声波清洗器(昆山市超声仪器有限公司);Sartorius AG电子天平(北京赛多利斯仪器系统有限公司)。
1.2 材料 红曲购自浙江三禾生物工程有限公司(批号2014012301),经兰州大学药学院药物制剂研究所倪京满教授鉴定为曲霉科紫色红曲霉Monascu sPurPureus经籼米深层发酵所得的红曲米粉末,标本保存于兰州大学医学院标本馆。内酯型洛伐他汀标准品(批号130320)购自成都普菲德生物技术有限公司。柱层析硅胶(200~300目)和GF254薄层层析硅胶均购自青岛海洋化工有限公司。乙腈为色谱纯(批号WXBB6406V,美国Sigma-Aldrich公司);其他试剂均为分析纯。
2 方法与结果
2.1 红曲中洛伐他汀的分离 取干燥的红曲粉5 g,250 mL乙醇回流提取5 h,提取液浓缩后得到红色浸膏1.5 g,硅胶拌样,过柱层析硅胶(200~300目,20 mm× 250 mm),流动相为石油醚(30~60℃)-乙酸乙酯(1∶1),冲柱至第2条黄色带流出,共得150个流份。薄层色谱分析后,合并第21~51号单一斑点的流份,得到白色结晶150 mg。具体见表1。

表1 不同批次红曲中洛伐他汀的分离情况(n=5)
2.2 洛伐他汀的鉴定
2.2.1 薄层色谱鉴定将内酯型洛伐他汀标准品、红曲中分离的白色结晶、酸型洛伐他汀、红曲乙醇(25℃)以及热乙醇(60℃)提取物点样于硅胶薄层板上,展开剂为石油醚(30~60℃)-乙酸乙酯(1∶4),紫外灯下测得内酯型洛伐他汀标准品和分离品的Rf值都为0.69,而酸型洛伐他汀为0.48,5%硫酸乙醇显色后都为红褐色,红曲经加热提取后未见酸型洛伐他汀,见图1。
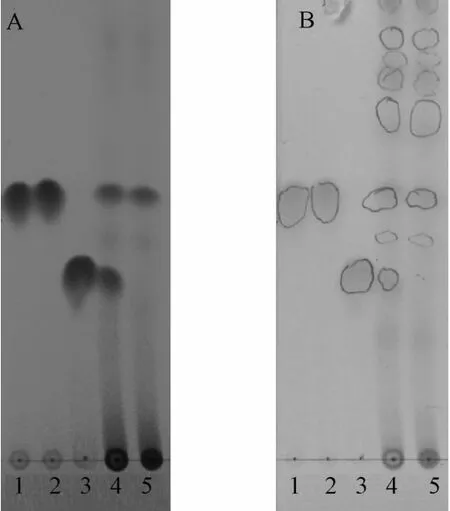
A.254 nm波长 B.喷洒5%硫酸乙醇1.内酯型洛伐他汀标准品 2.分离品 3.酸型洛伐他汀4.室温提取的红曲 5.加热提取的红曲图1 两种洛伐他汀和红曲样品的TLC图
2.2.2 HPLC色谱条件[12]Lichrospher C18色谱柱(7 μm,4.6 mm×250 mm);柱温25℃;检测波长237.8 nm;流动相为乙腈∶磷酸水(1 g/L)(65∶35);体积流量1 mL/min;进样量20 μL。
2.2.3 内酯型洛伐他汀标准品溶液的配制 乙腈配制,质量浓度为0.34 mg/mL。
2.2.4 酸型洛伐他汀对照品溶液的制备及配制 取内酯型洛伐他汀标准品3.4 mg,加入10 mL 0.2 mol/L NaOH溶液(70%乙醇配制),50℃水浴下反应1 h,峰面积归一化法测定,结果见图2。由图可知,内酯型洛伐他汀已全转化为酸型结构,纯度大于98.8%,转化率大于98.8%。
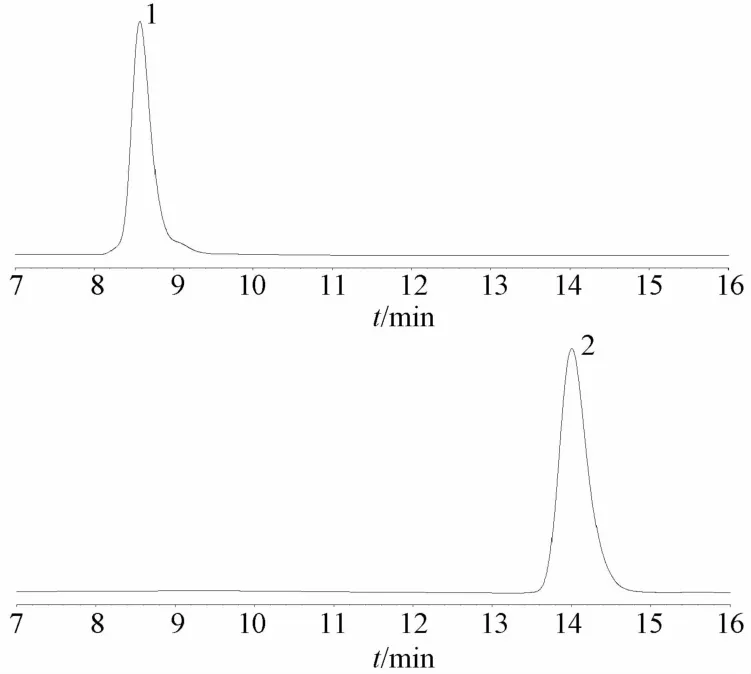
1.酸型洛伐他汀 2.内酯型洛伐他汀图2 酸型和内酯型洛伐他汀的HPLC色谱图
2.2.5 所分离的洛伐他汀溶液的配制 乙腈配制,质量浓度为1.53 mg/mL。
2.2.6 红曲提取液的配制 取红曲10 mg,甲醇溶解,50℃下超声提取1 h(120 W、24 Hz),置于10 mL量瓶中定容。
2.2.7 精密度实验 同1天取0.017、0.085、0.17 mg/mL内酯型洛伐他汀标准溶液,在“2.2.2”项色谱条件下连续测定6次,测得RSD为1.39%,即日内精密度;连续6天,取0.017、0.085、0.17 mg/mL内酯型洛伐他汀标准溶液,在“2.2.2”项色谱条件下进行测定,测得RSD为1.62%,即日间精密度。由此表明,仪器精密度良好。
以内酯型和酸型洛伐他汀为对照,对所分离的洛伐他汀进行鉴别,并且在红曲的HPLC色谱图上定位出2种异构体的出峰位置。见图3。
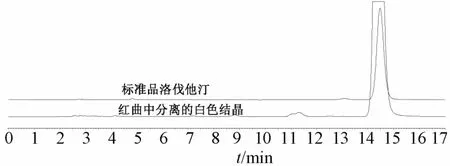
图3 内酯型和红曲中所分离洛伐他汀的HPLC色谱图
2.3 红曲中洛伐他汀的稳定性研究
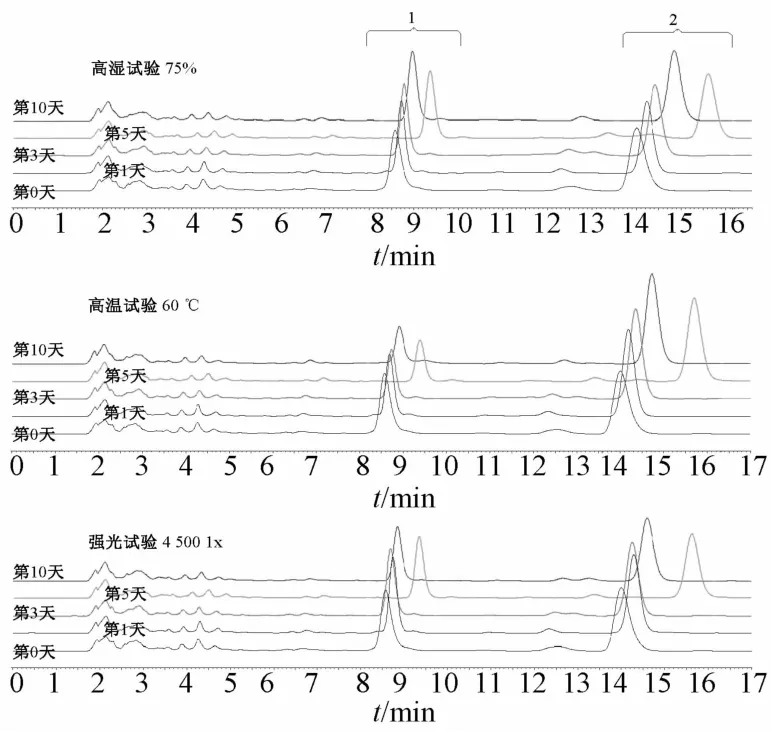
2.3.1 高湿实验 称取红曲500 mg(90~100目),置于培养皿中,摊开成3 mm左右的薄层,放入相对湿度为92%的密闭干燥器中,1 d后取样,测得吸湿率为9.2%,大于5%。因此,再取红曲500 mg,置于培养皿中,摊开成1 mm左右的薄层,放入相对湿度为75%的密闭干燥器中,温度为25℃,置于暗处,于第0、1、3、5、10天取样,每次取样10 mg,测定吸湿率,在“2.2.2”项色谱条件下比较红曲中2种构型洛伐他汀的转化情况,以评价其药用功能性变化,结果见图4。由图可知,红曲在第3天时的吸湿率达到最高,但到第10天时小于5%,并且最大吸湿率接近30%,表明红曲易引湿,在贮藏时要放在干燥处,并采取防潮措施。而且,高湿条件下2种构型洛伐他汀的含有量及其总和几乎没有变化,构型转化也不明显,见图5、表2、图6。

注:净吸湿率为前一次到本次取样时红曲的吸湿率,累计吸湿率为第0天到本次取样时红曲的总吸湿率图4 高湿条件(75%)下红曲的吸湿率
1.酸型洛伐他汀 2.内酯型洛伐他汀图5 2种构型洛伐他汀的出峰图
表2 2种构型洛伐他汀含有量的变化(±s)
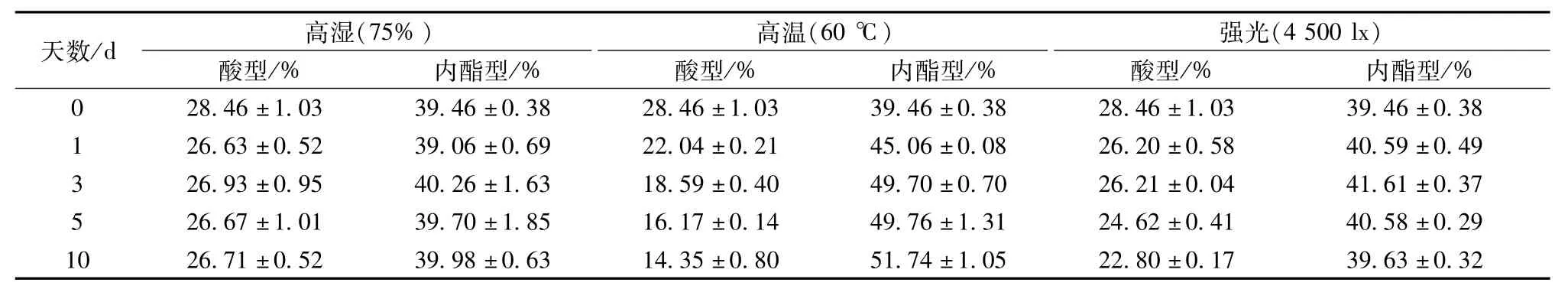
表2 2种构型洛伐他汀含有量的变化(±s)
天数/d 高湿(75%)强光(4 500 lx)酸型/% 内酯型/% 酸型/% 内酯型/% 酸型/% 内酯型/高温(60℃)% 0 28.46±1.03 39.46±0.38 28.46±1.03 39.46±0.38 28.46±1.03 39.46±0.38 1 26.63±0.52 39.06±0.69 22.04±0.21 45.06±0.08 26.20±0.58 40.59±0.49 3 26.93±0.95 40.26±1.63 18.59±0.40 49.70±0.70 26.21±0.04 41.61±0.37 5 26.67±1.01 39.70±1.85 16.17±0.14 49.76±1.31 24.62±0.41 40.58±0.29 10 26.71±0.52 39.98±0.63 14.35±0.80 51.74±1.05 22.80±0.17 39.63±0.32

注:峰面积比值=单个峰面积/总峰面积×100%,峰面积比值之比=酸型峰面积比值/内酯型峰面积比值。与第0天比较,*p< 0.05,**p<0.01图6 2种构型洛伐他汀峰面积比值之比与总和(n=3)
2.3.2 高温实验 称取红曲500 mg(90~100目),置于培养皿中,摊开成3 mm左右的薄层,放入药物稳定性检查仪的暗处,温度设置为60℃,相对湿度实测值为20%,于第0、1、3、5、10天取样,每次取样10 mg,在“2.2.2”项色谱条件下比较红曲中2种构型洛伐他汀的转化情况,以评价其药用功能性变化,结果见图5、表2、图6。第0~10天,红曲中酸型洛伐他汀的色谱峰逐渐降低,而内酯型逐渐升高,第0天时酸型峰面积是内酯型的72.1%,而第10天时是27.8%,表明高温对洛伐他汀构型转化的影响较大,故红曲放置于高温环境时,可影响其药用功能。
2.3.3 强光实验 称取红曲500 mg(90~100目),置于培养皿中,摊开成3 mm左右的薄层,放入药物稳定性检查仪光照强度为4 500 lx的位置,温度为25℃,相对湿度实测值为20%,于第0、1、3、5、10天取样,每次取样10 mg,在“2.2.2”项色谱条件下比较红曲中2种构型洛伐他汀的转化情况,以评价其药用功能性变化,结果见图5、表2、图6。强光条件下,红曲中洛伐他汀构型也发生了一定转化,可能是由于强光为酸型转化成内酯型提供了能量,从第5天开始,两者转化差异显著高于第0天(p< 0.05),但其总含有量有略微下降的趋势,而且强光对红曲的色素也有影响。因此,在使用和贮存时,强光也是一个不可忽略的影响因素。
3 讨论
3.1 红曲中洛伐他汀的分离与结构鉴定 图1显示,内酯型洛伐他汀标准品和红曲分离品的薄层色谱特征相似,通过与酸型洛伐他汀比较后,确定分离品为内酯型洛伐他汀。在“2.2.2”项色谱条件下,酸型洛伐他汀的保留时间为8.575 min,而内酯型为14.004 min。内酯型洛伐他汀标准品和红曲中所分离洛伐他汀的保留时间一致,纯度都大于98%,10 g红曲可分离出30 mg左右洛伐他汀,HPLC法测得其实际含有量为30.658 mg/g,提取率大于等于97.9%。而且,分离得到的单体均为内酯型洛伐他汀,在红曲中的含有量较高,可能是在提取过程中乙醇回流温度在75℃以下,红曲中大量酸型洛伐他汀转化为内酯型,而后者极性更小,易于洗脱分离,故得到全是羽状结晶的该类成分。该方法简单易行,经反复验证(表1),其重复性良好。
3.2 红曲中洛伐他汀的稳定性影响因素 图4显示,红曲在相对湿度为75%的环境中极易吸湿,在第1天时吸湿率高达6.61%,而在第10天时累计吸湿率达24.43%,说明其吸湿性非常强,故其应密封保存于玻璃或金属容器中,而且制备剂型时应加入防潮剂(甘露醇、糊精、淀粉、乳糖等)或制成颗粒药物。结合图5和图6可知,红曲在高湿、高温、强光条件下,2种构型洛伐他汀峰面积比值总和在62.42%~67.92%之间,随取样天数增加而有所降低,但程度不明显,说明在影响因素激烈的条件下,红曲药用功能性物质洛伐他汀的总含有量基本不变,仅有少量的损失。
图5显示,在第5天取样测定时,2种构型洛伐他汀的HPLC色谱图都向右发生了漂移,漂移时间约为1 min,可能是由于流动相中磷酸溶液的质量浓度大于1 g/L,或HPLC色谱仪在分配流动相比例时有机相比例减小,流动相极性增大,导致色谱峰右移。结合图5和表2可知,在高温和强光条件下,随着取样天数延后,酸型洛伐他汀的峰面积(或峰高)逐渐下降,而内酯型逐渐上升;图6显示,2种构型洛伐他汀的峰面积比值之比在高温和强光条件下,随着取样天数增加而减小,但总含有量基本不变,推测两者可能发生了构型转化,酸型洛伐他汀转化为内酯型,并且高温条件下更为明显,这与文献[13-14]一致。然而,强光条件下构型转化不明显,而且红曲色素的颜色随着取样天数增加而变浅,说明强光只对红曲色素产生较大影响,但对其药用功能性无显著作用。由于酸型洛伐他汀的生理活性在体内强于内酯型[15],故在高温或强光条件下,贮存过的红曲要考虑其药用安全性问题,同时作为着色剂还要考虑色素的光敏性和稳定性。
综上所述,制剂在生产过程中应避免高温对活性成分的影响、引湿性和强光下色素分解等问题。
参考文献:
[1] Jirasatid S,Nopharatana M,Kitsubun P,et al.Degradation kinetics of monacolin K in red yeast rice powder using multiresponsemodeling approach[J].J Food Eng,2013,116(2):436-443.
[2] Avula B,Cohen PA,Wang Y H,etal.Chemical profiling and quantification ofmonacolins and citrinin in red yeast rice commercial raw materials and dietary supplements using liquid chromatography-accurate QToF mass spectrometry:Chemometrics application[J].J pharm Biomed Anal,2014,100(22):243-253.
[3] Yang CW,Mousa S A.The effect of red yeast rice(Monascus PurPureus)in dyslipidemia and other disorders[J].ComPlement Ther Med,2012,20(6):466-474.
[4] 崔春黎,周珂杨,罗 明,等.复方红曲胶囊治疗高血脂症45例临床观察[J].中成药,2002,24(2):107-110.
[5] 臧 吾,王荣富,王 陵,等.脂必妥治疗高脂血症的疗效分析[J].中成药,1997(10):25-26.
[6] Childress L,Gay A,Zargar A,et al.Review of red yeast rice content and current Food and Drug Administration oversight [J].JClin LiPidol,2013,7(2):117 -122.
[7] 董夏莲,王红英,钱斯日古楞,等.红曲霉诱导产生红曲色素条件的研究[J].中成药,2012,34(4):637-640.
[8] 崔 莉,张德权,张培正.红曲色素的研究现状分析[J].食品科技,2004,24(9):115-116.
[9] 梁彬霞,白卫东,杨晓暾,等.红曲色素的功能特性研究进展[J].中国酿造,2012,31(3):21-24.
[10] 厍守权,刘 刚,李 妍,等.红曲霉-人参双向固体发酵产物成分变化的初步分析[J].中成药,2015,37(3):599-603.
[11] 王丽君,彭 曼,景 蕾.洛伐他汀合成的研究[J].河北化工,2010,33(5):47-48.
[12] 朱 华,许赣荣,陈 蕴.HPLC法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[13] 李永国,柳 红,王峥涛,等.中药红曲化学稳定性多成分综合评价[J].高等学校化学学报,2006,27(1):35-38.
[14] 王铁军,许赣荣.水溶性红曲中MonacolinK的稳定性[J].生物加工过程,2009,7(1):64-68.
[15] 汪 静.HPLC法同时测定红曲中两种构型洛伐他汀的含量[J].浙江中西医结合杂志,2014,24(3):273-274.
*通信作者:倪京满(1965—),女,博士,教授,研究方向为药物新剂型与新技术。Tel:(0931)8915683,E-mail:nijm@lzu.edu.cn
作者简介:缑三虎(1990—),男,硕士生,研究方向为药物新剂型与新技术。E-mail:goush13@lzu.edu.cn
收稿日期:2015-07-13
doi:10.3969/j.issn.1001-1528.2016.05.050
中图分类号:R284.1
文献标志码:B
文章编号:1001-1528(2016)05-1184-04

