膝骨关节炎患者关节液中miR-140的表达及其临床意义
韩朝永
(江苏省南京市浦口区中医院,江苏 南京 211800)
膝骨关节炎患者关节液中miR-140的表达及其临床意义
韩朝永
(江苏省南京市浦口区中医院,江苏 南京 211800)
[摘要]目的探讨miR-140在膝骨关节炎(KOA)患者关节液中的表达及临床意义。方法选取60例KOA患者和20名健康对照者作为研究对象。采用实时荧光定量RT-PCR检测KOA患者和健康对照者关节液中miR-140表达水平,分析关节液中miR-140表达水平与KOA的相关性。结果KOA患者关节液miR-140表达水平明显低于健康对照者(P<0.05)。进一步研究发现患者关节液中miR-140水平与Kellgren-Lawrence 分级有显著相关性(r=-0.742,P<0.05)。结论关节液miR-140的表达水平不仅可以作为KOA的早期诊断标志物,也可作为判断KOA严重程度的参考指标。
[关键词]膝骨关节炎;关节液;miR-140
膝关节骨性关节炎(Knee osteoarthritis,KOA)是一种常见于中老年人的慢性关节疾病,其病理改变主要表现为关节软骨的退行性变和继发性骨质增生。临床上多表现为膝关节肿胀、疼痛、活动受限,严重者可导致关节畸形[1]。据流行病学统计数据显示,60岁以上人群KOA患病率约为60%,75岁以上人群则高达80%,其致残率可高达50%以上。不仅给个人带来严重的痛苦,也给家庭和社会造成沉重的负担[2-3]。因此,如何有效地预防和治疗KOA已成为重大的公共卫生学问题。KOA病因复杂,多种致病因素和因子均会导致KOA的发生和发展。microRNA(miRNA)是近年来发现的一类内源性单链小分子RNA,通过对靶基因转录后水平的调控来发挥其功能[4]。目前的研究证实miRNA参与调控一系列重要生理病理过程,包括在免疫炎症反应以及骨关节炎发病中也发挥着重要的调节作用。新近的研究发现,miR-140与关节炎发生密切相关[5-6]。本研究通过对膝关节液中miR-140表达水平的测定,探讨其在KOA发病中的作用,为KOA的诊断和治疗提供依据。
1临床资料
1.1一般资料选择2014年1月—2015年6月在我院接受治疗的60例KOA患者和20名健康对照者作为研究对象。60例KOA患者中男17例,女43例;年龄53~78(57.74±4.92)岁;病程1~8(3.47±1.52)年。所有患者均符合美国风湿病学会推荐的KOA诊断标准:①膝关节痛在就诊的前1个月内≥14 d;②膝关节活动时有骨磨擦音;③X射线示膝关节骨端边缘有骨刺增生或骨赘形成;④膝关节骨性肿胀;⑤膝关节晨僵≤30 min;⑥年龄≥40岁。符合上述条件中的①③或①②④⑤⑥即可诊断为KOA。采用Kellgren-Lawrence(K-L)[7]分级评估KOA临床病情:其中Ⅱ级20例,Ⅲ级24例,Ⅳ级16例。排除标准:①有感染性关节炎,膝关节创伤及手术史,糖尿病患者;②类风湿关节炎等自身免疫性疾病的患者;③检查前2周使用过糖皮质激素或非甾体类抗炎药的患者;④其他反应性关节炎等关节疾病的患者。本研究经过医院伦理委员会批准,每位受试者均签署知情同意书。
1.2关节液的收集与保存受试者取平卧位,膝关节局部消毒麻醉后,取髌上外侧入路行膝关节腔穿刺,抽取关节液约2 mL,室温下静置1 h。然后3 000 r/min离心20 min去除细胞和关节组织残存碎片,取上清置于新1.5 mL微量离心管,-80 ℃冰箱保存待后续检测。
1.3miR-140检测①总RNA的提取:Trizol法提取关节液总RNA。变性琼脂糖凝胶电泳和分光光度计检测法检测RNA质量和浓度。②miRNA逆转录:制备20 μL RT混合反应液:Total RNA 0.3 μg,dNTP (2.5 mM each)2 μL,RT特异引物(1 μM)0.5 μL,MMLV反转录酶(10 IU/μL)2 μL,RNA酶抑制剂(40 IU/μL) 0.3 μL,10×RT Buffer 2 μL。RT反应条件:16 ℃,30 min;42 ℃,40 min;85 ℃,5 min;反应结束后,冰上冷却5 min,-80 ℃保存。③Realtime PCR反应:采用8 μL的反应体系:dNTP(2.5 mM each)1.0 μL,10×PCR缓冲液1.0 μL,MgCl2溶液0.6 μL,Taq聚合酶0.5 IU,Sybergreen I至终浓度0.25×,10 μM的PCR特异引物F 0.4 μL,10 μM的PCR特异引物R 0.4 μL,2×ROX Reference Dye 0.2 μL。反应条件如下:95 ℃,3 min;40个PCR循环(95 ℃,15 s;60 ℃,30 s;70 ℃,30 s),实验重复3次。以U6 snRNA作为内参,数据采用2-ΔΔCT法进行分析。miR-140上游引物5’-GCCTCAGTGGTTTTACCCTA-3’,下游引物5’-GTGCAGGGTCCGAGGT -3’。
2结果
2.1KOA患者与健康人关节液miR-140表达比较RT-PCR结果显示:健康对照者关节液miR-140相对表达水平为1.04±0.29,KOA患者关节液miR-140表达水平为0.51±0.24,KOA患者明显低于健康对照者(P<0.05),见图1。

图1 不同分组患者关节液miR-140水平
2.2不同严重程度KOA患者关节液miR-140表达比较不同K-L分级患者中,Ⅱ级患者关节液miR-140相对表达水平为0.69±0.30,Ⅲ级患者关节液miR-140表达为0.51±0.24,Ⅳ级患者关节液miR-140表达为0.36±0.21;K-LⅣ级患者关节液miR-140表达明显高于Ⅱ级和Ⅲ级患者(P<0.05),见图1。
2.3KOA患者关节液miR-140表达与K-L分级的相关性Spearman秩相关分析结果显示:miR-140在关节液中的表达水平与KOA的K-L分级呈显著负相关性(r=-0.742,P<0.05),见图2。
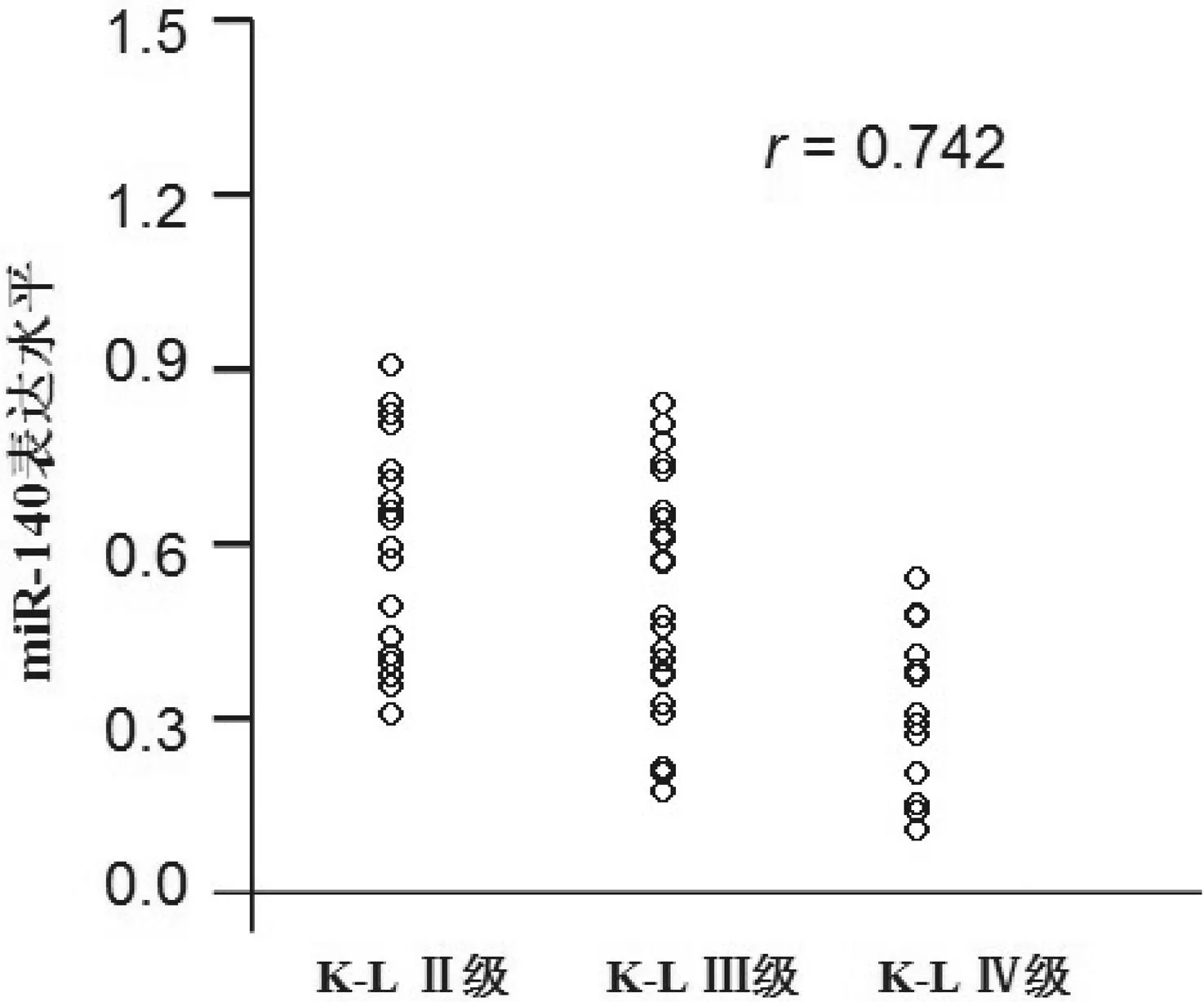
图2 关节液miR-140水平与KL分级的相关性散点图
3讨论
KOA的发病机制十分复杂,目前尚未完全阐明,可能为关节生物力学性质的改变、关节创伤、机体免疫反应、细胞因子、性激素水平等因素综合作用所致[8]。随着对miRNA研究的不断深入,目前已有大量文献报道miRNA与KOA的发生、发展存在密切关系。Iliopoulos等[9]对比检测发现,KOA患者和正常健康者软骨组织间存在16个差异表达的miRNAs,提示这些miRNAs可以用来区分KOA细胞和正常的软骨细胞。目前的研究已经证实,KOA的发病与软骨细胞和基质中异常活化的炎症递质和基质降解酶密切相关。Yamasaki等[10]研究发现,随着骨关节炎软骨退行性病变的加重,软骨中miR-146a的表达量逐渐减少,而基质金属蛋白酶-13(MMP-13)则呈平行上升趋势。特别是经IL-1β体外刺激可以导致软骨细胞miR-146a表达明显升高。提示miR-146a可能通过调控IL-1β和MMP-13来参与调控KOA的发病。由于miRNA与靶基因的mRNA的3’-UTR不完全互补结合,因此miRNA具有调控多个靶基因的能力。因此miRNA在KOA发病机制中起的重要作用也逐步受到学者们的认可和重视。
miR-140为软骨细胞中特异性高表达的miRNA,不仅参与调控人类软骨形成和发育,同时在维持软骨细胞平衡方面起着重要作用[11]。动物研究发现,敲除miR-140可导致的小鼠软骨内成骨的生长缺陷,关节软骨细胞发生凋亡[12]。尤为重要的是小鼠出现了与骨性关节炎的病理改变,而转基因过表达miR-140则可以抵制抗原诱导的关节炎的出现。进一步研究发现,其可能机制在于miR-140能直接抑制Adamts-5这一导致骨关节炎关节软骨基质降解的重要水解酶的表达。而骨关节炎病程中由于某种因素导致miR-140表达失调引起Adamts-5正常调控机制的失衡,从而导致骨关节炎的发生。
随着高灵敏性基因芯片和PCR技术的使用,目前在人体液(如血液、关节液、腹腔液、精液等)中能够检测到稳定表达的miRNAs,且其表达谱和表达水平的异常改变与多种疾病病变情况密切相关。目前已经证实KOA患者关节液中相关细胞因子和蛋白酶表达水平会发生改变,且这种改变与软骨损伤程度和疾病的严重程度有关[13]。本研究采用RT-PCR检测KOA患者关节液中miR-140表达改变情况。结果显示:KOA患者关节液中miR-140表达水平明显低于健康人,提示关节液miR-140的低表达不仅可以作为早期诊断KOA的生化指标,且miR-140的缺失可能是导致KOA发生发展的重要因素,这与相关报道是一致的[14]。由于关节液由关节面滑膜分泌产生,因此,根据以往文献报道认为关节液中的miR-140主要来源于关节软骨和滑膜组织的分泌和渗透[15]。由于KOA患者关节软骨和滑膜组织的miR-140表达明显降低,因而导致关节液中miR-140表达水平也相应降低。进一步采用Kellgren-Lawrence对60例KOA患者严重程度进行分级,结果显示:随着骨关节炎疾病的进展,KOA患者关节液中miR-140表达也依次降低。即KOA患者关节液中miR-140表达水平与骨关节炎严重程度呈负相关。这表明关节液中miR-140表达水平还可以作为评价膝骨关节炎影像和病变严重进展的生化指标。
总之,本次研究结果结合国内外相关报道,证明miR-140与KOA的发生发展密切相关。深入研究miR-140不仅有助于进一步阐明KOA的发病机制,关节液miR-140的表达也可以为KOA的诊断和病情评估提供重要参考依据。此外,通过将miR-140作为KOA干预治疗的靶点,从基因组学和转录调控机制上为KOA的治疗提供一种新的手段。
[参考文献]
[1]Ikeuchi M,Izumi M,Aso K,et al. Clinical characteristics of pain originating from intra-articular structures of the knee joint in patients with medial knee osteoarthritis[J]. Springerplus,2013,2:628
[2]Bennell K,Dobson F. Review: Exercise interventions improve pain and function in people with knee osteoarthritis compared with no exercise[J]. Evid Based Nurs,2014,17(4):109
[3]Khan AA,Jahangir U,Urooj S. Management of knee osteoarthritis with cupping therapy[J]. J Adv Pharm Technol Res,2013,4(4):217-223
[4]David R. Small RNAs:miRNA machinery disposal[J]. Nat Rev Mol Cell Biol,2013,14(1):4-5
[5]Araldi E,Schipani E. MicroRNA-140 and the silencing of osteoarthritis[J]. Genes Dev,2010,24(11):1075-1080
[6]Hwang S,Park SK,Lee HY,et al. miR-140-5p suppresses BMP2-mediated osteogenesis in undifferentiated human mesenchymal stem cells[J]. FEBS Lett,2014,588(17):2957-2963
[7]Spector TD,Cooper C. Radiographic assessment of osteoarthritis in population studies: whither Kellgren and Lawrence?[J]. Osteoarthritis Cartilage,1993,1(4):203-206
[8]Iqbal MN,Haidri FR,Motiani B,et al. Frequency of factors associated with knee osteoarthritis[J]. J Pak Med Assoc,2011,61(8):786-789
[9]Iliopoulos D,Malizos KN,Oikonomou P,et al. Integrative microRNA and proteomic approaches identify novel osteoarthritis genes and their collaborative metabolic and inflammatory networks[J]. PLoS One,2008,3(11):e3740
[10] Yamasaki K,Nakasa T,Miyaki S,et al. Expression of MicroRNA-146a in osteoarthritis cartilage[J]. Arthritis Rheum,2009,60(4):1035-1041
[11] Nicolas FE,Pais H,Schwach F,et al. Experimental identification of microRNA-140 targets by silencing and overexpressing miR-140[J]. RNA,2008,14(12):2513-2520
[12] Miyaki S,Sato T,Inoue A,et al. MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J]. Genes Dev,2010,24(11):1173-1185
[13] Mabey T,Taleongpong P,Udomsinprasert W,et al. Plasma and synovial fluid autotaxin correlate with severity in knee osteoarthritis[J]. Clin Chim Acta,2015,444:72-77
[14] Zhang R,Ma J,Yao J. Molecular mechanisms of the cartilage-specific microRNA-140 in osteoarthritis[J]. Inflamm Res,2013,62(10):871-877
[15] 周新华,王敏,姬颜辉,等. miRNA-140在早期骨关节炎软骨细胞中的表达规律及功能[J]. 第二军医大学学报,2014,35(6):610-615
[收稿日期]2015-12-31
[中图分类号]R593.21
[文献标识码]B
[文章编号]1008-8849(2016)13-1422-03
doi:10.3969/j.issn.1008-8849.2016.13.018

