唑来膦酸对钛微粒诱导的破骨细胞前体细胞RAW 264.7分化的影响
张怡元 林煜 肖莉莉 王武炼 冯尔宥
【摘 要】目的:观察唑来膦酸对钛微粒诱导的破骨细胞前体细胞RAW 264.7分化的影响,探讨其防治假体周围骨质疏松的可能性。方法:体外培养单核巨噬细胞白血病细胞RAW 264.7。制备钛微粒,MTT法检测绘制RAW 264.7细胞增殖曲线,寻找唑来膦酸最佳干预浓度。将RAW 264.7分为3组:Ti微粒组(0.1%体积比钛微粒+含质量分数为10%的胎牛血清培养基)、Ti+唑来膦酸组(0.1%体积比钛微粒+含质量分数为10%的胎牛血清培养基+最佳浓度唑来膦酸)和对照组(含质量分数为10%的胎牛血清的常规培养基)。采用抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色法观察细胞的形态。采用ELISA法检测培养液中细胞核因子κB活化因子受体(receptor activator of NF-κB,RANK)的浓度,生化法测定细胞上清液中TRAP活力,用qPCR法检测TRAP、基质外金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、碳酸酐酶Ⅱ(carbonic anhydraseⅡ,CAⅡ)、磷酸酶-活化T细胞核因子(NFATcl) mRNA的表达;Western Blot法检测TRAP、RANK、CtsK蛋白的表达。结果:钛微粒能刺激RAW 264.7分泌促破骨细胞分化的因子,并能促进单核细胞向破骨细胞转化。唑来膦酸可明显下调钛微粒诱导的RAW 264.7 RANK的表达,以及TRAP、MMP-9、CAⅡ、NFATcl mRNA和蛋白的表达,差异有统计学意义(P < 0.05)。结论:唑来膦酸能有效抑制破骨细胞前体细胞RAW 264.7分化,减少破骨细胞的形成,下调RANK、TRAP等破骨细胞特异细胞表型和功能基因mRNA的转录水平,有望成为防治人工关节置换术后假体周围骨质疏松的药物。
【关键词】 唑来膦酸;钛微粒;RAW 264.7;共培养分化
doi:10.3969/j.issn.2095-4174.2016.03.001
Effect of Zoledronic Acid on the Differentiation of Titanium Particle Induced Osteoclast Precursor
Cells RAW 264.7
ZHANG Yi-yuan,LIN Yu,XIAO Li-li,WANG Wu-lian,FENG Er-you
【ABSTRACT】Objective:To observe the effect of zoledronic acid on the differentiation of titanium particle-induced osteoclast precursor cells RAW 264.7 to probe its possibility in the prevention and treatment of osteoporosis around prosthesis.Methods:RAW 264.7 cells were cultured in vitro.A preparation of titanium particles was made and the MTT method was used to detect the growth curve of RAW 264.7 cells in order to look for the best concentration of zoledronic acid for intervention.Cells Raw 264.7 was divided into three groups:the Ti particles group (0.1% volume ratio of titanium particles + 10% fetal bovine serum culture medium),the Ti+ zoledronic acid group (0.1% volume ratio of titanium particles + 10% fetal bovine serum culture medium + optimal concentration of zoledronic acid) and the control group (10% fetal bovine serum culture medium).The tartrate resistant acid phosphatase (TRAP) staining was used to observe the morphology of cells.The ELISA method was used to detect the concentration of RANK (receptor activator of NF-κB).The biochemical method was used to determine the activity of TRAP in the supernatant of cells.The qPCR method was used for the detection of the expressions of TRAP,matrix metalloproteinase 9 (MMP-9),carbonic anhydraseⅡ(CAⅡ) and (NFATcl) mRNA;Western Blot was used to detect the expressions of TRAP,RANK,CtsK and proteins.Results:Titanium particles could stimulate RAW 264.7 to secrete osteoclast differentiation factors and promote the transformation of mononuclear cells to osteoclasts.Zoledronic acid could obviously make a down regulation for the expression of titanium particle-induced RAW 264.7 RANK and the expressions of TRAP,MMP-9,CAⅡ,NFATcl mRNA and proteins.The difference was statistically significant (P < 0.05).Conclusion:Zoledronic acid can effectively inhibit the differentiation osteoclast precursor cells RAW 264.7,reduce the formation of osteoclast and make a down regulation of the phenotype of osteoclast and the transcription level of functional gene mRNA,which is expected to become a drug for the prevention and treatment of postoperative periprosthetic osteoporosis.
【Keywords】 zoledronic acid;titanium particle;RAW 264.7;co-culture and differentiation
随着我国人口的老龄化,由于外伤、股骨头坏死、骨质疏松导致髋部骨折的患者不断增加,而人工髋关节置换术(total hip arthroplasty,THA)已经成为恢复髋部功能的主要方式[1]。目前,影响髋关节稳定性、假体使用寿命及增加翻修率的主要原因是THA术后假体周围骨质疏松导致的假体无菌性松动[2]。研究表明,置换后的金属与聚乙烯衬垫因持续磨损而产生大量的含有金属的微粒与亚微粒,脱落的微粒会随着机械微动迁移至骨-假体界面,这些磨损微粒能通过促进破骨细胞分化和骨吸收活性从而引起假体周围骨质疏松[3-4]。唑来膦酸(zoledronate,ZOL)是目前治疗骨质疏松的双膦酸盐类代表药物,主要通过抑制破骨细胞分化、降低骨重建发挥作用[5]。近来研究发现,ZOL能通过抑制假体周围破骨细胞的分化、减缓骨重建的速度增加假体周围骨质量[6]。因此,本实验拟通过研究ZOL干预钛微粒诱导的破骨细胞前体细胞
RAW 264.7,观察其对RAW 264.7分化的影响,以期为临床采用ZOL预防THA术后因假体周围骨质疏松而引起的无菌性松动提供依据。
1 实验材料
1.1 实验药物和细胞 ZOL由北京诺华制药有限公司提供[规格5 mg·(100 mL)-1,进口药品注册证号H20070127];RAW 264.7采购自广州吉尼欧生物科技有限公司(小鼠单核巨噬细胞白血病细胞)。
1.2 主要试剂和检测仪器 直径平均为(0.91±
0.65)μm钛微粒(北京有色金属公司);Trizol(invitrogen公司);RANK ELISA检测试剂盒(西唐公司);抗酒石酸酸性磷酸酶染色试剂盒(南京建成生物工程研究所);PCR引物(上海生工生物工程技术服务技术有限公司);CtsK、RANK、TRAP、β-actin抗体(Cell Signaling公司);PrimeScriptTM RT reagent Kit、SYBR Premix Ex TaqTM PCR Kit(TAKARA公司);9600型PCR扩增仪(美国PE公司);7500 Fast实时定量PCR仪(美国ABI公司);ELx800酶标仪(BIO-TEK公司)。
2 方 法
2.1 干预前钛微粒的预处理 首先将钛微粒置于烤箱,300 ℃6 h,将100 mg钛微粒悬浮于
25 mL质量分数为75%的乙醇中制成混悬液。放在200 r·min-1水平摇床,24 h后离心去上清液。更换乙醇继续振荡24 h,离心去液体,PBS洗涤3次。再次干燥后,置于紫外线中照射24 h。检测处理后的钛微粒内毒素质量分数 < 0.10 EU·mL-1,可以排除内毒素对细胞的影响。最后预处理后的钛微粒置于DPBS中,配制成体积比为0.1%的混悬液即每毫升0.1%(v/v)的混悬液终含钛微粒4.5×107。在干预前须用超声磁力震荡器震荡10 min消除粘连。
2.2 ZOL干预 将RAW 264.7以1×106个每孔密度接种于6孔板,将其放入培养箱过夜。分为
3组:Ti微粒组(0.1%体积比钛微粒+含质量分数为10%的胎牛血清培养基)、Ti+唑来膦酸组(0.1%体积比钛微粒+含质量分数为10%的胎牛血清培养基+最佳浓度唑来膦酸)和对照组(含质量分数为10%的胎牛血清的常规培养基)。干预后连续培养48 h。同时采用TRAP染色,观察是否分化为破骨细胞。
2.3 ZOL对RAW 264.7增殖的影响 将RAW 264.7
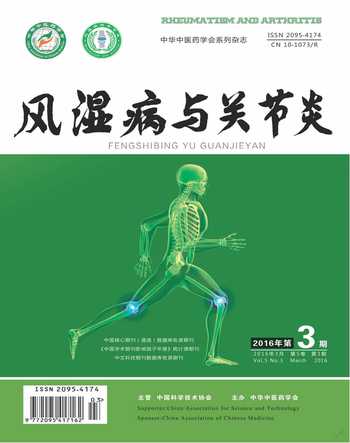
细胞以104·mL-1的密度接种于96孔培养板中,过夜后弃去旧培养液,分别加入含0,10-9,10-8,10-7,10-6,10-5,10-4,10-3,10-2,10-1 mol·L-1的培养基,每个浓度设8孔,培养72 h,加入四唑盐液(5 g·L-1)20 μL每孔,37 ℃孵育4 h后吸去上清液,加入DMSO液体150 μL每孔,在摇床上振荡10 min,用酶标仪选择490 nm波长测定各孔吸光度值(A),其值与细胞数量成正比。比较不同ZOL对RAW 264.7增殖的影响,并找出最佳的干预RAW 264.7的浓度。
2.4 ELISA法检测培养液RANK浓度 取干预48 h
后离心,分别取细胞与培养液,细胞用TX-1000
裂解后,按照试剂盒说明书,在待测96孔板中分别加入样品、标准品、空白液各100 μL,加样后,置于温箱37 ℃30 min,洗板并加入酶标偶合液100 μL,37 ℃20 min。洗板后加入底物、终止液50 μL,与酶标仪上长读取OD值。样本均设复孔。
2.5 生化法检测细胞液TRAP浓度 取干预48 h后培养液加入试管,每管0.05 mL,将蒸馏水0.05 mL、
0.1 mg·mL-1酚标准应用液0.05 mL加入空试管中,再加入缓冲液、基质液各0.5 mL充分混匀,37 ℃水浴15 min,最后加入1.5 mL显色剂,立即混匀,520 nm,0.5 cm光径比色,空白管调零,测各管
吸光度。
2.6 qPCR法检测TRAP、MMP-9、CAⅡ、NFATcl
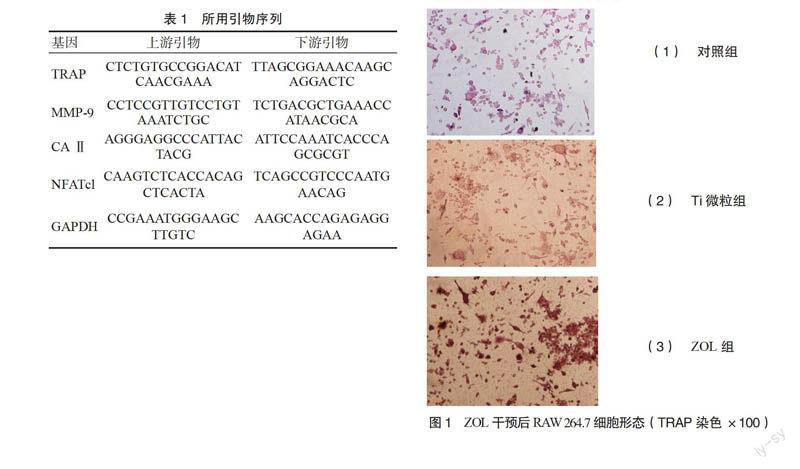
mRNA表达 见表1。
采用Trizol法提取细胞总RNA,计算出抽提后的RNA浓度,取500 ng提取后的RNA,按试剂盒说明书进行逆转录。设复孔在7500 Fast实时定量PCR仪上按进行cDNA扩增,得到扩增曲线、CT值、溶解曲线,每个指标每个样本均设3个复孔。使用7500 system SDS 软件将得到的CT值换算成最终数据。
2.7 Western Blot法检测细胞中RANK、MMP-9、
NFATcl蛋白的表达 提取总蛋白,用BCA法测定蛋白浓度,以每泳道上样30 μg蛋白,质量分数为12%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,采用半干转法将蛋白转印至PVDF膜。在室温下封闭30 min,加入一抗封1 h。每次40 mL洗液漂洗膜6次,即:1 min 2次,20 min 2次,5 min 2次。然后将二抗室温封闭30 min,洗膜5次。AP化学发光底物与膜在室温下孵育反应5 min,压片曝光、显影。采用Phoretix 1D生物电泳图像分析系统分析胶片中蛋白的条带,计算机自动读取并记录每条带的光密度值。
2.8 统计学方法 采用SPSS 18.0软件进行统计分析。计量资料以表示,首先比较样本是否呈正态分布,并检验方差齐性,多组之间比较先采用F检验,而后进行q检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 ZOL干预后RAW 264.7细胞形态 显微镜下观察发现,与钛微粒共培养后部分RAW 264.7细胞核增多,伪足增多,细胞间排列不齐,有伪足。干预后的细胞采用抗酒石酸酸性磷酸酶染色,发现细胞的胞浆部位形成棕红色沉淀,细胞核染色成阴性。其中Ti微粒组最为明显,Ti+ZOL组次之,对照组无明显改变。见图1。
3.2 ZOL促RAW 264.7细胞增殖情况 MTT法检测后绘制RAW 264.7细胞增殖曲线图发现,细胞在ZOL浓度为0~10-6 mol·L-1之间无明显变化,之后随着浓度增加细胞增殖能力逐渐降低。因此确定浓度为10-6 mol·L-1 ZOL为干预最佳浓度。
3.3 各组RAW 264.7细胞中RANK、TRAP表达 Ti微粒组中RANK、TRAP表达最高,Ti+ZOL组次之,对照组最低,两两比较,差异有统计学意义(P < 0.05)。见表2。
3.4 各组RAW 264.7细胞中TRAP、MMP-9、CAⅡ、NFATcl基因表达 qPCR结果表明,Ti微粒组及Ti+ZOL组的TRAP、MMP-9、CAⅡ、NFATcl的RNA表达均高于未含钛颗粒的正常组,且Ti微粒组的TRAP、MMP-9、CAⅡ、NFATcl表达高于Ti+ZOL组,各组间比较,差异有统计学意义(P < 0.05)。见表3。
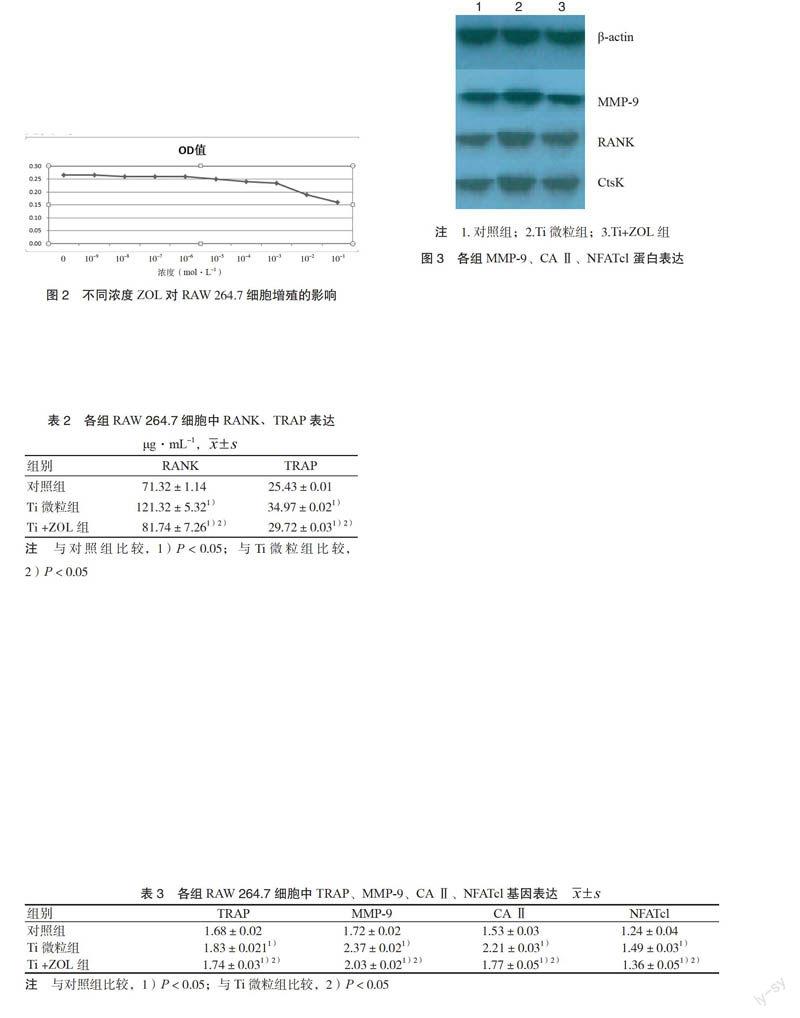
3.5 各组RAW 264.7细胞中RANK、MMP-9、NFATcl蛋白表达 各组RANK、MMP-9、NFATcl蛋白表达量情况以Ti微粒组的蛋白表达含量最高,Ti+ZOL组次之,对照组最低。各组比较,差异均有统计学意义(P < 0.05)。见图3。
4 讨 论
THA是治疗晚期髋关节疾病的理想方法。目前,影响假体长期生存率的原因主要是假体松动,假体周围骨量的丢失与松动具有显著的关系[7-8]。THA假体植入后假体周围磨损颗粒激活循环血单核细胞并将其募集至假体周围,破骨细胞前体细胞也聚集在异物单核细胞群周围,引发破骨细胞前体细胞向破骨细胞分化,因此,破骨细胞前体细胞在假体周围骨质疏松中扮演重要角色。虽然手术技术、假体材料及制作工艺较之前有明显的改善,但是假体上磨屑颗粒的产生却是无法避免的。要解决假体周围骨质疏松导致的假体松动,除了改进假体材料与制作工艺以尽量减少磨屑颗粒产生和提高手术技术外,如何抑制因磨屑颗粒导致破骨细胞的活化,实现延长假体使用寿命,减少关节翻修率就显得尤为重要。
TRAP主要存在于巨噬细胞、破骨细胞、单核吞噬细胞等细胞中,是破骨细胞重要的酶组化识别标志[9]。MMP-9在破骨细胞中特异性高表达,可特异性地降解非矿化的软骨和释放细胞外基质结合的血管内皮生长因子,发挥其直接趋化、活化破骨细胞的作用,同时还在破骨细胞迁移过程中发挥重要的作用,是破骨细胞移动到骨表面的关键因素[10]。RANK则位于破骨前体细胞上,能被RANKL识别,RANKL与破骨细胞受体结合后,诱导破骨细胞的形成和活化[11]。NFATcl是RANKL介导的破骨细胞分化过程中最重要的因子,能活化RANKL/RANK途径的下游,促进破骨细胞前体细胞RAW 264.7向破骨细胞分化,并诱导破骨细胞的各种特异性基因的表达,如TRAP、CAⅡ等[12]。本研究结果显示,与钛微粒共培养后,RAW 264.7中RANK、TRAP、MMP-9、CAⅡ、NFATcl的表达较对照组有显著性提高(P < 0.05),提示钛微粒能促进单核细胞向破骨细胞转化。
ZOL是双膦酸盐类中最新一代的制剂,通过其含氮杂环能与骨骼紧密结合来抑制假体磨屑颗粒引起的破骨细胞功能活化带来的骨溶解,从而达到改善假体的生物学固定效果[13]。研究表明,ZOL能抑制THA术后假体无菌性松动狗模型的假体周围骨溶解,并且提高假体周围的骨密度,从而改善皮质骨生物力学性能,并且还能保护膜内成骨;同时ZOL还可以显著提高植入的带有生物型羟基磷灰石涂层假体周围骨的骨密度及生物力学参数[14-15]。此外,ZOL还能抑制整合素αv、β3在破骨细胞中基因的表达,从而影响破骨细胞在黏附、细胞骨架重排以及骨吸收中的作用[16]。本实验在采用ZOL干预后,干预组与钛微粒组比较,RAW 264.7细胞和细胞液中RANK的表达,TRAP、MMP-9、CAⅡ、NFATcl mRNA和蛋白的表达均明显下降(P < 0.05)。表明ZOL可能是通过RANKL/RANK途径,阻滞RANK受体的结合,抑制NFATcl的表达,并下调RAW 264.7细胞中TRAP、MMP-9的表达,最终抑制破骨细胞的分化成熟,从而降低破骨细胞的骨吸收功能。
总之,本研究采用ZOL对钛微粒诱导的破骨细胞前体细胞RAW 264.7干预,发现ZOL能抑制RAW 264.7向破骨细胞分化;但ZOL对关节假体周围骨吸收的长期作用到底如何,且对假体上磨屑颗粒的产生炎症因子是否有抑制作用,均有待于进一步研究。
5 参考文献
[1] Godoy Monzón D,Iserson KV,Jauregui J,et al.Total hip arthroplasty for hip fractures:5-year follow-up of functional outcomes in the oldest independent old and very old patients[J].Geriatr Orthop Surg Rehabil,2014,5(1):3-8.
[2] Chalmers PN,Sporer SM,Levine BR.Correlation of aspiration results with aseptic loosening in total hip arthroplasty[J].J Arthroplasty,2013,28(9):1671-1676.
[3] Green JM,Hallab NJ,Liao YS,et al.Anti-oxidation treatment of ultra high molecular weight polyethylene components to decrease periprosthetic osteolysis:evaluation of osteolytic and osteogenic properties of wear debris particles in a murine calvaria model[J].Curr Rheumatol Rep,2013,15(5):325.
[4] Goodman SB,Gibon E,Pajarinen J,et al.Novel biological strategies for treatment of wear particle-induced periprosthetic osteolysis of orthopaedic implants for joint replacement[J].J R Soc Interface,2014,11(93):962-966.
[5] Piper PK Jr,Gruntmanis U.Management of osteoporosis in the aging male:focus on zoledronic acid[J].Clin Interv Aging,2009,(4):289-303.
[6] 袁宏,陆琳松,钟惠琴,等.唑来膦酸对骨质疏松患者全髋关节置换术后假体周围骨密度的影响[J].中华关节外科杂志(电子版),2014,8(3):278-285.
[7] Sabo D,Reiter A,Simank HG,et al.Periprosthetic mineralization around cementless total hip endoprosthesis:longitudinal study and cross-sectional study on titanium threaded acetabular cup and cementless Spotorno stem with DEXA[J].Calcif Tissue Int,1998,62(2):177-182.
[8] Huang Q,Shen B,Yang J,et al.Changes in bone mineral density of the acetabulum and proximal femur after
total hip resurfacing arthroplasty[J].J Arthroplasty,2013,28(10):1811-1815.
[9] Takayanagi H.The role of NFAT in osteoclast forma-
tion[J].Annals N Y Acad Sci,2007(1116):
227-237.
[10] Lacey DL,Tan HL,Lu J,et al.Osteoprotegerin ligand
modulates murine osteoclast survival in vitro and in vivo[J].Am J Pathol,2000,157(2):435-448.
[11] Suda T.How is bone formed and resorbed?--molecular
mechanisms of bone formation and resorption[J].Rinsho Byori,2002,50(3):267-272.
[12] Patel N,Nizami S,Song L,et al.CA-074Me compound inhibit osteoclastogenesis via suppression of NFATcl an
c-Fos signsling pathways[J].J Orthop Res,2015,33(10):1474-1486.
[13] Sk?ldenberg OG,Salemyr MO,Bodén HS,et al.The
effect of weekly risedronate on periprosthetic bone resorption following total hip arthroplasty:a randomized,double-blind,placebo-controlled trial[J].J Bone Joint Surg Am,2011,93(20):1857-1864.
[14] Wise LM,Waldman SD,Kasra M,et al.Effect of zoledronate on bone quality in the treatment of aseptic loosening of hip arthroplasty in the dog[J].Calcif Tissue Int,2005,77(6):367-375.
[15] Peter B,Pioletti DP,La?b S,et al.Calcium phosphate drug delivery system:influence of local zoledronate release on bone implant osteointegration[J].Bone,2005,36(1):52-60.
[16] 林珏杉,董伟,徐纯峰,等.唑来膦酸对破骨细胞黏附及整合素αv、β3基因表达的影响[J].华西口腔医学杂志,2014,32(4):547-551.
收稿日期:2015-10-29;修回日期:2016-01-12