一种烯啶虫胺新型半抗原的合成与免疫应用
赵方方 罗金辉 谢德芳 吕岱竹

摘 要 为建立烯啶虫胺(nitenpyram,NIT)残留免疫分析方法,通过合成烯啶虫胺新型半抗原并进行紫外和质谱等技术的分析确证,分别将半抗原与牛血清蛋白(BSA)和卵清蛋白(OVA)偶联成完全的免疫抗原和包被抗原。免疫小鼠后测定抗血清的效价,随着免疫次数的增加先逐渐升高后再逐渐降低,最高达到1 ∶ 16 000。选取抗血清效价最高的小鼠,用间接竞争ELISA法测定其灵敏度,其半抑制浓度(IC50)较低,为1.68 μg/mL,竞争效果明显。将建立的检测方法与液相色谱方法进行比较,虽线性范围和灵敏度较液相色谱方法稍低,但回收率均≥80%,无明显差异,具有明显的识别效应,为烯啶虫胺高灵敏的单克隆抗体制备及残留免疫分析奠定基础。
关键词 烯啶虫胺;新型半抗原;合成;免疫效果
中图分类号 TQ450.2 文献标识码 A
Abstract A new type of nitenpyram hapten was analyzed and confirmed after being synthesized by UV spectrum and mass spetrum in order to establish a method for the analysis of the residues of nitenpyram(NIT). And the NIT hapten was then coupled with BSA and OVA to prepare immunogen (NIT-BSA) and coating antigen (NIT-OVA). The titer of the antiserum was determined by immune mice, and the titer increased and then reduced gradually with the increase of the number of times. The maximum reached 1 ∶ 16 000. The mice with the highest titer were selected, and the sensitivity was determined by indirect competitive ELISA method. The IC50 was 1.68 μg/mL, the semi inhibition concentration was low and the competition effect was obvious. Compared with the method of liquid chromatography, the linearity range and sensitivity are slightly lower than that of liquid chromatography. The two recovery rates were more than 80% without obvious difference which showed obvious recognition effect. This study laid a foundation for the preparation of monoclonal antibodies that has the high sensitivity and the immunoassay.
Key words Nitenpyram;New type of hapten;Synthesis;Immune effect
doi 10.3969/j.issn.1000-2561.2016.07.024
烯啶虫胺是日本继吡虫啉、啶虫脒之后开发的又一种新烟碱类农药,具有较强的内吸性和渗透性,对于飞虱、蚜虫、粉虱等刺吸式口器害虫具有较强的灭杀效果,广泛应用于水果、蔬菜、水稻等作物害虫的防治,现已成为有机磷、有机氯等高毒农药及产生抗性的拟除虫菊 酯类等农药的优秀替代品种[1-4]。然而该药在农业生产中广泛、大量的使用,同时因其强大的内吸和渗透作用,很容易造成果蔬等生鲜食用的作物中残留超标,严重威胁消费者的身体健康[5-6]。因此,加强对上市果蔬中烯啶虫胺残留检测十分必要。
文献报道的烯啶虫胺检测方法主要有液相色谱[7-9]、气相色谱[10]、色谱质谱联用等方法[11-12]。而针对果蔬等货架期较短的产品,这些方法普遍存在时间久、费用高、操作复杂等不适用性,因此,建立快速、灵敏、廉价的免疫检测方法对于此类产品具有重要意义[13-15]。彭方毅等[15]建立了定量测定吡虫啉的间接竞争ELISA方法;李广领等[13]建立了噻虫嗪残留酶联免疫吸附的检测方法,线性范围良好,检出限达到0.001 mg/L。而目前针对烯啶虫胺建立的残留免疫分析方法只有王俊平等[16]在烯啶虫胺分子芳环上添加连接臂连接载体蛋白进行免疫。本研究将烟碱类农药的特征性芳环结构进行暴露,对烯啶虫胺分子结构的化学修饰,从远芳环端进行修饰,再与大分子载体共价偶联制备其完全抗原,通过免疫实验动物产生针对烯啶虫胺的特异性抗体,为烯啶虫胺残留免疫分析奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂与耗材 烯啶虫胺(98%)购自武汉康泰宝精细化工公司;牛血清白蛋白(BSA)、卵清蛋白(OVA)、羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC-HCl),弗氏完全佐剂、弗氏不完全佐剂均购自sigma公司;其他试剂购自国药公司,水为实验室制备超纯水
1.1.2 仪器设备 酶标仪(ELx800,Biotek公司)、超纯水系统(ULUP-IV-20T,成都超纯科技有限公司)、旋转蒸发仪(R-3,Buchi公司)、洗板机(Elx50,Biotek公司)、电泳仪(PowerPac,bio-rad公司)、液相色谱-串联质谱(API4000,AB SCIEX公司)
1.2 方法
1.2.1 半抗原的合成 称取5.26 g(19 mmol)烯啶虫胺(98%)置于三口瓶中,加适量无水乙醇溶解后,在70 ℃恒温通入氮气,加入二水合氯化亚锡21.44 g,加入无水乙醇使氯化亚锡完全溶解,通氮气15 min后密封,持续通入冷凝水,磁力搅拌反应2 h后挥干乙醇,加入碳酸钠溶液(6.00 g碳酸钠溶于40 mL水),使混合液pH=8-9,剧烈振摇后静置过滤,用乙酸乙酯萃取上清3次,无水硫酸钠干燥过夜后蒸干,用硅胶柱净化后得到4.08 g浅黄色胶状物质,产率为89.2%,Rf=0.329(乙酸乙酯∶石油醚=1 ∶ 3),反应线路见图1。
1.2.2 完全人工抗原的合成 称取400 mg BSA(合成免疫原)或OVA(合成包被原),溶于3 mL pH=5的PBS溶液中,加入2 g EDC,搅拌使其完全溶解活化20 min,然后加入0.20 g NHS搅拌反应30 min。称取200 mg半抗原溶于少量DMF中,并滴入上述蛋白活化液中,边滴边搅拌,反应过夜。将反应液装入透析袋中于4度下透析,透析液为PBS缓冲液,每6~10 h换一次透析液,透析72 h后将反应液定容,反应线路见图2。
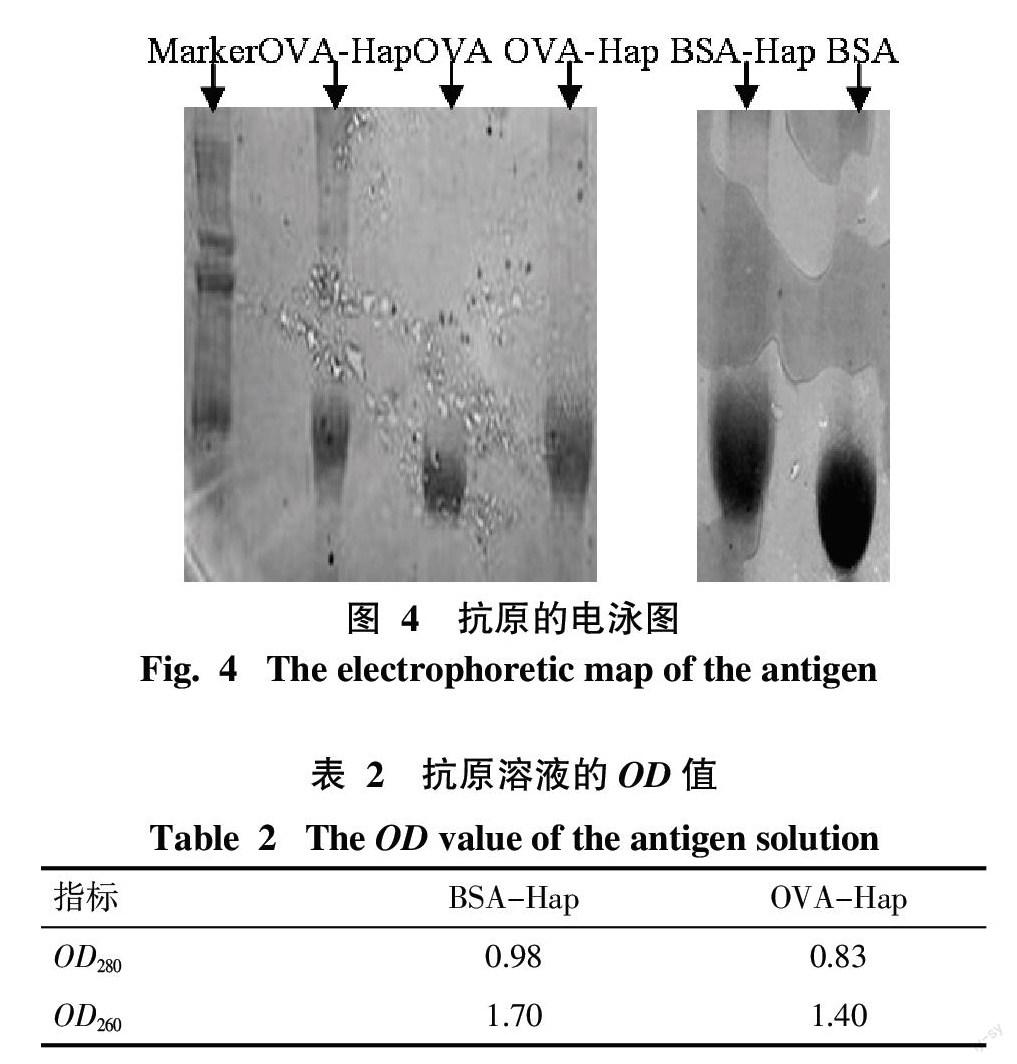
1.2.3 抗原浓度的测定 根据蛋白溶液光密度值测定抗原浓度[17],测定波长为280 nm和260 nm抗原溶液的OD值,按照公式:蛋白浓度(mg/mL)=1.45×OD280-0.74×OD260,计算抗原浓度。
1.2.4 免疫试验 将免疫原对小鼠按照表1所示流程进行免疫。
1.2.5 抗血清多克隆抗体的应用 包被不同浓度梯度抗原,使用上述小鼠的抗血清进行梯度稀释,使用十字交叉法进行抗原和抗体浓度的优化,建立间接竞争ELISA方法。确定烯啶虫胺最大吸收波长,优化流动相组成及配比,建立烯啶虫胺液相色谱检测方法。液相色谱采用紫外检测器,波长为272 nm,甲醇 ∶ 水=15 ∶ 85为流动相,进行检测。分别建立2种方法的标准曲线,前处理按照标准[18]进行;同时进行2种方法的样品加标回收试验(浓度为0.10 μg/g),并进行比较。
2 结果与分析
2.1 半抗原的合成鉴定
半抗原合成反应进行时用TLC监测,反应结束时,在紫外灯下观察唯一吸收点(Rf=0.32),比原料点(Rf=0.75)小,说明极性比烯啶虫胺大,与理论分析结果一致。
对半抗原进行核磁共振(氢谱)分析,1H-NMR(600 M,CDCl3,TMS),δ:4.63(s,1H,CHN);1.88~2.12(t,1H,NH);2.35~2.53(d,3H,CH3);2.33~2.63(m,2H,CH2CH3);0.88~1.12(t,3H,CH2CH3);3.83(s,1H,CHN);7.75~9.06(m,3H,CH);所得数据与氢原子位移的理论分析结果一致。
质谱结果见图3,其中准分子离子峰([M-H]-=239.26)丰度最大,与目标产物的分子量一致,且存在Cl元素的同位素峰;从分子结构分析,在电离时能量较低的2个双键C原子与N原子成键能量较低且容易断裂,脱掉-NH-CH3、-NH2成键断裂后形成新的离子,理论分子量为195,与质谱图中195.24峰吻合,说明半抗原合成成功。
2.2 抗原的鉴定
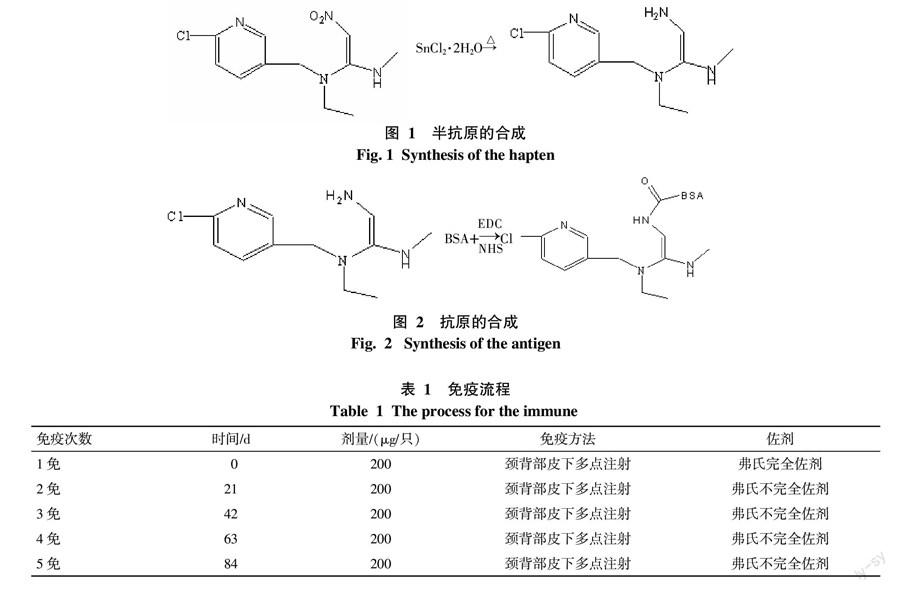
将透析后的人工抗原离心后除去变性及自身结合的蛋白质分子,采用电泳进行完全抗原的鉴定,结果见图4,与半抗原反应以后的载体蛋白质(BSA、OVA)均比载体蛋白在电场中的位移要小,说明载体蛋白结合了其他物质,导致分子量增大,而且根据电场力公式及加速度公式有S=F/2m×t2,说明在电泳时间相同的情况下,位移跟质量成正比,说明不是蛋白质之间的结合而是蛋白质结合了小分子量的半抗原。
2.3 抗原浓度
抗原溶液的OD值见表2,经过计算,得出免疫原的浓度为0.163 mg/mL,包被原的浓度为0.168 mg/mL。
2.4 抗血清效价
从第2次开始,每次免疫后1周对小鼠断尾取血,间接ELISA法测定抗血清效价,结果见图5,随着免疫次数的增加,效价逐渐增加至最大值,然后开始出现下降,1号小鼠效价最高达1 ∶ 16 000。
2.5 免疫效果
选取抗血清效价较高的1号小鼠,间接竞争ELISA法测定其抗血清中多克隆抗体的灵敏度,其IC50为1.68 μg/mL(图6),免疫效果明显,直接证明了半抗原及完全抗原的合成成功。
2.6 抗血清的应用
选择十字交叉法中OD值为1所对应的抗原和抗体浓度建立间接ELISA法,其中包被抗原浓度为0.2 μg/g,抗血清进行1 ∶ 8 000倍稀释,将结果与所建立的液相方法进行比较,其标准曲线和样品加标回收结果见表3。2种方法回收率均位于80%~90%,均为较佳结果且无明显差异,但ELISA方法的线性范围较窄为0.72~3.30 μg/mL,对比之下液相色谱法线性范围较宽,为0.025~5.00 μg/mL。因此,所建立的ELISA方法适宜测量的样品浓度范围小。此外,ELISA检测限也较液相色谱法高,说明多克隆抗体直接应用于样品的检测还存在一定的局限性。但本研究为高质量的单克隆抗体的研制提供了较好的预期。
3 讨论与结论
目前,普遍的烯啶虫胺残留检测主要采用色谱、色谱质谱联用等仪器检测法。然而这些方法普遍存在着分析时间久、费用高、操作专业等缺点。相对于这些缺点,免疫检测具有速度快、价格低廉、操作简单等优点,对烯啶虫胺这种水溶性大的农药尤其适用。
王俊平等[16]报道的烯啶虫胺的半抗原是从新烟碱农药的特征结构-芳香环处进行修饰,添加连接臂,与其不同的是本研究针对此特征性芳环结构,设计了新型的半抗原,并通过对烯啶虫胺分子进行改造,在远离芳环端改造基团,成功合成了能够暴露其特征结构的烯啶虫胺半抗原,与从头合成相比,最大程度的保留了烯啶虫胺的原有特征,以确保动物机体对烯啶虫胺或新烟碱类农药的识别程度,以获得灵敏度较高的多克隆抗血清。
与彭方毅等[15]、王俊平等[16]、李广领等[19]所做的新烟碱类农药单克隆抗体进行比较,本研究所制备的多克隆抗血清的灵敏度与其还存在一定差距,这是由于初步免疫时,抗原组分复杂,产生的多克隆抗体的抗原识别位点较多,导致非特异性较强,灵敏度较差,是多克隆抗体的特性所决定的。通常此类研究都是从灵敏度和特异性相对较强的多克隆抗体入手,进行进一步的筛选、驯化,以得到灵敏度和特异性较高的单克隆抗体。与液相色谱法相比,通过该多克隆抗体建立的检测方法回收率较好,无明显差异,但线性范围比液相色谱法小,检测灵敏度较低,说明多克隆抗体直接应用于样品的检测还存在一定的局限性,但其为高质量的单克隆抗体的研制提供了较好的预期。
本研究初步验证了该新型抗原具有较好的免疫原性和反应原性,为烯啶虫胺高灵敏度或高通用性新烟碱类单克隆抗体的研制做了前期研究,也奠定了较为良好的基础,以期能够研制出高灵敏度或高通用性的单克隆抗体。
参考文献
[1] 李 敏, 成四喜, 李海屏,等. 新烟碱类杀虫剂烯啶虫胺述评[J]. 农药研究与应用, 2012, 16(2): 1-5.
[2] 王党生. 烯啶虫胺的合成路线[J]. 农药, 2002, 41(10): 43-44.
[3] 孙 慧, 杨春河. 新型杀虫剂烯啶虫胺[J]. 研发前沿, 2009, 17(11): 16-18.
[4] 王志敏. 烯啶虫胺的高效液相色谱分析[J]. 现代农药, 2007, 6(1): 29-31.
[5] 李广领. 吡虫啉残留免疫学快速检测技术研究[D]. 新乡:河南科技学院, 2010: 6.
[6] 唐启林. 烯啶虫胺:让人欢喜让人忧—农药新品烯啶虫胺推广应用综述与前景分析[J]. 农药市场信息, 2009(7): 18-20.
[7] 吴 培, 林 波,刘敬民. 烯啶虫胺原药的高效液相色谱分析[J]. 农药, 47(6): 434-435.
[8] Obana H, Okihashi M, Akutsu K, et al. Determination of acetamiprid, imidacloprid,and nitenpyram residues in vegetables and fruits by high-performance liquid chromatography with diodearray detection[J]. J Agric Food Chem, 2002, 50(16): 4 464-4 467.
[9] Watanabe E, Baba K, Eun H. Simultaneous determination of neonicotinoid insecticides in agricultural samples by solid-phase extraction cleanup and liquid chromatography equipped with diode-array detection[J]. J Agric Food Chem, 2007, 55(10): 3 798-3 804.
[10] 张贵群, 聂思桥, 龙丽萍, 等. 气相色谱法分析甘蓝及其土壤中的烯啶虫胺残留[J]. 色谱, 2010, 28(11): 1 103-1 106.
[11] 付 岩, 林 婷, 陈梦丽,等. 烯啶虫胺在柑橘和土壤中的残留及消解动态[J]. 农药学学报, 2012, 14(4):423-428.
[12]Obana H,Okihashi M,Akutsu K,et al. Determination of neonicotinoid pesticide residues in vegetables and fruits with solidphase extraction and liquid chromatography mass spectrometry[J]. Agric Food Chem, 2003, 51(9): 2 501-2 505.
[13] 李广领, 王自良, 李金丽,等. 噻虫嗪单克隆抗体制备及酶联免疫吸附分析方法的建立[J]. 分析化学, 2012, 40(7): 1 098-1 103.
[14] 李广领, 姜金庆, 陈锡岭. 杀虫剂啶虫脒的免疫学特性[J]. 江苏农业学报, 2011, 27(2): 458-460.
[15] 彭方毅, 姜海蓉, 陈远翔,等. 吡虫啉的酶联免疫吸附分析方法研究[J]. 分析化学, 2010, 38(12): 1 737-1 741.
[16] 王俊平, 生 威, 张昕哲, 等. 烯啶虫胺半抗原、人工抗原和抗体及其制备方法与应用 201210429862: 中国[P]. 2013-02-27.
[17] 袁利鹏, 孙远明,雷红涛. 沙丁胺醇人工抗原合成及鉴定研究[J]. 食品科学, 2006, 27(2): 276-280
[18] NY/T 761-2008. 蔬菜和水果中有机磷、 有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S]. 北京: 中华人民共和国农业部, 2008: 4.
[19] 李广领, 姜金庆, 陈锡岭,等. 吡虫啉残留酶联免疫吸附检测方法的建立[J]. 食品科学, 2011, 32(12): 228-233.

