新型医用β钛合金研究的发展现状及加工方法
戴世娟,朱运田,陈 锋
(1.南京理工大学 纳米结构材料中心, 南京 210094;2.东南大学 材料科学与工程学院, 南京 211102)
新型医用β钛合金研究的发展现状及加工方法
戴世娟1,2,朱运田1,陈锋2
(1.南京理工大学 纳米结构材料中心, 南京210094;2.东南大学 材料科学与工程学院, 南京211102)
摘要:简述了生物医用β钛合金的发展历程,从元素体系上将其分为Ti-Mo系、Ti-Zr系、Ti-Ta系和Ti-Nb系,归纳了目前报道的典型β钛合金的研究现状,重点介绍了Ti-Nb系β钛合金的发展状况,总结了生物医用β钛合金的塑性加工和热处理工艺,提出了目前研制的β钛合金存在的问题,并对钛合金的发展趋势进行了展望。分析结果表明:根据市场及社会需求发展,生物医用钛合金的应用前景乐观,开展新型β钛合金的研发和临床实践十分必要。
关键词:β钛合金;加工方法;力学性能
钛及其合金以优良的生物相容性能、力学性能和抗腐蚀性能在生物医用金属材料中具有其他材料无法比拟的优势。钛及钛合金作为生物医用材料始于20世纪40年代初期,Bothe等[1]发现:相对于不锈钢和钴合金,钛与骨之间无任何不良反应。随后将钛引入医学领域。到20世纪60年代,Branemark[2-3]将钛合金用作口腔种植体,从此钛作为外科植入材料得到了广泛的发展。医用钛及其合金材料的应用按照研究时间的先后顺序大致分为3个阶段:第1阶段是以纯钛和Ti-6Al-4V(TC4)为代表的α型合金;第2阶段是以Ti-5Al-2.5Fe和Ti-6Al-7Nb为代表的无钒α+β型合金;第3个阶段是具有更好生物相容性和更低弹性模量的β钛合金。
随着科技的进步,人类社会对生物医用金属材料的要求不断提高,纯钛、TC4和无钒α+β型合金已经不能满足植入承载体的要求,迫切需要研究以无毒和低弹性模量为主要特点的β钛合金。β钛合金从元素体系上可分为Ti-Mo系、Ti-Zr系、Ti-Ta系和Ti-Nb系,其中Ti-Nb系的研究开展较多。
1生物医用β钛合金的研究现状
1.1Ti-Mo系
Mo元素是钛合金的β稳定元素,其添加有利于β钛合金的形成。与TC4相比,Ti-Mo系合金具有更高的拉伸强度、断裂韧性,更好的耐磨损性能以及更低的弹性模量。为了设计新型的Ti-Mo系医用合金,研究人员对各种合金元素对Ti-Mo合金组织和性能影响进行了深入的研究。Zhang等[4]研究了添加Nb元素对βTi-15Mo合金的显微组织和力学性能的影响,结果显示:随着Nb元素的增加,β晶粒尺寸减小,硬度和弹性模量降低。Maeshimal等[5]研究了Sn含量和时效条件的变化对Ti-Mo-Sn体系超弹性的影响,结果表明:经固溶处理后,Ti-5Mo-5Sn(at%)合金可达3.0%的超弹性应变;该合金在600 ℃下时效 5 min 后,可达到3.5%的可回复应变。Maeshima等[6]也研究了Ti-Mo-Sn系合金,结果表明:一定成分比的Ti-Mo-Sn合金可获得良好的形状记忆效应,可回复应变达3%以上。
表1为现有的部分Ti-Mo系β型钛合金的力学性能。由表1可知:虽然一些Ti-Mo系合金具有超弹性,但也有一部分合金屈服强度较低,如Ti-15Mo 和Ti-2Mo-2Zr-3Al,不能作为承受应力部位的植入材料;另外,部分合金含有有毒元素Al,如Ti-15Mo-5Zr-3Al 和Ti-2Mo-2Zr-3Al,导致合金的生物相容性较差。
1.2Ti-Zr系
Ti-Zr系的代表合金为Ti-15Zr-4Nb-4Ta-0.2Pd合金,该合金经时效后其抗拉强度、屈服强度和弹性模量[9]分别为919 MPa,806 MPa和99 GPa。与Ti-Mo系合金相比,该合金的弹性模量明显偏高,而强度却偏低,因此发展潜力不大。
1.3Ti-Ta系
Ta的价格昂贵,并且其熔点很高(3 273 K),加工熔炼较困难,因此目前对Ti-Ta系的β钛合金研究较少。Zhou等[10]研究了Ta含量对生物医用二元Ti-Ta合金的弹性模量和拉伸性能的影响,结果表明:Ti-30Ta和Ti-70Ta具有较低的弹性模量和较高的强度。虽然该体系合金综合性能较好,但加工困难,研究和应用范围受限。
1.4Ti-Nb系
近年来,美国和日本都致力于研发具有较低弹性模量的Ti-Nb系合金。如美国开发的 Ti-35.3Nb-5.1 Ta-7.1 Zr[3],其固溶态弹性模量达到了55 GPa,与人体致密骨的弹性模量非常接近。日本丰桥技术大学的Niinomi等[11]应用d电子合金设计理论,成功地设计了Ti-29Nb-13Ta-4.6Zr合金,该合金固溶态的弹性模量约为65 GPa,强度达550~650 MPa,力学性能较好。我国在新型β钛合金的研究方面也有重大突破,由中科院金属所研制的Ti-24Nb-4Zr-7.5Sn,在固溶状态下的弹性模量达到了52 GPa[12],有潜力成为具有竞争力的新型生物医用钛合金。表2列出了目前具有代表性的Ti-Nb系合金的力学性能,可以看出:与其他体系β钛合金相比,Ti-Nb系合金的弹性模量较低,更接近人骨的弹性模量,并且不含有毒元素Al和V,适合作为医用金属材料。
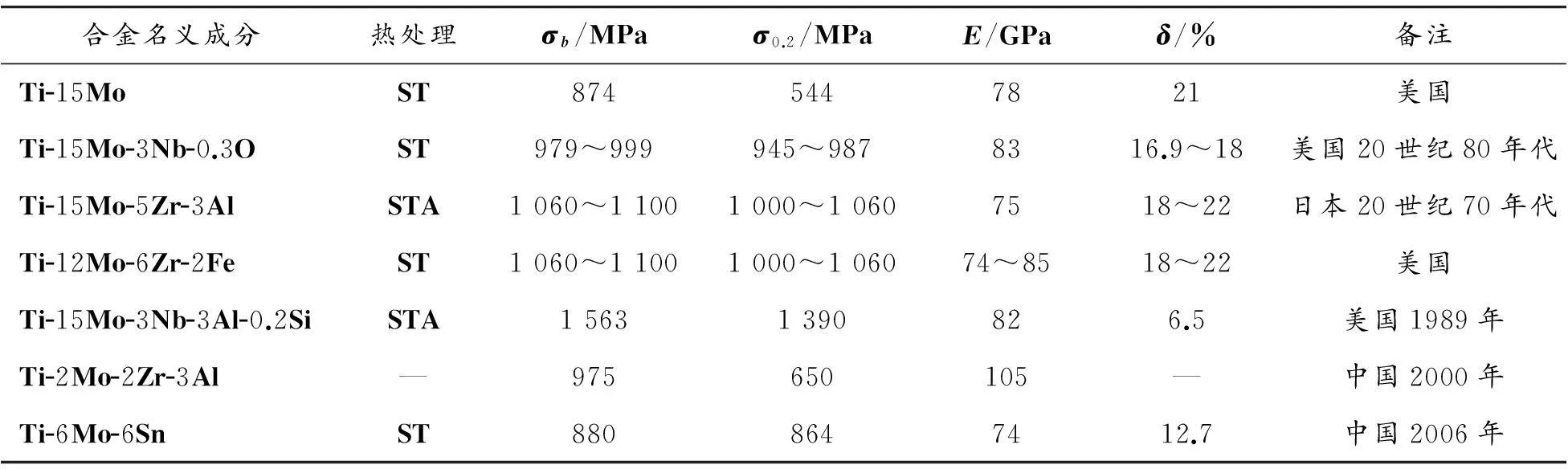
表1 现有部分Ti-Mo系β型钛合金力学性能[7-8]
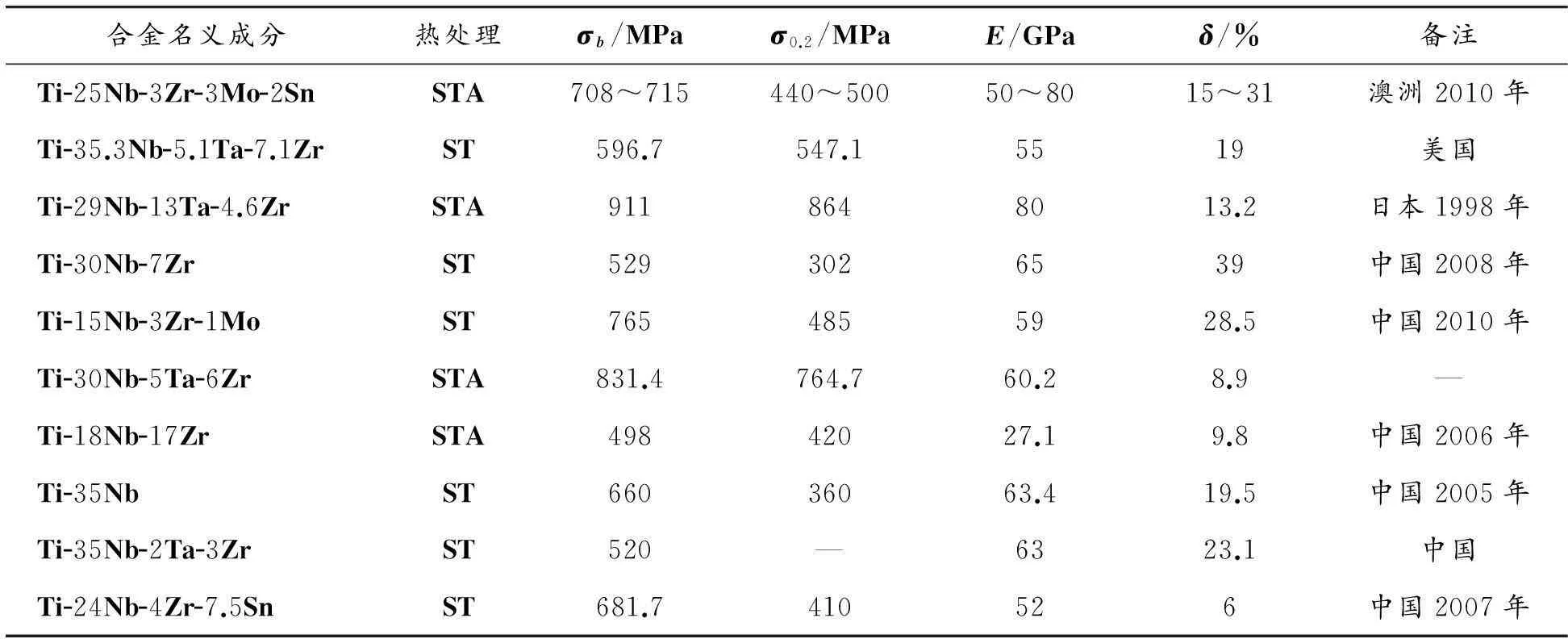
表2 现有Ti-Nb系合金的力学性能[3,10,11]
到目前为止,除了力学性能之外,国内外的研究人员对该体系合金在各种工艺处理后的显微组织、相变过程和所具备的特殊性能也十分关注。按照所添加的合金元素的不同可分为 Ti-Nb-Sn系、Ti-Nb-Ta系、Ti-Nb-Zr-Ta系和Ti-Nb-Zr-Sn系等。
1.4.1Ti-Nb-Sn体系
一定配比的Ti-Nb-Sn系合金具有较好的超弹性。文献[13]研究了掺杂4%~5%(质量分数)Sn的Ti-16Nb合金的马氏体相变及拉伸性能,结果表明:Sn量的增加可以使马氏体转变温度迅速下降,而且含Sn量越高,越可以获得较大的超弹性应变。文献[14]通过室温下拉伸试验研究了Ti- 14Nb- 4Sn和Ti-16Nb- 4Sn合金的超弹性,结果发现:锻造态和400 ℃冰水淬火态的Ti-16Nb-4Sn合金超弹性良好,通过4%变形量循环拉伸3次即可获得完全的超弹性;而400 ℃冰水淬火态的Ti-14Nb- 4Sn合金通过3%变形量循环拉伸2次即可完全回复。
另外,经相关工艺处理后的该体系合金的弹性模量较接近人骨。Ozaki等[15]研究了冷轧并经后续热处理的Ti-35Nb-4Sn合金的弹性模量和抗拉强度,结果表明:合金沿轧制方向的弹性模量降低、抗拉强度提高;经过冷轧处理的合金的主相是α″+β相,其弹性模量比较接近人骨的弹性模量,约为42 GPa,但是该合金的强度较低,为600~800 MPa。
1.4.2Ti-Nb-Ta体系
Ti-Nb-Ta体系为Ti-Nb系β钛合金中研究较广泛的一种,国内外的研究学者比较关注的是该体系合金的显微组织和力学性能。文献[16]研究了三元合金Ti-(13~26)Nb-(22~38)Ta,结果表明:合金的相变对合金的成分和冷却速率很敏感。该合金水淬后,在β相基体上可形成α″相;空冷后,可形成细小的α相和ω相。随着Nb+Ta含量的增加,马氏体的体积分数下降。另外,有研究表明:该体系合金具有超弹性和较低的弹性模量。文献[17]的研究结果表明:Ti-25Ta-25Nb合金经过适当的热机械处理后具有一定的超弹性并可获得较低的弹性模量(55 GPa)。
1.4.3Ti-Nb-Zr-Ta体系
Ti-Nb-Zr-Ta体系属于四元合金体系,合金元素种类较多,并且大多具有一定的β稳定能力,因此当合金元素含量较高时,该体系合金有利于获得完全的β相组织。例如:文献[16]在研究了三元合金Ti-(13~26)Nb-(22~38)Ta的同时,还向该合金中加入了Zr元素,研究了Ti-(13~35.5)Nb-(5~22)Ta-(4~7.2)Zr的四元合金,结果表明:加入元素Zr后可起到稳定β相、降低马氏体的转变温度和抑制ω相形成的作用。
1.4.4Ti-Nb-Zr-Sn体系
与Ti-Nb-Zr-Ta系类似,Ti-Nb-Zr-Sn体系的合金通常在水淬后可获得较高含量的β相,并且具有较低的弹性模量。例如文献[18]研究了四元合金Ti-(20~26)Nb-(2~8)Zr-(3.5~11.5)Sn,结果表明: Ti-24Nb-4Zr-7.5Sn合金水淬后由单一的β相构成,在室温条件下可获得2%的可回复弹性应变,并可获得较低的弹性模量(52 GPa)。
1.4.5其他体系
除上述4个体系外,还有一些合金因具有良好的力学性能得到了研究人员的关注。Tavares等[19]研究了Ti-Nb-Si体系医用合金,结果显示:微量Si的加入可有效抑制ω相的析出,并能稳定β相和细化晶粒。随着Si含量的增加,固溶强化效应和硬度增加,并且由于硬脆相ω相的消失,弹性模量显著降低。Ti-35Nb-0.15Si合金的弹性模量为65 GPa,较接近人骨,具有较大的应用潜力。Guo等[20]设计了Ti-30Nb-1Mo- 4Sn医用合金。由于马氏体相的存在,该合金经固溶处理后屈服强度较低(大约130 MPa),但经过冷轧和退火处理后,合金弹性模量低至45 GPa,而抗拉强度高至 1 GPa,可作为理想的医用植入材料。
2生物医用β钛合金的塑性加工和热处理工艺
2.1塑性加工
目前,对β钛合金的塑性加工主要有拉拔和冷轧2种方法。
1) 拉拔
拉拔又称拉伸、拉制,是塑性加工钛材的常用方法之一。主要方法是拉伸成形,即金属坯料在拉拔力的作用下,通过横截面积逐渐减小的拉伸模孔,获得与模孔尺寸、形状相同的制品的金属塑性成形方法。对于钛合金,如冷拉拔有困难,也可采用温拉拔。
Wang Liqiang等[21]研究了Ti-Nb-Zr系钛合金的冷拔组织与性能。该合金冷拔后未见α″相,20%冷拔后有孪晶出现。当形变率达到80%时,得到比较优异的力学性能,抗拉强度大于1.17 GPa,延伸率大于10%。
2) 冷轧
冷轧是钛材塑性加工的主要工艺,通过冷轧可以获得各种板带箔材,是目前最经济实用的塑性加工手段。冷轧变形可使钛材发生加工硬化,从而提高合金的强度。另外,一定的冷轧变形还会导致冷轧织构的形成。Ozaki等[14]研究了冷变形及热处理对Ti-35Nb-4Sn合金组织与性能的影响,研究表明:该合金经过89%冷轧后,由于出现了明显的<110>丝织构,在冷轧方向上的弹性模量只有43 GPa,经低温时效(250~300 ℃)处理后,合金的强度大幅度提高,但是由于在时效过程中有ω相的析出,导致合金的弹性模量也有较大幅度的提高。另外,MA等[22]研究了α+β型的Ti-10V-4.5Fe-1.5Al的冷轧变形行为及织构变化,该合金在60%冷轧变形后得到的β相织构为{015}<100>,{001}<210>,{112}<110>,{001}<130>和{113}<332>。到目前为止,对于生物β型钛合金的冷变形织构的研究还十分有限,需进一步探索。
钛合金在冷轧变形过程中还可能伴随相变过程,如北京科技大学曾研究了Ti-35Nb-5Ta-7Zr的冷轧变形特点,发现该合金固溶态出现了少量α″相,经90%冷轧变形后α″相消失,但产生了少量应力诱发ω相。冷轧过程中,钛合金的力学性能随着合金组织的变化而变化,其中包括位错、孪晶、亚结构等微观组织。目前,对于该方面的研究,以纯钛作为研究对象较多,对其变形机制的研究也较为系统,但对于生物医用β钛合金的研究较少。郭文渊等[23]研究了Ti-35Nb-5Ta-7Zr冷轧过程中微观组织的变化,SINGH等[24]对TNTZO合金(Ti-23Nb-0.7Ta-2Zr-O)的冷变形机理进行了研究。但对于新型β钛合金来讲,其冷变形及变形过程中微观组织的变化机理的研究尚需完善。
通过以上分析可知:对新型β钛合金进行冷轧变形,并系统深入地探讨其变形机制、微观组织及织构的演变,可为具有优异性能的β钛合金的制备提供重要的指导作用。
2.2热处理工艺
为了改善钛合金的性能,除了合金化、塑性变形外,还可进行适当的热处理。钛合金的相变原理是钛合金热处理的理论基础。钛合金能进行的热处理类型较多,如固溶、时效和再结晶退火等。
2.2.1固溶
由于固溶处理温度较高,导致合金氧化比较严重,因此在热透的前提下应尽可能缩短保温时间。一般情况下,固溶保温时间可按经验公式计算[25]:
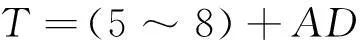
(1)
式中:T为保温时间(min);A为保温时间系数(3 min/mm);D为工作有效厚度(mm)。
对于亚稳β钛合金,经快速冷却能得到室温单一亚稳β相。将合金加热到Ts温度,由于Ts温度低于相变点,β相自由能比α相高(见图1),所以亚稳β相有向α相转变的趋势。由于能量起伏和结构起伏的作用,在起伏点上首先形成α相晶核,随着晶核的长大,合金元素从α相中被排斥出来,在其周围形成合金元素含量较高的区域。随着α相周围合金元素逐渐增加,亚稳β相逐渐稳定,当合金元素达到平衡组成时,β相不再发生相变而保存下来。自此,相变过程基本结束,此即为钛合金的时效原理[26]。
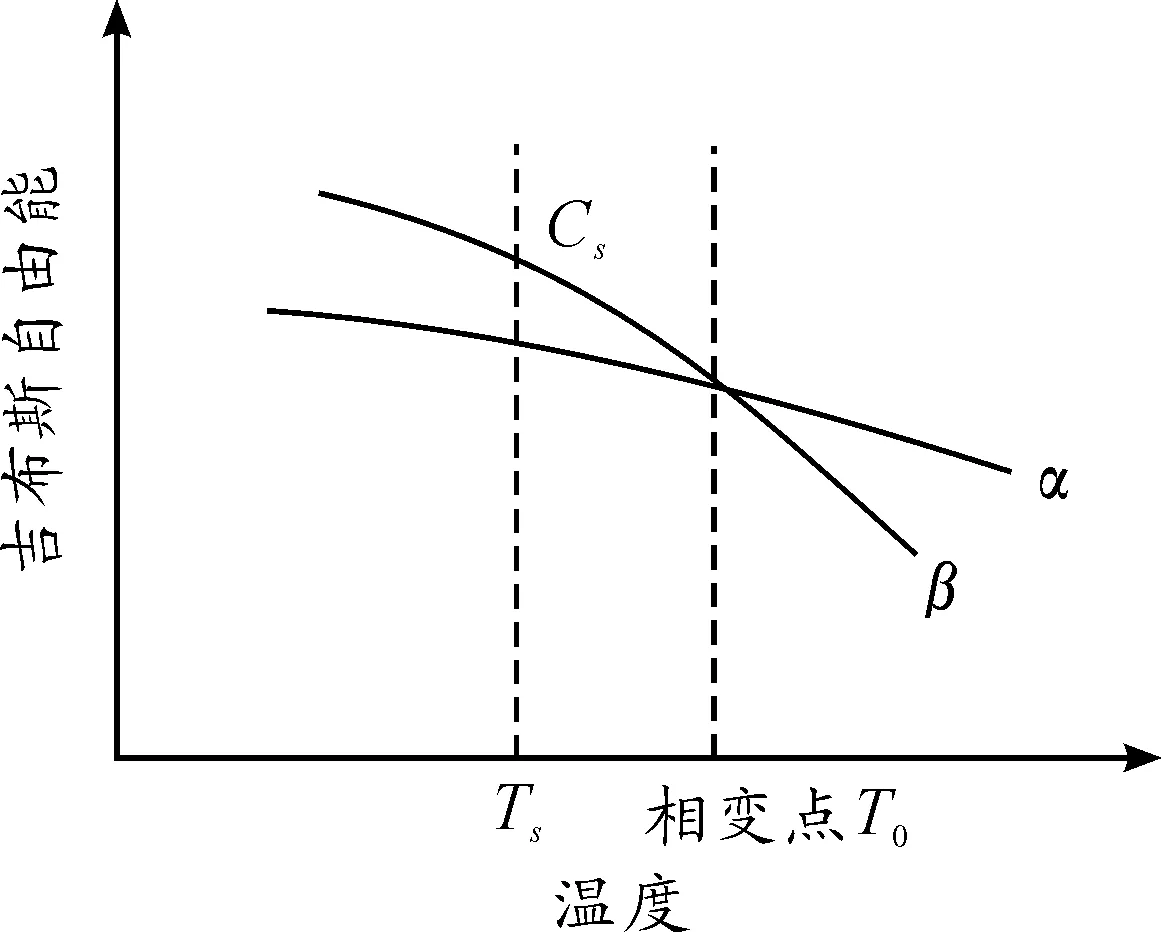
图1 钛合金α、β相自由能随温度变化示意图
由于弥散相α的析出,通过时效工艺可使合金的强度大幅度提高,但同时也会造成弹性模量的上升和塑性的下降。例如日本学者[27]1998年利用d电子合金设计理论设计的Ti-29Nb-13Ta-4.6Zr合金,在固溶处理后合金的弹性模量只有50 GPa,但其抗拉强度也较低(550 MPa),时效后由于α相的析出导致强度大幅度上升(930 MPa),但弹性模量也同步上升(80 GPa)。
2.2.2双级时效
双级时效就是对固溶处理后的合金在不同温度进行两次时效处理,即先低温预时效,然后在高温进行时效。双级时效处理工艺目前主要应用在铝合金领域。在较低温度进行预时效,目的在于在合金中获得高密度的GP区,由于GP区通常是均匀成核的,当其达到一定尺寸后,就可以成为随后沉淀相的核心,之后在稍高温度下保持一定时间进行最终时效。
目前钛合金的双级时效工艺应用较少,主要在航空航天领域。例如申请号为200810232780.7的专利涉及一种提高冷成型β钛合金时效后塑性的热处理工艺[28],对航空航天领域使用的Ti-15V-3Cr-3Sn-3Al合金采用冷变形和双级时效工艺。制备工艺为:① 将TB3合金在820℃固溶后空冷,室温下经过5%~30%冷变形;② 将冷变形后的试样在正常的时效温度(500 ℃)下保温2 h;③ 将时效温度提高到550 ℃,再保温1 h。经过该工艺处理后,合金可获得优异的力学性能,抗拉强度达到1.2 GPa,延伸率在13%以上。
对生物医用钛合金而言,关于采用双级时效工艺提高钛合金综合力学性能的专利和论著更加少见。2011年4月巴西学者[29]研究了双级时效工艺对Ti-30Nb合金组织和性能的影响,采用的工艺为:① 真空电弧熔炼;② 1 000 ℃×12 h均匀化热处理;③ 900 ℃热轧;④ 1 000℃×1 h固溶处理;⑤ 260 ℃×(1 min,2 h,4 h)+400 ℃×(1 min,20 min,30 min,1 h)处理。时效后由于ω相的析出,合金弹性模量在90~105 GPa,较时效前显著提高。在双级时效的工艺参数选择上要注意避免合金形成硬质相ω。
2.2.3冷变形后再结晶退火
再结晶退火工艺是指通过控制变形和再结晶工艺参数,调节再结晶晶粒的大小和体积分数,以达到稳定组织、消除或减小内应力和改善合金疲劳性能的目的。沈阳金属研究所[30]对Ti-24Nb-4Zr-8Sn合金采用“冷变形+再结晶退火”工艺来改善合金的组织与性能,结果表明:冷轧70%的合金板材,700 ℃发生完全再结晶,得到细小的等轴晶组织,测得力学性能为σb=810 MPa,σ0.2=380 MPa,E=53 GPa,δ=15%,综合力学性能优良。
另外,冷轧变形后进行再结晶退火是钛合金显微组织和织构形成的关键过程之一,合理地控制再结晶退火后的合金显微组织和织构类型是改善钛合金力学性能的重要途径,因此对合金再结晶织构的研究对改善合金的性能具有重大的实际意义。而目前对具有高强度和低弹性模量的生物医用β钛合金的冷变形后再结晶织构的研究还鲜见报道。
3目前国内研究存在的问题及展望
我国是一个拥有约13亿人口和6 000万残疾人的大国。据民政部门报告:我国现有的肢体不自由患者已超过1 500万,其中残肢者约800万,由类风湿引发的大骨节病患者数百万,冠心病患者已超过1 000万,牙缺损和牙缺失患者高达3亿,约占全国人口的1/4。此外,我国正步入老龄化社会,60岁以上的老年人口达1.39亿,约占全国人口的10.69%,年老体衰不断引发机体组织和器官的病变,需要及时治疗[31-32],为此要提供大量优质的生物医用材料及器件以供临床诊治的需要。我国在医用种植体方面的研究起步较晚,目前人工关节近一半需要进口,而牙科种植体更是90%以上使用进口产品,价格十分昂贵,普通工薪阶层的百姓难以承受。因此,开发无毒性、低弹性模量且价格低廉的新型植入用钛合金是一个值得研究的课题。
迄今为止,国内外的研究学者们争相对新型医用钛合金进行深入研究,设计了多种无毒并具有较低弹性模量的新型钛合金。由目前的研究成果可知:最具有应用潜力的新型钛合金为Ti-Nb系合金。与其他体系β钛合金相比,Ti-Nb系合金的弹性模量更低,更接近人骨的弹性模量,且不含有毒元素Al和V,是植入体的理想替代医用金属材料。但是现有的Ti-Nb系合金还存在一系列问题,阻碍其替代传统植入材料,例如:难以解决低弹性模量和高强度的矛盾(Ti-Nb系合金虽然弹性模量低,但是强度普遍不高);生物医用钛合金的加工工艺并不成熟(Ti-Nb系合金难以进行冷加工);在加工过程中微观组织的演变机理研究尚不完善(涉及Ti-Nb系合金的变形过程的研究偏少)等。这些问题决定了生物医用钛合金下一步研究的动向和趋势:积极探索生物医用钛合金的新型设计方法,尝试对新合金的加工工艺进行改善并研究在加工过程中微观组织(金相组织、缺陷和织构等)及其力学性能的变化和机理等。研究上述问题能为新型生物医用钛合金的发展提供试验依据,有着重要的科学价值和现实意义,可为新型医用钛合金的应用奠定理论基础。
参考文献:
[1]WANG Z G,HUANG W J,MA Y L.Micro-scale abrasive wear behavior of medical implant material Ti-25Nb-3Mo-3Zr-2Sn alloy on various friction pairs[J].Mater Sci Eng C,2014,42:211-218.
[2]KEIVAN A N,NOURI A,HILDITCH T.Mechanical properties and microstructure of powder metallurgy Ti-xNb-yMo alloys for implant materials[J].Mater Design,2015,88:1164-1174.
[3]BRANEMARK H P,HANSSON B,ADELL R,et al.Intraosseous anchorage dental prostheses:I experimental studies[J].Scand Reconstruct Surg Suppl,1977,16:1-4.
[4]ZHANG L B,WANG K Z,XU L J,et al.Effect of Nb addition on microstructure,mechanical properties and castability of β-type Ti-Mo alloys[J].Trans Nonferrous Met Soc China,2015,25:2214-2220.
[5]MAESHIMAL T,NISHIDA M.Shape memory properties of biomedical Ti-Mo-Ag and Ti-Mo-Sn alloys[J].Mater Trans,2004,45(4):1096-1100.
[6]MAESHIMA T,USHIMARU1 S,YAMAUCHI K,et al.Effects of Sn content and aging conditions on superelasticity in biomedical Ti-Mo-Sn alloys[J].Mater Trans,2006,47(3):513-517.
[7]戚玉敏,崔春翔,申玉田,等.生物医用β-钛合金[J].河北工业大学学报,2003,32(6):7-9.
[8]GORDIN D M,GLORIANT T,NEMTOI G,et al.Synthesis,structure and electrochemical behavior of a beta Ti-12Mo-5Ta alloy as new biomaterial[J].Mater Lett,2005,59(23):2959-2964.
[9]OKAZAKI Y,RAO S,TATEISHI T,et al.Cytocompatibility of various metal and development of new titanium alloys for medical implants[J].Mater Sci Eng A,1998,243(1/2):250-256.
[10]ZHOU Y L,NIINOMI M,AKAHORI T,et al.Corrosion resistance and biocompatibility of Ti-Ta alloys for biomedical applications[J].Mater Sci Eng A,2005,398(1/2):28-36.
[11]SAKAGUCHI N,NIINOMI M,AKAHORI T,et al.Effect of Ta content on mechanical properties of Ti-30Nb-XTa-5Zr[J].Mater Sci Eng C,2005,25(3):370 -376.
[12]郝玉琳,杨锐.高强度多功能Ti-Nb-Zr-Sn合金[J].中国基础科学研究进展,2007(5):19-20.
[13]TAKAHASHI E,SAKURAI T,WANANABE S,et al.Effect of heattreatment and Sn content on superelasticity in biocompatible TiNbSn alloys[J].Mater Trans,2002,43(12):2978-2983.
[14]王涛,戴品强,项忠楠,等.生物医用Ti-Nb-Sn合金的超弹性[J].材料科学与工程学报,2008,26(6):940-945.
[15]OZAKI T,MATSUMOTO H,WATANABE S,et al.Beta Ti alloyswith low Young’s modulus[J].Mater Trans,2004,45(8):2776-2779.
[16]TANG X,AHMED T,RACK H J.Phase tansformations in Ti-Nb-Ta and Ti-Nb-Ta-Zr alloys[J].J Mater Sci,2000,35(7):1805-1811.
[17]BERTRAND E,GLORIANT T,GORDIN D M.Synthesis and characterisation of a new superelastic Ti-25Ta-25Nb biomedical alloy[J].J Mech Behav Biomed,2010,3(8):559-564.
[18]HAO Y L,LI S J,SUN S Y,et al.Effect of Zr and Sn on Young’s modulus and super-elasticity of Ti-Nb-based alloys[J].Mater Sci Eng A,2006,441(1/2):112-118.
[19]TAVARESA A M G,RAMOSA W S,BLASB J C G,et al.Influence of Si addition on the microstructure and mechanical properties of Ti-35Nb alloy for applications in orthopedic implants[J].J Mech Behav Biomed,2015,51:74-87.
[20]GUO S,MENG Q K,CHENG X N,et al.Microstructural evolution and mechanical behavior of metastable β-type Ti-30Nb-1Mo-4Sn alloy with low modulus and high strength[J].Progress in Natural Science:Materials International,2015,25(5):414-418.
[21]WANG L Q,YANG G J,YANG H B,et al.Microstructure and mechanical properties of TiNbZr alloy during cold drawing[J].Rare Metal Mat Eng,2009,38(4):0579-0582.
[22]MA X M,SUN W.Characterization of deformation localization in cold-rolled metastable β-Ti-Nb-Ta-Zr alloy[J].J Alloy Compd,2011,509:S294-S298.
[23]郭文渊,邢辉,孙坚.亚稳态β钛合金冷旋锻形变组织的EBSD和TEM研究[J].电子显微学报,2008,27(6):469-472.
[24]SINGH A K,BHATTACHARJEE A,GOGIA A K.Microstructure and texture of rolled and annealed β titanium alloy Ti-10V-4.5Fe-1.5Al[J].Mater Sci Eng A,1999,270(2):225-230.
[25]王荣滨.钛合金热处理强化与应用[J].有色金属与稀土应用,2004(4):1-6.
[26]王春建,蒋业华,周荣,等.新型生物钛合金时效处理组织演变[J].特种铸造及有色合金,2007,27(10):816-818.
[27]AHN H,LEE D,LEE K M,et al.Oxidation behavior and corrosion resistance of Ti-10Ta-10Nb alloy[J].Surf Coat Tech,2008,202(22/23):5784-5789.
[28]孙巧燕,宋振亚.一种提高冷成型β钛合金时效后塑性的热处理工艺[P].200810232780.7.2009-05-20.
[29]LOPESA E S N,CREMASCOA A.Effects of double aging heat treatment on the microstructure,Vickers hardness and elastic modulus of Ti-Nb alloys[J].Mater Charact,2011,62(7):673-680.
[30]崔天成,李述军,郝玉琳,等.热处理对 Ti2448 合金冷轧板组织和性能的影响[J].材料研究学报,2009,22(3):225-229.
[31]LI S J,YANG R,NIINOMI M.Phase transformation during aging and resulting mechanical properties of two Ti-Nb-Ta-Zr alloys[J].Mater Sci Tech,2005,21(6):678-686.
[32]草道英武.金属钛及其应用[M].北京:冶金工业出版社,1989.
(责任编辑陈艳)
Present Status and Processing Methods of Novel β Titanium Alloys for Biomedical Applications
DAI Shi-juan1, 2, ZHU Yun-tian1, CHEN Feng2
(1.Nano Structural Materials Center, Nanjing University of Science & Technology,Nanjing 210094, China; 2.School of Materials Science & Technology,Southeast University, Nanjing 211102, China)
Abstract:A sketch of the development history of the biomedical titanium alloys was given and it divided it into Ti-Mo, Ti-Zr, Ti-Ta and Ti-Nb system based on alloy elements. The research status of the studied β titanium alloys was reviewed and the developments of Ti-Nb titanium alloys were introduced in detail. The plastic working and heat treatment of titanium alloys were summarized, and the problems were proposed for the studied β titanium alloys and the development trend was prospected for the new β titanium alloys. The analysis result shows that according to the needs of market and social development, the prospects for biomedical titanium alloys are cheerful and it is necessary to develop new β titanium alloys for clinical practice.
Key words:β titanium alloy; processing method; mechanical property
文章编号:1674-8425(2016)04-0027-08
中图分类号:TG139
文献标识码:A
doi:10.3969/j.issn.1674-8425(z).2016.04.006
作者简介:戴世娟(1982—),女,讲师,主要从事纳米结构材料研究。
基金项目:国家自然科学基金资助项目(51005115);江苏省博士后科研资助计划项目(1402008A)
收稿日期:2015-12-22
引用格式:戴世娟,朱运田,陈锋.新型医用β钛合金研究的发展现状及加工方法[J].重庆理工大学学报(自然科学),2016(4):27-34.
Citation format:DAI Shi-juan, ZHU Yun-tian, CHEN Feng.Present Status and Processing Methods of Novel β Titanium Alloys for Biomedical Applications[J].Journal of Chongqing University of Technology(Natural Science),2016(4):27-34.

