β连环蛋白翻译后修饰与肾间质纤维化
肖 争 综述 李 瑛 审校
·肾脏病基础·
β连环蛋白翻译后修饰与肾间质纤维化
肖 争 综述 李 瑛 审校
β连环蛋白(β-catenin)在细胞中具有双重作用,一是参与钙黏蛋白(cadherin)介导的细胞间的黏附作用,二是作为经典wnt信号通路中最重要的信息分子,调控细胞生长、分化和凋亡等。β-catenin能发生多种蛋白翻译后修饰,如磷酸化、泛素化、乙酰化,影响其自身稳定性、细胞定位及活性,进而介导E-cadherin/β-catenin复合物完整性,并调节Wnt/β-catenin信号通路,调控β-catenin靶基因的表达,最终影响肾间质纤维化的发生发展过程。
β-catenin 蛋白翻译后修饰 肾间质纤维化
肾间质纤维化(RIF)是指在各种致病因子如炎症、药物、糖尿病和遗传因素等作用下,募集并激活成纤维母细胞,细胞外基质(ECM)增多,导致肾小管间质的纤维化[1]。成纤维母细胞有一部分是由肾小管上皮细胞向肌成纤维细胞转分化(EMT)形成,转分化后的肾小管上皮细胞E钙黏蛋白(E-cadherin)表达缺失,并产生大量α平滑肌肌动蛋白(α-SMA),加重肾间质纤维化[2]。肾间质纤维化及瘢痕组织的形成是各种慢性肾脏病进展至终末期肾衰竭的最终共同通路,与肾小球硬化相比,肾间质纤维化程度与肾功能减退的相关性更为密切[3]。许多细胞因子和信号通路可促进肾间质纤维化,如TGF-β/Smad、Wnt/β-catenin、PI3K/AKT等,但肾间质纤维化的发展机制尚不清楚[4]。
大量研究证实Wnt/β-catenin 通路在肾间质纤维化的发生发展中发挥着重要作用[5],β连环蛋白(β-catenin)是Wnt信号传导途径中重要的“调节子”[6]。Wnt信号激活后,糖原合成酶激酶3β(GSK-3β)磷酸化,使自身活性受抑制,进而激活转录复合体β-catenin/TCF促进EMT的发生,致使肾间质纤维化[7]。β-catenin作为以上通路的关键下游信号分子,无疑在肾间质纤维化中扮演着举足轻重的角色。β-catenin蛋白能发生多种化学修饰 ,如磷酸化、 泛素化、 乙酰化、类泛素化和甲基化等,影响自身稳定性、细胞定位及活性,进而调节以上通路,最终影响肾间质纤维化的发生发展过程。深入研究β-catenin蛋白化学修饰与肾间质纤维化的关系 ,可为抗肾脏纤维化的治疗提供新的可能途径及干预靶点。
β-catenin结构及生物特性
β-catenin最早作为一种黏附因子被发现,后来人们发现β-catenin还是一种多功能的蛋白质。β-catenin由12个中间连接臂(arm)重复区及独特的氨基(N)末端和羧基(C)末端结构组成(图1)[8]。N末端含有约150个氨基酸,富含Ser/Thr残基,负责调控β-catenin的稳定性。重复区是β-catenin与多种配体结合的主要部位,也是β-catenin最保守的区域, 约含550个氨基酸,12个相邻的arm重复序列组合在一起形成不对称的超螺旋结构, 可使β-catenin与上皮细胞钙黏蛋白、T细胞转录因子(TCF)、淋巴增强因子(LEF)、 结肠腺息肉蛋白(APC)、 轴蛋白(Axin)等重要分子结合,发挥其细胞黏附与传导细胞间信号的功能;C末端是β-catenin 与转录活化因子结合的场所, 包含约100个氨基酸, 呈较强的酸性, 调节下游靶基因的转录[9]。
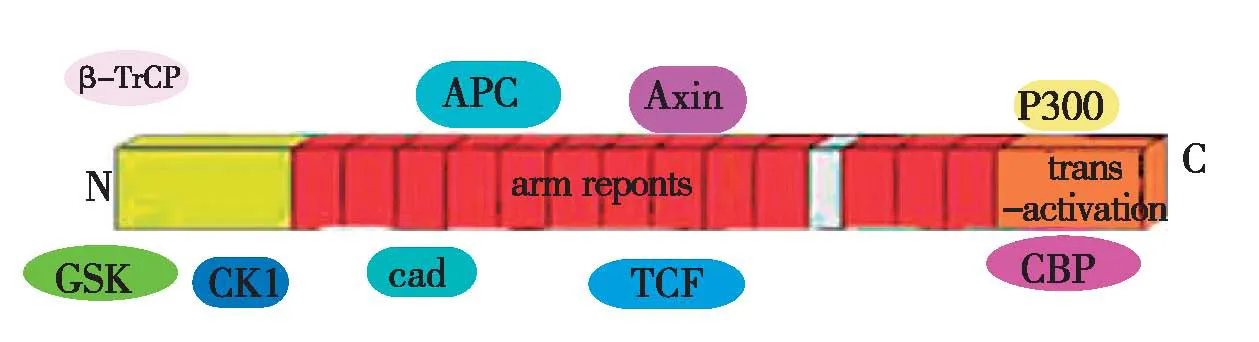
图1 β-catenin的结构示意图[8]β-TrCP:β转导重复相容蛋白;APC:结肠腺瘤息肉;Axin:轴蛋白;GSK:糖原合酶激酶;CK1:酪蛋白激酶;cad:钙黏蛋白;TCF:T细胞因子;CBP:cAMP-结合蛋白;β-catenin 蛋白由中间连接臂(arm)重复区及独特的氨基端、羧基端构成arm重复序列能够与cadherins,APC 和TCF转录因子家族等蛋白结合;GSK 和 CK1 与β-catenin氨基末端结合控制着β-catenin的稳定性; CBP/P300 与β-catenin 羧基末端结合对下游靶基因进行调控
在细胞内,β-catenin具有两个定位池,一个是位于细胞膜,另一个则在细胞质。在静息状态下,主要定位于细胞膜的少量游离的β-catenin可被胞质内的蛋白酶系统所降解。β-catenin在细胞中具有双重作用:一是通过与细胞膜上钙黏蛋白(cadherin)相互作用,参与细胞间黏附。 另一作用是作为经典wnt信号通路中最重要的信息分子,调控细胞生长、分化和凋亡等[6](图2)。
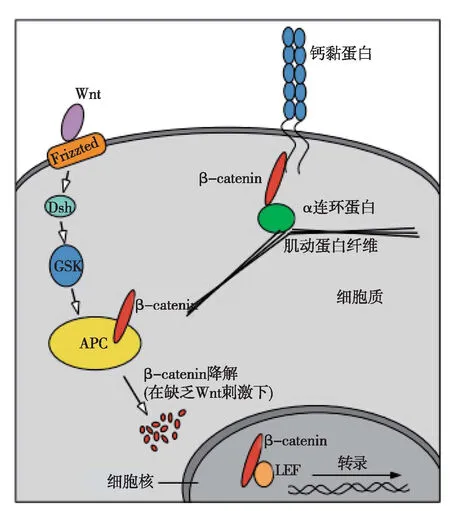
图2 β-catenin在细胞黏附和信号传导中的作用[9]Frizzted:卷曲蛋白;Dsh:蓬乱蛋白;GSK:糖原合酶激酶;APC:结肠腺瘤息肉;β-catenin:β连环蛋白;LET:淋巴增强因子;β-catenin与cadherin组成细胞黏连复合物,而且β-catenin在Wnt生长因子信号通路中也发挥重要作用,其作为一个靶基因的转录共激活因子参与细胞的增殖与分化,Wnt信号调控β-catenin在细胞质内的表达水平,只有当β-catenin高表达时,β-catenin才能进入细胞核内参与对靶基因转录的调控
与肾间质纤维化相关的Wnt/β-catenin信号通路的靶基因
以往有大量研究致力于寻找与肾脏纤维化相关的Wnt/β-catenin靶基因,至今已有部分靶基因被证实:纤维连接蛋白(FN),成纤维特异性蛋白1(Fsp1),Snail1,基质金属蛋白酶7(MMP-7),纤溶酶原激活物抑制剂1(PAI-1)和肾素-血管紧张素系统(RAS)的成分。
众所周知,FN为ECM的主要成分,而Fsp1为纤维母细胞和肌成纤维细胞重要标志[4]。两者在纤维化中起着重要的作用。
锌指蛋白转录因子Snail1活化以及持续高表达对于纤维化的进展和炎症细胞浸润是至关重要的。Snail1活化致使肾脏上皮的标志分子(Cadh1,Cadh16)表达下调,部分上皮细胞α平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(Col-Ⅰ)表达上调, 发生EMT;而且在典型的纤维化模型-梗阻肾(UUO)小鼠中,敲除Snail1可恢复肾脏形态和功能[10]。另一方面,β-catenin高表达后可诱导肾小管上皮细胞表达Snail1,促进EMT形成[11]。
MMP-7是含有Zn2+且活性依赖Ca2+的中性蛋白水解酶,它不仅能够降解机体ECM的各种蛋白成分,而且还能介导E-cadherin脱落,促使EMT发生[12]。既往研究证实受损肾脏中MMP-7的表达主要由β-catenin调控;而且,尿MMP-7可作为预测Wnt/β-catenin通路活性的一种生物标记,它和肾脏纤维化程度密切相关[13]。
PAI-1可通过诱导TGF-β表达,募集炎症细胞和肌纤维细胞致纤维化,在肾间质纤维化中扮演着重要的角色[14]。研究发现PAI-1启动子有结合TCF/LEF的区域,而且无论是TGF-β还是Wnt活化介导的β-catenin高表达,均可导致PAI-1在肾小管上皮细胞中高表达。而敲除PAI-1上与TCF/LEF结合的区域,这种诱导作用消除,这表明PAI-1的表达受到β-catenin的调控[7]。
RAS有几个关键成分,包括血管紧张素原、肾素、血管紧张素Ⅱ受体、血管紧张素转化酶(ACE),其中肾素和ACE最重要,可生成RAS活性肽-血管紧张素Ⅱ(AngⅡ)。既往研究证实RAS表达上调可造成肾脏损害,并且在肾脏损伤的病理过程中,RAS各成分表达均上调[15]。Zhou等[16]研究发现RAS基因含有TEF/LEF结合部位,为经典的Wnt/β-catenin通路直接调控靶点,其中β-catenin是影响RAS所有成分表达的主要“调节子”。
β-catenin磷酸化与肾间质纤维化
β-catenin的磷酸化修饰可显著地影响其稳定性及与DNA的结合力,进一步调控自身的脱落、降解、核转位以及转录活性。
胞膜上的β-catenin磷酸化与肾间质纤维化 β-catenin在胞膜与E-cadherin结合形成稳定的复合物介导细胞间连接,肾小管上皮细胞E-cadherin/β-catenin复合物表达下降是其发生EMT获得间叶特征的关键步骤[17]。在细胞膜的黏附连接处,β-catenin 与E-cadherin的结合状态受到磷酸化修饰的调控。
胞膜上β-catenin的主要磷酸化位点包括Y654、T120、Y64、Y86、S552、S663、S675、Y142、Y489、Y331/Y333。研究表明蛋白激酶A(PKA)诱导β-catenin的Y654位点磷酸化,破坏E-cadherin/β-catenin复合物完整性,促使肾小管上皮细胞向肌成纤维细胞转分化,进而介导肾间质纤维化的发生[18];而且PKA可促使β-catenin S675 位点磷酸化,增强β-catenin和cAMP应答元件结合蛋白的辅激活蛋白(CBP) 结合,促进靶基因转录[19]。又有研究证实端锚聚合酶介导β-catenin的S552位点磷酸化,减弱β-catenin与E-cadherin蛋白结合能力,使β-catenin从E-cadherin/β-catenin复合体中解离,胞质内游离的β-catenin增加,进而入核,介导肾间质纤维化[20]。
胞质的β-catenin磷酸化与肾间质纤维化的关系 在细胞质中,酪蛋白激酶1a(CK1a)使β-catenin氨基端Ser45磷酸化。在此基础上,GSK-3β进一步将β-catenin上的Thr41、Ser37和Ser33位点磷酸化,磷酸化的Ser37和Ser33被转导重复相容蛋白(β-transducing repeat containing protein,β-TrCP)识别,随后经泛素-蛋白酶体途径降解[21]。当细胞受到Wnt 信号刺激时,胞质内的Dsh蛋白激活,Axin/APC/GSK-3β/CK1a降解复合体被破坏,细胞内的 β-catenin 稳定性增加,继而进入细胞核内,与TCF/LEF结合,启动下游靶基因(如 FN, Col-Ⅰ,MMP7 等),最终促进肾间质纤维化的发生[7]。
既往研究证实在肾间质纤维化大鼠模型中,β-catenin磷酸化水平存在不同程度的下降[22]。环孢素A可介导HK-2细胞内GSK-3β磷酸化,降低β-catenin磷酸化水平,促使其入核,上调下游靶基因Snail1的表达,抑制E-cadherin的表达,导致EMT发生,最终肾脏纤维化[2]。且Arellanes-Robledo等[23]研究表明乙醛可下调β-catenin磷酸化水平,促进乙醛相关的纤维化发生。有研究也证实NCTD可增加β-catenin磷酸化水平,减少β-catenin入核,进而改善肾间质纤维化(结果尚未发表)。Rac1属于Ras 超家族蛋白中Rho亚家族的一员,其参与了细胞骨架的重构、基因转录调控及信号传导通路,在致肺纤维化过程中,Rac1 被认为是极为重要的调控因子[24]。研究表明Rac1可介导β-catenin上特定丝氨酸-S191A 和S605A磷酸化,促进β-catenin与LEF结合,激活Wnt靶基因,但其是否在肾间质纤维化中起作用,尚不清楚[25]。以上可说明β-catenin磷酸化水平很大程度影响着肾间质纤维化的进展。
β-catenin泛素化与肾间质纤维化
游离态β-catenin被降解的关键步骤是其泛素化过程。蛋白的泛素化由泛素激活酶E1(E1)、泛素结合酶E2(E2)和泛素连接酶E3(E3)共同完成,是一个蛋白级联反应。目前已明确有两种泛素化途径参与β-catenin 降解,一种途径依赖于β-catenin磷酸化,Skp-CDC53-F-box(SCF)复合物的RING结构域家族的泛素连接酶 E3在这个过程中起重要作用;另一种途径不依赖于β-catenin磷酸化,而是直接与F-Box蛋白上的TBL1/Ebi 结合,由另一个类似于SCF复合物的E3酶(由Skp1、APC、SIP 组成)介导其泛素化[26]。但是经典的泛素化途径是依赖于磷酸化的。在Wnt 不存在的情况下,β-catenin 被GSK-3β磷酸化,与F-box蛋白β-TrCP重复序列结合;随后,β-TrCP招募SCF 泛素连接酶复合物,介导β-catenin泛素化;最后,泛素化的β-catenin被26s蛋白酶体降解,使细胞质内的β-catenin 的持续减少,不能入核,Wnt 信号通路的传导被抑制;反之,当Wnt信号激活后,β-catenin泛素化降解减少,在胞质内富集并向细胞核内转移,启动Wnt靶基因的表达[7]。
研究证实增加β-catenin泛素化水平会抑制EMT发生,改善肾间质纤维化[27]。He等[13,28]的体内实验表明,在纤维化肾组织中β-catenin泛素化水平降低,表达下降;体外实验证实,激活Wnt/β-catenin信号途径后,β-catenin泛素化减少,许多致纤维化因子的表达上调,如锌指转录因子Snail1、PAI-1、MMP-7和Fn。以上研究说明,β-catenin泛素化水平上升后可改善肾间质纤维化。
既往研究证实多种蛋白均可影响β-catenin泛素化水平,进而促进或者抑制Wnt/β-catenin信号通路。去泛素化酶USP47/UBP64E能通过与β-catenin羧基末端结合抑制β-catenin泛素化,也可通过与β-catenin竞争性结合β-Trp,降低β-catenin泛素化水平,进而激活Wnt/β-catenin靶基因[29]。核转录因子κB(NF-κB)是介导炎症反应的关键信号分子,其通过诱导Smad泛素化调节因子1(Smurf1)和Smad泛素化调节因子1(Smurf2)的产生,促进β-catenin泛素化降解[30]。而泛素接合酶Rad6B可诱导β-catenin特定赖氨酸-K394泛素化降解[31]。 虽然以上蛋白介导的β-catenin泛素化在肾间质纤维化的作用尚不清楚,却为探讨肾间质纤维化的发病机制提供了多种思路。
β-catenin乙酰化与肾间质纤维化
“乙酰化”是改变蛋白质功能最主要的修饰方式之一。真核细胞80%~90% 的蛋白质有乙酰化,包括组蛋白和非组蛋白。β-catenin乙酰化是在乙酰转移酶催化下将Acetyl CoA的乙酰基转移到β-catenin侧链基团上。该过程是可逆的,在组蛋白去乙酰化酶(HDACs)催化下又可以去掉乙酰基。已鉴定的乙酰转移酶有P300/CBP (CREB-binding protein)家族、MYST家族、GN AT超家族、TAFII230/250 家族、P160家族等。其中P300/CBP为通用的赖氨酸乙酰转移酶,可介导β-catenin乙酰化。
经典Wnt信号活化后,β-catenin降解减少,其在细胞质内富集并向细胞核内转移,与TCF/LEF结合,随后募集CBP或者p300蛋白及其他基础转录复合物成分,形成转录激活复合物,增加β-catenin乙酰化水平,进而正向调控β-catenin靶基因转录[32]。NFAT5可通过干预β-catenin与p300/CBP的相互作用抑制β-catenin乙酰化,降低β-catenin的转录活性[33]。也有研究表明,小分子抑制剂ICG-001能抑制β-catenin/CBP的相互作用,降低β-catenin乙酰化水平,下调β-catenin靶基因-成纤维细胞特异蛋白(FSP1),cyclin D1和 survivin等的表达,改善肾间质纤维化[34]。Hao等[32]研究发现ICG-001能特异性抑制β-catenin/CBP信号通路(对β-catenin/p300相互作用无影响),下调β-catenin乙酰化水平,降低一连串纤维化基因的表达,如PAI-1、α-SMA、Snail1、Snail2(在介导EMT与肾间质纤维化中起关键作用的两个转录因子)、FSP1,抑制肾小管EMT的发生,改善梗阻性肾病肾间质纤维化。他们还证实了ICG-001通过抑制β-catenin/CBP信号通路,可阻断TGF-β1诱导的肾间质纤维化。而且近几年有研究证实在高血糖刺激可通过增加p300乙酰转移酶的活性并减少依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白脱乙酰酶(SIRT1)的活性,导致β-catenin N-末端的lysine345乙酰化,促进β-catenin/LEF-1复合物形成,提高β-catenin靶基因的转录活性[35]。
小结:β-catenin作为一种多功能蛋白质,其稳定性和活性受到多种蛋白翻译后化学修饰调节,并在调控介导肾间质纤维化的信号传导通路中起关键作用。但目前对β-catenin的化学修饰在肾间质纤维化中的作用及其调控机制尚未完全阐明,同时β-catenin其他形式化学修饰和这些化学修饰之间的相互联系与介导肾间质纤维化的信号传导通路的相互作用均需要进一步研究证实。随着对β-catenin蛋白不断深入了解,有望从β-catenin蛋白翻译后修饰途径寻找抗肾间质纤维化治疗的研究方向。
1 Lu J,Shi J,Li M,et al.Activation of AMPK by metformin inhibits TGF-β-induced collagen production in mouse renal fibroblasts.Life Sci,2015,127:59-65.
2 Berzal S,Alique M,Ruiz-Ortega M,et al.GSK,snail,and adhesion molecule regulation by cyclosporine A in renal tubular cells.Toxicol Sci,2012,127(2):425-437.
3 Wang L,Li CL,Wang L,et al.Influence of CXCR4/SDF-1 axis on E-cadherin/β-catenin complex expression in HT29 colon cancer cells.World J Gastroenterol,201,17(5):625-632.
4 Liu Y.Cellular and molecular mechanisms of renal fibrosis.Nat Rev Nephrol,2011,7(12):684-696.
5 Dang Y,Liu B,Xu P,et al.Gpr48 deficiency induces polycystic kidney lesions and renal fibrosis in mice by activating Wnt signal pathway.PLoS One,2014,9(3):e89835.
6 Moura RS,Carvalho-Correia E,daMota P,et al.Canonical Wnt signaling activity in early stages of chick lung development.PLoS One,2014,9(12):e112388.
7 Tan RJ,Zhou D,Zhou L,et al.Wnt/β-catenin signaling and kidney fibrosis.Kidney Int Suppl (2011),2014,4(1):84-90.
8 Sun J,Weis WI.Biochemical and structural characterization of β-catenin interactions with nonphosphorylated and CK2-phosphorylated Lef-1.J Mol Biol,2011,405(2):519-530.
9 Shapiro L.The multi-talented beta-catenin makes its first appearance.Structure,1997,5(10):1265-1268.
10 Grande MT,Sánchez-Laorden B,López-Blau C,et al.Snail1-induced partial epithelial-to-mesenchymal transition drives renal fibrosis in mice and can be targeted to reverse established disease.Nat Med,2015,21(9):989-997.
11 García de Herreros A,Baulida J.Cooperation,amplification,and feed-back in epithelial-mesenchymal transition.Biochim Biophys Acta,2012,1825(2):223-228.
12 Zhou D,Tan RJ,Zhou L,et al.Kidney tubular β-catenin signaling controls interstitial fibroblast fate via epithelial-mesenchymal communication.Sci Rep,2013,3:1878.
13 He W,Tan RJ,Li Y,et al.Matrix metalloproteinase-7 as a surrogate marker predicts renal Wnt/β-catenin activity in CKD.J Am Soc Nephrol,2012,23(2):294-304.
14 Hamasaki Y,Doi K,Maeda-Mamiya R,et al.A 5-hydroxytryptamine receptor antagonist,sarpogrelate,reduces renal tubulointerstitial fibrosis by suppressing PAI-1.Am J Physiol Renal Physiol,2013,305(12):F1796-1803.
15 Cao W,Zhou QG,Nie J,et al.Albumin overload activates intrarenal renin-angiotensin system through protein kinase C and NADPH oxidase-dependent pathway.J Hypertens,2011,29(7):1411-1421.
16 Zhou L,Mo H,Miao J,et al.Klotho Ameliorates Kidney Injury and Fibrosis and Normalizes Blood Pressure by Targeting the Renin-Angiotensin System.Am J Pathol,2015,185(12):3211-3223.
17 Galván JA,Astudillo A,Vallina A,et al.Prognostic and diagnostic value of epithelial to mesenchymal transition markers in pulmonary neuroendocrine tumors.BMC Cancer,2014,14:855.
18 van Veelen W,Le NH,Helvensteijn W,et al.β-catenin tyrosine 654 phosphorylation increases Wnt signalling and intestinal tumorigenesis.Gut,2011,60(9):1204-1212.
19 Spirli C,Locatelli L,Morell CM,et al.Protein kinase A-dependent pSer(675) -β-catenin,a novel signaling defect in a mouse model of congenital hepatic fibrosis.Hepatology,2013,58(5):1713-1723.
20 Jung HJ,Kim SY,Choi HJ,et al.Tankyrase-mediated β-catenin activity regulates vasopressin-induced AQP2 expression in kidney collecting duct mpkCCDc14 cells.Am J Physiol Renal Physiol,2015,308(5):F473-486.
21 Sineva GS,Pospelov VA.Inhibition of GSK3beta enhances both adhesive and signalling activities of beta-catenin in mouse embryonic stem cells.Biol Cell,2010,102(10):549-560.
22 Wang W,Li F,Sun Y,et al.Aquaporin-1 retards renal cyst development in polycystic kidney disease by inhibition of Wnt signaling.FASEB J,2015,29(4):1551-1563.
23 Arellanes-Robledo J,Reyes-Gordillo K,Shah R,et al.Fibrogenic actions of acetaldehyde are β-catenin dependent but Wingless independent:a critical role of nucleoredoxin and reactive oxygen species in human hepatic stellate cells.Free Radic Biol Med,2013,65:1487-1496.
24 Lin CH,Shih CH,Tseng CC,et al.CXCL12 induces connective tissue growth factor expression in human lung fibroblasts through the Rac1/ERK,JNK,and AP-1 pathways.PLoS One,2014,9(8):e104746.
25 Jamieson C,Lui C,Brocardo MG,et al.Rac1 augments Wnt signaling by stimulating β-catenin-lymphoid enhancer factor-1 complex assembly independent of β-catenin nuclear import.J Cell Sci.2015 Nov 1;128(21):3933-46.
27 Zhang L,Zhou F,Li Y,et al.Fas-associated factor 1 is a scaffold protein that promotes β-transducin repeat-containing protein (β-TrCP)-mediated β-catenin ubiquitination and degradation.J Biol Chem,2012,287(36):30701-30710.
28 He W,Kang YS,Dai C,et al.Blockade of Wnt/β-catenin signaling by paricalcitol ameliorates proteinuria and kidney injury.J Am Soc Nephrol,2011,22(1):90-103.
29 Shi J,Liu Y,Xu X,et al.Deubiquitinase USP47/UBP64E Regulates β-Catenin Ubiquitination and Degradation and Plays a Positive Role in Wnt Signaling.Mol Cell Biol,2015,35(19):3301-3311.
30 Chang J,Liu F,Lee M,et al.NF-κB inhibits osteogenic differentiation of mesenchymal stem cells by promoting β-catenin degradation.Proc Natl Acad Sci U S A,2013,110(23):9469-9474.
31 Gerard B,Sanders MA,Visscher DW,et al.Lysine 394 is a novel Rad6B-induced ubiquitination site on beta-catenin.Biochim Biophys Acta,2012,1823(10):1686-1696.
32 Hao S,He W,Li Y,et al.Targeted inhibition of β-catenin/CBP signaling ameliorates renal interstitial fibrosis.J Am Soc Nephrol,2011,22(9):1642-1653.
33 Wang Q,Zhou Y,Rychahou P,et al.NFAT5 represses canonical Wnt signaling via inhibition of β-catenin acetylation and participates in regulating intestinal cell differentiation.Cell Death Dis,2013,4:e671.
34 Henderson WR Jr,Chi EY,Ye X,Nguyen C,et al.Inhibition of Wnt/beta-catenin/CREB binding protein (CBP) signaling reverses pulmonary fibrosis.Proc Natl Acad Sci U S A,2010,107(32):14309-14314.
35 García-Jiménez C,García-Martínez JM,Chocarro-Calvo A,et al.A new link between diabetes and cancer:enhanced WNT/β-catenin signaling by high glucose.J Mol Endocrinol,2013,52(1):R51-66.
(本文编辑 青 松 春 江)
Post-translational modification of β-catenin and renal interstitial fibrosis
XIAOZheng,LIYing
DepartmentofNephrology,SecondXiangyaHospital,CentralSouthUniversity,Changsha410011,China
β-catenin plays a dual role in cells, is not only involved in cadherin-mediated intercellular adhesion, but also as the most important information molecules in classical Wnt signaling pathway, regulates cell growth, differentiation and apoptosis. β-catenin can be modified by phosphorylation, ubiquitylation and acetylation. These post-translational modifications influence the stability, translocation and activity of β-catenin as to mediate E-cadherin/β-catenin complex integrity and regulate the Wnt/β-catenin signaling pathway, influencing the expression of β-catenin target genes. And then they affect the progression of renal interstitial fibrosis.
β-catenin post-translational modification renal interstitial fibrosis
10.3969/cndt.j.issn.1006-298X.2016.03.014
国家自然科学基金(81100486和81370792),湖南省科技计划项目(2013SK3036),中华医学会临床医学专项资金(13030400425)
中南大学湘雅二医院肾内科(长沙,410011)
2015-09-21

