“软模板”法调控胶原的仿生矿化研究
李 娜,罗学仕,叶碧华,李志文,吴 狄,李立华,李 红,周长忍
(暨南大学 材料科学与工程系,人工器官与材料教育部工程中心,广州 510632)
“软模板”法调控胶原的仿生矿化研究
李娜,罗学仕,叶碧华,李志文,吴狄,李立华,李红,周长忍
(暨南大学 材料科学与工程系,人工器官与材料教育部工程中心,广州 510632)
摘要:在模拟体内pH值=7.4的胶原溶胶-凝胶体系中,加入β-甘油磷酸钠(β-GP)作为矿化的磷源,并引入聚丙烯酸(PAA)和三聚磷酸钠(TPP)作为“软模板”模拟体内非胶原蛋白DMP-1的N端和C端的隔离功能域,调控Ⅰ型胶原的矿化,构建了纳米羟基磷灰石/胶原(n-HA/COL)复合支架材料。并以人脐带间充质干细胞hUMSCs作为种子细胞,探究了其对细胞的粘附、增殖、分化的影响。结果表明,胶原纤维组织与矿化同步进行,陈化处理有利于羟基磷灰石(HAp)晶体的结晶。自组装HAp纳米微粒不仅在胶原纤维外部沉积,也可以在原胶原分子上及胶原微纤维的末端被发现,同时纳米磷酸钙盐沿着胶原微纤维的圆柱形表面分布。细胞培养表明n-HA/COL并没有明显促进hUMSCs细胞的增殖,但能够诱导hUMSCs向成骨细胞分化,促进成骨细胞AKP的表达,并且n-HA/COL复合支架材料与成骨诱导液(OICM)联用时诱导效果更加显著。这种以“bottom-up”深度矿化方法为骨支架材料的制备提供了新思路,n-HAp/collagen复合材料有望用于骨组织填充修复。
关键词:胶原;矿化;聚丙烯酸;三聚磷酸钠
0引言
Ⅰ型胶原是结缔组织中极其重要的结构蛋白质,因而广泛应用于生物材料领域。胶原蛋白作为“硬模板”有机基底矿化生成羟基磷灰石的过程并不是简单的物理沉积。矿化过程中确实存在着—COO…Ca的配位螯合作用,胶原纤维上的—COOH是形成HAp主要的成核位点[1]。最近的研究表明,胶原纤维的矿化过程首先是形成纳米级液相的无定形磷酸钙(ACP)前驱体并进入胶原纤维的内部[2],然后ACP前驱体在胶原纤维内部均相成核转变成HAp[3],但胶原纤维自身并不能克服均相成核中的热力学壁垒障碍[4]以诱导成核。磷蛋白如DMP-1、骨涎蛋白等酸性非胶原蛋白可以通过动力学驱动均相成核,一方面可以作为隔离基元使ACP形成稳定的纳米前驱体;另一方面也可以作为模板基元来启动HAp的成核及分自组装[5-6]。但这些非胶原体外活性低,价格昂贵,无法广泛应用于骨组织工程。
聚阴离子电解质可以在胶原的仿生矿化中用来模拟这些非胶原蛋白的功能基元,多元羧酸如聚丙烯酸和聚天冬氨酸等常被用作模仿这些基质蛋白的隔离基元功能的仿生类似物[7]。比如,低分子量的聚丙烯酸可以用来模拟DMP-1蛋白的N端片段的隔离基元。这些聚阴离子电介质可以包裹Ca2+、PO43-形成稳定的纳米级液相ACP前驱体,并通过毛细管作用渗入胶原纤维的孔区和原纤维缝隙间,进而在胶原纤维内部结晶形成Hap,整个矿化过程符合聚合物诱导液相前驱体机理(PILP)[6,8]。无机小分子的聚磷酸盐如三偏磷酸钠(STMP)和三聚磷酸钠(TPP)等在仿生矿化中起到重要作用。它们可以模拟DMP-1蛋白带负电荷的C端片段的模板功能基元,在胶原纤维内部为Ca2+提供负电荷螯合位点[9]。
本文拟采用pH值=7.4的溶胶-凝胶体系中,加入β-甘油磷酸钠这种可促进矿化的活性小分子作为矿化的磷源,且引入低分子量的聚丙烯酸作为隔离功能基元,三聚磷酸钠作为模板功能基元,两者作为“软模板”模拟非胶原蛋白的功能域来调控I型胶原的仿生矿化,制备新型的骨组织工程支架材料。
1实验
1.1材料和仪器
β-甘油磷酸钠(β-GP,Sigma-Aldrich),三聚磷酸钠(TPP,Sigma-Aldrich)和聚丙烯酸(PAA,MW为1 800 Da,Sigma-Aldrich),氯化钙(广州化学试剂厂,AR),鼠尾Ⅰ型胶原(鼠尾腱Ⅰ型胶原,暨南大学生物材料实验室)。实验中其它试剂均为分析纯。X射线衍射仪(XRD,MSAL XD-2X,中国布莱格)超高分辨率场发射扫描电镜(FESEM,Nova NanoSEM430,荷兰FEI公司),高分辨率透射电子显微镜(HRTEM,JEM-2100F,日本 JEOL)。
1.2实验方法
1.2.1“软模板”调控仿生矿化I型胶原纤维
将鼠尾I型胶原溶解于10 mmol/L HCl溶液中,待胶原完全溶解后,缓慢加入96 mmol/L CaCl2。待溶液完全澄清后,边搅拌边用氨气熏蒸至略显乳白色,此时测得溶液pH值约为7.0。 将与HCl等量的25 mmol/L Tris-HCl buffer分成两份,一份加入TPP,待完全溶解后,加入胶原CaCl2溶液中,静置5~10 min;另一份加入PAA和β-GP,完全溶解后,迅速加入胶原CaCl2-TPP混合溶液中,最终溶液中各组分浓度为胶原5 mg/mL,CaCl248 mmol/L,β-GP 28.8 mmol/L,TPP 0.5%(质量分数),PA 1 mg/mL。此过程中制备4组不同的样品相互对照。(1) 空白对照组:不加入TPP和PAA;(2) 模板功能调控组:加入TPP,不加入PAA;(3) 隔离功能调控组:加入PAA,不加入TPP;(4) 模板-隔离双调控组:同时加入TPP和PAA。
搅拌2 min后,放入37 ℃恒温水浴箱中陈化0.5~24 h。样品呈乳白色凝胶状,用三蒸水洗涤3次以上,-80 ℃预冷后冷冻干燥,得到磷酸钙/胶原复合支架材料。
1.2.2无机晶相组成分析
取部分支架材料挤压成膜后,用X射线衍射法(XRD)测定样品的晶相组成,测试条件为电压36 kV,管流20 mA,CuKα靶,扫描范围(2θ)5~80°,扫描速度8°/min。
1.2.3FESEM微观形貌观察及能谱仪(EDS)元素分析
取经冷冻干燥后的多孔支架材料样品,经喷金处理后,置于超高分辨率场发射扫描电镜(FESEM,工作电压3.0~5.0 kV)下观察其显微形貌,并用联用的能谱仪对材料微区成分元素种类与含量进行分析。
1.2.4HRTEM微观形貌观察及选区电子衍射(SAED)晶相分析
将样品用环氧树脂固化包埋后,超薄切片,充分分散并沉积到铜网上,置于高分辨率透射电子显微镜(HRTEM,工作电压100 kV)下观察其显微结构,并利用傅里叶变换选区电子衍射(SAED)对无机相进行晶相分析。
1.2.5细胞培养
选取模板-隔离基元双调控并陈化24 h的n-HA/COL复合支架作为种子细胞的支架材料。将经过钴60(辐照强度为5 kgy)灭菌的Ø10 mm×8 mm n-HA/COL复合支架置于24孔培养板中,无菌PBS冲洗3次,用含10%胎牛血清、1%双抗的高糖DMEM培养液浸泡过夜。取传至第5代的人脐带干细胞(hUMSCs),0.25%的胰酶消化3~5 min后用培养液终止消化,1 000 r/min离心5 min收集,培养液吹散成细胞悬液,倒置显微镜下血球计数板计数并调整细胞密度为4.15×105个/mL,向每个支架及空白对照孔滴加100 μL细胞悬液。在CO2为0.5%,37 ℃条件下培养3 h细胞贴壁后,将支架孔及对照孔分为4组,分别为A组:对照组(加普通培养液培养);B组:成骨剂诱导组(加成骨诱导培养液(osteoblast inducing conditional media,OICM)培养);C组:支架材料组(加普通培养液培养);D组:联合培养组(同时使用支架材料和成骨诱导液培养)。向各孔小心加入1 mL 培养液,每两天PBS清洗并换液1次。
1.2.6细胞粘附率统计

(1)1.2.7MTT法细胞活性检测
在第1,3,5和7 d,每天各从A、B、C、D组中取3孔样品作为测定孔,将原有培养液吸除后PBS吹洗3次,向测定孔及背景孔加入80 μL 5 mg/mL的MTT,再加入1 mL培养液继续培养4 h后吸除废液,并向各孔加入400 μL 三联液(10%SDS-5%异丙醇-12 mmol/L HCl),继续培养12 h后快速震荡5 min后将各孔中的溶液分别转移到96孔培养板中,每孔180 μL,用酶标仪在492 nm波长处测定其光吸收值(OD值),计算相对细胞活性
1.2.8碱性磷酸酶活性测定
第7,14和21 d时,弃去培养基,PBS清洗3次,加入1%的Triton X-100 PBS溶液常温下裂解30~40 min,将细胞裂解液转移至96孔培养板中,根据AKP测定试剂盒的说明,定义每克蛋白37 ℃下与基质作用15 min产生1 mg酚为1个金氏单位,并按照说明书的方法测定各孔液体在492 nm波长的吸光度值(OD)。同时按照BCA试剂盒说明绘制标准曲线并测定各孔细胞裂解液在570 nm波长的吸光度值(OD),并计算出相应的蛋白质浓度。最后计算出每单位质量蛋白质中碱性磷酸酶的活性。


1.2.9统计学分析
对数据进行统计学分析,数据表示为mean±SD,采用SPSS16.0(SPSS,Chicago)分析软件的独立样品方差分析进行分析。P≤0.05时认为有统计学差异,P≤0.01时认为有显著性差异。
2结果与讨论
2.1仿生矿化支架无机晶相组成分析
图1为37 ℃陈化0.5h后各组样品胶原纤维表面矿物的XRD谱图。从图1((b)-(e))衍射峰位置与标准的HAp衍射峰位置相比基本一致可知,体系在很短的时间内就生成了磷酸钙盐的晶体,无论是否加入软模板调控矿化,各样品中无机盐的组成都是基本相同的,呈现出非典型的HAp衍射峰,没有出现其它磷酸钙盐或者非钙磷盐杂质,说明胶原具有比较好的诱导HAp生成的能力。此外,图1(b)-(e)与(a)标准的HAp衍射峰相对比,各自的HAp的三强主基衍射峰(约32°,对应HAp的(211)、(112)、(300)晶面)仍出现明显的衍射峰锐化现象,同时在46°附近的衍射峰(对应HAp的(222)晶面)明显尖锐,但在26°附近的HAp特征衍射峰(对应HAp的(002)晶面)不明显,且(图1(b)、(c)、(d))三者相比几乎无明显差异,说明HAp的晶体受“硬模板”胶原的影响主要沿(211)和(222)面生长[10],生成的HAp处于一种非典型的结晶或者由无定形磷酸钙(ACP)向HAp晶体过渡的状态。
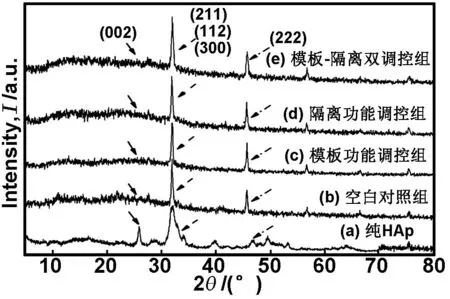
图1 37 ℃陈化0.5 h后各组样品XRD谱图
Fig1XRDpatternsofthesamplesafterageingfor0.5hat37 ℃
2.2陈化时间对无机晶相的影响
由图2((b)-(d))可知,在模板-隔离双调控组中,随着陈化时间的延长,26°附近的HAp特征衍射峰(对应HAp的(002)晶面)逐渐显露出来,但更为明显的是,三强主基峰及46°附近的衍射峰(对应HAp的(222)晶面)峰强明显在增大,说明软模板调控胶原矿化的过程中,HAp在自组装过程中更倾向于在(211)和(222)上生长,表现出非典型的结晶途径。
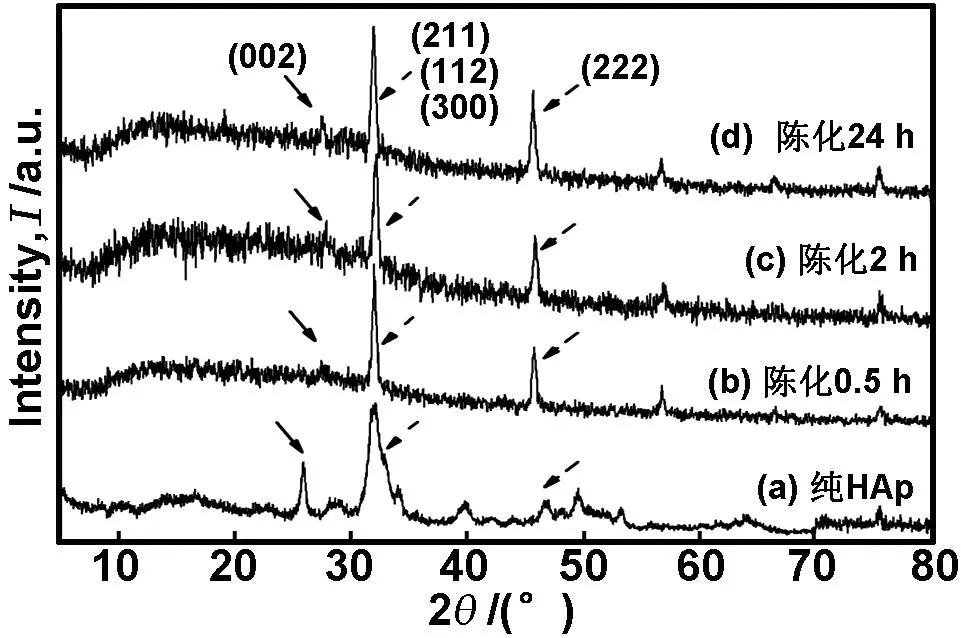
图2双调控组37℃陈化不同时间后样品XRD谱图
Fig 2 XRD patterns of templating-sequestration samples after aging for different time at 37 ℃
2.3FESEM微观结构观察及EDS元素分析
图3为37 ℃陈化0.5 h后4组样品的胶原支架内横截面扫描电镜图片。4组样品胶原纤维表面均沉积了大量的尺寸在100~200 nm之间的磷酸钙盐,多为无定形态、不规则的片状或者球状晶体,这与XRD结果相吻合,晶体相互交叠堆垛,呈现出不完全结晶的形态。图3(a)表明,当体系中不存在具有隔离和模板功能的软模板调控矿化时,生成的磷酸钙盐形貌杂乱无章,有些部分已经开始融合。图3(b)显示,只加入TPP调控而无聚丙烯酸时,大量片状或球状晶体附着在胶原纤维外表面。这是因为在矿化初始阶段,由于缺乏隔离功能基元来调控稳定纳米ACP前驱体,导致反应溶液中已经形成了尺寸较大的无定形磷酸钙,大于胶原纤维的周期横纹间距约为67 nm,无法进入胶原纤维内部从而在胶原纤维外表面无规随机的吸附沉积成球晶[11]。胶原纤维外表面被这些球晶覆盖,因此无法观察到胶原内部的矿化情况。图3(c)表明,当只加入聚丙烯酸调控矿化而没有加入TPP时,除了在胶原纤维外部有大量弱结晶的磷酸钙盐以外,更为重要的是,发现胶原纤维内部也有发生类似矿化过程的倾向,如图3(c)两黑线间所示,根据材料表面特征推测,胶原纤维内部很有可能被大量的磷酸钙盐填充,由此推断,在聚丙烯酸的隔离功能基元作用下,Ca2+和PO43-形成稳定的纳米无定形前驱体小液滴,能够顺利进入胶原纤维的孔区并进一步结晶生成HAp。但接下来的矿化过程由于缺乏模板调控限制了HAp的分级自组装,从而导致产生了相互交叠,以致于掩盖了胶原纤维的周期性结构[6]。图3(d)显示出,当加入聚丙烯酸作为隔离调控基元,TPP作为模板调控基元,在胶原纤维外部发生了可控的矿化过程,此外,两黑线间为明亮区域,相距大约60 nm,应为HAp在胶原纤维的孔区形成,由此推测出,在聚丙烯酸的隔离调控下,纳米无定形前驱体小液滴通过孔区进入了胶原纤维内,并在TPP的模板调控下进一步发生了HAp的分级自组装,从而形成了周期性的矿化胶原纤维结构。从图3(c)、(d)发现胶原纤维束的长度>1 μm,直径约为300 nm左右。整个调控矿化过程符合PILP理论。

图3 37 ℃陈化0.5 h后各组样品FESEM谱图
从图4(a)模板-隔离双调控组37 ℃陈化0.5 h后SEM照片的黑色方框区域的选区能谱散射分析(EDS)可知,Ca/P=1.19,而标准HAp的Ca/P=1.67,可以认为胶原纤维外表面上除了生成大量的HAp晶体外,还存在ACP和很少量其它的钙磷盐[12]。

图4双调控组37 ℃陈化不同时间后样品SEM & EDS照片
Fig 4 SEM & EDS images of the templating-sequestration samples after aged for different time at 37 ℃
从图4(b)可知,随着陈化时间的延长,ACP和其它钙磷盐向HAp晶体转变并长大,陈化24 h后,形成尺寸在1 μm左右的不规则片晶或球晶,这与XRD显示的晶体优先沿(211)和(222)生长的结果相一致。从图4(b)中黑色方框区域内的EDS可知,Ca/P=1.30,接近于HAp的Ca/P=1.67。
2.4HRTEM与SAED分析
HRTEM可以更加直接地研究胶原纤维与形成的晶体间的相互关系。必须要说明的是制样过程中破坏了胶原纤维的结构,仅可以观察到原胶原分子及胶原微纤维。图5(a)显示出胶原纤维的外表面沉积着几十纳米尺寸的HA晶粒。图5(c)为(b)图中方框区域内的放大图像。在图5(b)中,黑色长箭头线表示出胶原微纤维的纵向[13]。自组装HA纳米微粒不仅在胶原纤维外部沉积,也可以在原胶原分子上及胶原微纤维的末端被发现[10](如图5(b)、(c)黑色短箭头线所示),同时纳米ACP也沿着胶原微纤维的圆柱形表面分布[14](如图5(b)、(c)黑色短箭头线所示)。图5(c)黑色长箭头线显示的是原胶原纤维的纵向,之间的距离约为1.3 nm,这与报道的胶原分子直径数据相一致。图5(d)为(c)区域的傅利叶变换选区电子衍射图像。电子衍射图像呈不连续的圆弧状,说明生成的HA为多晶体,同时也存在无定形态。根据计算由内向外,各圆弧分别对应HA的(002)、(211)和(222)晶面,此结果与XRD的结果互相吻合。根据Kikuchi等[15]的研究结果,HA及胶原纤维自组装的程度可以根据胶原纤维的长度及HA(002)晶面对应的电子衍射弧的弧长来判断, 本文中自组装的程度比较好。
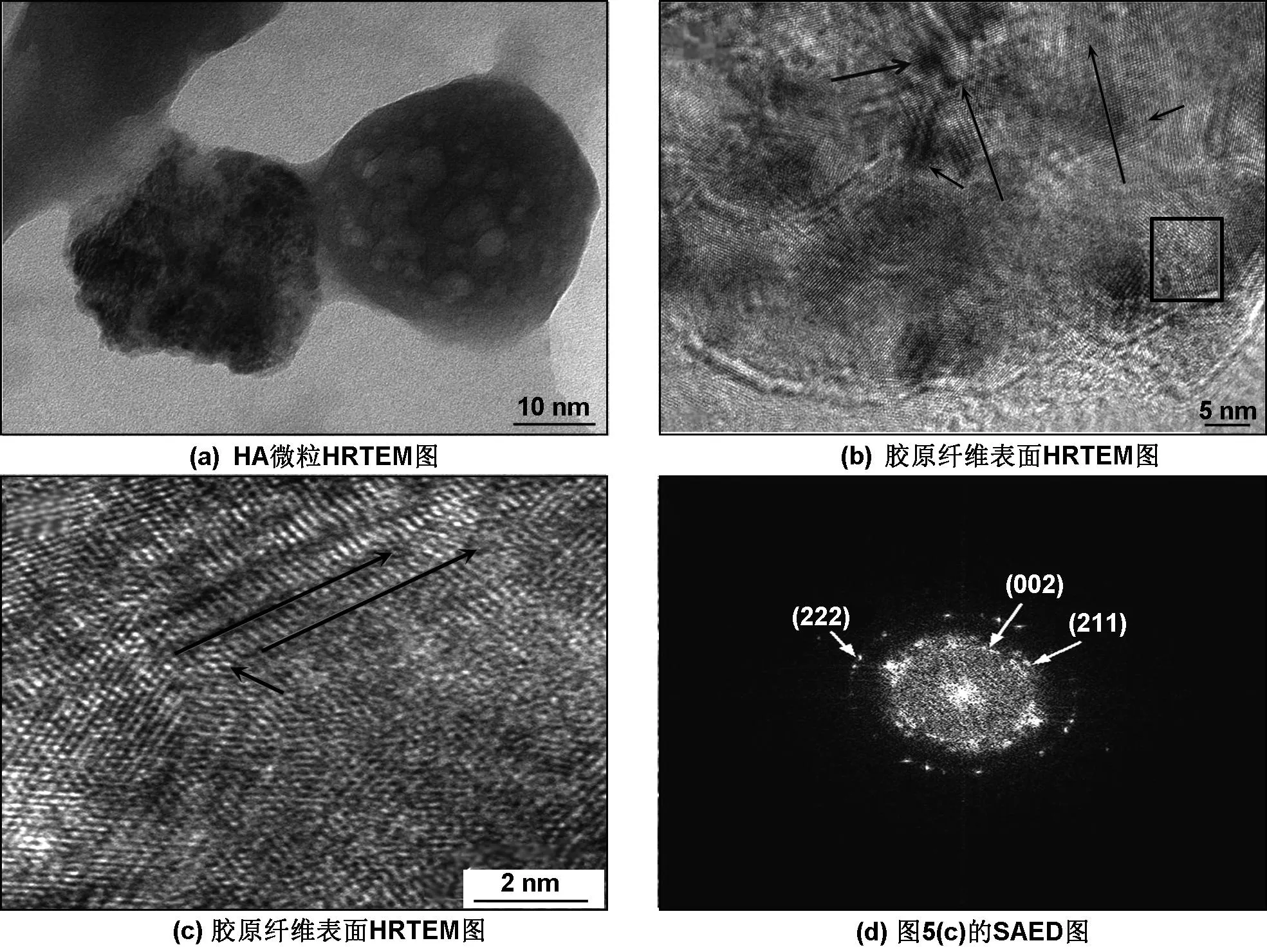
图5 双调控组37 ℃陈化24 h后样品HRTEM & SAED照片
2.5细胞粘附率
如表1所示,hUMSCs细胞在n-HA/COL复合支架组和联合培养组支架上的粘附率分别为(89.64±1.21)%,(93.73±1.69)%。两种支架的粘附率都非常高,这是因为材料的吸水性较好,细胞悬液迅速被支架吸收,同时复合支架材料上连通的拓扑孔洞较为规整,更加有利于细胞的粘附和伸展,在一定程度上提高了细胞的粘附率。
表1hUMSCs在n-HA/COL复合支架上的粘附率
Table 1 The adherence ration of hUMSCs on the n-HA/COL composite scaffolds

SampleSeededcells/×104Unattachedcells/×103Celladhesionrate/%支架材料组4.154.3±0.589.64±1.21联合培养组4.152.6±0.793.73±1.69
2.6MTT法相对细胞活性统计分析
图6显示的是MTT法检测相对细胞活性统计分析结果。与对照组相较,第1 d时,C、D组的相对细胞活性在78%~84%之间,这是因为支架孔里的细胞有一些没有贴壁以及湿态的支架降低了MTT的浓度导致反应不完全等原因造成的。根据柱形图的趋势可以发现,随着培养时间的延长,不论是成骨剂诱导组(B组),支架材料组(C组)还是联合培养组(D组),各组的相对细胞活性与对照组相比均没有明显提高,表明细胞增殖速度也没有明显的提高,说明n-HA/COL复合支架及成骨诱导液并没有明显促进hUMSCs细胞的增殖,但也没有抑制细胞的生长。本文结果具有显著的统计学意义。在图6中B、C和D与A组比较,*P<0.05,**P<0.01。
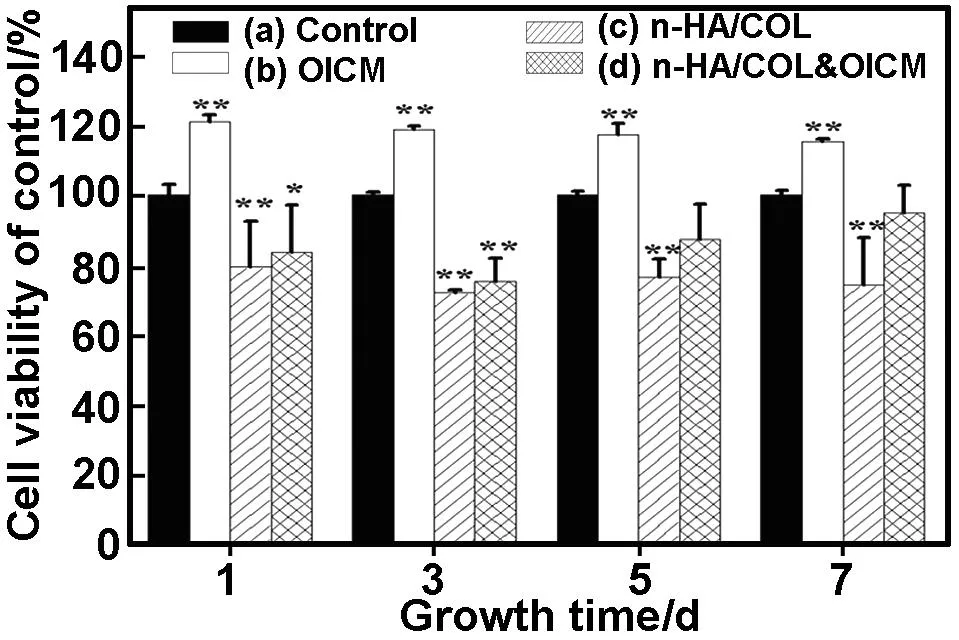
图6MTT法检测n-HA/COL及成骨诱导剂培养细胞的相对细胞活性
Fig 6 The relative cell viability of the cells on the n-HA/COL scaffolds and OICM with MTT
2.7碱性磷酸酶活性
碱性磷酸酶(alkaline phosphatase,AKP)是分化成骨细胞过程中的早期标志物,也是细胞外基质成熟的标志,是成骨细胞的催化剂,能促进骨基质的矿化。从图7可知,在第7,14,21 d时,n-HA/COL复合支架材料诱导组(C组)及与成骨诱导液联用的联合诱导组(D组)中,AKP活性明显高于空白对照组。随着培养时间的延长,各组中AKP活性都有不同程度的提高;更为明显的是,随时间延长,含有复合支架的实验组(C和D组)中AKP活性的提高速度明显加快,而且联合诱导组(D组)更胜于复合支架诱导组(C组),与空白对照组相比具有统计学显著性差异。这说明n-HA/COL复合支架材料能够诱导hUMSCs向成骨细胞分化,促进成骨细胞AKP的表达,并且n-HA/COL复合支架材料与成骨诱导液联用时诱导效果更加显著。在图7中B、C和D与A组比较,*P<0.05,**P<0.01。
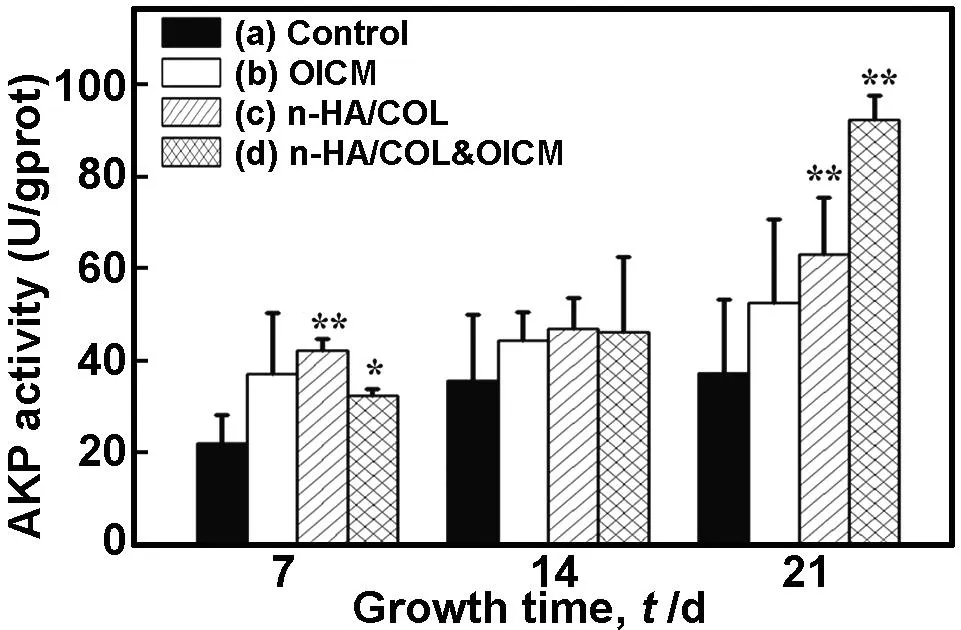
图7n-HA/COL及成骨诱导剂培养细胞7,14,21 d后的碱性磷酸酶活性
Fig 7 The AKP activity of the cells on the n-HA/COL scaffolds and OICM after 7,14,21d
3结论
pH值=7.4的胶原溶胶-凝胶体系中,以TPP和PAA双调控“软模板”来调控I型胶原的仿生矿化。 PAA作为隔离功能基元可以在矿化的初始阶段调控形成稳定的纳米ACP前驱体小液滴,从而进入胶原纤维内部,此过程符合PILP理论;TPP作为模板功能基元可以调控胶原纤维内部的HAp的自组装,从而在纤维内部形成纳米晶粒,并使胶原纤维产生周期性的明暗条纹。细胞培养表明hUMSCs在n-HA/COL复合支架组和联合培养组支架上的生长状态良好且AKP活性明显高于对照组和OICM组,显示出了较为显著的成骨诱导性。因此,这种以“bottom-up”方式仿生构建的n-HA/COL复合材料有望用于骨组织修复材料[16]。
参考文献:
[1]Rhee S H, Lee J D, Tanaka J. Nucleation of hydroxyapatite crystal through chemical interaction with collagen[J]. Journal of the American Ceramic Society, 2000, 83(11): 2890-2892.
[2]Crane N J, Popescu V, Morris M D, et al. Raman spectroscopic evidence for octacalcium phosphate and other transient mineral species deposited during intramembranous mineralization[J]. Bone, 2006, 39(3): 434-442.
[3]Tsuji T, Onuma K, Yamamoto A, et al.Direct transformation from amorphous to crystalline calcium phosphate facilitated by motif-programmed artificial proteins[J]. Proceedings of the National Academy of Sciences, 2008, 105(44): 16866-16870.
[4]Wang L, Nancollas G H. Pathways to biomineralization and biodemineralization of calcium phosphates: the thermodynamic and kinetic controls[J]. Dalton Transactions, 2009, (15): 2665-2672.
[5]Hao J, Ramachandran A, George A. Temporal and spatial localization of the dentin matrix proteins during dentin biomineralization[J]. Journal of Histochemistry & Cytochemistry, 2009, 57(3): 227-237.
[6]Zhao L, Burguera E F, Xu H H, et al. Fatigue and human umbilical cord stem cell seeding characteristics of calcium phosphate-chitosan-biodegradable fiber scaffolds[J]. Biomaterials, 2010,31:840-847.
[7]Shen Xiaobing, Li Bo, Zhao Jun, et al. Research progress of regulating the hydroxyapatite microstructure by the method of hydrothermal[J]. Journal of Functional Materials,2014,45(3):03006-03010.
沈小兵, 李波, 赵军,等.孙维均水热法调控羟基磷灰石微结构研究进展[J]. 功能材料,2014,45(3):03006-03010.
[8]Ding Shan, Tang Minjian, Zhou Changren, et al. Synthesis of biomimetic functionalized chitosan and mineralization behavior research[J]. Journal of Functional Materials, 2012,43(2):174-177.
丁珊, 唐敏健, 周长忍,等.仿生功能化壳聚糖的合成及矿化行为 研究[J].功能材料,2012,43(2):174-177.
[9]Liu Y, Kim Y K, Dai L, et al. Hierarchical and non-hierarchical mineralisation of collagen[J]. Biomaterials, 2011, 32(5): 1291-1300.
[10]Kim Y K, Gu L S, Bryan T E, et al.Mineralisation of reconstituted collagen using polyvinylphosphonic acid/polyacrylic acid templating matrix protein analogues in the presence of calcium, phosphate and hydroxyl ions[J]. Biomaterials, 2010, 31(25): 6618-6627.
[11]Ficai A, Andronescu E, Voicu G, et al. Self-assembled collagen/hydroxyapatite composite materials[J]. Chemical Engineering Journal, 2010, 160(2): 794-800.
[12]Xu Z, Neoh K G, Kishen A. A biomimetic strategy to form calcium phosphate crystals on type Ⅰ collagen substrate[J]. Materials Science and Engineering: C, 2010, 30(6): 822-826.
[13]Li Y, Asadi A, Monroe M R, et al. pH effects on collagen fibrillogenesis in vitro: electrostatic interactions and phosphate binding[J]. Materials Science and Engineering: C, 2009, 29(5): 1643-1649.
[14]Yang X, Liang C, Cai Y, et al. Recombinant human-like collagen modulated the growth of nano-hydroxyapatite on niti alloy[J]. Materials Science and Engineering: C, 2009, 29(1): 25-28.
[15]Zhai Y, Cui F. Recombinant human-like collagen directed growth of hydroxyapatite nanocrystals[J]. Journal of Crystal Growth, 2006, 291(1): 202-206.
[16]Kikuchi M, Itoh S, Ichinose S, et al. Self-organization mechanism in a bone-like hydroxyapatite/collagen nanocomposite synthesized in vitro and its biological reaction in vivo[J]. Biomaterials, 2001, 22(13): 1705-1711.
Biomimetic mineralization of collagen fibers regulated with “soft template”
LI Na,LUO Xueshi, YE Bihua, LI Zhiwen,WU Di, LI Lihua, LI Hong, ZHOU Changren
(Department of Material Science and Engineering, Engineering Research Center of Artificial Organs and Materials, Jinan University, Guangzhou 510632,China)
Abstract:In this paper, polyacrylic acid (PAA) and sodium tripolyphosphate (TPP) were applied as “soft template” which simulated respectively as the N- and C-terminal domains of the non-collageneous proteins DMP-1 in vivo to control the mineralization process of type Ⅰ collagen. Experimental pH was settled at 7.4 and β sodium glycerophospate was applied as the phosphorus scource. Nano-hydrixyapatite (HAp)/collagen scaffold (n-HA/COL) was fabricated in this experiment. In addition,human umbilical cord mesenchymal stem cells (HUMSCs) were selected to study the effects of the materials on the cell adhesion, proliferation, and differentiation. Results showed that self-organization and minimization of the collagen fibers were simultaneous. The aging process contributed to the growth of HAp. Self-assembled HAp nanoparticles depositedboth on the external collagen fibres and the terminal of microfibrils. Nano-calcium phosphate crystals were distributed along the cylindrical surface of the collagen microfibrils. Cell culture showed that n-HA/COL did not significantly promote the proliferation of hUMSCs cells but can induce osteoblast differentiation and to promote AKP expression. Also, the osteogenic effect was more significant when n-HA/COL combined with OICM. This “bottom-up” method of deep mineralization provides a novel approach for preparation of bone compositescaffolds, and the n-HAp/collagen composite is expected to be used for bone repairing and regeneration.
Key words:collagen; mineralization; polyacrylic acid; tripolyphosphate
DOI:10.3969/j.issn.1001-9731.2016.03.024
文献标识码:A
中图分类号:Q81
作者简介:李娜(1988-),女,山东德州人,在读硕士,师承李立华教授,从事生物材料研究。
基金项目:国家自然科学基金资助项目(31270021);广东省优秀博士论文资助项目(sybzzxm201121);广东省医学基金资助项目(A2013334)
文章编号:1001-9731(2016)03-03129-07
收到初稿日期:2015-03-24 收到修改稿日期:2015-10-27 通讯作者:李立华,E-mail: tlihuali@jnu.edu.cn

