Ti-35Nb-7Zr/10CPP生物复合材料微观组织与性能研究
何正员,张玉勤,2,周 荣,蒋业华
(1. 昆明理工大学 材料科学与工程学院, 昆明 650093;
2. 云南省钛材应用产品工程技术研究中心, 昆明 650093)
Ti-35Nb-7Zr/10CPP生物复合材料微观组织与性能研究
何正员1,张玉勤1,2,周荣1,蒋业华1
(1. 昆明理工大学 材料科学与工程学院, 昆明 650093;
2. 云南省钛材应用产品工程技术研究中心, 昆明 650093)
摘要:添加了占钛合金基体10%(质量分数)的焦磷酸钙(CPP)生物活性陶瓷粉末,利用放电等离子烧结(SPS)技术制备了Ti-35Nb-7Zr/10CPP生物复合材料,研究了其物相组成、微观组织形貌、元素分布、力学性能以及生物活性等。结果表明,该复合材料主要由β-Ti相基体、少量的α-Ti相及金属-陶瓷相(CaO、Ti2O、CaTiO3、CaZrO3、TxPy)组成;复合材料具有较低的压缩弹性模量(46 GPa)和较高的抗压强度(1 434 MPa),显示了良好的力学相容性;与Ti-35Nb-7Zr合金相比,复合材料在人工模拟体液(SBF)浸泡7 d后表面生成了大量的类骨磷灰石层,显示出良好的生物活性。
关键词:生物复合材料;微观组织;力学性能;生物活性
0引言
钛及钛合金作为硬组织修复及替换材料,以其优异的生物相容性、力学性能和耐蚀性能在临床上得到了广泛的应用和重视[1]。β型Ti-Nb-Zr合金因低弹性模量、高强度以及优异的耐腐蚀性,成为最有应用潜力的一种钛合金[2-3]。然而,此类合金表现为生物惰性,易造成移植体与宿主主骨之间难以形成骨结合,从而导致移植失败。因此提高其生物活性,是生物材料领域研究的重点[4]。
近年来,钛及钛合金中混入生物活性陶瓷(羟基磷灰石-HA或焦磷酸钙-CPP)制备金属基生物复合材料的研究发现,其生物活性较金属材料有了较大改善[5-9]。金属/陶瓷生物复合材料除改善自身活性外,还应该考量基体的性能和材料成本。国内外学者的研究[9-11]发现,β型Ti-35Nb-7Zr合金中添加生物陶瓷(CPP或HA),通过SPS工艺能制备致密度较高、性能较好的生物复合材料,但是随着CPP或HA含量的增加,Ti-35Nb-7Zr合金中的Ti减少,Nb与Zr的含量不变,这导致材料中Nb和Zr的促β-Ti相形成与稳定作用发挥不充分,同时造成材料成本攀升。因此,协同控制复合材料中Ti、Nb、Zr元素的变化,既能维持β型基体,又能降低材料成本。
基于以上分析,本文加入CPP生物活性陶瓷,同时替代Ti-35Nb-7Zr为基体中Ti、Nb、Zr 3种元素,实现了复合材料基体中Ti、Nb、Zr元素的协同变化,充分发挥Nb、Zr促β-Ti相的形成作用,旨在维持β型基体,保证基体的低弹性模量。本文利用SPS技术制备了Ti-35Nb-7Zr/10CPP复合材料,研究了其组织与性能,探讨了CPP的影响机理,为获得低成本、高强度、低模量、良好生物活性以及骨整合能力的新型骨修复与骨替代材料提供理论支撑。
1实验
实验所用原料为Ti、Nb、Zr粉末(北京中诺新材科技有限公司)以及CPP粉末(上海晶纯实业有限公司),其纯度与粒度如表1所示。

表1 原料粉末的纯度与粒度
按照Ti-35Nb-7Zr的质量比称取Ti、Nb、Zr粉末后,放入行星式球磨机真空球磨罐中,按球料比3∶1加入不锈钢球,同时加入无水酒精并将其抽真空至10 Pa,在300 r/min速度下机械合金化8 h;然后加入金属粉末总质量10%的CPP粉末,在300 r/min速度下混粉2 h。将混合后的Ti-Nb-Zr粉末和Ti-Nb-Zr-CPP粉末分别取出烘干后装入石墨模具中,在SPS-515S型放电等离子烧结设备(SPS Syntex Inc.,Japan)上进行烧结,烧结原理如图1所示。烧结工艺为:首先按100 ℃/min加热至900 ℃,再以50 ℃/min升温至烧结温度1 050 ℃,保温5 min后随炉快速冷却,烧结过程中持续外加40 MPa轴向压力,系统真空度为2~10 Pa。
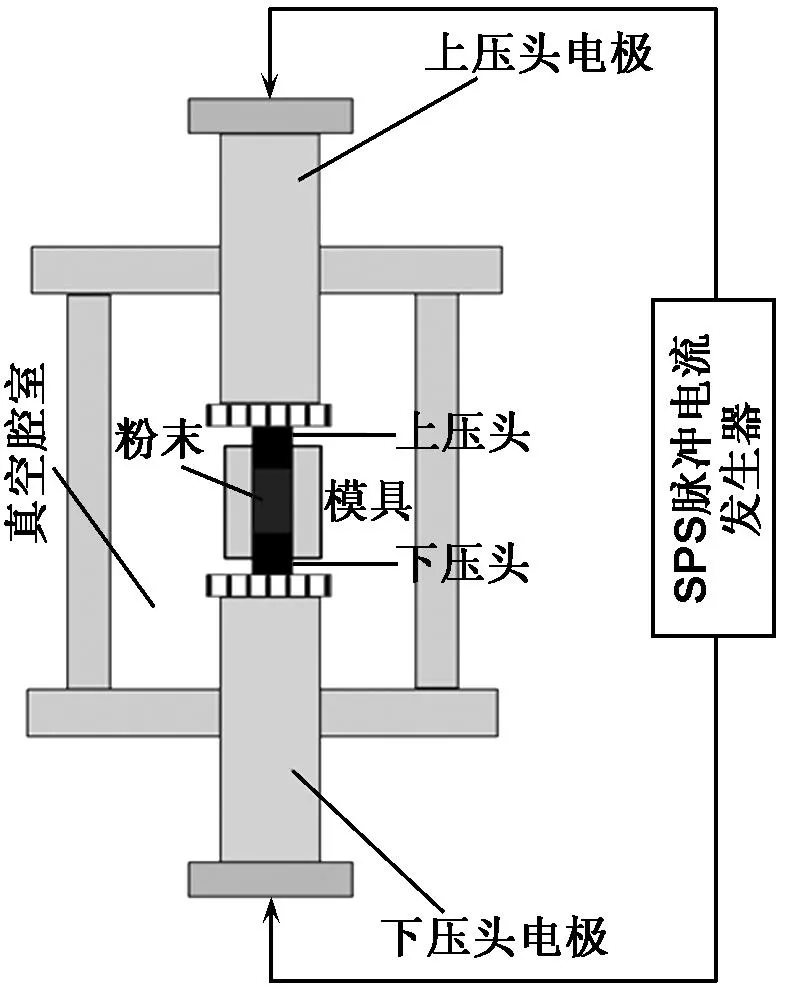
图1 放电等离子烧结示意图
Fig 1 Schematic diagram of SPS (spark plasma sintering)
粉末以及烧结体的物相分析在Bruker D8 Advance 型X射线衍射仪上进行。烧结后试样的组织分布状态与成分检测利用FEI quanta 600型扫描电镜(SEM)结合能谱(EDS)进行,其力学性能测试在岛津AG-X万能材料试验机上进行。根据GB/T7314-2005要求,将试样线切割成尺寸分别为Ø4 mm×10 mm和Ø2 mm×10 mm的小圆柱,前者用来测量试样的抗压强度,后者是用来测量试样的压缩弹性模量,在实验过程中,试样的压缩速率为1 mm/min。压缩断口的形貌利用Hitachi TM3000型台式扫面电镜进行观察。将试样线切割成Ø20的薄片,磨抛、清洗后放入人工模拟体液(SBF)[12],恒温在37 ℃浸泡,每天更换一次溶液,然后取出并用去离子水清洗,其表面沉积形貌经过喷金后借助Tescan VEGE 3 SB型扫描电镜进行观察。
2结果与讨论
2.1机械合金化
图2为经过8 h机械合金化与2 h混合的XRD图谱。
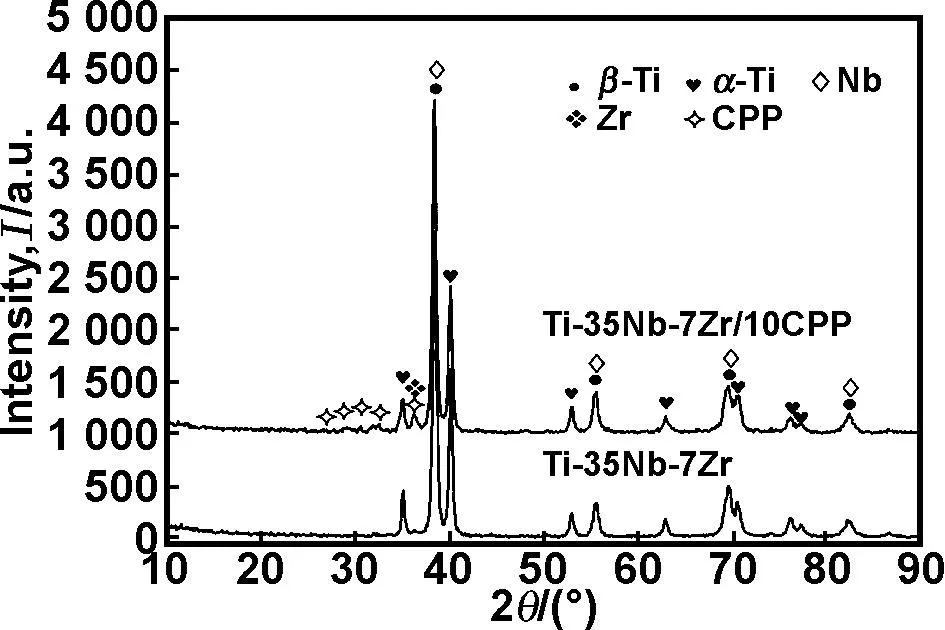
图2 混合粉末的XRD谱线
由XRD分析结果可知,机械合金化球磨促进了α相向β相的转变。因为高速球磨与碰撞过程中,大量的动能转化为α相向β相转变所需的能量,从而降低了相变能,最终转变温度低于理论温度882 ℃(如图3)[13]。在随后的2 h混粉过程中,CPP并没有分解。所以机械合金化与混粉工艺的搭配,有利于获得以β相为主、混合均匀的粉末。球磨过程中α-Ti向β-Ti的物相转变,可能会影响烧结体的组织与性能。
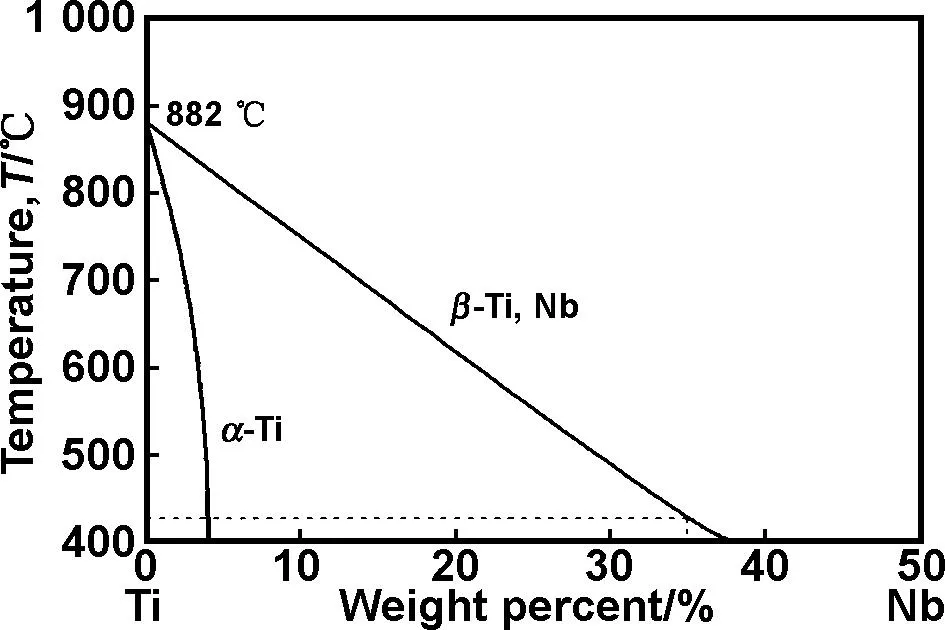
图3 Ti-Nb二元合金局部相图[13]
2.2组织
图4为Ti-35Nb-7Zr合金与 Ti-35Nb-7Zr/10CPP复合材料的XRD谱线。由图可知,Ti-35Nb-7Zr合金主要由β-Ti、少量的α-Ti和Zr组成。当加入CPP后,复合粉材料主要是由β-Ti,少量α-Ti以及金属-陶瓷相(CaTiO3,Ti2O,CaO,CaZrO3,TixPy)组成。从图4可知,随着CPP的加入,复合材料中出现了金属-陶瓷相,同时,α-Ti的峰明显增强。究其原因在于,CPP的加入导致烧结过程中Ti、Nb、Zr元素的扩散受阻,从而减弱了Nb、Zr元素对β相的稳定作用;烧结过程中,金属元素与CPP之间发生反应,如反应式(1)与(2)所示,伴随着上述反应的进行,其生成物(金属-陶瓷相)增加,锆与氧在高温下也容易生成ZrO2,根据文献[14- 15]报道,由于CaO与ZrO2在约920 ℃时可形成CaZrO3,1 200 ℃左右大量生成。
(1)
(2)
金属-陶瓷相的生成复合材料提供了Ca、P等活性元素,利于提高材料生物活性。另外,金属-陶瓷相的强化作用,会影响复合材料的力学性能。
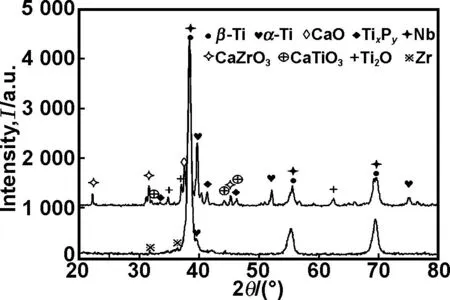
图4Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP生物复合材料的XRD图谱
Fig 4 XRD patterns of Ti-35Nb-7Zr alloy and Ti-35Nb-7Zr/10CPP biocomposite
借助高低倍背散射扫描电镜(BSEM)以及EDS能谱分析,研究了Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP复合材料的组织形态与分布。图5为Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP复合材料背散射电子形貌,图6为复合材料的元素面分布。从图5中可以看出,Ti-35Nb-7Zr合金主要由大块状的β-Ti相以及少量的针状α-Ti相组成,其中β-Ti主要由灰色的Ti(Nb)或者Ti(NbZr)固溶体以及亮白色的Nb(Ti)固溶体组成(如图5(a));随着CPP的加入,复合材料组织主要由基体相(块状的β-Ti相和少量α-Ti相)以及金属-陶瓷相组成,基体相中亮白色的Nb(Ti)固溶体减少,灰色的Ti(Nb)或者Ti(NbZr)固溶体更加均匀细小,金属-陶瓷相析出于基体晶界上,复合材料表面出现大量孔洞。

图5Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP生物复合材料的BSEM形貌
Fig 5 BSEM images of Ti-35Nb-7Zr alloy and Ti-35Nb-7Zr/10CPP biocomposite

图6 Ti-35Nb-7Zr/10CPP生物复合材料的元素面分布
结合图6可知,复合材料的中Ca、P等元素分布较均匀,且Ca、P、Zr主要分布在孔洞区域,上述元素主要以金属-陶瓷相形式存在,即孔洞区域主要为金属与CPP的反应产物的聚集区。这主要是由于CPP与金属的热膨胀系数存在较大差异,导致在烧结过程中容易在晶界处产生孔洞。在烧结过程中,金属与陶瓷的反应产物在随后的冷却过程中依附于金属基体相的晶界析出,并弥散分布在基体相之间,阻碍了连续基体相的形成,割裂了基体,最终导致晶粒尺寸减小。
生物材料表面的微孔结构有利于细胞的粘附、分裂和增殖,从而提高钛的生物活性[16],因此,Ti-35Nb-7Zr/10CPP复合材料的组织结构特征符合骨移植体的结构要求;Ca、P等元素的分布较均匀使得复合材料从成分设计上满足了移植体生物活性的要求。
2.3力学性能
通过压缩实验测试了Ti-35Nb-7Zr合金和Ti-35Nb-7Zr/10CPP复合材料的压缩弹性模量和抗压强度,如表2所示。其应力-应变曲线如图7所示。
表2Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP复合材料的压缩弹性模量和抗压强度
Table 2 Compressive elastic modulus and compressive strength of Ti-35Nb-7Zr alloy and Ti-35Nb-7Zr/10CPP composite

材料名称抗压强度/MPa弹性模量/GPaTi-35Nb-7Zr合金189842Ti-35Nb-7Zr/10CPP复合材料143446
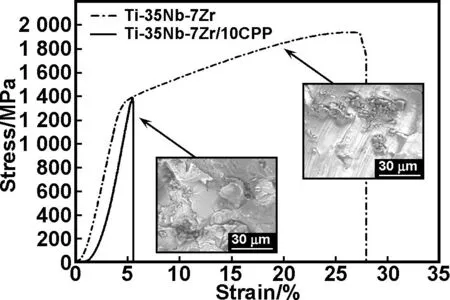
图7Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP生物复合材料的压缩应力-应变曲线
Fig 7 Compression stress-strain curves of Ti-35Nb-7Zr alloy and Ti-35Nb-7Zr/10CPP composite
经过1 050 ℃烧结的Ti-35Nb-7Zr合金与Ti-35Nb-7Zr/10CPP复合材料的平均压缩弹性模量值分别为42和46 GPa,平均抗压强度值分别为1 898和1 434 MPa。复合材料的弹性模量与Ti-6Al-7Nb和TC4合金的弹性模量(100 GPa左右)[17]相比有大幅下降,显示了良好的力学相容性,能够满足生物医用植入材料对强度的要求。从应力-应变曲线分析可知,Ti-35Nb-7Zr合金表现出一定的塑性变形;添加CPP后,复合材料应力应变曲线上没有出现塑性变形阶段,其断裂模式为典型的脆性断裂。观察Ti-35Nb-7Zr合金断口发现,断口处有明显的剪切带,在剪切带的终端有大量的颗粒状突起,提供了变形的抗力,所以Ti-35Nb-7Zr合金抗压强度较高并表现出较明显的塑性变形;添加CPP后的复合材料断口处会有大量的黑色颗粒物团聚在金属基体上,断裂可能从颗粒聚集处或者孔洞处发生,从而使得材料强度的降低。另外,CPP的加入产生了大量的金属-陶瓷硬质相,提高了材料的弹性模量。
综上所述,利用SPS技术制备的Ti-35Nb-7Zr/10CPP复合材料在1 050 ℃烧结,获得了较低的压缩弹性模量和抗压强度,断口上有大量的陶瓷相聚集,从而影响力学性能与断裂机制。考虑到生物医用植入材料,较低的弹性模量(特别是与天然人体骨越接近)将有利于降低植入体与骨头的“应力-屏蔽”现象。因此,Ti-35Nb-7Zr/10CPP生物复合材料的压缩强度与弹性模量适中,其分布均匀且含Ca和P的金属-陶瓷相也为骨细胞诱导生长提供了条件。
2.4体外生物活性
Ti-35Nb-7Zr/10CPP生物复合材料经过人工模拟体液浸泡7 d后,在材料表面形成了大量的类骨磷灰石层,其表面形貌如图8所示。

图8在人工模拟体液中浸泡7 d后材料表面的SEM形貌
Fig 8 SEMimages of samples after soaking in SBF for 7 d

据文献报道[16],只有经过表面处理的生物材料在SBF中浸泡后,材料表面的局域浓度才可达到成核的阈值。而Ti-35Nb-7Zr/10CPP生物复合材料不经过任何的前处理,仅表面打磨、清洗后浸泡7 d,即可在表面形成大量的类骨磷灰石,表面类骨磷灰石层的形成是材料具有骨诱导性的先决条件,所以此复合材料显示了较好的生物活性与骨诱导性。
3结论
(1)以钛、铌、锆以及CPP粉末为原料,经过机械合金化球磨与混粉工艺能得到以β相为主相的混合粉末,CPP在球磨过程中没有明显的分解现象。
(2)在1 050 ℃条件下,放电等离子烧结制备的Ti-35Nb-7Zr/10CPP生物复合材料主要由β-Ti,少量α-Ti以及金属-陶瓷相(CaTiO3,Ti2O,CaO,CaZrO3,TixPy)组成;金属-陶瓷相主要分布在基体晶界上,割裂了基体,导致基体晶粒变小,材料表面产生了大量孔洞。
(3)Ti-35Nb-7Zr合金断裂过程中出现一定塑性变形阶段,而复合材料呈现典型的脆性断裂;与Ti-35Nb-7Zr合金相比,生物复合材料的压缩强度降低,弹性模量略微升高,显示了良好的力学相容性。
(4)复合材料表面浸泡7 d后,形成了一层类骨磷灰石,表现出较好的生物活性和骨诱导性。
参考文献:
[1]Chen Q, Thouas G A. Metallic implant biomaterials[J]. Mater Sci Eng R, 2015, 87:1-57.
[2]Taddei E B, Henriques V A R, Silva C R M, et al. Production of new titanium alloy for orthopedic implants[J]. Mater Sci Eng C, 2004, 24(5):683-687.
[3]Banerjee R, Nag S, Fraser H L. A novel combinatorial approach to the development of beta titanium alloys for orthopaedic implants[J]. Mater Sci Eng C, 2005, 25(3):282-289.
[4]Banerjee R, Nag S, Samuel S,et al. Laser-deposited Ti-Nb-Zr-Ta orthopedic alloys[J]. J Biomed Mater Res A, 2006, 78(2):298-305.
[5]Zhang Fan, Cui Chunxiang, Qi Yumin, et al. Studies on cultured osteoblast cells on HA/Ti substitute for bone tissue[J]. J Funct Mater,2005, 36(5):740-742.
张芳, 崔春翔, 戚玉敏,等. 羟基磷灰石/钛合金骨替代材料体外培养成骨细胞的实验研究[J]. 功能材料, 2005, 36(5):740-742.
[6]Balbinotti P, Gemelli E, Buerger G, et al. Microstructure development on sintered Ti/HA biocomposites produced by powder metallurgy[J]. Mater Res, 2011, 14(3):384-393.
[7]Mondal D, Sarkar S K, Oh I H, et al. Comparative study of microstructures and material properties in the vacuum and spark plasma sintered Ti-calcium phosphate composites[J]. Mater Trans, 2011, 52(7):1436-1442.
[8]Woo K D, Kim S M, Kim D G, et al. Mechanical properties and biocompatibility of Ti-Nb-Zr-Mo-CPP biomaterial fabricated by spark plasma sintering[J]. Korean J Mater Res, 2013, 23(2):135-142.
[9]Park S H, Woo K D, Kim S H, et al. Mechanical properties and bio-compatibility of Ti-Nb-Zr-HA biomaterial fabricated by rapid sintering using HEMM powders[J]. Korean J Mater Res, 2011, 21(7):384-390.
[10]Woo K D, Park S H, Kim J Y, et al. Microstructure and mechanical properties of Ti-35Nb-7Zr-XCPP biomaterials fabricated by rapid sintering[J]. Korean J Mater Res, 2012, 22(3):150-154.
[11]Wang Tao, Zhang Yuqin, Jiang Yehua, et al. Mechanical properties of Ti-35Nb-7Zr-XCPP biomedical composites prepared by spark plasma sintering [J]. Rare Metal Materials and Engineering, 2015, 44(4): 1030.
王涛, 张玉勤, 蒋业华,等. Ti-35Nb-7Zr-XCPP生物复合材料的放电等离子烧结制备及其力学性能研究[J]. 稀有金属材料与工程, 2015, 44(4):1030-1034.
[12]Li P J, Kangasniemi I, de Groot K, et al. Bonelike hydroxyapatite induction by a gel-derived titania on a titanium substrate[J]. J Am Ceram Soc, 1994, 77(5):1307-1312.
[13]Omran A M, Woo K D, Kim D K, et al. Effect of Nb and Sn on the transformation of alpha-Ti to beta-Ti in Ti-35Nb-2.5 Sn nanostructure alloys using mechanical alloying[J]. Met Mater Int, 2008, 14(3):321-325.
[14]Nanjing University of Technology, Tsinghua University, South China University of Technology. Research methods of ceramic materials [M]. Beijing: China Architecture & Building Press, 1980: 289-290.
南京化工学院, 清华大学, 华南工学院. 陶瓷材料研究方法[M]. 北京: 中国建筑工业出版社, 1980: 289-290.
[15]Evis Z, Usta M, Kutbay I. Hydroxyapatite and zirconia composites: effect of MgO and MgF2on the stability of phases and sinterability[J]. Mater Chem and Phys, 2008, 110(1):68-75.
[16]Wang Xiaohong, Cao Yang, Zhang Li, et al. Alkali and thermal treatment of titanium and its effect on the bioactivity [J]. Journal of Functional Materials, 2013, 42(2):275-280.
王小红, 曹阳, 张利,等. 碱热处理对钛表面生物活性的影响[J]. 功能材料, 2013, 44(2):275-280.
[17]Geetha M, Singh A K, Asokamani R, et al. Ti based biomaterials, the ultimate choice for orthopaedic implants- a review[J]. Prog Mater Sci, 2009, 54(3):397-425.
[18]Duan Yourong, Wang Chaoyuan, Chen Jiyong, et al. Bone -like a patite formation on caleium phos phate dense ceramics in dynamie SBF[J]. J Inorg Mater, 2002, 17(3):552-558.
段友容, 王朝元, 陈继镛,等. 致密磷酸钙陶瓷在动态SBF中类骨磷灰石层形成研究[J]. 无机材料学报, 2002, 17(3):552-558.
[19]Weng J, Liu Q, Wolke J G C, et al. Formation and characteristics of the apatite layer on plasma-sprayed hydroxyapatite coatings in simulated body fluid[J]. Biomaterials, 1997, 18(15):1027-1035.
Study on microstructure and properties of Ti-35Nb-7Zr/10CPP biocomposite
HE Zhengyuan1, ZHANG Yuqin1,2, ZHOU Rong1, JIANG Yehua1
(1. School of Materials Science and Engineering, Kunming University of Science and Technology,Kunming 650093, China;2. Engineering Technology Research Center of Titanium Products and Application of Yunnan Province,Kunming 650093, China)
Abstract:With addition of bioactive ceramic powder of calcium pyrophosphate (CPP), as 10wt% of titanium matrix, the Ti-35Nb-7Zr/10 CPP composite was prepared by spark plasma sintering (SPS) technology. The study was focus on phase composition, microstructure, mechanical properties and bioactivity of the composite. The results showed that the composite was consisted of a β-Ti phase matrix, a little residual α-Ti phase and metal-ceramic phases (CaO, Ti2O, CaTiO3, CaZrO3 and TixPy). The composite appeared low elastic modulus of 46 GPa and high compressive strength of 1 434 MPa, revealing a good mechanical compatibility. Compared to Ti-35Nb-7Zr alloy, the surface of composite was deposited lots of bone-like apatite after soaking in SBF for 7 d, which showed a good bioactivity.
Key words:biocomposite; microstructure; mechanical properties; bioactivity
DOI:10.3969/j.issn.1001-9731.2016.03.032
文献标识码:A
中图分类号:TF124; TB333
作者简介:何正员(1983-),男,山东日照人,在读博士,师承周荣教授,从事生物材料研究。
基金项目:国家自然科学基金资助项目(31160197);云南省中青年学术和技术带头人后备人才培养资助项目(2010CI011)
文章编号:1001-9731(2016)03-03175-06
收到初稿日期:2015-09-20 收到修改稿日期:2015-11-25 通讯作者:张玉勤,E-mail: zyqkust@163.com

