自发说谎的光学脑成像研究
李 放, 朱绘霖, 高倩倩, 胡自强, 郭 欢, 徐贵雄, 何赛灵
(1. 华南师范大学华南先进光电子研究院,广州 510006; 2. 华南师范大学心理学院,广州 510631)
自发说谎的光学脑成像研究
李放1,2, 朱绘霖1*, 高倩倩1,2, 胡自强1,2, 郭欢2, 徐贵雄1, 何赛灵1
(1. 华南师范大学华南先进光电子研究院,广州 510006; 2. 华南师范大学心理学院,广州 510631)
摘要:基于功能性近红外光谱技术,采用半自发说谎范式考察对个人信息自发说谎的神经机制. 实验以26名大学生志愿者为研究对象,将其分为说谎组和控制组. 在说谎组中,要求研究对象对个人信息进行自发说谎;而在控制组中,要求研究对象对个人信息全部说真话. 研究采用含氧血红蛋白增量作为神经激活的指标. 结果表明,对个人信息进行自发说谎可引发左侧额中回的显著激活,不进行自发说谎的则不引发前额皮层区域的显著激活.
关键词:自发说谎; 光学脑成像; 前额皮层
说谎是一种较复杂的心理活动,包括抑制真相、产生新反应、后果评估、了解他人心理状态等多种心理过程[1-3]. 另外,说谎具有有意性和自愿性[4-5]. 由于受主试指导下的说谎行为不符合现实情境[6],目前学者倾向采用自发说谎范式研究说谎机制,即允许被试按自己意愿对实验材料进行说谎或真实反应[7]. 自发说谎范式分为半自发说谎范式和纯自发说谎范式. 半自发说谎范式虽允许被试对实验材料自发反应,但须明确提示被试实验的目的是达到欺骗效果,且对反应模式有一定要求[4-6]. 而纯自发说谎范式则没有这些限制.
近年来,采用自发说谎范式中常用的假装记忆缺陷范式的研究取得了一系列进展. LEE等[8]研究表明,假装记忆缺陷会引发双侧前额皮层区域与双侧扣带区域等脑区的激活. 此后,LEE等[9]考察了假装记忆缺陷与无意犯错2种心理活动神经机制的区别,结果表明,假装记忆缺陷激活了腹外侧前额皮层、后扣带区域以及楔状叶区域,而无意犯错没有引发任何脑区的激活. 此外,采用其他自发说谎范式的研究也取得了进展. BAUMGARTNER等[10]考察自发违背承诺的说谎神经机制,提出违背承诺可引发背外侧前额皮层、前扣带回皮层及杏仁核的激活. ABE等[11]采用让被试有机会自发选择说谎并可获得更多奖励的范式研究发现,不诚实的被试在有机会说谎条件下,在额中回,额下回,海马、前扣带皮层区域有激活. 以上研究发现了自发说谎行为的普遍激活的脑区. 其中,腹外侧前额皮层(主要包括额下回)多与反应抑制有关[3,12-13], 背外侧前额皮层(主要包括额中回、额上回)多与推测他人心理状态、产生新反应有关[3,6],而扣带皮层区域多与后果期望、动机、调节冲突等有关[3,14-15]. 其中,前额皮层区域是与自发说谎行为关系最密切的脑区.
光学脑成像是一种新兴的脑成像技术. 其基本原理是:个体在认知活动过程中会出现含氧血红蛋白浓度的增加及脱氧血红蛋白浓度的降低. 而近红外光对组织有较强的穿透性,因此可通过计算出血液对近红外光的吸收量,推算出相应认知活动中含氧血红蛋白和脱氧血红蛋白浓度的变化值[16-18].光学脑成像技术有较好的时间分辨率和空间分辨率[19],目前普遍应用于考察如语言、注意、记忆等认知过程的神经机制中[20-22]. 光学脑成像技术具有以下突出优势:(1)对微动敏感度较低[23];(2)使用简便、成本低;(3)适合对婴儿等较特殊被试进行测量[16-23]. 目前采用光学脑成像技术对说谎研究尚处于起步阶段. 例如,DING等[24]采用光学脑成像技术初步研究了自发说谎的神经机制,结果表明,被试说谎时会引发左侧额上回的显著激活.
1研究方法
1.1实验流程
采用功能性近红外光谱技术(Functional near-infrared spectroscopy,简称fNIRS)研究对个人信息自发说谎的神经机制. 共26名大学生(男生11人,女生15人,年龄分布为19~26岁,平均年龄为23岁)参与了本实验. 测试实验采用2(说谎组、控制组)×2(任务条件、基线条件)混合设计,组别为被试间变量,实验条件为被试内变量.
首先,实验要求被试对个人信息的问题进行判断,这些问题关注被试前1天的行为(如:昨天你是否去学校外吃过饭?)或被试的固定信息(如:你是否有1个表弟?). 然后,研究者将被试随机分为“说谎组”和“控制组”(每组各13人),每组被试均需完成“任务条件”和“基线条件”. 每组的每个实验条件包含32个问题,即每个实验条件有32个随机呈现的试次. 每个试次持续15.05 s, 因此整个实验条件持续481.60 s. 被试在完成1个实验条件后进行休息,休息好后按键进入下一个实验条件.
在每个组别中,对被试完成实验条件的顺序进行平衡(即一半被试先完成任务条件,后完成基线条件;另一半被试先完成基线条件,后完成任务条件). 在说谎组中,“基线条件”即让被试对所有问题进行真实反应,而“任务条件”让被试对所有问题进行自发说谎;在控制组中,“基线条件”和“任务条件”均让被试对所有问题作真实反应. 研究采用半自发说谎范式引发说谎情景. 在该范式中,研究者首先让被试想像某种现实中需说谎的场景,告知实验目的是通过对实验材料的判断达到这种欺骗目的,并对实验材料的反应作一定限制(如告知被试不能对所有实验材料说谎,因为在实际生活中这样做容易被识别出来)[25]. 根据此方法,在“任务条件”开始前,主试要求被试想像一个被警方询问的场景. 对于说谎组被试,主试让被试想像是个逃犯,将会被警方询问,要求其对接下来的问题进行有策略的说谎以逃避惩罚. 而对于控制组被试,主试要求被试对接下来的问题全部如实回答.
将被试分为说谎组和控制组分别进行实验任务,是基于以下2点考虑:(1)在测谎的实际应用中,检出说谎者和排除无辜者同等重要. 因此,不仅要考察说谎者在测谎任务中的神经活动,也要考察无辜者在测谎任务中的神经活动,才更有利于寻找能区分两者的神经指标;(2)在现实生活中,个体在同一事件中只可能是犯罪者和无辜者的两者之一. 若让被试在同一实验中同时想象自己是犯罪者和无辜者来为自己辩护,可能造成额外的认知冲突,影响实验效果. 因而这种设计具有更高的生态效度.
1.2测试方法
采用日本岛津公司FOIRE-3000作为光学脑成像设备. 该设备包含3个波长的近红外光(780、805、830 nm),采用14.29 Hz的采样频率进行测量. 根据比尔朗伯吸收定律,血红蛋白对近红外光的吸收率可以转换为血红蛋白浓度的变化值(单位为任意单位). 本次实验使用42个测量通道,覆盖被试的整个前额皮层(光纤头架如图1A),每个通道输出个体大脑皮层含氧血红蛋白(HbO)、脱氧血红蛋白(Hb)及总血红蛋白(HbT)的浓度变化值.
选择前额皮层作为测量区域的原因:第一,前额皮层在说谎的认知机制中起到非常重要的作用. 虽在不同种类的说谎中,不同个体心理活动具有类别和程度上的差异,但抑制真相、产生新反应2种心理活动存在于所有种类的说谎中,而这2种基本心理活动又与前额皮层激活有最紧密的联系[26-27]. 第二,由于前额皮层头发较少,恰好是光学脑成像技术最为理想的测量区域, 因此,使用光学脑成像技术有利于针对性地寻找稳定指标. 本文采用国际10-10定位系统[28](图1B)定位前额皮层.

图1光学脑成像光纤头架及42个光学通道在前额皮层的位置
Figure 1Headgear for the optical brain imaging setup and the positions of 42 channels in the prefrontal cortex
选用含氧血红蛋白(HbO)变化值进行考察. 对fNIRS数据预处理如下:首先对被试数据采用Hemodynamic Response Function(简称HRF) 去除频率较高的噪音,再用 Wavelet-MDL去除漂移[24,29].然后,对每个被试在每种实验条件下的HbO变化值求平均值.考察2个组别在2种实验条件下HbO变化值的情况.
2结果与讨论
2.1自发说谎引发前额皮层HbO的变化
对2组被试分别检测“任务条件减去基线条件”后HbO的浓度变化(图2). 相对于基线条件,说谎组的任务条件在通道25、36和42处HbO浓度明显增加,而控制组任务条件在通道15处HbO浓度明显增加.
采用光学脑成像技术考察对个人信息自发说谎的神经机制,初步发现,对个人信息自发说谎可引发前额皮层的明显激活,而未进行自发说谎的条件下,前额皮层区域的激活相对不明显.
从实验方法上,自发说谎范式允许被试者在实验过程中按自己意愿选择真实反应或说谎反应,是一种更接近于现实生活情境的研究范式. 本文采用半自发说谎范式.然而,研究者在采用半自发说谎范式还是纯自发说谎范式上产生了分歧. 事实上,2种范式各有优劣:半自发说谎范式设计相对简化,容易控制,但其本质并未完全脱离主试指导下的说谎,在提升生态效度方面有一定局限;自发说谎范式更接近真实场景,更具生态效度,但实验设计通常较复杂,许多因素难以控制. 例如,在有报酬的实验中,被试很可能因希望得到更多报酬而多次说谎,甚至全部说谎. 但也有一些研究结果由于说谎暗示太过明显,又存在被试说谎反应偏少的情况[30].
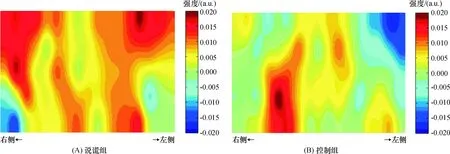
图2 2组被试“任务条件减去基线条件”的HbO浓度变化
2.2HbO浓度变化
为更精确考察2组任务条件相对于基线条件的HbO改变,以通道15、25、36和42作为感兴趣的区域(ROI)(表1),分别进行2×2重复测量方差分析,组别作为组间因子,实验条件作为组内因子.
表12组被试在相应ROI中HbO浓度变化值(平均数±标准差)
Table 1Changes in HbO concentration of the corresponding ROIs from two groups (mean±standard deviation)

a.u.
对个人信息进行撒谎的研究表明:一方面,相对于基线条件,对个人信息自发说谎会引发显著的左侧额中回区域激活. 这与以往研究既有类似又有区别. 左侧额中回区域激活的结果与BROWNDYKE等[31]、JIANG等[32]95使用其他范式的自发说谎研究的结果基本一致. 但DING等[24]采用fNIRS考察自发说谎神经机制表明,自发说谎引发了左侧额上回的激活. 造成差异的可能原因是,DING采用纯自发说谎范式,被试没有预先被告知需有策略地说谎,因此被试要花更多的努力去设计具体的反应模式,而计划则是额上回的主要功能之一[29]. 然而,DING在实验流程上,让被试者对猜硬币的结果进行自发说谎,其现实意义不及个人信息大,被试者不需过努力去抑制真相,因此没有体现出包含抑制功能的脑区激活. 而在本研究中,被试者对个人信息自发说谎会激发其更强的抑制努力. 由于额中回与抑制控制、产生新反应的功能有密切关系[29],因此,本研究说谎的激活集中体现在左侧额中回. 另一方面,本研究发现对个人信息进行真实反应没有引发左侧额中回区域的显著激活. 表明左侧额中回区域可能是对个人信息自发说谎的专属激活脑区. 在实际测谎应用中,此区域有助于较好地区分说谎者和无辜者.
为避免多重比较误差,F检验的P值采用P=0.05/4≈0.013标准(Bonferroni多重比较矫正). 结果表明,在通道42(右侧额下区域)上,组别的主效应显著(P=0.007<0.013),说谎组的HbO增加量显著大于控制组,而实验条件的主效应及组别与实验条件的交互效应均不显著(Pmin>0.013). 而在通道36(左侧额中回区域)上,组别与实验条件的主效应不显著(P>0.013), 组别与实验条件的交互效应显著(P=0.005<0.013). 简单效应分析发现,说谎组在任务条件的HbO增量显著大于基线条件,而控制组在任务条件与基线条件的HbO增量没有显著差异(图3). 另外,通道15、25的组别、实验条件的主效应以及组别与实验条件的交互效应均不显著(Pmin>0.013).

图3 2组被试在2种实验条件中通道36的HbO变化值
Figure 3Changes of HbO in Channel 36 of two conditions from two groups
将来的研究若要将测谎技术应用于司法领域,则有必要将自发说谎范式应用到特殊被试群体中,以揭示自发说谎神经机制的个体差异和测谎指标的一致性. 例如,JIANG等[32]以反社会人格障碍青少年作为研究对象,采用图片选择任务,要求被试首先从10张中性图片中随机选出3张,接着呈现一系列图片,让被试判断呈现的图片是否是被试自己挑选出来的3张图片之一. 在自发说谎条件中,要求被试有策略地说谎. 结果表明,相比真实条件,自发说谎条件在双侧背外侧前额皮层、双侧额中回、左侧缘上回、双侧前扣带回等区域有显著激活. 研究表明,反社会人格障碍青少年与普通人在自发说谎中存在相似的神经机制.
3结论
基于功能性近红外脑成像技术,采用半自发说谎范式考察对个人信息自发说谎的神经机制. 实验以26名大学生为研究对象,要求说谎组和对照组对个人信息分别进行自发说谎和全部说真话,对2组对象的脑活动采取近红外脑成像,监控脑活动引起的脑组织中含氧血红蛋白(HbO)、脱氧血红蛋白(Hb)及总血红蛋白(HbT)相对含量变化量,采用含氧血红蛋白增量作为神经激活的指标,检测感兴趣区域的显著激活. 发现对个人信息进行自发说谎可引发左侧额中回的显著激活,而未进行自发说谎的条件下前额皮层区域没有出现显著激活.
基于光学脑成像技术这一可靠、便利、成本低的测量技术,采用自发说谎这一生态效度较好的范式的研究结果,揭示了前额皮层在自发说谎中的神经机制,为自发说谎提供了有效的测谎指标,有助于进一步展开测谎的应用研究.
参考文献:
[1]YOKOTA S, TAKI Y, HASHIZUME H, et al. Neural correlates of deception in social contexts in normally developing children[J]. Frontiers in Human Neuroscience, 2013, 7(4): 424-442.
[2]KOZEL F A, JOHNSON K A, MU Q, et al. Detecting deception using functional magnetic resonance imaging[J]. Biological Psychiatry, 2005, 58(8): 605-613.
[3]SIP K E, ROEPSTORFF A, MCGREGOR W, et al. Detecting deception: the scope and limits[J]. Trends in Cognitive Sciences, 2008, 12(2): 48-53.
[4]崔茜,蒋军,杨文静,等. 欺骗的神经机制和测谎应用:来自fMRI研究的证据[J]. 心理科学进展,2013, 21(9):1629-1642.
CUI Q, JIANG J, YANG W J, et al. Neural mechanism of deception and its application to lie detection: evidences from fMRI studies[J]. Advances in Psychological Science, 2013, 21(9): 1629-1642.
[5]DERKSEN M. Control and resistance in the psychology of lying[J]. Theory & Psychology, 2012, 22(2): 196-212.
[6]SPENCE S A, KAYLOR-HUGHES C, FARROW T F, et al. Speaking of secrets and lies: the contribution of ventrolateral prefrontal cortex to vocal deception[J]. NeuroImage, 2008, 40(3): 1411-1418.
[7]PANASITI M S, PAVONE E F, MANCINI A, et al. The motor cost of telling lies: electrocortical signatures and personality foundations of spontaneous deception[J]. Social Neuroscience, 2014, 9(6): 574.
[8]LEE T C, LIU H L, CHAN C H, et al. Neural correlates of feigned memory impairment[J]. Neuroimage, 2005, 28(2): 312.
[9]LEE T M, AU R K, LIU H L, et al. Are errors differentiable from deceptive responses when feigning memory impairment? An fMRI study[J]. Brain and Cognition, 2009, 69(2): 410.
[10]BAUMGARTNER T, FISCHBACHER U, FEIERABEND A, et al. The neural circuitry of a broken promise[J]. Neuron, 2009, 64(5): 756-770.
[11]ABE N, GREENE J D. Response to anticipated reward in the nucleus accumbens predicts behavior in an Independent test of honesty[J]. Journal of Neuroscience, 2014, 34(32): 10570.
[12]SIP K E, CARMEL D, MARCHANT J L, et al. When Pinocchio’s nose does not grow: belief regarding lie-detectability modulates production of deception[J]. Frontiers in human neuroscience, 2013, 7: 16.
[13]FREEDMAN M, BLACK S, EBERT P, et al. Orbitofrontal function, object alternation and perseveration[J]. Cerebral Cortex, 1998, 8(1): 26.
[14]董珊珊,陈飞燕,何宏建.脑成像技术的测谎应用及其心理生理学基础[J].生物物理学报,2013, 29(2):102.
DONG S S, CHEN F Y, HE H J. Lie detection using brain imaging technology and its psychophysiological basis[J]. Acta Biophysica Sinica, 2013, 29(2): 102.
[16]BOAS D A, ELWELL C E, FERRARI M, et al. Twenty years of functional near-infrared spectroscopy: introduction for the special issue[J]. Neuroimage, 2014, 85(1): 1-5.
[17]刘宝根,周兢,李菲菲.脑功能成像的新方法——功能性近红外光谱技术(fNIRS)[J].心理科学,2011, 34(4):943-949.
LIU B G, ZHOU J, LI F F. Functional near-infrared spectroscopy:an emerging functional neuroimaging technology[J]. Journal of Psychological Science, 2011, 34(4): 943-949.
[18]KONTOS A P, HUPPERT T J, BELUK N H, et al. Brain activation during neurocognitive testing using functional near-infrared spectroscopy in patients following concussion compared to healthy controls[J]. Brain Imaging and Behavior, 2014, 8(4): 621-634.
[19]李军,朱志方,朱绘霖,等.自闭症患者的光学脑成像研究[J].华南师范大学学报(自然科学版),2013, 45(6):62.
LI J, ZHU Z F, ZHU H L, et al. Opticl brain imaging of Autism[J]. Journal of South China Normal University(Natural Science Edition), 2013, 45(6): 62.
[20]GALLAGHER A, BÉLAND R, LASSONDE M. The contribution of functional near-infrared spectroscopy (fNIRS) to the presurgical assessment of language function in children[J]. Brain and Language, 2012, 121(2): 124-129.
[21]DE JOUX N, RUSSELL P N, HELTON W S. A functional near-infrared spectroscopy study of sustained attention to local and global target features[J]. Brain and Cognition, 2013, 81(3): 370-375.
[22]BENAVIDES-VARELA S, GMEZ D M, MEHLER J. Studying neonates’ language and memory capacities with functional near-infrared spectroscopy[J]. Frontiers in Psychology, 2011, 2: 1-5.
[23]ZHU H, FAN Y, GUO H, et al. Reduced interhemispheric functional connectivity of children with autism spectrum disorder: evidence from functional near infrared spectroscopy studies[J]. Biomedical Optics Express, 2014, 5(4): 1270.
[24]DING X P, GAO X, FU G, et al. Neural correlates of spontaneous deception: a functional near-infrared spectroscopy (fNIRS)study[J]. Neuropsychologia, 2013, 51(4): 708.
[25]LIANG C Y, XU Z Y, MEI W, et al. Neural correlates of feigned memory impairment are distinguishable from answering randomly and answering incorrectly: an fMRI and behavioral study[J]. Brain and Cognition, 2012, 79(1): 72.
[26]GAMER M. Mind reading using neuroimaging:is this the future of deception detection?[J]. European Psychologist, 2014, 19(3): 172-183.
[27]VRIJ A. Interviewing to detect deception[J]. European Psychologist, 2014, 19(3): 184-194.
[28]KOESSLER L, MAILLARD L, BENHADID A, et al. Automated cortical projection of EEG sensors: anatomical correlation via the international 10-10 system[J]. NeuroImage, 2009, 46(1): 68.
[29]DING X P, SAI L, FU G, et al. Neural correlates of second-order verbal deception: a functional near-infrared spectroscopy (fNIRS) study[J]. NeuroImage, 2014, 87(4): 512.
[30]梁静,李开云,曲方炳,等. 说谎的非言语视觉线索[J].心理科学进展,2014, 22(6):995-1005.
LIANG J, LI K Y, QU F B, et al. The nonverbal visual cues to deception[J]. Advances in Psychological Science, 2014, 22(6): 995-1005.
[31]BROWNDYKE J N, PASKAVITZ J, SWEET L H, et al. Neuroanatomical correlates of malingered memory impairment: event-related fMRI of deception on a recognition memory task[J]. Brain Injury, 2008, 22(6): 485.
[32]JIANG W, LIU H, LIAO J, et al. A functional MRI study of deception among offenders with antisocial personality disorders[J]. Neuroscience, 2013, 244(3): 90-98.
【中文责编:谭春林英文责编:肖菁】
Optical Brain Imaging of Spontaneous Deceptions
LI Fang1,2, ZHU Huilin1*, GAO Qianqian1,2, HU Ziqiang1,2, GUO Huan2, XU Guixiong1, HE Sailing1
(1. South China Academy of Advanced Optoelectronics, South China Normal University, Guangzhou 510006, China;2. School of Psychology, South China Normal University, Guangzhou 510631, China)
Abstract:The characteristics, classification and experimental paradigm of spontaneous deceptions are studied. By introducing optical brain imaging technique, the advantages of using functional near-infrared spectroscopy (fNIRS) to examine neural mechanism of spontaneous deceptions are summarized, and the relevant studies are reviewed. The recent study shows that, spontaneous lie to personal information is associated with activation of the left middle frontal gyrus. This result once again proves significance of the prefrontal cortex during spontaneous deceptions and the feasibility of utilizing fNIRS to detect the cortical response to deception.
Key words:spontaneous deceptions; optics brain imaging; the prefrontal cortex
中图分类号:O439
文献标志码:A
文章编号:1000-5463(2016)01-0024-06
*通讯作者:朱绘霖,博士后,Email: huilin.zhu@coer-scnu.org.
基金项目:中国博士后科学基金项目(2015M580725);广东省自然科学基金-博士启动项目(2014A030310502);广东省引进创新团队计划项目(201001D0104799318)
收稿日期:2015-05-10《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n

