根际微生物群落多样性在重金属土壤修复中的研究
丁巧蓓, 晁元卿, 王诗忠, 陈燕玫, 仇荣亮
(中山大学环境科学与工程学院,广州 510275)
根际微生物群落多样性在重金属土壤修复中的研究
丁巧蓓, 晁元卿*, 王诗忠, 陈燕玫, 仇荣亮*
(中山大学环境科学与工程学院,广州 510275)
摘要:植物根际微生物在植物修复重金属污染土壤时分泌的激素、铁载体、ACC脱氨酶、黄酮类化合物和酚酸类等有机物具有增强植物生长、促进植物根际对重金属吸收、转运和积累的作用,同时促进适应相应根际环境的功能微生物群落的建立. 文章结合作者课题组的研究结果,概述根际微生物在植物修复重金属污染土壤过程中的作用,总结了根际细菌、真菌、古菌在植物修复中的作用,进一步分析了土壤污染类型、改良剂、根际植物的种类等对根际微生物活动的影响,对今后植物修复重金属污染土壤过程中与根际微生物作用相关的研究进行了展望.
关键词:重金属污染土壤; 植物修复; 根际微生物; 微生物群落
2014年《全国土壤污染状况调查公报》[1]指出,我国土壤环境状况总体不容乐观,耕地点位超标率为19.4%.污染类型以无机型为主,占全部超标点位的82.8%,主要无机污染物包括Cd、Hg、As、Cu、Pb、Cr、Zn、Ni等重金属.在全国24个省份(城市)调查的所有污染农作物种植地中,重金属污染土壤占总面积80%,全国遭受不同程度重金属污染的耕地面积已接近2 000万hm2,约占耕地总面积1/5.严重的土壤重金属污染对生态环境和人体健康构成巨大威胁,已经成为制约区域土地可持续开发利用和影响生态安全的关键因素.因此,对土壤重金属污染的修复治理势在必行.
较之传统物理化学方法,植物修复因治理过程原位、治理成本低、管理与操作简易以及环境美学兼容等不可替代的优势而受到重视[2]. 植物修复包括植物提取和植物稳定过程.植物提取主要是通过植物根系吸收可溶性重金属并将其转移、贮存到植物茎叶,然后收割茎叶以达到去除土壤重金属目的(图1A).植物稳定主要是通过植物根系的吸收、螯合、沉淀及还原作用将高毒性形态转化为低毒形态,将重金属固定在根系和根际土中[3].同时植物根际分泌物能通过改变根际环境的pH或Eh,使有毒重金属的形态发生改变,如在根际菌的作用下可将Cr6+还原为Cr3+,从而降低Cr的毒性(图1B).然而在实际应用中,植物修复技术具有修复周期长、对重金属深层污染修复困难、植株成活率低的缺点[4],修复过程中常利用化学修复与微生物修复技术以辅助植物修复,其中微生物修复技术中的根际微生物在植物修复中发挥重要作用.
根际微生物是指在植物根系直接影响的土壤范围内生长繁殖的微生物,能通过定殖、竞争、共生和调节土壤的营养动态等活动影响植物的生长[5].根际微生物对于重金属污染土壤植物修复效率的提高具有重要的辅助作用[6],主要通过合成、分泌植物促生物质增加植物生物量,同时通过功能酶、铁载体、有机酸及生物表面活性剂等物质活化土壤重金属(图1C),从而增强植物提取效果[7].此外,根际微生物还能通过生物吸附和富集作用、溶解和沉淀作用、氧化还原作用改变重金属离子在土壤中的贮存形式,以缓解重金属对植物的毒害[8].

图1 根际微生物在植物修复重金属污染土壤的作用机制
本文系统介绍了在植物修复过程中根际微生物的种类、影响根际微生物修复重金属污染的因素、关于根际微生物在植物修复重金属研究的主要观点与不足,对根际微生物在植物修复重金属污染土壤中的研究现状进行分析,并对今后植物修复重金属污染土壤过程中根际微生物作用的相关研究进行了总结和展望.
1根际微生物在植物修复过程中的群落多样性表征
大多数根际微生物对重金属产生敏感性反应,即根际微生物接触重金属后会产生应激作用,通过分泌有机酸类物质与重金属结合,抑制重金属对植物的毒害[9].利用微生物群落的敏感性反应辅助植物修复重金属污染土壤,不仅克服单一功能微生物修复过程中微生物难存活与难收集的缺点,还可改善植物修复效果,具有广阔的应用前景[10].有研究证实,不同类型微生物在植物根际的功能不同[11],主要体现在根际细菌是通过化学反应改变重金属的价态及存在形态(络合态、脱烷基),从而降低重金属毒性,根际真菌主要是辅助宿主植物获取更多的矿质营养[12],促进寄主植物在重金属污染土壤中的生长,增加其生物量,根际古菌虽存在于重金属污染土壤但其主要功能并不明晰[13].
1.1根际细菌
根际细菌数量繁多,在根际分布较广,且在根际的不同部位,细菌数量和类型分布也有差异.有研究[14]表明,相比于非根际区,根际更适宜细菌的生长.VIK等[15]通过统计植物根际和根内的操作分类单位(Operational Taxonomic Units, 简称OTUs),发现根际细菌多样性以及根际细菌的数量和种类都显著高于根内细菌.BULGARELLI等[16]发现拟南芥根际中数量最多是变形菌门细菌,且以链霉菌科和丛毛单胞菌科细菌为主导;LUNDBERG等[17]研究显示,拟南芥根际菌以放线菌门和变形菌门为主,其中变形菌门丰度最高,主要以α、β、γ 3种纲的细菌为主.
在受污染土壤中,根际细菌的数量和种类最多,且以放线菌门、厚壁菌门和变形菌门为主(表1).这3种菌门的根际细菌耐重金属性强,在重金属污染土壤中大量存在.重金属胁迫条件对根际细菌的结构与功能具有重要的影响.EISONBATY等[26]研究发现当细菌暴露于有毒物质或环境时,外界氧化胁迫的压力是使细胞死亡的一种常见机制.虽然该机制会减少土壤中根际细菌的数量、种类,影响根际细菌群落结构,但具有特定耐性功能的根际细菌群落仍能在重金属胁迫环境条件下存活.MARGESIN等[27]在Pb/Zn污染土壤中发现有较多的可培养的、需氧的Pb/Zn耐性根际细菌.SOLIS-DOMINGUEZ等[28]研究发现丛枝菌根真菌(Arbuscular Mycorrhizal Fungi, 简称AMF)影响根际细菌群落在重金属污染土壤中的修复作用,二者在植物根系进行相互选择性作用,表明根际细菌群落会受到其它类型微生物的影响.

表1 根际细菌分类情况
在重金属污染土壤中,根际细菌对重金属的抗性及解毒能力是影响植物修复的关键性因素[8].根际细菌与重金属接触后可发生离子交换、配位、螯合、沉淀等作用,使重金属离子在细胞表面结合.同时,根际细菌还能通过其自身的细胞代谢活动来调节变价重金属元素的氧化还原反应,使重金属的价态及存在形态(络合态、脱烷基)发生改变,从而降低重金属毒性[29].BAI等[30]发现枯草芽孢杆菌BacillusSubtilisDBM能通过生物吸附、积累方式降低Pb的生物有效性,通过使Pb沉淀的作用方式缓解Pb的毒性作用.RAJKUMAR等[31]发现根际细菌Pseudomonassp. PsA4和Bacillussp.Ba32能通过催化反应将高毒性的Cr6+还原成低毒性的Cr3+,从而减缓Cr对芥菜的重金属毒性.此外,土壤中还存在一些氧化硫杆菌、氧化亚铁杆菌等能直接或间接地通过氧化、还原、络合、吸附或溶解作用去除重金属,缓解植物根际的重金属毒性效应[31].可见,根际细菌在降低重金属对植物的毒害,增强植物对重金属的转化和吸收等方面起着重要作用.
根际细菌是植物修复重金属污染土壤的重要根际微生物,它能缓解重金属对植物根际的毒害效应.根际细菌群落的多样性能有效地表征植物修复重金属污染效果.因此研究根际细菌分类情况、群落结构特征及群落的功能,有利于筛选和利用在植物修复重金属污染过程中起重要作用的根际细菌,强化植物修复重金属污染土壤技术.
1.2根际真菌
根际真菌是指分布在根际周围的真菌,分为腐生真菌和菌根真菌[32].在重金属污染土壤修复实践中应用较多的是菌根真菌,主要包括内生菌根真菌、外生菌根真菌以及内外生菌根真菌.
1.2.1内生菌根真菌内生菌根真菌在促进植物生长和降低农作物对重金属吸收方面起到重要的辅助作用[33].LIU等[34]筛选出3种来自玉米根际能吸收和富集Cd的内生菌根真菌,它们分泌的植物激素可将土壤中的多磷酸盐沉淀吸附于细胞壁上,并且这些沉淀物能将Cd螯合固定在真菌细胞内,有利于缓解Cd对植物生长的毒害作用.另有研究表明,具有重金属耐性的内生菌根真菌可通过影响宿主羊茅属植物对Cd、Zn、Cu等重金属的吸收和转运机制,缓解重金属对羊茅属植物的毒害作用,与未接种内生菌根真菌的植株相比,接种处理的植株具有较高的生物量和生长指数[35].
从枝菌根真菌(AMF)在重金属污染修复,尤其是与植物联合修复方面的潜力已有较多的研究.AMF在重金属污染土壤植物修复中的作用主要是辅助寄主植物获得更多的矿质营养和提高寄主植物对重金属的抗性[36].在重金属污染土壤中,植物因缺少必需的矿质养分影响生长,而AMF的存在能帮助宿主植物获取更多的矿质营养[37].肖雪毅等[38]发现AMF能显著增加金鸡菊地上部和根系的P浓度,从而促进金鸡菊的生长并提高其生物量.AMF另可通过提高宿主植物P营养水平,使宿主植物根部中的重金属与磷酸根形成难溶物质[39],抑制重金属向地上部转运,减少植物地上部重金属含量[40].此外,AMF能够减轻重金属对寄主植物的毒性,提高寄主植物的重金属耐性[41].CHEN等[36]和DONG等[42]通过室内盆栽实验发现AMF不仅能改善植物营养元素P的浓度,还能降低植物地上部Cd、Cu和As的浓度,减轻重金属对寄主植物的毒性.在Cr污染土壤中AMF对车前草促生效应显著,减少车前草地上部分Cr的浓度,表明AMF对Cr的耐性能改变植物对重金属的积累与吸收效应[43].此外,AMF通过改变根际土壤微生物群落结构及其物理化学性质间接地影响重金属形态变化.在Mn污染土壤中,AMF能改变根际土壤中Mn氧化和Mn还原细菌群落的组成,因而降低Mn的生物有效性,减缓植物受Mn的胁迫,促进植物生长[44].
1.2.2外生菌根真菌外生菌根是高等植物营养根系和外生菌根真菌(Ectomycorrhizal Fungi, 简称ECMF)形成的共生体,在重金属胁迫条件下可将重金属固定于真菌细胞壁内,调节寄主植物细胞的生理、化学过程,阻止过多的重金属进入植物根部,以促进寄主植物的生长,增强寄主植物对重金属的耐受性[45].FINLAY等[46]发现根际ECMF优势种为担子菌门或子囊菌门.
ECMF缓解植物重金属毒害作用的机理主要是能对重金属进行吸收、转运和分布[46].Zn、Cu、Mn是植物和外生真菌所需的微量营养元素,通过吸收和氧化还原反应调整它们在植物根际的分布情况,促进植物对这些元素的吸收、转运,使植物生物量增加.过多的微量重金属进入植物根际时会对植物产生毒害.LANGER等[47]发现在ECMF的植物根际,随着Zn浓度的增加,植物根际中Zn的转运系数下降.研究[48]表明,较之无菌根植株,接种了美味牛肝菌(Boletusedulis)菌根和混合菌根的植株体内Cd以及根部Cu浓度均显著降低.可能的原因是土壤中的重金属破坏了无菌根植物根部的原生质膜,损伤了原生质膜的功能,导致重金属离子大量流入根部并向枝叶转移,而接种菌根可以减少对有害重金属的过量吸收,有效缓解土壤中重金属对植物的毒害,促进植物在重金属污染土壤中的生长,使植物生物量增加.
1.3根际古菌
古菌作为生命的第三种形式[49],主要存在和生活于极端环境中,如热泉、盐湖等,因而被归为极端微生物.研究表明,重金属污染土壤中也存在一定丰度和种类的古菌,如SANDAA等[50]研究发现,相比于无污染土壤,重金属污染土壤中古菌的数量减少1.3%±0.3%.一般认为古菌不会在植物根际存在[51],但随着研究的进展,科学家们在受重金属污染土壤的植物根际也发现了古菌[52].例如,唐黎等[49]通过提取重金属污染场地中棉花不同生长时期根际土中微生物的DNA,采用T-RFLP分析微生物群落结构,发现了在棉花根际土中有古菌存在,且古菌的群落结构受季节变化影响.OLLIVIER等[13]在Pb和As污染土壤中的植物根际发现了氨氧化细菌和氨氧化古菌,且细菌和古菌的数量不相同,有机质较低的土壤中细菌数量多于古菌,有机质较丰富的土壤中古菌的数量显著高于细菌.氨氧化过程是硝化作用的第一步,氨氧化细菌和古菌通过控制单加氧酶(amoA)的活性来控制氨氧化成亚硝酸盐的速率.研究[53-54]发现根际土中泉古菌门的古细菌含有amoA基因,证实氨氧化古菌能调控植物根际的氨氧化过程.
关于根际古菌在植物修复重金属污染土壤过程中的作用仍不清晰,根际古菌群落结构、群落功能、环境影响因子和植物的关系等关键问题仍是未知的.在今后的研究中应多关注根际古菌在植物修复重金属污染过程中对根际植株生长的影响、根际古菌自身群落结构的变化以及根际古菌群落与根际其它微生物群落的关系,进一步探索根际古菌在重金属污染土壤植物修复过程中的作用.
1.4根际微生物之间相互作用
根际微生物在重金属污染土壤中相互作用的关系主要包括消极作用、积极作用(互利共生、偏利共生)、中立作用(既无利又无害)[55].在实际的重金属污染修复中多利用根际微生物的积极作用探讨在植物根际起修复作用的微生物群落辅助植物修复重金属污染的过程.
当前,根际菌群的研究多于内生菌群的研究,因为根际微生物产生的根系分泌物对植物修复重金属污染土壤有重要作用.根际分泌的有机酸、铁载体、ACC脱氨酶、生长素等与重金属结合减少重金属对植物的毒害,增加植物的抗氧化防御系统,促进植物的生长[7].关于根际微生物种类的研究中,单独研究根际细菌的较多,研究根际细菌与真菌结合的较少,但根际真菌在植物修复重金属污染过程中能调节重金属在根际的分布情况,促进寄主植物对重金属元素的吸收、转运,减少重金属对植物的毒害,促进植物在重金属污染土壤中的生长,使植物生物量增加等作用[46-47].今后研究应多关注根际细菌与真菌结合的研究,综合利用细菌与真菌互利共生的关系,增加植物根际的重金属耐性,促进根际植物的生长,辅助根际植物修复重金属污染土壤,加强对根际古菌与其它根际微生物群落关系的研究.
2不同污染场地中根际微生物群落多样性差异及其对重金属修复效果的影响
根际微生物的活性受土壤温度、营养状况、水的可利用性及其它一些能引发群落耐性的环境污染因素的影响[56].此外,根际微生物也会受到土壤污染类型(单一或复合污染)、是否添加改良剂和改良剂种类以及根际植物种类等的影响[57].如污染土壤的理化性质会影响根际微生物的分离和纯化,土壤污染程度及土壤特性会影响根际微生物群落结构的分布,植物的种类会影响根际微生物在根际的定殖等[15].THION等[32]研究发现子囊菌亚门、担子菌亚门和接合菌亚门3种AMF,它们在不同的植物种类、土壤pH、含N量和含水量条件下物种组成和功能都各不相同,且根际土中AMF的多样性显著高于非根际土.这表明在植物修复重金属污染过程中根际微生物的结构与功能受多种因素的影响.
土壤污染的类型主要分为单一或者复合重金属污染以及重金属与有机物的复合污染.研究发现重金属种类和浓度会影响植物修复重金属过程中根际微生物的种类、丰富度及其群落结构[58-59].重金属种类能影响根际微生物的多样性,在不同种类重金属污染土壤中优势植物的种类不同,根际微生物的多样性及优势种也会有差异.表2显示,单一重金属污染条件下,植物种类不同,根际微生物的多样性和优势种有显著差异.不同种类重金属污染条件下,同种植物的根际微生物的多样性和优势种不相同.几种相同重金属污染条件下,不同植物和不同重金属浓度下的根际微生物的多样性和优势种也有所差异.不同浓度Pb污染条件,水稻根际微生物的多样性不相同[60].不同浓度As污染下,荆(Wattle)和发草(Deschampsiacaespitosa)的根际微生物多样性和优势种均有所差异[61].相同重金属元素的复合污染下,各重金属浓度不同,植物根际微生物多样性及优势种类也不同.在同一重金属污染的土壤中重金属浓度的差异使得根际微生物的多样性发生改变,产生的根际微生物的优势种也不同,可见重金属浓度对土壤中根际微生物群落结构具有重要影响.

表2 不同重金属对根际微生物多样性及优势种的影响
受重金属污染的土壤一般酸性高且贫瘠,常添加改良剂调节土壤pH、改善土壤基本理化性质[70].其中有机质改良剂(如生物炭)可以改善微生物营养,提升微生物活性[71].生物炭能为植物提供更多的营养物质促进植物生长和吸引有利的细菌以刺激真菌的生长[72].生物炭能改变根际环境的物理化学参数,为细菌和真菌提供一个安全有利的生长环境[33];添加生物炭后能改变土壤中根际微生物呼吸作用的速率,影响土壤中的碳循环,使土壤的理化性质发生改变,增加微生物的生物量,从而影响根际微生物的种类及其在根际的定殖情况[72].矿物类改良剂在植物修复重金属污染土壤中对根际微生物具有重要影响.杜瑞英等[73]研究多金属污染土壤中微生物群落功能对麻疯树-化学联合修复的响应时发现,施用改良剂粉煤灰后土壤微生物指标显著高于对照土壤,说明粉煤灰对污染土壤环境的改善具有重要的影响.改良剂的投加能沉淀重金属或提高土壤对重金属的吸附,从而降低有效态金属含量.因而施加改良剂有利于提高土壤微生物群落功能多样性,有利于加强植物修复重金属污染效果[74].
植物种类不同,根际微生物的多样性和优势种有显著差异[61-62].CLAY等[5]研究表明,重金属土壤中根际细菌的群落结构会因为植物的种植而发生改变,同时根际细菌群落的相互作用也会影响植物的多样性与修复效果.例如,在受重金属污染的连续区域中,植物根际土中的细菌群落比非根际土中的丰富很多,且不同植物的根际细菌群落结构也有差异,其中优势植物种高羊茅根际中的耐性细菌的种类与数量最多.研究者[75]认为,该区域耐性细菌与高羊茅具有最强的共生关系,这种共生关系减少了该区域的植物多样性,增强了高羊茅的优势性,使其成为该区域修复重金属的先锋植物,极大地增强了高羊茅修复重金属污染效果.根际微生物群落多样性越丰富,植物修复重金属效果越显著.
3当前研究存在的问题
关于根际微生物群落多样性在植物修复重金属污染土壤中的大多数研究只考虑单一细菌或真菌的作用(表3),其它重金属的干扰会影响修复效果.然而实际污染场地多以复合污染为主,此外,细菌和真菌都是根际微生物重要组成部分,它们对植物吸收、重金属积累都具有重要影响,单一地研究细菌或真菌无法反映出整个根际微生物群落对植物修复体系的影响.当前的研究中较少关注根际细菌与耐性植物之间的相互选择性以及重金属污染场地的植物再生.大多数研究中只关注根际细菌或真菌的群落结构变化,较少关注整个根际微生物群落的结构与功能.关于根际微生物群落结构的研究争议主要是单一污染与复合污染在哪种条件下根际微生物群落结构更丰富.THION等[32]研究发现受寄主紫花苜蓿的调控下复合污染场地中具有修复作用的真菌群落结构比较单一,真菌种类和数量都比较少.SOLIS-DOMINGUEZ等[28]研究受Pb、Cr复合污染的铅锌尾矿时发现菌根丛枝真菌与受单一重金属污染的菌根丛枝真菌相比,菌落的种类与结构更加丰富.根际微生物群落结构变化与植物修复重金属污染的作用效果紧密相关,结构丰富度越高,修复效果越好.但在具体的修复应用中根际微生物群落结构变化与修复效果的关系如何仍有待研究.
4展望
利用植物修复土壤重金属污染具有很大的潜力.在进行重金属污染土壤的生物修复过程中,重视并应用植物根际微生物转移、积累重金属的特性,实现根际微生物与超富集植物协同治理具有重要的实践价值.对于根际微生物群落多样性在植物修复重金属污染土壤的研究可从以下几方面展开:
(1)理论机制.通过植物根际微生物菌种筛选、鉴定、繁殖、菌剂生产等方面技术的应用,进一步了解根际微生物群落中各菌种的生物和生态学特征及其功能机制,采取多菌联用技术,将2种及2种以上具有相同功能的根际菌应用于植物修复重金属污染过程中,进一步加强菌种、植物根系、介质载体三者相互的复合功能研究.同时还需分析不同植物种类根际菌群的特点,根系生长对接种生物生长繁殖和生物学特征及功能的影响,根际微生物、内生菌、菌根等与宿主的关系以及根际菌增强植物抗性与促进植物吸收重金属的过程原理等.
(2)适用技术开发.重金属污染土壤的主要类型有土壤质地污染、理化性质上的污染、重金属种类与污染程度等方面的污染.由于重金属污染类型的不同,以及受污染场地地理环境的差异,如气候变化导致降水量、气温等条件的不同,用于场地重金属修复的超富集植物和耐性植物的种类多样,至今我国已发现400多种重金属超富集植物,因此,对于根际菌菌剂产品的研发要有针对性,要结合受污染场地的土壤类型特点、场地环境影响因素,以及与超富集植物或耐性植物的匹配性筛选出高效根际菌菌种或高效根际菌群,并结合植物群落的配置特点研发适用且高效的植物-微生物联合修复技术,使其向技术化的方向发展.
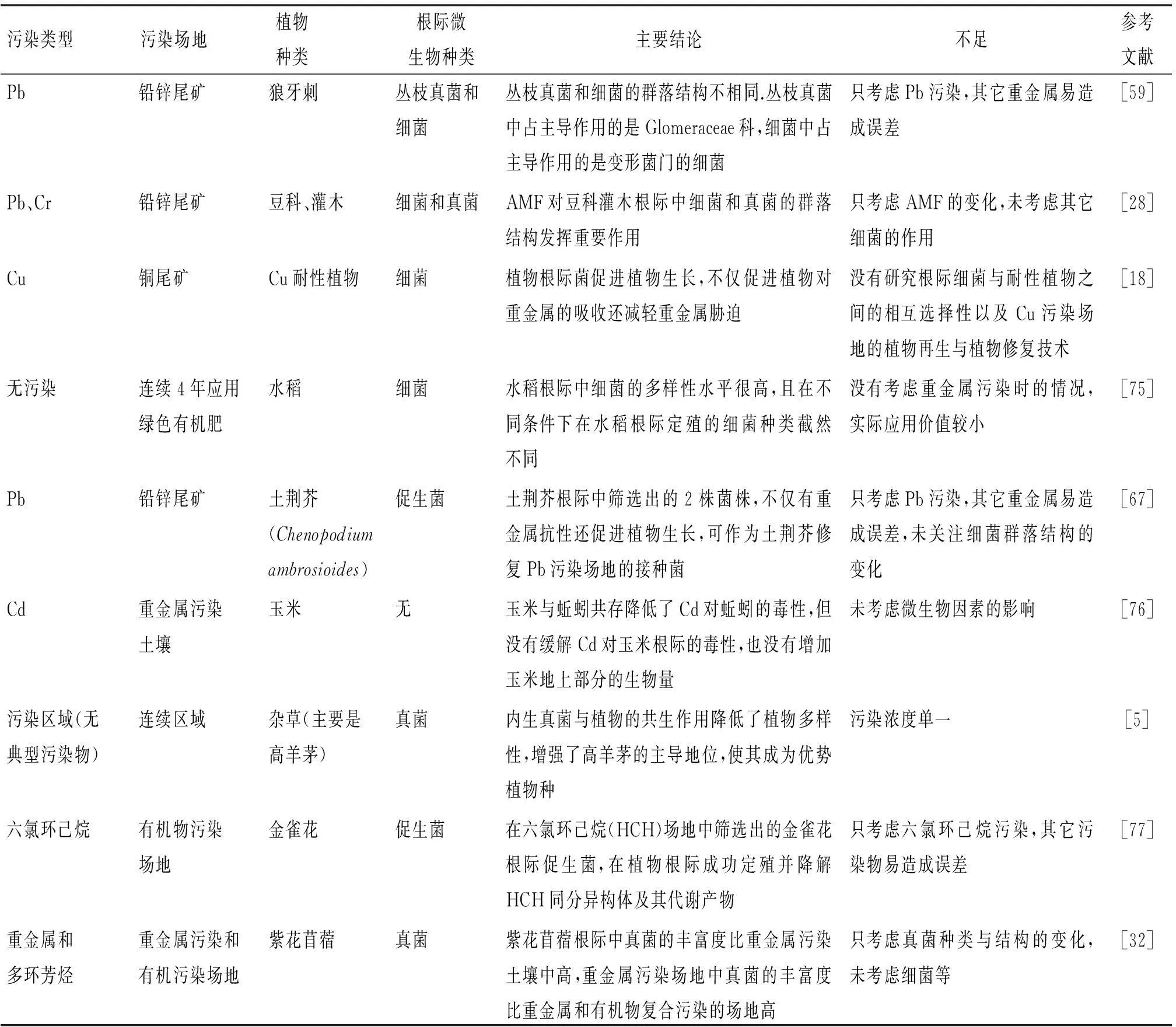
表3 根际微生物在植物修复重金属污染土壤中的应用
(3)利用生物信息学技术,对具有耐重金属特性的根际微生物群落结构进行基因测序,分析根际微生物的多样性及其优势种,进一步分析根际微生物群落结构与功能之间的关系,探讨根际微生物在植物根际的定殖机理.研究重金属污染场地中具有植物促生功能的根际促生菌群落,阐明其植物促生机制,将其有效地应用到实际生产中.
(4)技术产品安全性问题.筛选并进行繁殖的抗性根际微生物菌种,一般具有很强的抵抗重金属毒性的能力,因此在实际修复应用过程中应当注重根际微生物菌种的安全性与可控性.重金属污染土壤治理的目标之一是保护周边生态环境尤其是土壤与水域环境,在生态治理过程中应注重植物物种、微生物菌种与生态环境相互之间的关系,应用时必须综合考虑环境的生态安全问题.
参考文献:
[1]中华人民共和国环境保护部,中华人民共和国国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17)[2015-07-30].http://www.zhb.gov.cn/gkml/hbb/qt/201404/W020140417558995804588.pdf.
[2]严群,周娜娜.植物修复重金属污染土壤的技术进展[J]. 有色金属科学与工程,2012,3(5):61.
YAN Q,ZHOU N N. The technology progress of phytoremediation on heavy metal contaminated soils[J]. Nonferrous Metals Science and Engineering, 2012,3(5):61.
[3]肖鹏飞,李法云,付宝荣.土壤重金属污染及其植物修复研究[J]. 辽宁大学学报,2004,31(3):280-281.
XIAO P F,LI F Y,FU B R. Soil contaminated by heavy metal and its phytoremediation[J]. Journal of Liaoning University, 2004,31(3):280-281.
[4]陈燕玫,柏珺,杨煜曦.植物根际促生菌辅助红麻修复铅污染土壤[J]. 农业环境科学学报,2013,32(11):2159.
CHEN Y M,BAI J,YANG Y X. Phytoremediation of Pb polluted soil by kenaf with assistance of plant growth promoting rhizobectrium[J]. Journal of Agro-Environment Science,2013,32(11):2159.
[5]CLAY K, HOLAH J. Fungal endophyte symbiosis and plant diversity in successional fields[J]. Science, 1999,285(5434): 1743.
[6]DIMKPA C O, MERTEN D, SVATOS A, et al. Metal-induced oxidative stress impacting plant growth in contaminated soil is alleviated by microbial siderophores[J]. Soil Biology and Biochemistry, 2009, 41(1): 156.
[7]施积炎,陈英旭,林琦.根分泌物与微生物对污染土壤重金属活性的影响[J]. 中国环境科学,2004,24(3):316.
SHI J Y,CHEN Y X,LIN Q. The influence of root exudates and microbe on heavy metal activity in contaminated soil[J].China Environmental Science, 2004,24(3):316.
[8]马莹,骆永明,滕应.根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报,2013, 50(5): 1021.
MA Y,LUO Y M,TENG Y.Plant growth promoting rhizobacteria and their roles in phytoremediation of heavy metal contaminated soils[J].Acta Pedologica Science,2013, 50(5): 1021.
[9]CATRIONA A M, YANG X, CLARK I M, et al. Relative impact of soil, metal source and metal concentration on bacterial community structure and community tolerance[J]. Soil Biology & Biochemistry, 2010, 42(9):1409.
[10]刘劲松, 张健君, 杨淑芳.内生菌参与植物/微生物联合修复重金属污染土壤的研究进展[J].中国植保导刊,2014,34(2): 27.
LIU J S,ZHANG J J,YANG S F.Research progress on remediation of heavy metal contaminated soils by endophyte in plant-microorganism[J].China Plant Protection, 2014,34(2): 27.
[11]COMPANT S, CLÉMENT C, SESSITSCH A.Plant growth-promoting bacteria in the rhizo- and endosphere of plants:their role, colonization, mechanisms involved and prospects for utilization[J]. Soil Biology & Biochemistry,2010, 42(5): 674.
[12]CHEN Y X, WANGY P, LIN Q, et al. Effect of copper tolerant rhizosphere bacteria on mobility of copper in soil and copper accumulation by Elsholtzia splendens[J]. Environment International, 2005, 31(6):863.
[13]OLLIVIER J, WANAT N, AUSTRUY A. Abundance and diversity of ammonia-oxidizing prokaryotes in the root-rhizosphere complex ofMiscanthus×giganteusgrown in heavy metal-contaminated soils[J]. Microbial Ecology,2012, 64(4):1040.
[14]TKACZ A, POOLE P. Role of root microbiota in plant productivity[J]. Journal of Experimental Botany,2015,66(8):2167.
[15]VIK U, LOGARES R, BLAALID R, et al. Different bacterial communities in ectomycorrhizae and surrounding soil[J]. Scientific Report,2013, 3471(3):3473.
[16]BULGARELLI D, ROTT M, SCHLAEPPI K, et al. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota[J]. Nature, 2012,525(7583): 92.
[17]LUNDBERG D S, LEBEIS L, PAREDES S H, et al. Defining the coreArabidopsisthalianaroot microbiome[J]. Nature, 2012, 488(7409): 88.
[18]HE L Y, ZHANG Y F, MA H Y, et al. Characterization of copper-resistant bacteria and assessment of bacterial communities in rhizosphere soils of copper-tolerant plants[J]. Applied Soil Ecology, 2010,44 (1): 51.
[19]DELMOTTE N, KNIEF C, CHAFFRON S, et al. Community proteogenomics reveals insights into the physiology of phyllosphere bacteria[J]. Proceedings of the National Academy of Science of the United States of America,2009,106(164):29.
[20]RAIJMAKERS J M,WELLER D M. Natural plant protection by 2,4-diacetylphloroglucinol-producing seudomonasspp: in take-all decline soils[J]. Molecular Plant-Microbe Interactions, 1998,11(2):146.
[21]GURDEEP K A. Heavy metal resistance of bacteria and its impact on the production of antioxidant enzymes[J]. Cademic Journals, 2012,7(20): 2291.
[22]RASTOGI G, SBODIO A, TECH J J, et al. Leaf microbiota in an agroecosystem: spatiotemporal variation in bacterial community composition on field-grown lettuce[J]. International Society for Microbial Ecology Journal,2012,6(10):1816.
[23]LOPZE-VELASCO G, WELBAUM G E, BOYER R R, et al. Changes in spinach phylloepiphytic bacteria communities following minimal processing and refrigerated storage described using pyrosequencing of 16S rRNA amplicons[J]. Journal of Applied Microbiology, 2011,110(5):1208.
[24]FINKEL O M, BURCH A Y, LINDOW S E, et al. Geographical location determines the population structure in phyllosphere microbial communities of a salt-excreting desert tree[J]. Applied and Environmental Microbiology,2011,77(21):7649.
[25]WHIPPS J M, HAND P, PINK D,et al. Phyllosphere microbiology with special reference to diversity and plant genotype[J]. Journal of Applied Microbiology, 2008, 105(6): 1748.
[26]ElSONBATY S M, ElHADEDY D E. Combined effect of cadmium, lead, and UV rays onBacilluscereususing comet assay and oxidative stress parameters[J]. Environmental Science and Pollution Research, 2015,22(5): 3401.
[27]MARGESIN R,GRAZYNA A P,STEFANIE K.Characterization of bacterial communities at heavy-metal-contaminated sites[J]. Chemosphere, 2011,82(11):1584.
[28]SOLIS-DOMINGUEZ F A, ALEXIS V V, JON C, et al. Effect of arbuscular mycorrhizal fungi on plant biomass and the rhizosphere microbial community structure of mesquite grown in acidic lead/zinc mine tailings[J]. Science of the Total Environment, 2011,409(6): 1011.
[29]KASHEFI K,LOVLEY D R.Reduction of Fe(Ⅲ),Mn(Ⅳ),and toxic metals at 100℃ byPyrobaculumislandicum[J]. Applied and Environmental Microbiology,2000,66(3):1050.
[30]BAI J,YANG X, DU R. Biosorption mechanisms involved in immobilization of soil PbbyBacillussubtilisDBM in a multi-metal-contaminated soil[J].Journal of Environmental Sciences,2014,26(10):2064.
[31]RAJKUMAR V S. Platelet-derived growth factor-beta receptor activation is essential for fibroblast and pericyte recruitment during cutaneous wound healing[J]. American Journal of Pathology,2006,169(6): 2263.
[32]THION C, CÉBRON A, BEGUIRI STAIN T, et al. Long-term in situ dynamics of the fungal communities in a multi-contaminated soil are mainly driven by plants[J]. Microbiology Ecology, 2012,82(1): 1574.
[33]WAQAS M, KHAN A L, KANG S M, et al. Phytohormone-producing fungal endophytes and hardwood-derived biochar interact to ameliorate heavy metal stress in soybeans[J]. Biology and Fertility of Soils, 2014,50(7): 1155.
[34]LIU L Z, GONG Z Q, ZHANG Y L, et al. Growth, cadmium uptake and accumulation of maize (ZeamaysL.) under the effects of arbuscular mycorrhizal fungi[J]. Ecotoxicology, 2014, 23(10): 1984.
[35]张兴旭,南志标,李春杰.内生真菌提高禾草耐重金属胁迫的研究进展[J]. 草业科学,2014, 31(8):1467.
ZHANG X X,NAN Z B,LI C J. Research progress of improved resistance of the grass to the heavy metal stress by endophyte[J].Pratacultural Science, 2014,31(8):1467.
[36]CHEN B,XIAO X,ZHU Y G, et al.The arbuscular mycorrhizal fungusGlomusmosseaegives contradictory effects on phosphorus and arsenic acquisition byMedicagosativaLinn[J].Science of the Total Environment,2007,379(2/3):226.
[37]CHEN B D,LI X L,TAO H Q, et al.The role of arbuscular mycorrhiza in zinc uptake by red clover growing in a calcareous soil spiked with various quantities of zinc[J]. Chemosphere,2003,50(6): 839.
[38]肖雪毅.丛枝菌根真菌在植物适应铜尾矿的应用[D].北京:北京林业大学,2006:40.
XIAO X Y.Role of arbuscular mycorrhzal fungi in plant adaptation to copper mine tailings[D]. Beijing:Journal of Beijing Forestry,2006:40.
[39]BROWN S L, CHANEY R L, ANGLE J S, et al. Zinc and cadmium uptake by hyperaccumulatorThlaspicaerulescensgrown in nutrient solution[J]. Soil Science Society of America, 1995, 59: 127.
[40]LEE Y J, GEORGE E.Contribution of mycorrhizal hyphae to the uptake of metal cations by cucumber plants at two levels of phosphorus supply[J]. Plant and Soil, 2005, 278(1):361-370.
[41]TAMAYO E, GOMEZ G T, AZCON A C, et al. Genome-wide analysis of copper, iron and zinc transporters in the arbuscular mycorrhizal fungusRhizophagusirregularis[J]. Frontiers in Plant Science, 2014,5: 547.
[42]DONG Y,ZHU Y G,SMITH F A,et al.Arbuscular mycorrhiza enhanced arsenic resistance of both white clover (TrifoliumrepensLinn) and ryegrass(LoliumperenneL) plants in an a senic-contaminated soil[J]. Environmental Pollution,2008,155(1):180.
[43]NOGALES A,CORTES A,VELIANOS K,et al.Plantagolanceolatagrowth and Cr uptake alter mycorrhizal inoculation in a Cr amended substmte[J].Agriculture and Food Science,2012, 21(1):78.
[44]伍松林,张莘,陈保冬.丛枝茵根对土壤一植物系统中重金属迁移转化的影响[J]. 生态毒理学报,2013,8(6):847.
WU S L,ZHANG Q,CHEN B D.Effects of arbuscular mycorrhizal fungi on heavy metal translocation and transformation in the soil-plant continuum[J].Asian Journal of Ecotoxicology, 2013,8(6):847.
[45]黄艺,彭博,李婷.外生菌根真菌对重金属铜镉污染土壤中油松生长和元素积累分布的影响[J]. 植物生态学报,2007,31(5):923.
HUANG Y,PENG B,LI T.Growth and element accumulation ofPinustabulaeformisseedlings influenced by inoculation of ectomycorrhizal fungi in Cu and Cd contaminated soil[J].Journal of Plant Ecology, 2007,31(5):923.
[46]FINALAY R.Ecological aspects of mycorrhizal symbiosis: with special emphasis on the functional diversity of interactions involving the extra radical mycelium[J]. Journal of Experimental Botany,2008,59(5):1126.
[47]LANGER I, SANTNER J, KRPATA D,et al.Ectomycorrhizal impact on Zn accumulation ofPopulustremulaL. grown inmetalliferous soil with increasing levels of Zn concentration[J]. Plant and Soil,2012,355(1/2):297.
[48]TICHELEN K V, COLPAERT J V,VANGRONSVELD J. Ectomycorrhizal protection ofPinussylvestrisagainst copper toxicity[J]. New Phytologist, 2001,150:213.
[49]唐黎, 张永军, 吴晓磊.转Bt基因棉花根际细菌与古菌群落结构分析[J]. 土壤学报, 2007, 44(4): 717.
TANG L,ZHANG Y J,WU X L.Bacterial and archaeal community structure in rhizosphere soil planting Bt transgenetic cotton[J].Acta Pedologica Sinica, 2007, 44(4): 717.
[50]SANDAA R A,ENGER O, TORSVIK V. Abundance and diversity ofArchaeain heavy-metal-contaminated soils[J]. Applied Environment Microbiology, 1999,65(8):3296.
[51]SKOPHAMMER R G, HERBOLD C W, RIVERA M C, et al. Evidence that the root of the tree of life is not within theArchaea[J]. Molecular Biology Evolution, 2006,23(9):1648.
[52]SULLVAN T S, MCBRIDE M B, THIES J E. Rhizosphere microbial community and Zn uptake by willow (SalixpurpureaL.) depend on soil sulfur concentrations in metalliferous peat soils[J]. Applied Soil Ecology, 2013,67(5): 53.
[53]TREUSCH A H, LEININGER S, KLETZIN A, et al. Novel genes for nitrite reductase and amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J]. Environmental Microbiology, 2005, 7(12): 1986.
[54]CHRISTA S, GERMAN J, MELANIE J. Genomic studies of uncultivated archaea[J]. Nature Review of Microbiology, 2005, 3(6): 479.
[55]SINGH B K, PETER M, WHITELEY A S, et al. Unravelling rhizosphere-microbial interactions: opportunities and limitations[J].Trends in Microbiology,2004,12(8):386.
[56]MERTENS J, WAKELIN S A, BROOKS K. Extent of copper tolerance and consequences for functional stability of the ammonia-oxidizing community in long-term copper-contaminated soils[J]. Environmental Toxicology and Chemistry,2010,29(1):27.
[57]MGAVD H, KLAUS S. Root surface as a frontier for plant microbiome research[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015,112(8): 2299.
[58]DEANGELIS K, BRODIE E L, DESANTIS T Z, et al. Selective progressive response of soil microbial community to wild oat roots[J].The International Society for Microbial Ecology Journal, 2009,3(2):168.
[59]XU Z Y, TANG M, CHEN H, et al. Microbial community structure in the rhizosphere ofSophoraviciifoliagrown at a lead and zinc mine of northwest China[J]. Science of the Total Environment, 2012,435: 453.
[60]RONG H,CHEN X C, HU S P, et al. Lead availability and soil microbial community composition in rice rhizosphere affected by thiosulfate addition[J]. Applied Soil Ecology, 2010,45(3):234.
[61]CAVALCA L, CORSINI A, CANZI E, et al. Rhizobacterial communities associated with spontaneous plant species in long-term arsenic contaminated soils[J]. World Journal of Microbiology and Biotechnology,2015, 31(5):735.
[62]LU M, XU K, CHEN J,et al. Effect of pyrene and cadmium on microbial activity and community structure in soil[J]. Chemosphere, 2013, 91: 495.
[63]JEONG S, MOON H S, SHIN D, et al. Survival of introduced phosphate-solubilizing bacteria (PSB) and theirimpact on microbial community structure during the phytoextraction of Cd-contaminated soil[J]. Journal of Hazardous Materials,2013,263: 447.
[64]XU P, LENG Y, ZENG G. et al. Cadmium induced oxalic acid secretion and its role in metal uptake and detoxification mechanisms inPhanerochaetechrysosporium[J]. Applied Microbiology and Biotechnology, 2015,99(1): 435.
[65]SHI Y, LOU K, LI C. Promotion of plant growth by phytohormone-producing endophytic microbes of sugar beet[J]. Biology and Fertility of Soils, 2011, 45(6): 646.
[66]HUR M, KIM Y, SONG H R, et al. Effect of genetically modified poplars on soil microbial communities during the phytoremediation of waste mine tailings[J].Applied and Environmental Microbiology,2011,77(21):7617.
[67]ZHANG W H, HUANG Z, HE L Y, et al. Assessment of bacterial communities and characterization of lead-resistant bacteria in the rhizosphere soils of metal-tolerantChenopodiumambrosioidesgrown on lead-zinc mine tailings[J]. Chemosphere, 2012,87(10): 1175.
[68]LI X F, HUANG L B, PHILIP L B, et al. Bacterial diversity in response to direct revegetation in the Pb-Zn-Cutailings under subtropical and semi-arid conditions[J]. Ecological Engineering, 2014,44(3):238.
[69]TIPAYNO S, KIM C G,SA T.T-RFLP analysis of structural changes in soil bacterial communities in response tometal and metalloid contamination and initial phytoremediation[J]. Applied Soil Ecology,2012,61: 143.
[70]MCGOWEN S L, BASTA N T, BROWN G O. Use o f diammonium phosphate to reduce heavy metal solubi-lity and transport in smelter-contaminated soil[J]. Journal of Environmental Quality, 2001,30(2):493.
[71]JOHANNES R, PHILIP C B, ERLAND B. Investigating the mechanisms for the opposing pH relationships of fungal and bacterial growth in soil[J]. Soil Biology & Biochemistry,2010,42:926.
[72]STEINBEISS S, GLEIXNER G, ANTONIETTI M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology & Biochemistry, 2009,41(6): 1301.
[73]杜瑞英,柏珺,王诗忠,等.多金属污染土壤中微生物群落功能对麻疯树-化学联合修复的响应[J]. 环境科学学报, 2011, 31(3): 575.
DU R Y,BAI J,WANG S Z, et al.Response of soil microbial community function to chenical aided remediation of multimetal contaminated soils usingJatrophacurcas[J].Acta Scientiae Circumstantiae, 2011, 31(3): 575.
[74]杜瑞英.土壤改良剂和红麻联合修复对多金属污染土壤中微生物群落功能的影响[J]. 生态与农村环境学报, 2012,29(1):75.
DU R Y. Effects of application of soil amendment and cultivation of red ramie in remedying multi-metal contaminated soils on functions of soil microbial community[J].Journal of Ecology and Rural Environment, 2012,29(1):75.
[75]ZHANG X X, GAO J S, CAO Y H, et al. Long-term rice and green manure rotation alters the endophytic bacterial communities of the rice root[J]. Microbial Ecology, 2013,66(4): 926.
[76]DU Y L, HE M M, XU M, et al. Interactive effects between earthworms and maize plants on the accumulation and toxicity of soil cadmium[J]. Soil Biology and Biochemistry, 2014, 72: 193.
[77]BCERRAC C, KIDD P S, PRIETOFEM N, et al. Endophytic and rhizoplane bacteria associated withCytisusstriatusgrowing on hexachlorocyclohexane-contaminated soil: isolation and characterisation[J]. Plant and Soil, 2010,340(1/2): 432.
Research on Function of Rhizosphere Microbial Diversity in Phytoremediation of Heavy Metal Polluted Soils
DING Qiaobei, CHAO Yuanqing*, WANG Shizhong, CHEN Yanmei, QIU Rongliang*
(School of Environmental Science and Engineering, Sun Yat-Sen University, Guangzhou 510275, China)
Abstract:Rhizosphere microbes play important roles in phytoremediation of heavy metal polluted soils. They can strengthen the growth of plants and promote absorption, transportation and accumulation of heavy metals in the rhizosphere by excreting plant growth hormone, siderophore, 1-aminocyclopropane-1-carboxylate (ACC) deaminase, flavonoids compounds, phenolic acids and other organic substances. These secretions could further produce functional microbial community which can adapt to the stressed rhizosphere environment. The roles of rhizosphere microbes in phytoremediation of heavy metal contaminated soils was reviewed. Based on the systematical summary on the functions of rhizospheric bacteria, fungi and archaea in phytoremediation, the influences by pollution type, ameliorant and rhizosphere plant species to rhizosphere microbial activities were reported. The perspectives of the future research on related issues were also discussed.
Key words:heavy metal contaminated soil; phytoremediation; rhizosphere microbes; microbial community
中图分类号:Q89;X53
文献标志码:A
文章编号:1000-5463(2016)02-0001-12
*通讯作者:晁元卿,讲师,Email:chaoyuanq@mail.sysu.edu.cn;仇荣亮,教授,Email:eesqrl@mail.sysu.edu.cn.
基金项目:国家自然科学基金项目(41403060,2012AA06A202)
收稿日期:2015-08-30《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n

