乌鸡肽对环磷酰胺致免疫低下小鼠的免疫调节作用
朱小语,许丹,陈晓文,冯金秋,范爱琴,蔡木易,许雅君*,潘兴昌*
1(北京大学 医学部公共卫生学院,北京,100191) 2(中国食品发酵工业研究院,北京,100027)
乌鸡肽对环磷酰胺致免疫低下小鼠的免疫调节作用
朱小语1,许丹1,陈晓文1,冯金秋1,范爱琴1,蔡木易2,许雅君1*,潘兴昌2*
1(北京大学 医学部公共卫生学院,北京,100191) 2(中国食品发酵工业研究院,北京,100027)
摘要研究乌鸡肽对环磷酰胺致免疫低下小鼠的免疫调节作用。将60只ICR雌性小鼠按体重随机分成对照组、环磷酰胺模型组、乌鸡肽低、中、高剂量组。对照组连续腹腔注射3 d,80 mg/(kg·d)生理盐水,其余各组腹腔注射等量环磷酰胺建立免疫力低下模型,同时对照组、环磷酰胺模型组以2 g/(kg·bw)酪蛋白灌胃,乌鸡肽低、中、高剂量组分别以0.5、1、2 g/(kg·bw)乌鸡肽灌胃15 d。在实验结束后测量小鼠体重、免疫脏器指数、胸腺、脾脏形态学变化、骨髓有核细胞数、白细胞计数、T淋巴细胞亚群、细胞因子等。造模后,模型组小鼠骨髓有核细胞数、DNA含量、白细胞数、CD3+、CD8+均低于对照组,差异有统计学意义。乌鸡肽组比模型组小鼠显著增加骨髓有核细胞数、白细胞计数、CD3+、CD8+等,差异有统计学意义。乌鸡肽可改善环磷酰胺所致免疫低下小鼠的免疫功能。
关键词乌鸡肽;生物活性肽;环磷酰胺;免疫调节
乌鸡又名乌骨鸡、泰和鸡、武山鸡、竹丝鸡、丝羽乌骨鸡等[1],属脊索动物门,鸟纲,鸡形目,雉科,鸡属[2],是世界稀有、我国特有的药食同源珍禽[3]。我国古籍医书《本草纲目》、《神农本草经》、《食疗本草》、《中药志》[4]等均对乌鸡的滋补强壮、防治疾病的作用进行了详细记载。乌鸡营养价值丰富,因皮肤和内脏内含有抗氧化功能的黑色素[5],富含蛋白质和氨基酸,肌肉中脂肪酸含量合理,具有种类齐全且丰富的维生素和矿物质而备受关注[6]。
生物活性肽是结构介于蛋白质和氨基酸之间,分子质量小于6 000 u,具有抗氧化[7]、增强免疫力[8]、促进矿物质吸收[9]、抗炎[10]、抗菌[11]、降胆固醇[12]、抗血栓[13]等多种生理功能的肽类的统称。乌鸡肽作为生物活性肽的一种,是以乌鸡为原料,经酶解、分离、提纯后制得的低分子肽类[14]。研究表明,乌鸡肽可以通过促进巨噬细胞吞噬能力,来增强免疫调节功能[15]。然而,目前对于乌鸡肽免疫调节作用的细胞免疫、体液免疫途径并未做深入研究。为此,本实验通过分析乌鸡肽对环磷酰胺致免疫低下小鼠的体重、免疫脏器指数、骨髓细胞计数、骨髓DNA含量、细胞因子、T淋巴细胞亚群、白细胞计数等指标的影响,探讨乌鸡肽的免疫调节作用,为乌鸡肽的进一步开发与应用提供依据。
1材料与方法
1.1受试物
乌鸡肽干粉由中国食品发酵工业研究院提供,是由乌鸡蛋白经酶解制得的相对分子量低于1 000 u的寡肽混合物,其氨基酸组成见表1。
表1乌鸡肽的氨基酸组成

单位:g/(100g)
注:a)天冬氨酸+天冬酰胺(Asp+Asn);b)谷氨酸+谷氨酰胺(Glu+Gln)
1.2 实验动物
SPF级ICR健康雌性小鼠60 只,初始体重18~22 g,购自北京大学医学部实验动物科学部,合格证号:SCXK(京)2009-0008。饲养于屏障环境,温度范围为(22±2) ℃,相对湿度为50%~60%,明暗交替时间为12 h∶12 h,自由进食、饮水。
1.3仪器与试剂
美国BD FACSCalibur流式细胞仪,日本光电工业株式会社全自动血细胞分析仪MEK-7222K,UNIC-UV2100紫外可见分光光度计,SPN3001F电子天平,NIKON TE2000-S倒置荧光显微镜,BFX5-320自动平衡离心机,Sigma C5890酪蛋白,Sigma C0768环磷酰胺。
1.4模型制备
实验动物适应性喂养1 d,正式实验第1天称量小鼠初始体重,并按体重随机分为5组,每组12只,分别为对照组、环磷酰胺模型组、乌鸡肽低剂量组、乌鸡肽中剂量组和乌鸡肽高剂量组。对照组腹腔注射3 d,80 mg/(kg·d)生理盐水,其余各组连续腹腔注射3 d等浓度环磷酰胺,建立免疫低下小鼠模型。并于正式实验第1天开始,每天给对照组、环磷酰胺模型组2 g/(kg·bw)酪蛋白灌胃,以传统动物优质蛋白-酪蛋白作为对照。乌鸡肽低、中、高剂量组0.5、1、2 g/(kg·bw)乌鸡肽灌胃,实验持续15 d。
1.5检测指标
1.5.1体重及免疫脏器指数
灌胃第15天,称量小鼠终末体重。去眼球取血后,脊髓离断处死小鼠,剖离胸腺和脾脏,用电子天平称取小鼠胸腺、脾脏重量,并分别计算胸腺指数和脾脏指数。免疫脏器指数=脏器质量(mg)/体质量(g)。
1.5.2免疫脏器细胞形态学观察
将称重后的胸腺和脾脏固定于10%甲醛溶液中,石蜡包埋、切片,苏木精-伊红染色(HE染色),显微镜下观察胸腺组织和脾脏组织的形态学变化。
1.5.3骨髓有核细胞计数及DNA含量
将小鼠处死后,剖取各组小鼠左侧股骨,剔除周围附着的肌肉和筋膜,用10%浓度盐酸冲出小鼠骨髓液。每组6只小鼠进行骨髓有核细胞浓度测定,在显微镜下用血球计数板计数。另外6只小鼠进行骨髓DNA含量测定,采用紫外吸光光度计测量260 nm波长处OD值。
1.5.4外周血白细胞计数
将每组6只小鼠去眼球取血,全血滴入肝素抗凝管中,并用激光法对血常规五分类进行检测。
1.5.5外周血T淋巴细胞亚群检测
取外周血白细胞计数后的小鼠抗凝管中全血,采用流式细胞术检测外周血CD3+、CD4+、CD8+T淋巴细胞亚群百分率,并计算相应CD4+/CD8+比值。
1.5.6血清中细胞因子的测定
取每组6只小鼠T淋巴细胞亚群检测后血清20 μL,采用CBA流式液相多重蛋白定量法,用流式细胞仪测定小鼠血清中IL-2、IL-4、IL-5、IL-6、IL-10、IL-17、IL-1a、IFN、GM-CSF细胞因子含量。
1.6统计分析
数据均采用SPSS 21.0统计软件处理,结果以均数±标准差表示,采用单因素方差分析并进行方差齐性检验。若方差齐,则使用最小显著差法;若方差不齐,则使用Tamhane’s T2检验。P值小于0.05时,表明结果有统计学意义。
2结果
2.1体重和免疫脏器指数
如表2,各实验组间小鼠初始体重和终末体重并无统计学差异,且胸腺和脾脏指数各组间也并无明显差异。

表2 乌鸡肽对环磷酰胺致免疫低下小鼠体重和
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
2.2免疫脏器细胞形态学观察
如图1,在光学显微镜下对胸腺HE染色切片进行观察,可见对照组的胸腺皮质、髓质分界清晰,皮质面积大于髓质面积,且皮质颜色较深。环磷酰胺模型组中皮、髓分界不清,皮质面积缩小,且颜色变浅。乌鸡肽低、中、高剂量组相对于模型组而言,脾脏皮质颜色逐渐增深,皮质不断增厚,皮、髓交界清晰,且在高倍镜下可见乌鸡肽干预组淋巴细胞数量较模型组显著增加。
如图2,对照组脾小结发育良好,模型组脾小结相对并不完整,乌鸡肽低、中、高干预组脾小结结构完整。且在高倍镜下,可见模型组脾脏淋巴细胞数目较对照组减少,且在乌鸡肽干预中较模型组有不断增加。

A-对照组;B-环磷酰胺模型组;C-乌鸡肽低剂量组;D-乌鸡肽中剂量组;E-乌鸡肽高剂量组图1 乌鸡肽对环磷酰胺致免疫低下小鼠胸腺组织形态学变化影响(×100)Fig.1 Effect of SFP on morphologic variations of thymus of immunosuppression mice induced by cyclophosphamide(×100)

A-对照组;B-环磷酰胺模型组;C-乌鸡肽低剂量组;D-乌鸡肽中剂量组;E-乌鸡肽高剂量组图2 乌鸡肽对环磷酰胺致免疫低下小鼠脾脏组织形态学变化影响(×100)Fig.2 Effect of SFP on morphologic variations of spleen of immunosuppression mice induced by cyclophosphamide(×100)
2.3骨髓有核细胞计数及DNA含量
如图3,骨髓有核细胞计数结果表明,模型组与对照组相比有显著降低,差异有统计学意义。乌鸡肽低、中、高剂量组骨髓有核细胞浓度,与模型组相比有显著增高,表明乌鸡肽干预的明显保护作用。骨髓DNA含量,如图4,造模组骨髓DNA含量与对照组相比显著下降,乌鸡肽干预组较造模组DNA含量显著上升,且差异有统计学意义。

1对照组;2环磷酰胺造膜组;3乌鸡肽低剂量组;4乌鸡肽中剂量组;5乌鸡肽离剂量组图3 乌鸡肽对对环磷酰胺致免疫低下小鼠股骨骨髓有核细胞浓度的影响Fig.3 Effect of Sily fowl peptide on on concentration of bone marrow cells of immunosuppression mice induced by cyclophosphamide(注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01)

1对照组;2环磷酰胺造膜组;3乌鸡肽低剂量组;4乌鸡肽中剂量组;5乌鸡肽离剂量组图4 乌鸡肽对对环磷酰胺致免疫低下小鼠股骨骨髓DNA含量的影响Fig.4 Effect of SFP on bone marrow DNA content of immunosuppression mice induced by cyclophosphamide(注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01)
2.4外周血白细胞计数
由图5可见,小鼠给予环磷酰胺后外周血白细胞计数显著下降,乌鸡肽干预后白细胞计数有明显恢复,低、中剂量组数值较模型组增高,差异无统计学意义,而乌鸡肽高剂量组外周血白细胞数较模型组显著增高。
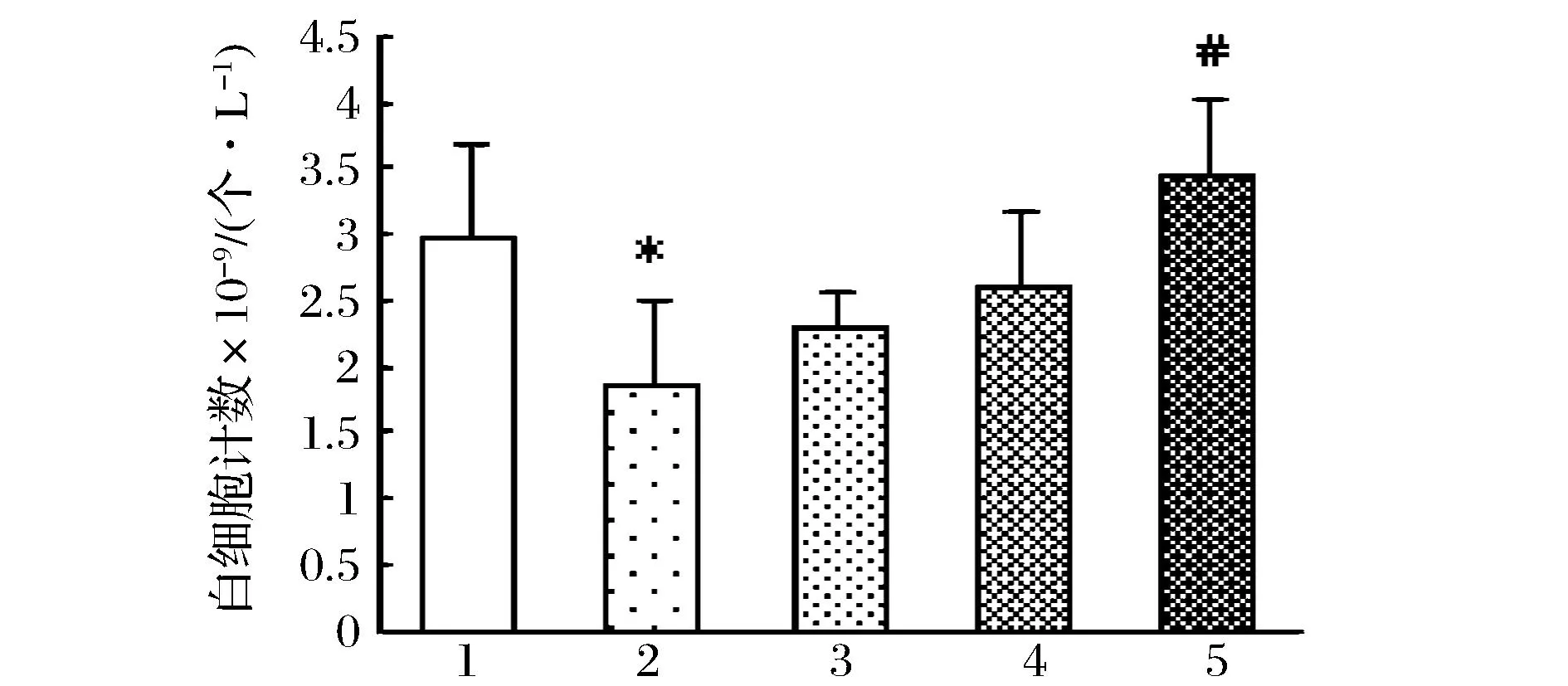
1对照组;2环磷酰胺造膜组;3乌鸡肽低剂量组;4乌鸡肽中剂量组;5乌鸡肽离剂量组图5 乌鸡肽对环磷酰胺致免疫低下小鼠外周血白细胞计数的影响Fig.5 Effect of SFP on on white blood cell count of immunosuppression mice induced by cyclophosphamide(注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01)
2.5外周血T淋巴细胞亚群检测
如表3,各试验组外周血CD4+T淋巴细胞百分率及CD4+/CD8+比值,与对照组和模型组相比,均无显著差异(P>0.05)。模型组和乌鸡肽低剂量组CD3+T淋巴细胞百分率显著低于对照组,而乌鸡肽中、高剂量组CD3+T淋巴细胞百分率显著高于模型组。对CD8+T淋巴细胞百分率而言,模型组显著低于对照组,且乌鸡肽高剂量显著高于模型组。
2.6血清中细胞因子水平的测定
如表4,血清细胞因子测定结果表明,小鼠注射环磷酰胺后,IL-2、IL-6、IL-10、IL-1a和IFN各剂量组间没有显著差异。模型组IL-5水平显著较对照组增高,且乌鸡肽中、高剂量组较模型组有显著地降低。此外,GM-CSF与IL-5趋势相近,模型组水平显著增高,乌鸡肽各剂量组较模型组明显降低。且IL-4乌鸡肽中剂量组较环磷酰胺组有明显增高,IL-17中、高剂量组较模型组显著降低。

表3 乌鸡肽对对环磷酰胺致免疫低下小鼠T淋巴
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。

表4 乌鸡肽对环磷酰胺致免疫低下小鼠细胞因子的影响
注:与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
3讨论
乌鸡肽作为一种重要的生物活性肽,具有抗自由基氧化[16]、增强免疫力等功效。然而,目前对于乌鸡肽的增强免疫力功能还仅局限于对巨噬细胞影响的研究。为此,本实验使用目前较为常用的化学造模剂环磷酰胺,一次大剂量给药造模,降低小鼠免疫功能,建立良好的免疫低下模型[17]。与此同时,本研究选用传统优质动物蛋白-酪蛋白作为对照组,评定乌鸡生物活性肽的功能。
胸腺和脾脏是机体重要的淋巴器官,其功能与机体免疫息息相关。胸腺是T淋巴细胞发育成熟的器官,乌鸡肽干预组与模型组相比可使皮质增厚,皮髓交界清晰,淋巴细胞数增多。脾脏是成熟T、B淋巴细胞定居的器官,乌鸡肽干预组与模型组相比,明显增加脾脏淋巴细胞数,维持脾小结结构的完整。表明乌鸡肽干预组虽然对胸腺、脾脏指数并无明显影响,但对于胸腺、脾脏组织形态学产生影响,乌鸡肽可在一定程度上增加免疫抑制小鼠的胸腺淋巴细胞的数量,并促进脾小结的发育[18]。
骨髓是机体重要的造血、免疫器官,骨髓经分化可生成红细胞、白细胞、血小板等各种血细胞而发挥其生理功能[19]。本实验观察到环磷酰胺造模组小鼠的白细胞计数、骨髓有核细胞数量以及骨髓DNA含量,与对照组相比均有明显下降。表明,环磷酰胺可以造成骨髓抑制,并引起外周血白细胞减少。而乌鸡肽各剂量组骨髓有核细胞计数均高于模型组,且乌鸡肽高剂量组白细胞计数明显高于模型组。表明,乌鸡肽对免疫低下小鼠的骨髓抑制状态有明显改善。
T淋巴细胞在机体细胞免疫功能中发挥着免疫防御、免疫调节等重要作用,包括CD3+、CD4+、CD8+T淋巴细胞。CD8+T细胞具有细胞毒性,通过抑制T细胞活化和B细胞产生抗体,进而达到抑制机体免疫的作用。与之相反,CD4+T细胞在细胞免疫过程中起着辅助作用。实验观察到,乌鸡肽可显著提高免疫低下小鼠脾脏中CD3+、CD8+T淋巴细胞水平,且乌鸡肽干预组CD4+/CD8+较模型组绝对值有所降低,提示乌鸡肽对免疫低下小鼠的细胞免疫具有改善功效[20]。
细胞因子是由免疫细胞分泌的一类具有免疫调节功能的蛋白或小分子肽类,按照分泌细胞不同,分为淋巴因子、单核因子等[21]。本实验中,IL-4、IL-5、IL-17为由T淋巴细胞分泌的淋巴因子,GM-CSF为巨噬细胞源性细胞因子。在环磷酰胺造模后,乌鸡肽干预可使IL-4、IL-5、IL-17、GM-CSF细胞因子水平向对照组回归。表明乌鸡肽干预,可以通过下调炎症因子IL-17、GM-CSF等的表达,在免疫机制中发挥保护作用。
研究表明,生物活性肽较游离氨基酸更易于通过肠壁转运,具有增强生物体免疫力、促进淋巴细胞增殖、促进抗体合成以及调节细胞因子等作用[22]。本实验中受试物乌鸡肽的小分子蛋白质含量占96.74%,且赖氨酸、 亮氨酸和精氨酸含量较高,具有较好的免疫调节活性。综上所述,乌鸡肽可通过改善环磷酰胺致免疫低下小鼠骨髓造血、免疫功能,免疫脏器形态学变化,淋巴细胞、细胞因子等,来起到免疫调节作用。
4结论
本实验初步探究了乌鸡肽对环磷酰胺致免疫低下小鼠初始、终末体重,免疫脏器指数,胸腺、脾脏组织形态变化,骨髓有核细胞数、DNA数,外周血白细胞数、以及T细胞亚群、细胞因子的影响,结果提示乌鸡肽对小鼠中枢免疫系统和外周免疫系统均具有较显著的保护作用,其分子机制有待进一步的研究。
参考文献
[1]李俊波.乌骨鸡营养与利用研究进展[J].禽畜业,1997,(8):47-49.
[2]李瑞成,尚永,管俊峰.乌骨鸡黑色素及其研究进展[J].肉类研究,2010(10):54-59.
[3]房兴堂,薛忠,王庆林.乌骨鸡的研究进展及产品开发[J].经济动物学报,2001,5(2):52-58.
[4]魏华,杨荣鉴,谢俊杰.乌骨鸡营养保健作用研究动态[J].夭然产物研究与开发,1995,7(3):85-91.
[5]贺淹才.我国的乌骨鸡与中国泰和鸡及其药用价值[J].中国农业科技导报,2003,5(1):64-66.
[6]吴红静,周晓琴.乌骨鸡种质概况及营养成分研究进展[J].雅安职业技术学院学报,2008,22(2):21-23.
[7]杨闯.生物活性肽在营养保健中的应用[J].食品科学,2003,24(12):153-154.
[8]宋琳琳,陈立,陈五岭.食源性生物活性肽对小鼠免疫功能的影响[J].生命科学与医药学,2009,39(4):612-616.
[9]张贵川,袁吕江.食源性生物活性肽的研究进展[J].中国粮油学报,2009,24(9):157-162.
[10]周婕慧,金赢凯,徐海红,等.生物活性肽的抗炎功能及其对氧化应激的调节作用[J].中国乳品工业,2014,42(3):4-14.
[11]李维,兰海,郭风,等.生物活性肽的研究进展[J]. 动物营养与饲料科学,2012,39(10):105-107.
[12]李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-9.
[13]曾晓波,林永成,王海英.食物中的生物活性肽:生物活牲及研究进展[J].食品工业科技,2004,25(4):151-154.
[14]刘艳,谷瑞增,鲁军.乌鸡低聚肽的成分分析及抗氧化活性研究[J].食品科技,2015,40(3):236-240.
[15]魏颖,谷瑞增,林峰.乌鸡肽免疫调节作用的研究[J].食品研究与开发,2014,35(16):1-4.
[16]刘文颖,马永庆,金振涛.乌鸡低聚肽体外抗氧化活性研究[J].食品与发酵工业,2010,36(10):19-23.
[17]杨颖,蔡玟,黄志彪.环磷酰胺致小鼠免疫功能低下模型建立与评价[J].中国公共卫生,2008,24(5):581-583.
[18]陈海英,陈建明,郑建盛.胸腺细胞渐进性凋亡对大鼠脾脏淋巴细胞增殖功能的影响[J].长治医学院学报,2009,23(2):95-98.
[19]贾亮亮,奚炜,金桂兰.地榆升白片对环磷酰胺致小鼠骨髓抑制的拮抗作用[J].中国实验方剂学杂志,2012,18(18):251-254.
[20]叶雷,陈庆森,李伟.乳源酪蛋白糖巨肽对小鼠外周血T淋巴细胞亚群的影响[J].食品科学,2014,35(11):209-214.
[21]姚金晶,陈宜涛.Th1/Th2平衡调节与疾病发生的研究进展[J].现代生物医学进展,2009,9(13):2 597-2 600.
[22]龚建苗,陈庆森,阎亚丽,等.生物活性肽调节NF-κB信号通路的研究进展[J].食品科学,2013,34(21):379-388.
Immuno-regulation effects of silky fowl peptide on immunosuppressed mice induced by cyclophosphamide
ZHU Xiao-yu1, XU Dan1, CHEN Xiao-wen1, FENG Jin-qiu1,FAN Ai-qin1, CAI Mu-yi2, XU Ya-jun1*, PAN Xing-chang2*
1(School of Public Health, Peking University Health Science Center, Beijing 100191, China) 2(China National Research Institute of Food & Fermentation Industries, Beijing 100027, China)
ABSTRACTThe objective of this paper was to investigate the immuno-regulation effects of sily fowl peptide (SFP) on mice with immunosuppression. Sixty ICR male mice were randomly divided into five groups based on their weight, including control group, cyclophosphamid model group, SFP low dose group, SFP moderate dose group and SFP high dose group. Control group was given intraperitoneal injection of saline (80 mg/kg·d), and other four groups were given equivalent dose of cyclophosphamid through intraperitoneal injection for three days to establish an immunosuppression model. At the same time, control group and model group received casein treatment (2 g/kg·bw orally once a day for 15 days) and other three groups received SFP treatment (0.5, 1 and 2 g/kg·bw orally once a day for 15 days, respectively). The body weight, immune organ index, morphologic variations of thymus and spleen, bone marrow nucleated cell count, white blood cell count, T lymphocytes and cytokine were measured at the end of the experiment. Results showed that the DNA content and the numbers of bone marrow cells, white blood cell, CD3+ and CD8+ in model group were decreased compared with control group. However, different doses of SFP significantly increased numbers of bone marrow cells, white blood cell, CD3+ and CD8+ compared with control. It could be concluded that SFP could effectively improve the immune function of immunosuppression mice induced by cyclophosphamide.
Key wordssily fowl peptide; bioactive peptide; cyclophosphamid; immune regulation
收稿日期:2015-08-29,改回日期:2015-12-20
基金项目:国家十二五科技支撑项目(2012BAD33B04-02);国家高技术研究发展计划项目(2013AA102205-02);科技北京百名领军人才培养工程项目(Z131110000513026);北京市科委国家现代农业科技城成果惠民科技示范工程项目(Z131100003113010)
DOI:10.13995/j.cnki.11-1802/ts.201604009
第一作者:硕士研究生(许雅君教授,潘兴昌博士为通讯作者,E-mail:xuyajun@bjmu.edu.cn,E-mail:nutripan@163.com)

