菊芋酒酿酒酵母的选择及发酵工艺
罗 腾, 张宝善*, 崔田田, 刘莎莎, 孙肖园(.陕西师范大学食品工程与营养科学学院,陕西西安70062;2.陕西省果蔬深加工技术研究中心,陕西西安70062)
菊芋酒酿酒酵母的选择及发酵工艺
罗腾1,2,张宝善*1,2,崔田田1,刘莎莎1,孙肖园1
(1.陕西师范大学食品工程与营养科学学院,陕西西安710062;2.陕西省果蔬深加工技术研究中心,陕西西安710062)
摘要:以菊芋为原料对菊芋酒的酿造工艺及香气成分进行初步研究。通过3种酵母菌对菊粉液体发酵的比较实验,确定菊芋酒最佳的酿造菌种。并通过单因素试验和正交试验,探索菊芋酒的最佳生产工艺。采用顶空固相微萃取(HS-SPME)与气质联用技术(GC-MS)对菊芋酒主要香气成分进行分析。结果表明:1)菊芋酒的最佳酿造酵母为实验室筛选的产菊粉酶酵母K.marxianus X2;2)当以产品的酒精度为衡量指标时,最佳发酵工艺条件为:主发酵温度30℃,酵母接种体积分数5%,菊芋汁糖度22°Bx;当以产品的感官品质为衡量指标时,最佳发酵工艺条件为:主发酵温度28℃,酵母接种体积分数为6%,菊芋汁糖度20°Bx;3)从菊芋酒中共鉴定出40种香味物质,含量相对较多的主体香气物质是乙酸戊酯、己酸乙酯及辛酸乙酯。选出了一株可以直接用于菊芋酿酒发酵的酵母菌种,获得色、香、味俱佳的菊芋酒。
关键词:菊芋酒;酵母菌;发酵工艺;香气成分
菊芋(Jerusalem artichoke)又称洋姜、鬼子姜,为菊科向日葵属多年生草本植物,地下形成块茎。菊芋块茎味甘、性平、无毒、营养丰富,在我国大部分地区都有分布。一般鲜菊芋块茎中含水79.8%,碳水化合物16.6%,蛋白质1%,脂肪1%,粗纤维0.6%,灰分2.8%,还有一定量的维生素,其中碳水化合物中78%为菊粉(菊糖)[1]。菊粉是由D-果糖经β(1→2)糖苷键连接而成的线性果聚糖,在菊粉酶的作用下可水解为易于乙醇发酵的果糖[2]。另外,菊芋具有耐寒、耐旱、耐盐碱、抗风沙、适应性广、繁殖性强等优点,在全国各地均有分布。目前,菊芋产品加工主要集中在初级产品加工,如泡菜、酱菜等,深加工只限于菊粉的提取和燃料乙醇,其他产品如高果糖浆、低聚果糖等只停留在试验阶段[3-7]。应菊芋产业发展要求,开发深加工产品,挖掘其巨大的潜在经济价值,特别是具有保健功能的产品具有重要意义。
目前菊芋发酵研究主要集中在菊芋发酵生产工业乙醇。而对发酵酒类产品研究甚少。所以深入研究菊芋发酵生产酒工艺条件,开发低成本、高附加值酒类产品具有广阔的市场前景,也符合我国酿酒业的“限制粮食酒,发展非粮食酒”的发展方向。
作者通过选择一株可直接用于菊芋酒发酵的酵母菌种并对菊芋酒发酵工艺进行研究,分析菊芋酒的主要香气成分,为菊芋酒生产提供技术理论参考。
1 材料与方法
1.1材料与试剂
1.1.1材料新鲜菊芋:市售;菊粉(相对分子质量约4 000):青海威德生物技术有限公司;柠檬酸、抗坏血酸:江苏歌得诺贝生物化工有限公司;其他试剂均为分析纯。
1.1.2酵母菌菌种安琪白酒酵母(S.cerevisiae)、安琪果酒酵母SY:市售;酵母菌K.marxianus X2:从菊芋的表皮经分离、纯化获得,经形态和生理生化鉴定为酵母菌并保藏于作者所在实验室。
1.1.3培养基活化培养基:葡萄糖20 g,酵母浸粉5 g,蛋白胨3 g,KH2PO42 g,(NH4)2SO42 g。蒸馏水1 000 mL,pH 6.0,121℃灭菌20 min。
1.1.4种子培养基菊粉30 g,酵母浸10 g,蛋白胨5 g,KH2PO43 g,(NH4)2SO45 g,蒸馏水1 000 mL,pH 6.0,121℃灭菌20 min。
1.1.5菊芋汁发酵培养基新鲜菊芋水提浓缩得到的菊芋汁。
1.2仪器与设备
XSZ-4G生物显微镜:重庆光学仪器厂;SPH-250型生化培养箱:上海森信实验仪器有限公司;AR2140电子天平:梅特勒-托利多仪器有限公司;BCN-1360型超净工作台:北京东联哈尔仪器有限公司;WS108型手持折光仪:上海测维光电技术有限责任公司;UV-160紫外可见分光光度计:日本日立公司;PHs-3c精密pH计:上海精密科学仪器有限公司;气相色谱(TRACE1300,Thermo Fisher Scientific,USA)质谱联用仪:(ISQ,Thermo Fisher Scientific,USA);顶空固相微萃取(HS-SPME)装置SPME手动进样手柄及PDMS萃取头(50/30 μm):美国SUPELCO公司。
1.3方法
1.3.1菊芋酒酿造工艺流程
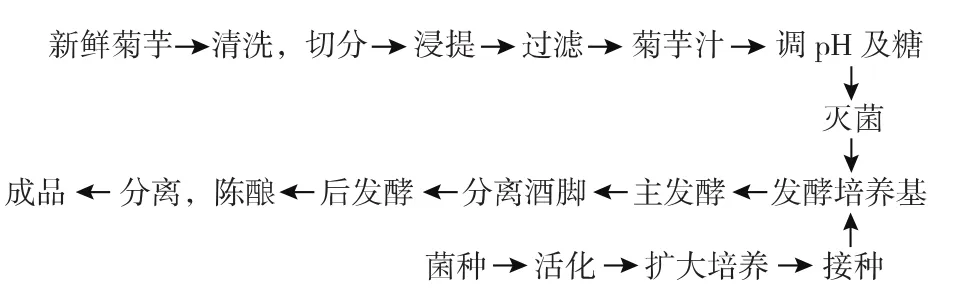
1.3.2原料的处理
1)菊芋汁的制备:新鲜菊芋经水洗,破碎,按料水比1∶2加入自来水,加热至85℃浸提30 min,过滤获上清液,备用。
2)菊芋汁的浓缩:使用旋转蒸发仪在水浴锅温度为55℃,转速为45 r/min,真空度为-0.095 MPa的条件下将菊芋汁浓缩至表观糖浓度为30°Bx,4℃冷藏备用。
1.3.3成分调整调整糖度:在不同的糖度下,酵母菌的活性不同。为了找出菊芋酒的最佳发酵糖度,将浓缩菊芋汁的表观糖度梯度调整控制在16~24°Bx,自然pH值。灭菌后装灌密封,迅速冷却。
1.3.4主发酵在发酵醪液中加入一定量酵母进行主发酵。发酵过程中每天搅动3~4次,当发酵醪液面泡沫逐渐下沉,酒液澄清,主发酵结束,时间为10 d。
1.3.5后发酵分离主发酵酒液的酒脚,进行后发酵。在后发酵过程中,酵母重新分布,对残糖继续利用,发酵速度较缓慢,发酵温度控制在20~25℃,经15~20 d后,发酵醪液残还原糖质量浓度小于4 g/L,后发酵结束,乙醇度达11%左右,分离酒脚,进入陈酿阶段。
1.3.6陈酿过滤后原酒进行密封陈酿,时间为1~2个月,陈酿温度在20℃以下。酒液尽可能满罐保存,以减少氧气接触,避免酒的氧化。
1.3.7过滤、澄清将陈酿的酒液除去酒脚,并加入明胶和单宁[8],静置过滤,得到金黄色的澄清菊芋酒。
1.3.8灌装、灭菌将过滤、澄清后的果酒分装于
玻璃瓶中,密封后在70℃下水浴杀菌30 min。
1.3.9菊芋酒发酵条件的单因素试验设计
1)发酵菌种的选择:将3种酵母保藏菌种,接种到种子培养基中活化24 h,使活化菌数量达到1.0×107cfu/mL,按照10%的接种体积分数接种到装有150 mL的20%菊粉发酵液的发酵培养基中,置于30℃发酵,观察发酵情况,每天测定乙醇的产率,发酵结束后测定发酵液酶活力和总糖利用率。另做一组杜氏小管试验观察气体的充盈情况,确定最佳的酿造菌种。
2)不同接种体积分数对酵母菌乙醇发酵影响:在发酵醪表观糖浓度20°Bx、发酵温度30℃,自然pH为4.8,分别在接种体积分数为4%、5%、6%、7%、8%的条件下进行主发酵。测定不同接种体积分数下发酵的菊芋酒的乙醇度与总糖利用率,以确定较为适宜的接种体积分数。
3)不同发酵温度对酵母菌乙醇发酵影响:在发酵醪表观糖浓度20°Bx,酵母接种体积分数6%,自然pH为4.8,分别在24、26、28、30、32℃的温度条件下进行主发酵。测定不同温度下发酵的菊芋酒的乙醇度与总糖利用率,以确定较为适宜的发酵温度。
4)初始底物浓度对乙醇发酵的影响:在发酵温度30℃,酵母接种体积分数6%,自然pH为4.8,分别在16、18、20、22、24°Bx的表观糖浓度条件下进行主发酵,测定不同糖度下发酵的菊芋酒的乙醇度与总糖利用率,以确定较为适宜的底物浓度。
1.3.10菊芋酒酿造工艺条件的正交试验优化以单因素试验确定菊芋酒酿造过程中主要影响因素的水平取值范围,以乙醇度和感官质量评分为指标进行L9(33)正交试验,对试验结果进行综合分析,进而优化酿造工艺条件。
1.3.11菊芋酒香气物质的萃取实验采用顶空固相微萃取法(head space solid -phase microextractions,HS-SPME)。取酒样10 mL于20 mL萃取瓶中,加1 g NaCl,插入经老化的萃取头(250℃老化1 h),50℃条件下顶空萃取50 mim,将萃取头插入GC-MS进样口,解析5 min[9]。
1.3.12品质鉴定
1)培养基或发酵液总糖含量测定:取1 mL培养基或发酵上清液,加入50 mL体积分数5%的HCl,70℃水浴酸解1 h。完成后流水迅速冷却至室温,用2 mol/L NaOH调节pH值至中性,并定容至100 mL。采用DNS法测定其中还原糖含量,即为总糖含量[10]。
2)总糖利用率的测定:总糖利用率=(起始总糖-剩余总糖)/起始总糖
3)乙醇度测定:参照GB/T15038—2006《葡萄酒、果酒通用分析方法》测定。菌体总数的测定:血球计数法测定。可溶性固形物测定(表观糖度):用手持折光仪测。酸度:酸碱滴定法[11]。pH值:用酸度计法。
4)菊粉酶酶活力测定:取1 mL发酵液,加入底物浓度为2.0%、pH值为5.4的菊粉溶液4 mL,55℃酶解10 min,DNS法测定其中的还原糖生成量。1 mL发酵液每分钟水解底物生成1 μmol还原糖所需的酶量为一个酶活力单位[12]。
1.3.13感官评定[13]因为菊芋酒没有本身的专业评价细则,作者结合葡萄酒和清酒的感官评价标准自行定制了菊芋酒的感官评价细则,外观20,香气30,滋味30,典型性20。按照表1中的标准由10名专业技术人员对菊芋酒进行综合感官评分,取其平均值作为评分结果,满分为100分。
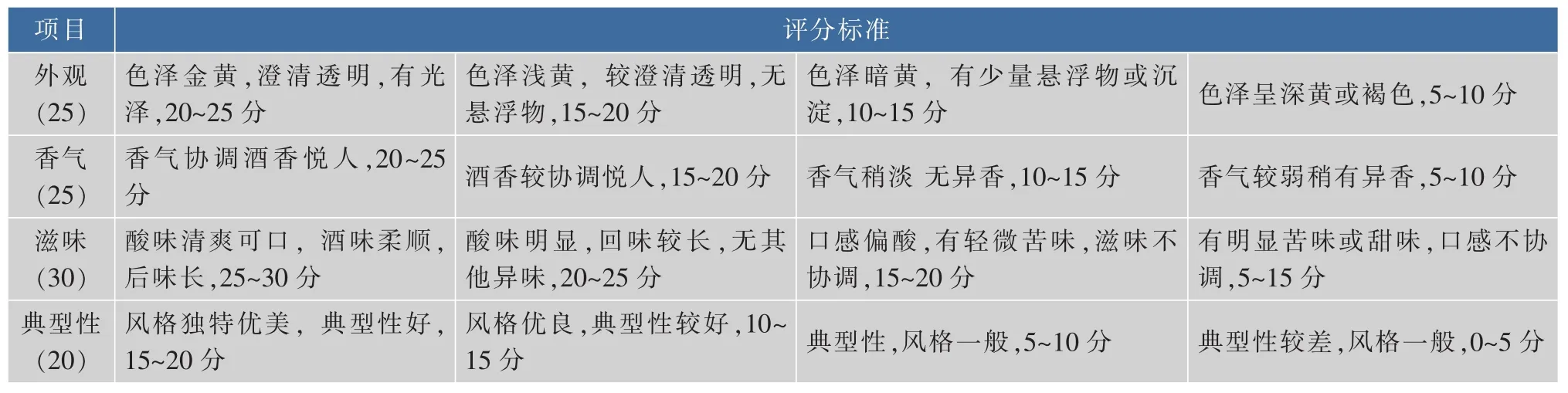
表1 感官评分标准Table 1 Sensory evaluation standards of Jerusalem artichoke wine product
1.3.14菊芋酒香气成分GC-MS分析
1)色谱条件:色谱柱HP-INNOWAX石英毛细血管色谱柱(60 m×0.32 mm×0.25 um,Agilent,USA);程序升温:40℃,保留10 min,4℃/min,升至200℃,保留10 min。载气为氦气,流速1.00 mL/min。不分流进样。
2)质谱条件:EI电离源,电子能量70 eV,离子源为250℃,接口为250℃,质量扫描范围45~500 amu。
3)香气成分分析:分析结果运用计算机谱库(NIST/WILEY)进行初步检索及资料分析,并结合已有的相关文献进行定性分析[14]。
2 结果与分析
2.1 3种酵母发酵菊芋酒的性能实验
从图1可以看出,3株酵母菌的乙醇增加都比较缓慢和平稳,原因是菊芋中的发酵糖主要是菊糖(多糖),酵母菌不能直接利用。所以酵母在发酵的过程中需要产生诱导酶,来分解这些多糖来进行发酵[15]。3株酵母都是进行边分解多糖边发酵产生乙醇。可以明显看出K.marxianus X2在发酵过程中乙醇产率明显高于其他酵母。K.marxianus X2在发酵第8~10天乙醇度变化局势不明显趋于平缓,主发酵结束,进入后发酵阶段。从表2可见,发酵完成后,K.marxianus X2的菊粉酶酶活为60.2 U/mL,总糖利用率为86.31%,发酵液乙醇度为10.6°,为3种酵母菌中最高。杜氏管充满气体的时间为31 h,起酵时间也最短。因此菌株K.marxianus X2更适合用于菊芋酒的发酵,是较优良的菌种。

图1 3种酵母发酵能力比较试验Fig. 1 Comparison of fermentation ability of 3 kinds yeast
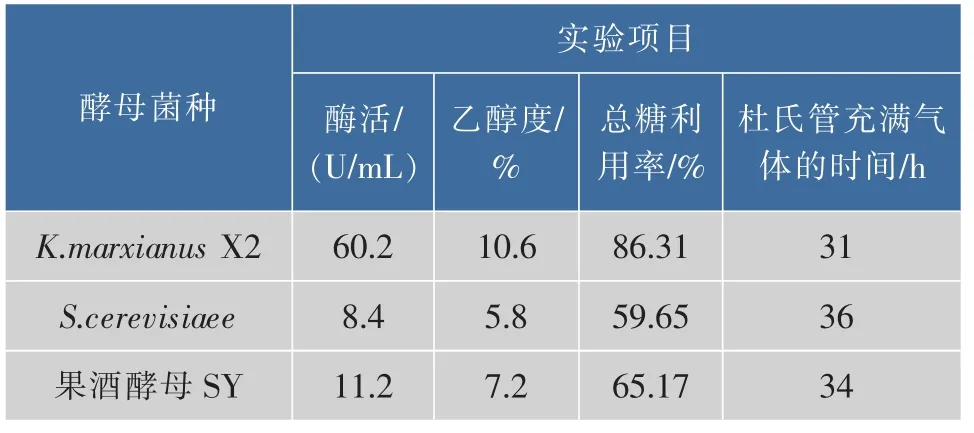
表2 实验发酵结果Table 2 Experimental results in fermentation
比较图1和表2,酿酒酵母乙醇发酵能力与其菊粉酶活正相关。菊粉酶活越高,发酵液乙醇体积分数越高,且乙醇发酵速度也越快。原因可能是同步糖化发酵过程中,菊粉需经菊粉酶水解成果糖,再被酿酒酵母利用发酵乙醇,因此酵母菌的菊粉酶活是乙醇发酵速度的限制性因素[16]。综上所述,选择K.marxianus X2作为菊芋酒的发酵菌种。
2.2单因素实验
2.2.1发酵温度对菊芋酒发酵的影响图2是温度对酿酒酵母K.marxianus X2乙醇发酵的影响。发酵温度对乙醇发酵和酵母的繁殖有着重要的影响,温度高酵母代谢旺盛,发酵速度快。温度过低酵母繁殖慢,发酵速度也相对较慢。由图2可知,在24~30℃范围内,随着发酵温度的升高,总糖利用率和乙醇体积分数的增加显著(p<0.05),在温度高于30℃,以后乙醇体积分数和总糖利用率开始显著下降(p<0.05)。当发酵温度达32℃时,最终乙醇体积分数大幅度下降,发酵液中残糖也明显增多。原因可能是24℃和26℃的温度过低,酵母代谢繁殖慢,发酵速度变慢,导致成品酒的酒度降低,另一方面原因是温度过低诱导酶菊粉酶的活性比较低,菊粉不能很好地被酶解成还原糖被利用。而30℃是发酵相对适宜的温度,酵母发酵速度快,不但可供杂菌生长的还原糖迅速减少,而且较快上升的乙醇体积分数对杂菌有抑制作用,另一方面诱导酶菊粉酶的活性也相应的增高,有更多的还原糖产生被利用[17],因此成品酒的乙醇体积分数较高。根据上述结果,确定发酵的较佳温度水平为30℃左右。

图2 发酵温度对菊芋酒的乙醇度和总糖利用率的影响Fig. 2 Effect of fermentation temperature on alcohol and total sugar utilization of Jerusalem artichoke wine
2.2.2接种体积分数对乙醇发酵的影响酵母接种体积分数对菊芋酒的发酵具有较大的影响。在不同的接种体积分数条件下,酵母将还原糖转化为乙醇的量是不同的。接种体积分数小,酵母的生物量不够,原料转化为乙醇速度慢,易污染杂菌;接种体积分数过大,酵母自身生长繁殖会消耗发酵液中大量的糖分,乙醇产量反而降低[18]。从图3可以看出,总糖利用率随着酵母接种体积分数的增加而增加。在接种体积分数为4%~6%之内乙醇体积分数显著增加(p<0.05),在6%时达到最高;当接种体积分数大于6%时,酵母菌繁殖过旺,本身需要消耗大量糖分,乙醇体积分数反而降低。综合上述,确定酵母最佳接种体积分数为6%左右为宜。

图3 酵母接种体积分数对菊芋酒的乙醇体积分数和总糖利用率的影响Fig. 3 Effect of yeast inoculum amount on alcohol and total sugar utilization of Jerusalem artichoke wine
2.2.3初始底物浓度对乙醇发酵的影响初始底物浓度,对发酵酒最终的乙醇度和品质有重要的影响,图4是菊芋汁中起始糖度对酿酒酵母K.marxianus X2乙醇发酵的影响,糖作为乙醇发酵最重要的底物,初始糖含量对乙醇发酵的最终乙醇产量呈正相关,但继续增加底物浓度,乙醇体积分数增加局势明显放缓,而总糖的利用率却随着起始总糖度的增加而逐渐下降,残糖量急剧上升。由图4可知,乙醇体积分数在表观糖度小于20°Bx时随糖度的增加而显著增加(p<0.05),总糖利用率也相对较高;当起始糖度高于20°Bx之后,虽然乙醇度仍在增加,可其增加速率明显下降,而总糖利用率却显著降低(p<0.05)。造成这种现象的原因可能有2种:1)发酵时间不够长,较多的糖需较长的时间来代谢转化;2)酿酒酵母K.marxianus X2所产生的菊粉酶活力还不够高,不能迅速将更多的菊糖转换成可利用糖[19]。根据以上结果,确定最佳初始底物浓度为20°Bx左右。
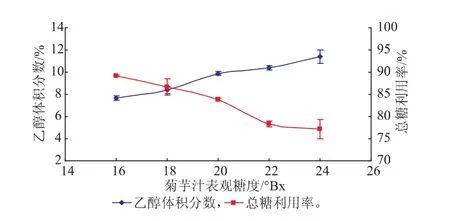
图4 菊芋汁表观糖度对菊芋酒的乙醇体积分数和总糖利用率的影响Fig. 4 Jerusalem artichoke juice apparent sugar on alcohol and total sugar utilization of Jerusalem artichoke wine
2.3正交试验结果
以主发酵温度、干酵母接种量和菊芋汁糖度为因素,进行三因素三水平的L9(33)正交试验。根据单因素试验的结果所选择每个因素的三个水平见表3,正交试验结果见表4。
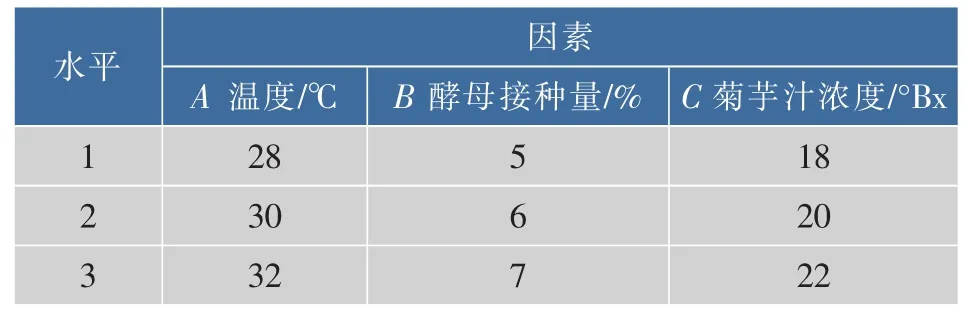
表3 发酵条件优化试验方案Table 3 Factors and levels of orthogonal test for the main fermentation technology optimization
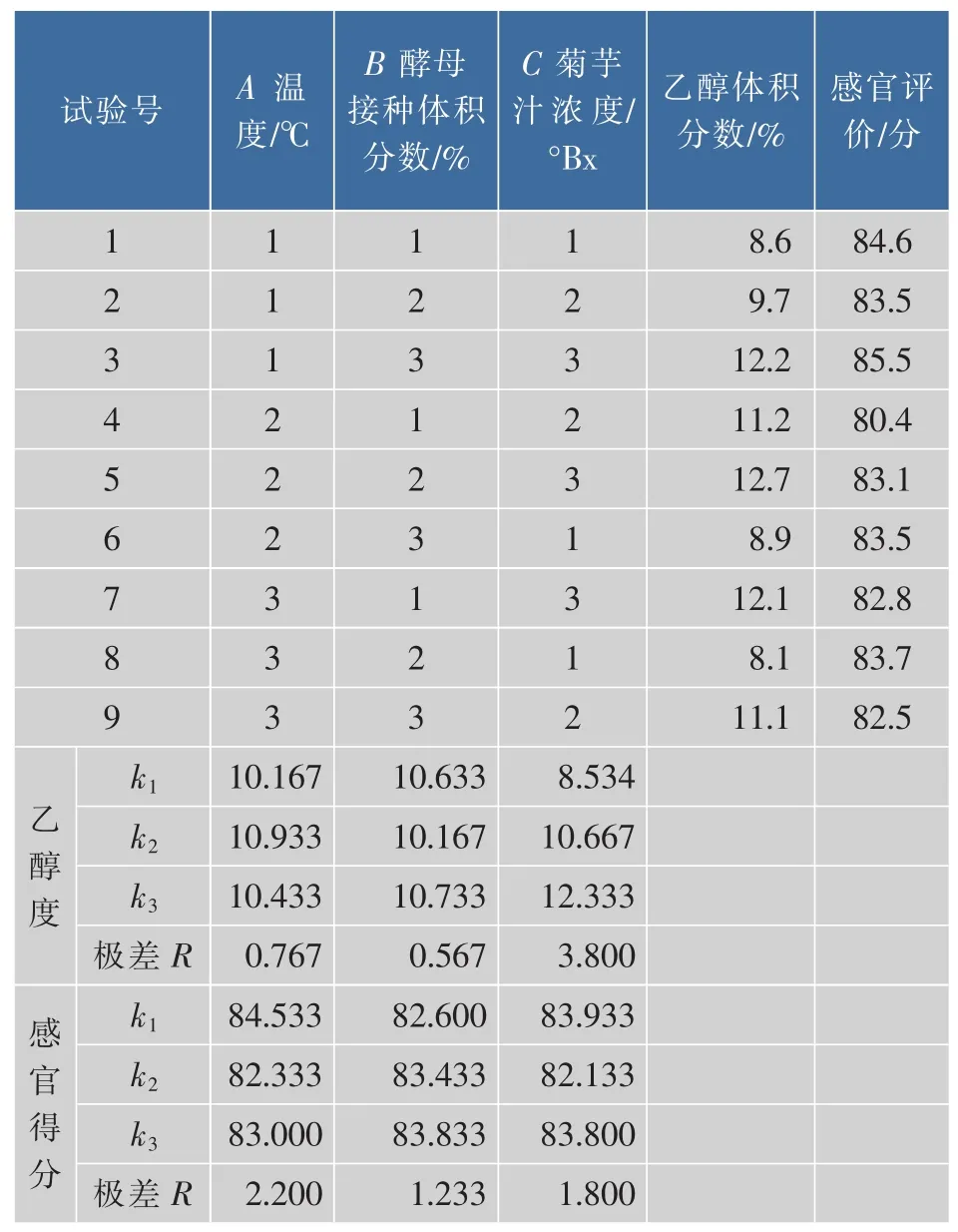
表4 发酵条件优化正交试验Table 4 Results of orthogonal test and range analyses
根据表4的极差分析结果可知,发酵工艺条件中影响产品乙醇度的因素极差大小排序为C>A>B,即菊芋汁浓度>发酵温度>酵母接种体积分数,与表5方差分析结果一致。表5更加深入分析出三个因素对结果影响的程度,C影响显著,A、B影响不显著,说明菊芋汁浓度是影响产品乙醇体积分数的主要因素,而发酵温度和酵母接种体积分数对产品乙醇体积分数影响较小。表4结果表明,以乙醇体积分数为指标发酵条件的最佳组合为A2B1C3,即主发酵温度为30℃,酵母接种体积分数为5%,菊芋汁糖度为22°Bx。由于正交试验中没有此发酵条件组合,对此发酵条件进行三次验证实验,结果产品乙醇体积分数为11.6%,所得菊芋酒感官评分的平均值为84。
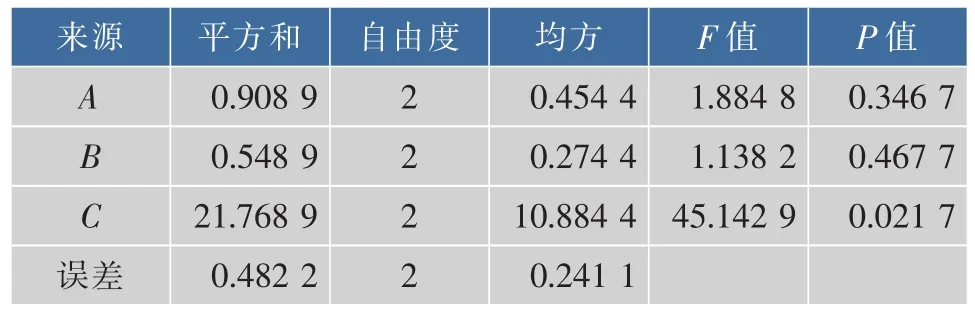
表5 乙醇度正交试验结果方差分析Table 5 Analysis of variance for alcohol degree
从表4的极差分析结果可以看到,发酵工艺条件中影响产品感官品质的因素极差大小排序为A>C>B,即发酵温度>菊芋汁浓度>酵母接种体积分数,与表6的方差分析结果一致。表6方差分析结果表明,A、C均对产品感官品质的影响极显著,B对产品感官品质的影响显著,说明菊芋汁浓度、主发酵温度和酵母接种体积分数都是影响产品感官品质的主要因素。表4结果分析表明,以感官评价为指标发酵条件的最佳组合为A1B2C2,即主发酵温度为28℃、酵母接种体积分数为6%、菊芋汁浓度为20°Bx。按优化试验设计组合进行了验证酿造试验,结果产品乙醇体积分数为11.3%,所得菊芋酒感官评分的平均值为87。
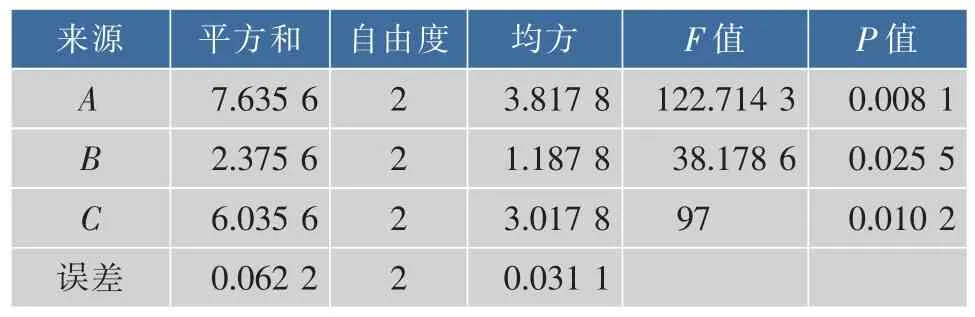
表6 菊芋酒感官指标正交试验结果方差分析Table 6 Analysis of variance for sensory evaluation score
2.4果酒主要香气成分分析
采用SPME-GC-MS对菊芋酒中的香气成分进行检测,得到可挥发性香气成分总离子流图,见图5。在本次试验条件下共测得40种化合物,前10种高丰度物质的定性和定量鉴定结果见表7。该10种物质占总化合物的68.37%;其中酯类3种,醇类2种,酸类2种,酮、烷氢和烯氢类各1种。
相关资料研究表明:发酵酒香气的主体香气物质为四大酯类(乙酸异戊酯、己酸乙酯、辛酸乙酯与乙酸乙酯)与两大醇类(异戊醇与异丁醇),其他挥发性化合物只是对主要香气物质的修饰和补充[20]。如表7所示,在菊芋酒高丰度香气成分中有乙酸戊酯、己酸乙酯、辛酸乙酯被检出。从香气分析结果可知,菊芋酒基本香气的形成过程中,乙酸戊酯、己酸乙酯、辛酸乙酯具有重要的作用。
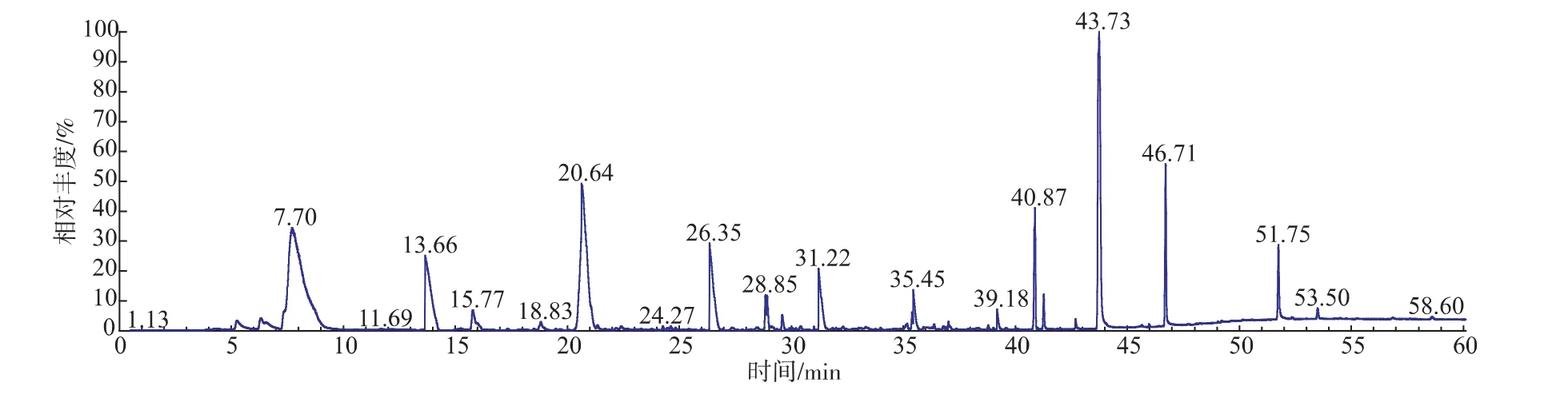
图5 菊芋酒挥发性成分的总离子流图Fig. 5 GC-MS total ion chromatogram of Jerusalem artichoke wine
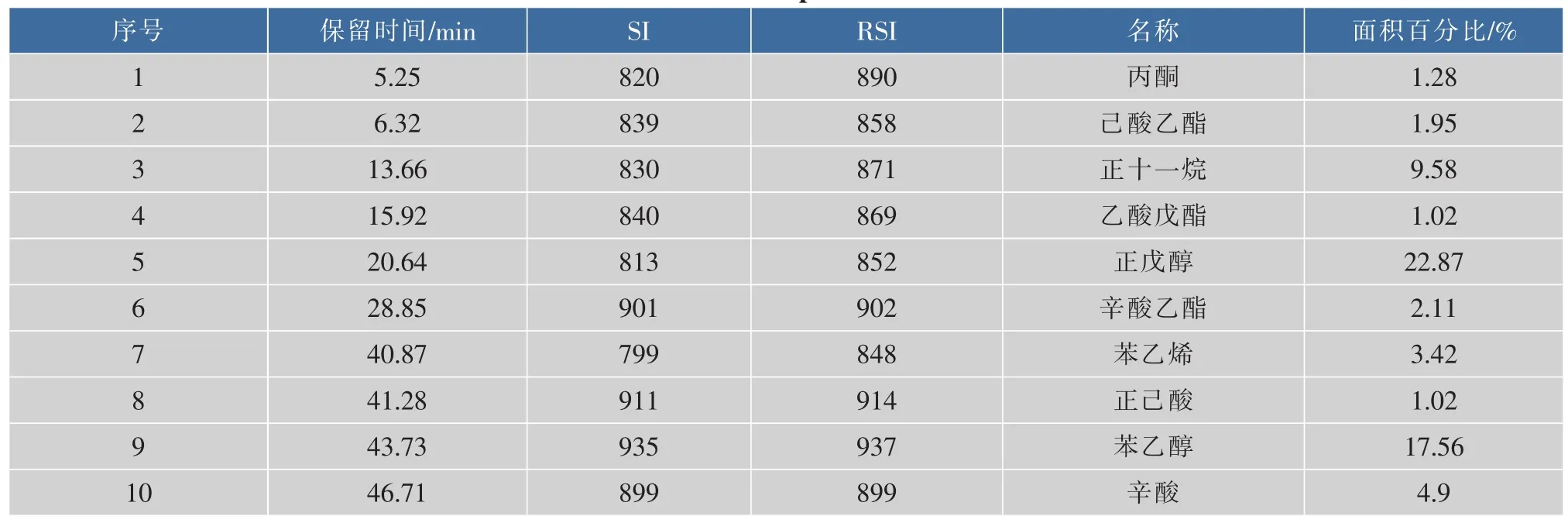
表7 菊芋酒主要挥发性成分分析Table 7 Identification of aromatic components in Jerusalem artichoke wine
3 结语
通过研究获得色、香、味俱全与具有独特风味的菊芋酒。从产品的乙醇度考虑,发酵条件的最佳组合为:主发酵温度为30℃,干酵母接种体积分数为5%,菊芋汁糖度为22°Bx。从产品感官品质考虑,发酵条件的最佳组合为:即主发酵温度为28℃、干酵母接种体积分数为6%、菊芋汁浓度为20°Bx。
采用顶空固相微萃取法对菊芋酒的香气成分进行提取,并利用气相色谱-质谱联用仪对香气成分进行了分析和鉴定,共检测出40种香气物质,相对含量高的高丰度香气成分有10种,该10种物质占总峰面积的68.37%;丙酮1.28%、己酸乙酯1.95%、正十一烷9.58%、乙酸戊酯1.02%、正戊醇22.87%、辛酸乙酯2.11%、苯乙烯3.42%、正己酸1.02%、苯乙醇17.56%、辛酸4.9%。
参考文献:
[ 1 ]袁文杰,常宝垒,任剑刚,等.菊芋生产燃料乙醇工艺路线探讨[J].可再生能源,2011(29):139-143. YUAN Wenjie,CHANG Baolei,REN Jiangang,et al. Analysis on ethanol production technology based on fermentation of Jerusalem artichoke[J]. Renewable Energy Resources,2011(29):139-143.(in Chinese)
[ 2 ]刘祖昕,谢光辉.菊芋作为能源植物的研究进展[J].中国农业大学学报,2012,17(6):122-132. LIU Zuxin,XIE Guanghui. An overview of researches on Jerusalem artichoke as biofuel crop[J]. Journal of China Agricultural University,2012,17(6):122-132.(in Chinese)
[ 3 ] Kim C H,Rhee S K. Ethanol production from Jerusalem artichoke by inulinase and Zymomonas mobile[J]. Applied Biochemistry and Biotechnology,1990,23:171-180.
[ 4 ] Ohta K,Hamada S,Nakamura T. Production of high concentrations of ethanol from inulin by simultaneous saccharification and fermentation using Aspergillus niger and Saccharomyces cerevisiae [J]. Applied and Environmental Microbiology,1993,59 (3):729-733.
[ 5 ] Nakamura T,Ogata Y,Hamada S,et al. Ethanol production from Jerusalem artichoke tubers by Aspergillus niger and Saccharomyces cerevisiae[J]. Journal of Fermentation and Bioengineering,1996,81(6):564-566.
[ 6 ]董晋军,郑璞,倪哗,等.菊芋原料同步糖化发酵生产丁二酸[J].食品与生物技术学报,2008,27(5):78-82. DONG Jinjun,ZHENG Pu,NI Ye,et al. Production of succinic acid by Simultaneous saccharification and fermentation from Jerusalem artichoke[J]. Journal of Food Science and Biotechnology,2008,27(5):78-82.(in Chinese)
[ 7 ] SINGH R SRAJESH D. Production of in ulinase from Kluyveromyces marxianus YS-1 using root extraet of as Paragus racemosus [J]. Process Biochemistry,2006,41(7):1703-1707.
[ 8 ]詹耀才,钟细娥,靳桂敏.岗稔果酒发酵工艺的研究[J].现代食品科技,2008,24(1):39-41. ZHANG Yaocai,ZHONG Xie,JIN Guimin. Study on the fermentation techniques of downy rosemyrtle wine [J]. Modern Food Science and Technology,2008,24(1):39-41.(in Chinese)
[ 9 ]盖禹含,辛秀兰,杨国伟,等.不同酵母发酵的蓝莓酒香气成分GC-MS分析[J].食品科学,2010,31(4):171-174. GAI Yuhan,XIN Xiulan,YANG Guowei,et al. GC-MSAnalysis of aromatic composition of blueberry wine fermented with different species of yeast strains[J]. Food Science,2010,31(4):171-174.(in Chinese)
[10]李俊俊,唐艳斌,唐湘华,等.复合酶在菊芋粉发酵生产燃料乙醇中的应用[J].酿酒科技,2009(3):65-68. LI Junjun,TANG Yanbin,TANG Xianghua,et al. Application of compound enzyme in fuel ethanol production by Jerusalem artichoke powder fermentation[J]. Liquor-making Science & Technology,2009(3):65-68.(in Chinese)
[11] GB/T15038)2006.葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2007.
[12]杨利博,张桂,赵国群.高菊粉酶活酿酒酵母的诱变选育[J].中国酿造,2010(5):139-142. YANG Libo,ZHANG Weili,ZHANG Gui. Mutation screening of yeast strains with higher inulinase activity[J]. China Brewing,2010(5):139-142.(in Chinese)
[13]顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,2009:372-373.
[14]张明霞,吴玉文,段长青.葡萄与葡萄酒香气物质研究进展[J].中国农业科学,2008,41(7):2098-2104. ZHANG Mingxia,WU Yuwen,DUAN Changqing. Progress in study of aromatic compounds in grape and wine [J]. Scientia Agricultura Sinica,2008,41(7):2098-2104.(in Chinese)
[15]袁文杰,任剑刚,赵心清,等.一步法发酵菊芋生产乙醇[J].生物工程学报,2008(11):1931-1936. YUAN Wenjie,REN Jiangang,ZHAO Xinqing,et al. One-step ethanol production from Jerusalem artichoke[J]. Chinese Journal of Biotechnology,2008(11):1931-1936.(in Chinese)
[16]王艳,金征宇,徐学明,等.酵母菌C10产菊粉酶酶学性质的研究[J].上海水产大学学报,2004(1):57-59. WANG Yan,JIN Zhengyu,XU Xueming,et al. Study on the enzymatic properties of inulinase produced by yeast C10[J]. Journal of Shanghai Fisheries University,2004(1):57-59.(in Chinese)
[17]周帼萍,沙涛,程立忠,等.菊粉酶的研究及应用[J].食品与发酵工业,2001(2):54-57. ZHOU Guoping,SHA Tao,CHENG Lizhong,et al. Application and research progress of inulinase [J]. Food and Fermentation Industries,2001(2):54-57.(in Chinese)
[18]周文斌,王崇均.火棘果酒生产工艺研究[J].食品科学,2009,30(4):81-84. ZHOU Wenbin,WANG Chongjun. Study on processing technology of pyracantha fortuneana fruit wine [J]. Food Science,2009,30(4):81-84.(in Chinese)
[19] Singh R S,Balwinder S S,Munish P. Optimizationof medium and process parameters for the productionof inulinase from a newly isolated Kluyveromyces marxianus YS-1[J]. Bioresource Technology,2007,98:2518-2525.
[20]杨雅利,沈海亮,阚建全.紫色甘薯酒香气成分分析和发酵规律[J].食品科学,2012,33(12):242-246. YANG Yali,SHEN Hailiang,KAN Jianquan. Analysis of aroma-active components in purple potato wine during fermentation[J]. Food Science,2012,33(12):242-246.(in Chinese)
Research on Selection of Yeasts and Fermentation Technology of Jerusalem artichoke Wine
LUO Teng1,2,ZHANG Baoshan*1,2,CUI Tiantian1,LIU Shasha1,SUN Xiaoyuan1
(1. College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi'an 710062,China;2. The Fruit and Vegetable Processing Technology Research Center in Shaanxi Province,Xi'an 710062,China)
Abstract:The preliminary study on aroma compositions and fermented processes for Jerusalem artichoke wine was carried out using J. artichoke(Helianthus tuberosus L.)tubers as raw materials. Through comparing three kinds of yeasts on J. artichoke liquid fermentation experiments,the optimal yeast was selected. Then a single-factor and with two orthogonal-factor models were used to explore the optimal technology. Head Space Solid-Phase Micro-Extractions(HS-SPME)and Gas Chromatography-Mass Spectrometer(GC-MS)were used to determine the dominated aromas and flavor profiles of wine. The results were shown as follows:1)K.marxianus X2 was the best active inulinase.2)The optimal conditions were 30℃,5% inoculum dose,and 22°Bx inulin when the yields of ethanol used as indexes,whereas the better conditions were 28℃,6% inoculum dose,andbook=212,ebook=10521°Bx inulin when the sensory quality of products as the scale index.3)Forty aromas and flavor components were characterized in J. artichoke wine,in which amyl acetates,ethyl hexanoates,and ethyl caprylates were dominated. A strain directly used for J. artichoke wine fermentation was elected to obtain the color,flavor and taste of J. artichoke wine.
Keywords:Jerusalem artichoke wine,yeast,fermentation technology,aroma -active components
*通信作者:张宝善(1968—),男,甘肃张掖人,农学博士,教授,硕士研究生导师,主要从事食品微生物及食品发酵方面的研究。E-mail:baoshan2@snnu.edu.cn
基金项目:陕西师范大学中央高校科研发展专项项目(GK201405006);西安市科技计划项目(SF1234-2)。
收稿日期:2014-09-08
中图分类号:TS 261.4
文献标志码:A
文章编号:1673—1689(2016)02—0211—08

