灵芝酒浸提过程中主要功能成分的变化及抗氧化作用研究
杨道强, 陆胜民, 夏其乐, 郑美瑜, 周锦云(.浙江省农业科学院食品科学研究所,浙江杭州3002;2.浙江师范大学化学与生命科学学院,浙江金华32004)
灵芝酒浸提过程中主要功能成分的变化及抗氧化作用研究
杨道强1,2,陆胜民*1,夏其乐1,郑美瑜1,周锦云1
(1.浙江省农业科学院食品科学研究所,浙江杭州310021;2.浙江师范大学化学与生命科学学院,浙江金华321004)
摘要:以灵芝子实体超细粉为原料,用不同体积分数的乙醇溶液浸提,对灵芝酒浸提过程中主要功能成分的变化规律及其抗氧化作用进行了研究。结果表明:灵芝酒中总皂苷、总多糖和总蛋白质3种主要活性成分的质量浓度均随浸提时间的延长而增加,其中总皂苷、总多糖的质量浓度在第35天左右达到峰值,之后略有下降,总蛋白质质量浓度在第30天左右达到峰值,之后开始降低;灵芝酒的DPPH自由基清除率和ABTS自由基清除率在第35天左右达到最大值,其抗氧化能力与总皂苷质量浓度、总多糖质量浓度和总蛋白质质量浓度均呈正相关;浸提用酒度数不同,制得灵芝酒的活性成分质量浓度不同,其抗氧化能力也不同,其中70°酒能较好地提取灵芝中3种主要活性成分,制得灵芝酒的抗氧化能力最强。因此,70°酒最适宜用来浸提灵芝酒,最佳浸提时间为35 d左右。
关键词:灵芝浸泡酒;总皂苷;总多糖;总蛋白;抗氧化
灵芝是一种名贵的药用真菌,属于灵芝菌科灵芝属,素有“仙草”之美誉,在我国有着悠久的药用历史。《本草纲目》中对灵芝记载道:主治耳聋,利关节,保神,益精气,坚筋骨,好颜色,久服轻身不老,延年、疗虚劳、治痔[1]。灵芝富含多种活性成分,如活性蛋白、多糖、三萜及皂苷类化合物、核苷酸、生物碱等[2]。现代药理学研究表明,灵芝活性成分对人体的神经、免疫、心血管等系统都具有较好的调节作用,尤其对保护肝脏、抑制肿瘤、防止失眠、抗衰老具有显著效果,且无毒副作用[3-5],此外还具有抑制胆固醇合成、抗菌、消炎、抗病毒等诸多药理作用[6-7]。
灵芝作为一种具有多种保健功效的珍贵中药,已广泛应用于各种保健食品[8]。目前国内外利用灵芝开发的保健品主要有灵芝孢子油、灵芝蜂蜜茶、灵芝人参酒等[9],其中对灵芝浸泡酒的研究主要集中在工艺上,而关于灵芝主要功能成分溶出过程的动态分析还未见报道。作者以灵芝子实体超细粉为原料,以不同酒精度的食用乙醇浸提,研究了灵芝酒在浸提过程中主要功能成分的变化及其抗氧化作用,为开发优质的灵芝保健酒提供理论依据。
1 材料与方法
1.1原料和试剂
1.1.1原料灵芝超细粉(产品原料为纯赤灵芝子实体):购于浙江省农科院园艺所食药用菌研发中心。
1.1.2试剂95%食用乙醇:浙江省食品工业总公司;人参皂苷Rb1(Ginsenoside Rb1)标准品、齐墩果酸标准品:上海源叶生物科技有限公司;D-无水葡萄糖标准品:上海江莱生物科技有限公司;牛血清蛋白标准品、考马斯亮蓝G-250:上海远慕生物科技有限公司;DPPH(2,2 -diphenyl -1 -picrylhydrazyl、ABTS(2,2 -azinobis -3 -ethylbenzothiazoline-6-sulfonic acid):Sigma公司;磷酸、浓硫酸、高氯酸、苯酚、冰乙酸、甲醇、无水乙醇、乙酸乙酯、香草醛等:均为分析纯。
1.2仪器与设备
UV-1800紫外/可见分光光度计:日本岛津公司;AL104-IC电子天平:梅特勒-托利多(上海)仪器公司;LXJ-IIB型离心机:上海诺顶仪器设备有限公司;RE52-99旋转蒸发器:上海亚荣生化仪器厂;DK-8D型电热恒温水槽:上海精宏实验设备有限公司。
1.3方法
1.3.1浸提方法设定3种不同的乙醇体积分数:52%、70%、95%,每份乙醇溶液用量500 mL,灵芝超细粉100 g,将灵芝超细粉与乙醇溶液混合后,摇晃均匀,静置,常温避光保存。定期取酒样分析总皂苷、总多糖、总蛋白质及其抗氧化指标,取样时间间隔为5 d。
1.3.2测定方法总皂苷质量浓度测定[10]:精确称取人参皂苷Rb1(Ginsenoside Rb1)标准品5 mg,加甲醇溶解并定容至50 mL摇匀,作为标准品溶液,于4℃冰箱中保存,备用。分别精确吸取标准品溶液0.3、0.6、0.9、1.2、1.5、1.8 mL于具塞试管中,水浴加热挥发去除溶剂,再分别加入新配置的5 g/dL香草醛-冰乙酸溶液0.2 mL和高氯酸0.8 mL,于60℃水浴中加热15 min,冰浴冷却后,各加入冰乙酸5 mL,放置15 min后于545 nm处测定吸光度,用甲醇作为空白对照。以标准品取样量(μg)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线,得线性回归方程为:Y=0.003 4X-0.002 9,R2=0.999 6。测定样品时,量取适量待测液,适当稀释后取1.0 mL代替标准品溶液,按照上述方法以甲醇为空白,在545 nm处测定吸光度值,从标准曲线上读出供试品溶液中皂苷的质量并计算其质量浓度。
总多糖质量浓度测定:参考石凤敏等[11]的方法,略加修改。准确称取于105℃干燥至恒质量的葡萄糖标准品5 mg,加水溶解并定容至50 mL摇匀,作为标准品溶液。分别取标准品溶液0、0.2、0.4、0.6、0.8、1.0 mL于15 mL具塞试管中,并加水至2 mL,再分别加入1 mL 5%苯酚溶液和5 mL浓硫酸,摇匀后于沸水中水浴20 min,取出后冰浴冷却10 min。以不加标准品溶液的试剂为空白对照,在490 nm处测定吸光度,以葡萄糖的质量(μg)为横坐标,以吸光度(A)为纵坐标,绘制标准曲线,得线性回归方程为:Y=0.006 5X-0.000 1,R2=0.999 4。测定样品时,取适量样液,蒸发浓缩,调整最终乙醇体积分数至80%,4℃冰箱放置过夜,离心,倾去上清液,所得沉淀用无水乙醇洗涤两次,加水溶解并适当稀释。取稀释后的样液1 mL和蒸馏水1 mL至15 mL具塞试管中,按照标准曲线制备项下的操作,测定吸光度值,从标准曲线上读出供试品溶液中葡萄糖的质量并计算其质量浓度。
蛋白质质量浓度的测定[12]:参考考马斯亮蓝G-250法,准确称取牛血清蛋白10.0 mg,用蒸馏水溶解并定容至100 mL得标准蛋白质液,于4℃冰箱中保存。分别精确吸取标准蛋白质液0、0.2、0.4、0.6、0.8、1.0 mL于15 mL具塞试管中,加水补充至1 mL,加考马斯亮蓝溶液5 mL,静置15 min,在波长595 nm处测定其吸光度值。以蛋白质质量浓度(μg/mL)为横坐标,以吸光度值(A)为纵坐标,绘制标准曲线,得线性回归方程为:Y=0.008 5X+0.009 9,R2=0.999 3。将样品液适当稀释,取1 mL加考马斯亮蓝溶液5 mL,室温静置15 min,于波长595 nm读取吸光度值,按标准曲线计算样品蛋白质质量浓度。
ABTS自由基清除率测定[13]:取适当稀释后的样品溶液0.1 mL,加入4 mL ABTS自由基反应液,避光静置6 min,在734 nm处测定吸光度值Ai;另设一空白,样液用无水乙醇代替,在734 nm处测定吸光度值A0。ABTS自由基清除率计算公式:
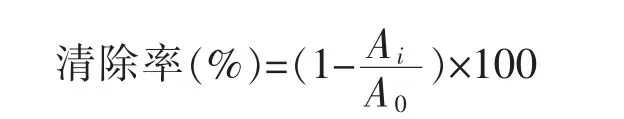
DPPH自由基清除率测定[14-15]:将样品液适当稀释,按表1数据加样,混匀后于暗处静置30 min,以无水乙醇调零,在517 nm处测定吸光度值。清除率计算公式:
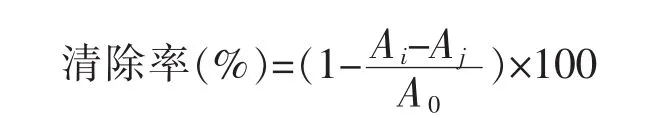
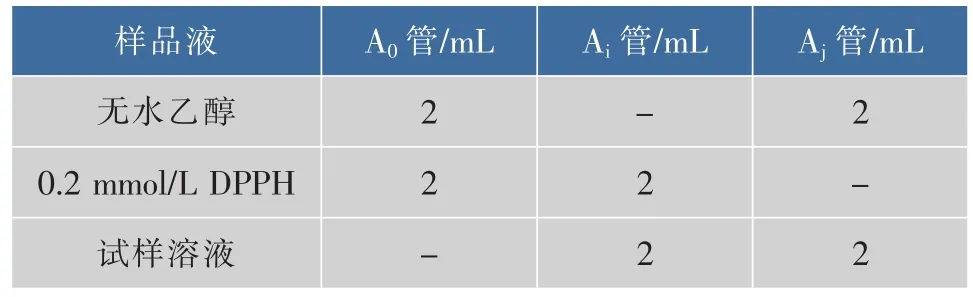
表1 DPPH自由基清除实验Table 1 Experiment of scavenging DPPH·
1.4统计学方法
采用Excel 2010和SPSS Statistics 17.0软件进行数据分析,每组重复3次,结果以均值±标准差(means±SD)表示,实验数据采用SPSS Statistics 17.0进行相关性分析和差异分析,P<0.05表明差异显著,P<0.01表明差异极显著。
2 结果与分析
2.1灵芝酒浸提过程中总皂苷质量浓度的变化
由图1可知,乙醇浸提时间及酒精度均会影响灵芝中总皂苷的溶出。在40 d的浸提时间内,3种灵芝酒中总皂苷质量浓度均随着浸提时间的延长而增加,35 d之后不再增加,甚至略有降低。这可能是因为原料颗粒内部溶质的溶解扩散较慢,时间延长有利于皂苷的溶出,酒中总皂苷质量浓度增加;但随着时间的进一步延长,固液两相中的皂苷质量浓度逐渐趋于平衡,液相中皂苷质量浓度不再增加[16],同时皂苷会发生水解,因而质量浓度降低。三种灵芝酒中总皂苷质量浓度也均不相同,随着浸提用酒的酒精度提高,灵芝中的总皂苷溶出增加,酒中的总皂苷质量浓度随之升高。
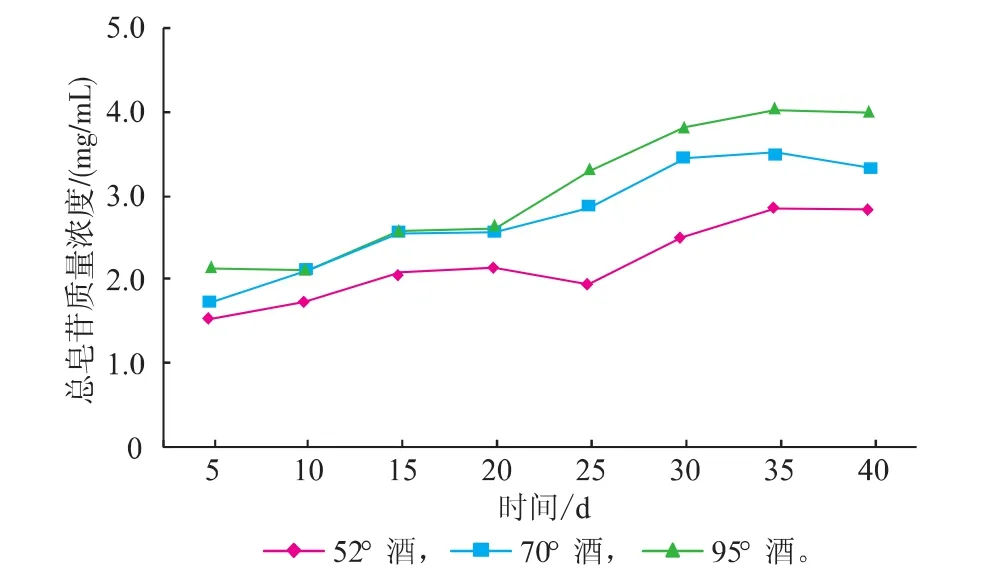
图1 灵芝酒浸提过程中总皂苷质量浓度的变化Fig. 1 Change of total saponin content in Ganoderma lucidum wine during extraction
2.2灵芝酒浸提过程中总多糖质量浓度的变化
由图2可知,3种灵芝酒中总多糖质量浓度均先增加,在第35天左右达到最大值,之后略有降低。随着浸提时间的延长,酒精溶液可充分渗透到灵芝组织细胞内,与胞内多糖充分接触并使之溶解[17],从而使酒中总多糖质量浓度增加,但浸提时间过长,部分多糖会被氧化或发生水解,因而导致酒中总多糖的质量浓度降低。由图2还可以看出,3种灵芝酒中总多糖质量浓度随浸提用酒的酒度升高而降低。灵芝多糖种类多,结构复杂,绝大部分能溶于水,而不溶于高度酒精[17]。浸提用酒的酒精度越低,其水含量越高,则其溶解的灵芝多糖就越多;而酒精度越高,大多数灵芝多糖不被溶出,甚至沉淀析出,因而浸提酒中的多糖质量浓度越低。

图2 灵芝酒浸提过程中总多糖质量浓度的变化Fig. 2 Change of total polysaccharides content in Ganoderma lucidum wine during extraction
2.3灵芝酒浸提过程中总蛋白质质量浓度的变化
灵芝中含有多种类型的蛋白质,包括糖蛋白、真菌免疫调节蛋白、凝集素、酶等[18],其中既有水溶性蛋白质又有醇溶性蛋白质。由图3可知,随着浸提时间的延长,3种灵芝酒中蛋白质质量浓度均先增加,在25~30 d达到峰值,之后开始下降。浸提时间的延长可使更多的灵芝蛋白质溶解到酒中,因此酒中蛋白质质量浓度增加,但浸提时间过长,溶解到酒中的蛋白质则会发生分解、变性,从而导致其质量浓度下降。浸提用酒的酒精度不同,酒中蛋白质的质量浓度也不相同,其中以70°酒浸提的最高,95°酒的次之,而52°酒的最低。不同度数的浸提用酒,因其中水和乙醇的比例不同,对水溶性蛋白和醇溶性蛋白的提取能力也不同。敖宏[19]的研究表明,灵芝醇溶性蛋白质的提取率随乙醇体积分数的增加而增加,其中以70%乙醇对醇溶性蛋白质的提取率最高,但随着乙醇体积分数的进一步提高,醇溶性蛋白的提取率反而下降。70°酒浸提所得灵芝酒中蛋白质质量浓度最高,可能是因为其既能充分地提取醇溶性蛋白质又能较好地溶解水溶性蛋白质。
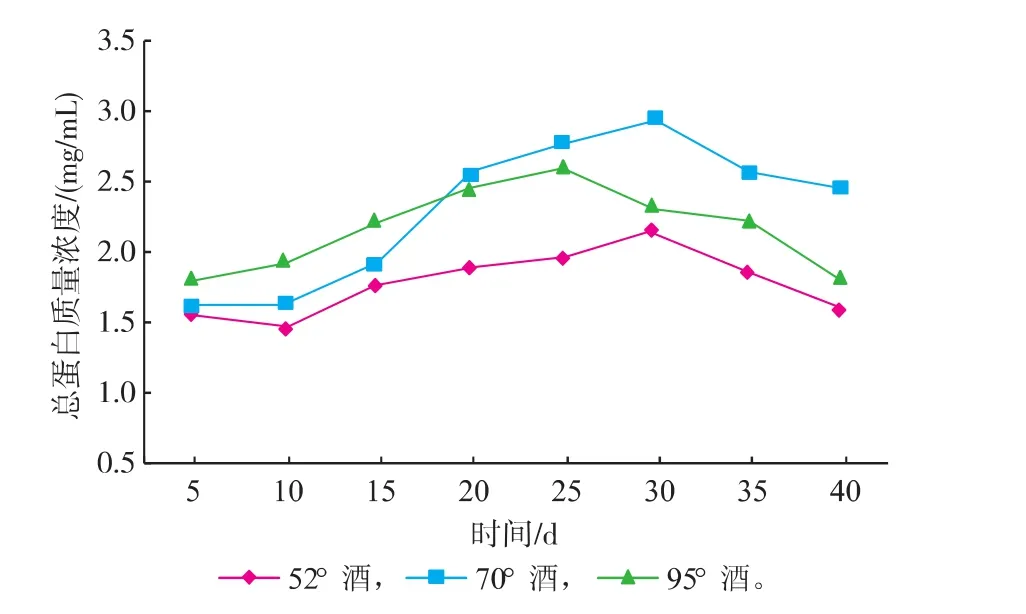
图3 灵芝酒浸提过程中总蛋白质质量浓度的变化Fig. 3 Change of total protein content in Ganoderma lucidum wine during extraction
2.4灵芝酒浸提过程中DPPH·清除能力的变化
DPPH自由基以氮为中心,较为稳定,对其清除率的高低常被用来评价抗氧化能力的强弱。灵芝皂苷、多糖、蛋白质等活性成分均具有较强的抗氧化活性,对DPPH自由基的清除能力也较强[17,19-20],灵芝酒因富含这些活性成分而具有较强的抗氧化性能。由图4可知,3种灵芝酒对DPPH自由基的清除率随着浸提时间的延长而增加,在30~35 d达到最大值,之后开始下降,这与酒中皂苷、多糖、蛋白质等活性成分质量浓度变化的趋势一致。由图4还可以看出,不同度数的灵芝酒对DPPH自由基的清除能力也不同。70°酒浸提所得灵芝酒中灵芝皂苷、多糖、蛋白质3种主要活性成分质量浓度总和最高,因此其对DPPH自由基的清除率也最高,在浸提35 d时,清除率高达(82.7±0.3)%。
2.5灵芝酒浸提过程中ABTS·清除能力的变化
ABTS自由基清除能力也是考察抗氧化性能的指标之一,目前关于灵芝活性成分ABTS自由基清除能力的相关研究较少。由图5可知,3种灵芝酒对ABTS自由基的清除率在浸提初期迅速增加,在20 d以后波动较小,基本保持平稳趋势,在30~35 d后开始下降。不同度数的灵芝酒ABTS自由基的清除能力也不同,这与酒中溶解的灵芝抗氧化活性成分质量浓度有关。同样,70°酒浸提所得灵芝酒的ABTS自由基清除能力最强,在浸提35 d时,清除率最高,达(80.5±0.8)%。
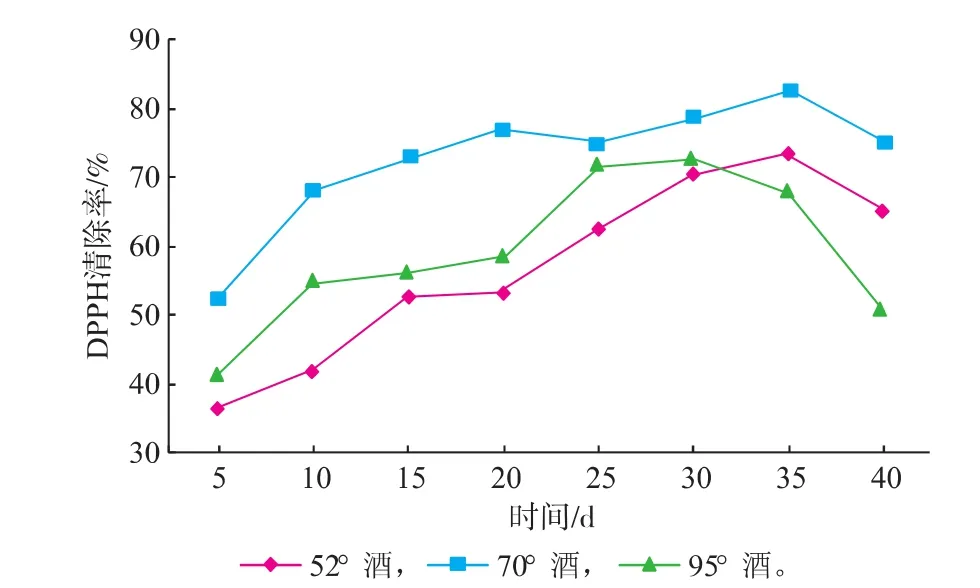
图4 灵芝酒浸提过程中DPPH·清除能力的变化Fig. 4 Change of DPPH radical scavenging activity of Ganoderma lucidum wine during extraction
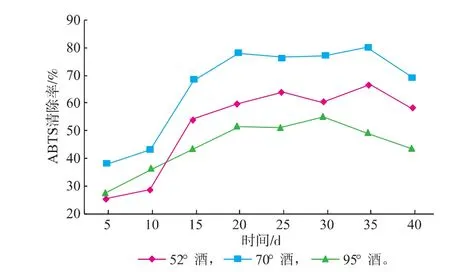
图5 灵芝酒浸提过程中ABTS·清除能力的变化Fig. 5 Change of ABTS radical scavenging activity of Ganoderma lucidum wine during extraction
2.6灵芝酒抗氧化能力与各活性成分质量浓度相关性分析
灵芝酒的抗氧化能力是溶在其中的皂苷、多糖、蛋白质等多种活性成分综合作用的结果。由表2可见,52°酒浸提所得灵芝酒的DPPH自由基清除率与总皂苷质量浓度、总多糖质量浓度均呈极显著正相关,与总蛋白质质量浓度相关性不显著;ABTS自由基清除率与3种主要活性成分质量浓度均呈显著正相关。70°酒浸提所得灵芝酒的DPPH自由基清除率与总皂苷质量浓度呈极显著正相关,与总多糖质量浓度和总蛋白质质量浓度均呈显著正相关;ABTS自由基清除率与3种主要活性成分质量浓度均呈极显著正相关。95°酒浸提所得灵芝酒的DPPH自由基清除率和ABTS自由基清除率与总皂苷质量浓度、总多糖质量浓度相关性不显著,但均与总蛋白质质量浓度显著正相关。总体上看,3种灵芝酒的DPPH自由基清除率和ABTS自由基清除率与总皂苷质量浓度、总多糖质量浓度和总蛋白质质量浓度均呈正相关。因此,灵芝酒中皂苷、多糖和蛋白质3种主要活性成分质量浓度越高,其营养价值越高,保健作用越好。
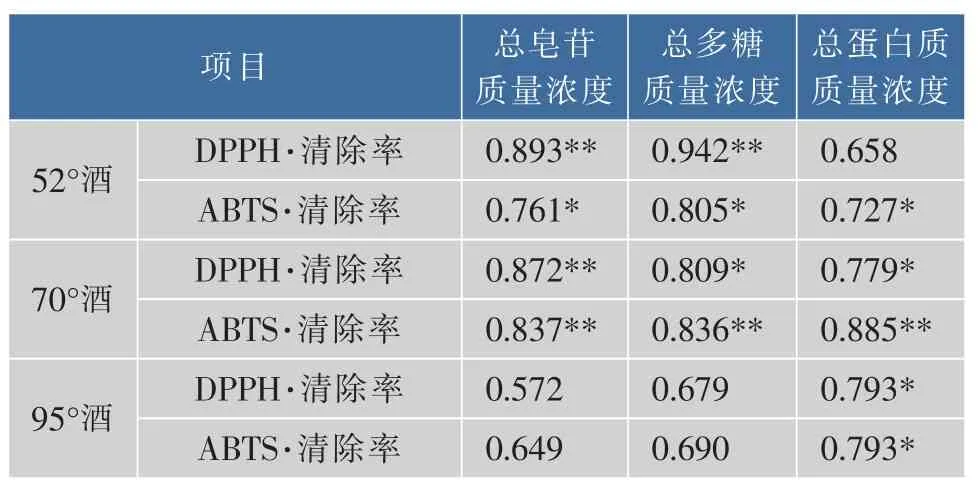
表2 灵芝酒抗氧化能力与各活性成分质量浓度相关系数Table 2 Correlation coefficient of antioxidant activity of Ganoderma lucidum wine and its active component concentration(mg/mL)
3 结语
灵芝酒中总皂苷、总多糖和蛋白质3种主要活性成分的质量浓度均随浸提时间的延长而增加,总皂苷、总多糖的质量浓度在第35天左右达到峰值,之后略有下降,蛋白质质量浓度在第30天左右达到峰值,之后开始降低。
灵芝酒的DPPH自由基清除率和ABTS自由基清除率在第35天左右达到最大值。灵芝酒的抗氧化能力与总皂苷质量浓度、总多糖质量浓度和总蛋白质质量浓度均呈正相关。
浸提用酒度数不同,制得灵芝酒中的活性成分质量浓度不同,其抗氧化能力也不同。70°酒能较好地提取灵芝中3种主要活性成分,制得灵芝酒的抗氧化能力最强。综合来看,70°酒最适宜用来浸提灵芝酒,最佳浸提时间为35 d左右。
本研究使用灵芝粉浸提制备灵芝酒,浸提速度快、效率高。以不同体积分数的食用乙醇浸提,研究了灵芝酒在浸提过程中主要功能成分的变化规律及灵芝酒的抗氧化作用,为开发营养、保健的优质灵芝酒提供了理论依据,但未对灵芝酒的感官品质做系统评价,因此要得到一款具有市场价值的灵芝保健酒,可能需要对其口感等进行调配,其感官品质仍需进一步研究。
参考文献:
[ 1 ]丘赛红,仇萍,黄宇明,等.灵芝的药理研究概况[J].湖南中医导报,1999,5(10):19-21. QIU Saihong,QIU Ping,HUANG Yuming,et al. A survey of pharmacodynamic study on Lucid ganoderma [J]. Hunan Guiding Journal of TCMP,1999,5(10):19-21.(in Chinese)
[ 2 ]袁学军,陈忠荫,陈光宙,等.不同干燥方式和洗涤时间对灵芝活性成分影响[J].中国食用菌,2013,32(4):38-40. YUAN Xuejun,CHEN Zhongyin,CHEN Guangzhou,et al. Effect of different drying ways and washing time on active components of Ganoderma lucidum[J]. Edible Fungi of China,2013,32(4):38-40.(in Chinese)
[ 3 ] Yue Q X,Guan S H,Xie F B,et al. Interaction of Ganoderma triterpenes with docetaxel and cisplatin in cytotoxicity against human carcinoma cells[J]. Chinese Journal of Natural Medicines,2008,6(5):367-371.
[ 4 ] Paterson R R M. Ganoderma a therapeutic fungal biofactory[J]. Phytochemistry,2006,67(18):1985-2001.
[ 5 ] Yen G C,Wu J Y. Antioxidant and radical scavenging properties of extracts from Ganoderma tsugae[J]. Food Chemistry,1999,65 (3):375-379.
[ 6 ] Smina T P,Mathew J,Janardhanan K K,et al. Antioxidant activity and toxicity profile of total triterpenes isolated from Ganoderma lucidum(Fr.)P. Karst occurring in South India[J]. Environmental Toxicology and Pharmacology,2011,32(3):438-446.
[ 7 ] Dudhgaonkar S,Thyagarajan A,Sliva D. Suppression of the inflammatory response by triterpenes isolated from the mushroom Ganoderma lucidum[J]. International Immunopharmacology,2009,9(11):1272-1280.
[ 8 ]杨晓丽,李翔,叶传松,等.灵芝超微粉理化特性研究[J].食品与生物技术学报,2013(1):69-74. YANG Xiaoli,LI Xiang,YE Chuansong,et al. Physicochemical properties of ultrafine Garnoderma lucidum powder [J]. Journal of Food Science and Biotechnology,2013(1):69-74.(in Chinese)
[ 9 ]肖智杰,王进军,连宾.灵芝产品的研究与开发现状[J].食品科学,2006,27(12):837-841. XIAO Zhijie,WANG Jinjun,LIAN Bin. Actuality of the exploitation and research on production of Ganoderma lucidum[J]. Food Science,2006,27(12):837-841.(in Chinese)
[10]许倩兮,黄勇,彭光华.雪灵芝总皂甙提取工艺及其数学模型研究[J].食品科学,2009(10):69-73. XU Qianxi,HUANG Yong,PENG Guanghua. Optimization of extraction technology of total saponins from Arenaria kansuensis maxim by mathematical model[J]. Food Science,2009(10):69-73.(in Chinese)
[11]石凤敏,佟曦然,丁自勉,等.三种灵芝不同部位的活性成分含量差异性分析[J].中国医药科学,2013,3(21):33-35. SHI Fengmin,TONG Xiran,DING Zimian,et al. Difference analysis of active components content in different medicinal parts of three species of Ganoderma lucidum[J]. China Medicine and Pharmacy,2013,3(21):33-35.(in Chinese)
[12]王文平,郭祀远,李琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发,2008(1):115-117. WANG Wenping,GUO Siyuan,LI Lin,et al. The determination of protein content in polysaccharides from stanuntonia Chinensis with coomassie brilliant blue method[J]. Food Research and Development,2008(1):115-117.(in Chinese)
[13] Re R,Pellegrini N,Proteggente A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9):1231-1237.
[14] Luo W,Zhao M,Yang B,et al. Identification of bioactive compounds in Phyllenthus emblica L. fruit and their free radical scavenging activities[J]. Food Chemistry,2009,114(2):499-504.
[15]查春节.龙眼多糖的流变性、结构鉴定及其清除自由基活性研究[D].武汉:华中农业大学,2013.
[16]许倩兮.雪灵芝皂甙的提取纯化及抗氧化活性研究[D].武汉:华中农业大学,2009.
[17]陈建旭.灵芝水溶性蛋白与碱溶性多糖的提取和抗氧化性研究及灵芝浆的研制[D].广州:华南理工大学,2010.
[18]周选围,林娟,李奇璋,等.灵芝蛋白类活性成分的研究进展[J].天然产物研究与开发,2008,19(5):917-924. ZHOU Xuanwei,LIN Juan,LI Qizhang,et al. Study progress on eioactive proteins from Ganoderma spp[J]. Nat Prod Res Dev,2008,19(5):917-924.(in Chinese)
[19]敖宏.灵芝蛋白的提取、酶解及抗氧化性能研究[D].广州:华南理工大学,2010.
[20]苏伟,赵利,袁美兰,等.氧化电位法评价皂苷抗氧化活性[J].食品科学,2014,35(5):116-118. SU Wei,ZHAO Li,YUAN Meilan,et al. Evaluation of antioxidant activity of saponin by oxidation-reduction potential[J]. Food Science,2014,35(5):116-118.(in Chinese)
Changes of the Main Functional Components and Antioxidant Capacity of Ganoderma lucidum Wine during the Extraction with Ethanol Solution
YANG Daoqiang1,2,LU Shengmin*1,XIA Qile1,ZHENG Meiyu1,ZHOU Jinyun1
(1. Food Science Institute,Zhejiang Academy of Agricultural Sciences,Hangzhou 310021,China;2. College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua 321004,China)
Abstract:Ganoderma lucidum powder was extracted by ethanol solution of different concentration and the changes of the main functional components and antioxidant capacity of Ganoderma lucidum wine during extraction were studied. The results showed that the content of the total saponin,polysaccharides and protein were increased with time. The content of total saponin and total polysaccharides reached the peak at the 35 th day and then was declined slightly,and the content of total protein was declined after 30 days when it reached the peak. DPPH radical scavenging activity and ABTS radical scavenging activity reached the peak at the 35 th day. Positive correlation was found between antioxidant capacity and the content of total saponin,total polysaccharides and totalbook=206,ebook=99protein. The antioxidant capacity and the content of functional components of Ganoderma lucidum wine varied with the concentration of ethanol solution used to extract Ganoderma lucidum for wine. The three main functional components could be extracted well with 70% ethanol solution,and the antioxidant capacity of the wine was the highest. So the best concentration of ethanol solution to extract Ganoderma lucidum for wine was 70%,and the best extraction time was about 35 days.
Keywords:Ganoderma lucidum steeping wine,total saponin,total polysaccharides,total protein,antioxidant
*通信作者:陆胜民(1969—),男,浙江兰溪水人,工学博士,研究员,主要从事农产品精深加工与综合利用方面的研究。E-mail:lushengmin@hotmail.com
基金项目:浙江省农科院创新能力提升项目(2014CX011)。
收稿日期:2014-09-09
中图分类号:Q 55
文献标志码:A
文章编号:1673—1689(2016)02—0205—06

