SOD乳酸菌高产菌株筛选鉴定及SOD分离纯化
邢德明, 李新华, 袁慎亮, 王晓辉*, 迟乃玉, 张庆芳(1.大连大学生命科学与技术学院,辽宁大连1166;.沈阳农业大学食品学院,辽宁沈阳110866;3.辽宁省海洋微生物工程技术研究中心,辽宁大连1166)
SOD乳酸菌高产菌株筛选鉴定及SOD分离纯化
邢德明2,3,李新华2,袁慎亮1,3,王晓辉*1,3,迟乃玉1,3,张庆芳1,3
(1.大连大学生命科学与技术学院,辽宁大连116622;2.沈阳农业大学食品学院,辽宁沈阳110866;3.辽宁省海洋微生物工程技术研究中心,辽宁大连116622)
摘要:筛选出一株产SOD乳酸菌,并对SOD进行分离纯化。采用平板富集、革兰氏染色等方法进行初筛。再通过邻苯三酚自氧化法检测SOD酶活进行复筛。并经形态学、生理生化试验、16S-rDNA基因序列分析进行菌种鉴定。通过硫酸铵沉淀、超滤、Sephadex-G100、DEAE-Sepharose FF等方法进行纯化。筛选得到一株产SOD相对较高菌株SD006,经鉴定为Lactobacillus plantarum,纯化后酶活达37 959.2 U/g。细菌SD006是一株产SOD的植物乳酸菌,乳酸菌是一种人体益生菌,乳酸菌SOD可作为食用SOD添加到食品中,具有潜在开发价值和广阔应用前景。
关键词:乳酸菌;超氧化物歧化酶;鉴定;分离纯化
超氧化物歧化酶(superoxide dismutase,ECl. 15.1.1,简称SOD),是一种广泛存在于生物体内的酸性金属酶。1938年由Mann和Keilin从牛红细胞中分离得到。1969年Mccord和Fridovich发现该酶生物催化活性并命名为超氧化物歧化酶[1-2]。SOD是生物体内最佳的自由基清除剂,其应用广泛,可应用于医药、食品、化妆品等领域[3-6]。目前SOD主要是从动物血液及植物中提取。从动物血液或植物中提取SOD存在成本高、易污染、易受季节影响等缺点;而微生物SOD则具有成本低、不易被污染、不受季节影响、工艺简单、易形成规模化生产等优点[7-8]。目前产SOD菌株研究多集中在酵母菌,对产SOD乳酸菌研究较少。乳酸菌是一类重要的工业微生物,其不仅可以提高食品营养价值,改善食品风味,且乳酸菌是人体益生菌,有增强人体免疫力、降血压等作用[9-14],因此产SOD乳酸菌选育具有潜在开发价值和应用前景。
通过邻苯三酚自氧化法从酸菜、牛奶、大酱等食品中筛选出一株产SOD酶活较高的菌株,并对其SOD进行初步纯化。
1 材料与方法
1.1材料
1.1.1样品来源采自辽中地区农村鲜牛奶、农家酸菜汁、农家黄豆酱样品共计50份。
1.1.2主要仪器雷磁PHS-3C型pH计:上海精科制造;JY98-3D超声波细胞破碎机;宁波新芝生物科技有限公司;HD-4电脑核酸蛋白检测仪:上海沪西分析仪器有限公司;CBS-B程控多功能自动部份收集器:上海沪西分析仪器有限公司;UV-1200型紫外可见分光光度计:上海美谱达仪器有限公司。
1.1.3主要试剂邻苯三酚AR(沪试);磷酸氢二钠AR(沪试);磷酸二氢钠AR(沪试);EDTA(Sigma公司)。
1.1.4富集培养基蛋白胨1 g/dL、酵母膏0.5 g/dL、NaCl 1 g/dL、琼脂2 g/dL;pH 7.0(0.1 MPa灭菌20 min)。
1.1.5初筛培养基葡萄糖2.5 g/dL、蛋白胨2.5 g/dL、酵母膏1 g/dL、溴甲酚紫0.02 g/dL、琼脂2 g/dL;pH 7.0(0.1 MPa灭菌20 min)。
1.1.6发酵培养基牛肉膏0.5 g/dL、酵母粉0.5 g/dL、蛋白胨1 g/dL、磷酸氢二钾0.2 g/dL、柠檬酸铁铵0.15 g/dL、乙酸钠0.5 g/dL、葡萄糖2 g/dL、吐温-80 0.1 g/dL、MgSO4·7H2O 0.05 g/dL、MnSO4·4H2O 0.02 g/dL;pH 7.0(0.1 MPa灭菌20 min)。
1.2方法
1.2.1产SOD乳酸菌初筛将样品接种于10 mL LB发酵液中做种子液,于25℃培养12 h,将种子液分别稀释10-7、10-10、10-13、10-16四个梯度,涂布于富集培养基上,25℃培养36 h,将不同菌落分别划线在初筛培养基上,25℃培养36 h。把使初筛平板变色的菌株进行革兰氏染色。将革兰氏阳性且无芽孢的菌株送宝生物工程(大连)有限公司鉴定。将鉴定为乳酸菌的菌株接种于发酵培养基中,25℃、150 r/min摇床培养36 h。
1.2.2产SOD乳酸菌复筛将初筛菌株发酵液于4℃、5 000 r/min离心15 min得到湿菌体,用无菌水洗2次,4℃、5 000 r/min离心15 min,将湿菌体用pH 7.8磷酸缓冲液按1∶5比例稀释,于300 W超声波、冰浴下破碎20 min(破碎5 s间隔5 s),6 000 r/min离心20 min,收集上清即粗酶液。采用邻苯三酚自氧化法[15-16]分别测定各菌株粗酶液SOD酶活。
酶活定义:以1 mL反应液每分钟抑制邻苯三酚自氧化速度50%的酶量为一个超氧化物歧化酶酶活力单位。
1.2.3菌株的鉴定
1)形态学观察:在平板培养基上观察菌落形状、颜色、大小等形态学特征,通过不同染色方法在光学显微镜(10×100)下观察菌落形态。
2)生理生化研究:根据《常见细菌系统鉴定手册》设计生理生化实验,对葡萄糖、麦芽糖、乳糖、鼠李糖、阿拉伯糖、木糖、甘露醇、山梨醇、甘油、明胶液化、H2O2、吲哚、甲基红等指标进行生理生化试验。
3)16S rDNA序列分析:采用酚氯仿抽提法提取菌株DNA。使用细菌16S rDNA的通用引物进行PCR扩增,设计引物序列为Forward primer P1(5’-CAGAGTTTGATCCTGGCT -3’)和Revese primer P2 (5’-AGGAGGTGATCCAGCCGCA-3’)。扩增反应体系Ex Taq(5 U/μL)0.25 μL,Buffer 5.0 μL,dNTP mixture 5.0 μL,P1 primer 1.0 μL,P2 primer 1.0 μL,加ddH2O至50 μL。PCR循环条件:98℃预变性4 min,一次循环;98℃变性30 s,55℃复性30 s,72℃延伸1 min,30次循环;修复延伸,72℃5 min。PCR扩增产物送上海生工生物有限公司测序。
提交菌株SD006的16SrDNA序列在NCBI数据库中进行比对,选取相似性最高的20株菌的16SrDNA序列,进行ClustalX比对,利用MEGA5.05软件分析,构建系统发育树。
1.2.4 SOD纯化
1)硫酸铵沉淀:粗酶液中加入硫酸铵,4℃盐析12 h,蛋白质沉淀用pH 7.8的磷酸缓冲液(含EDTA 0.2 mmol/L)溶解。分别测不同浓度下得到的沉淀酶活,最后收集含酶活的蛋白沉淀,溶解得盐析酶液。
2)透析超滤:将盐析酶液转入预先处理好的透析袋中,4℃透析24 h,用于除去小分子物质及金属离子。将透析后的酶液转入10 000超滤管,4℃、5 000 r/min离心30 min。回收浓缩酶液,4℃保藏。
3)葡聚糖(G-100)凝胶柱:取5 mL浓缩酶液,加入经pH 6.8磷酸缓冲液预平衡的Sephadex G100柱(Ф1.6 cm×50 cm),调节恒流泵洗脱速度0.3 mL/min。调节自动收集器每管3 mL,根据洗脱峰记录试管编号,分别测定每管酶活。
4)DEAE-Sepharose FF:取5 mL酶液,加入经pH 7.8磷酸缓冲液预平衡的DEAE-Sepharose FF柱(Ф1.6 cm×30 cm),依次用含0.1、0.2、0.3、0.4、0.5 mol/L NaCl的pH 7.8磷酸缓冲液洗脱。调节恒流泵洗脱速度0.3 mL/min。调节自动收集器每管3 mL,根据洗脱峰记录试管编号,分别测定每管酶活。
5)SDS-PAGE:采用SDS-PAGE鉴定酶液纯化程度,用考马斯亮蓝染色法确定电泳条带位置。电泳规格:分离胶12 g/dL,浓缩胶5 g/dL,电压150 V,1.5 mm梳,时间2 h,考马斯亮蓝R250染色。
2 结果与讨论
2.1菌种筛选及鉴定
2.1.1菌种筛选
1)产SOD乳酸菌菌株初筛:从所采集的样品中共分离得到57株菌株,其中使BCP平板变色的产酸菌32株,镜检革兰氏染色阳性无芽孢菌株21株,经鉴定,其中17株为乳酸菌。
2)产SOD乳酸菌菌株复筛:在初筛基础上,利用邻苯三酚自氧化法测出初筛分离得到的乳酸菌SOD粗酶液酶活和菌体湿重,见表1。其中菌株SD006菌体湿重为31.7 g/L,酶活2 957.63 U/g。其酶活相对较高,因此选用SD006为本实验出发菌株。
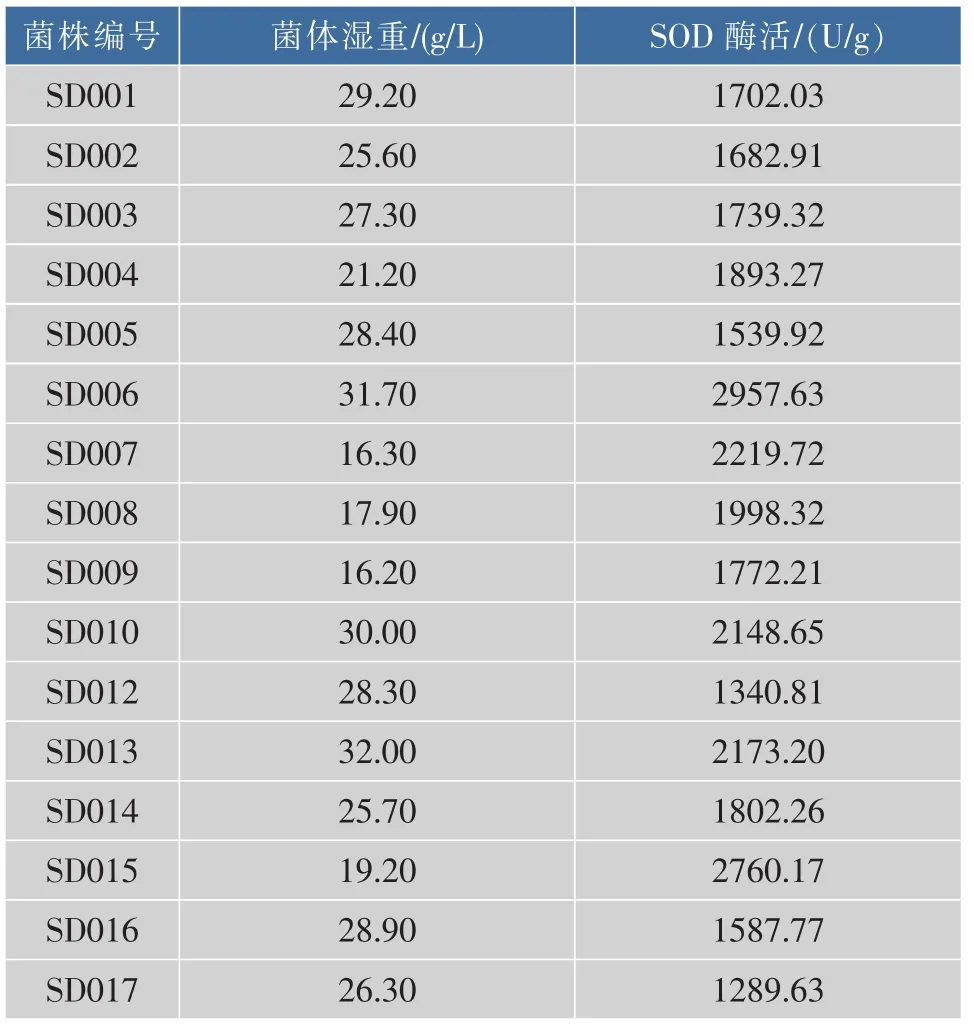
表1 菌株SOD酶活及菌体湿重Table 1 SOD activity and bacterial wet weight of strains
2.1.2菌株SD006鉴定
1)形态学观察:由图1-2可知,菌株SD006为圆形菌落,菌落突起,表面光滑。镜检为革兰氏阳性,杆状,无芽孢。

图1 菌株SD006平板划线图Fig. 1 Streak plate of strain SD006
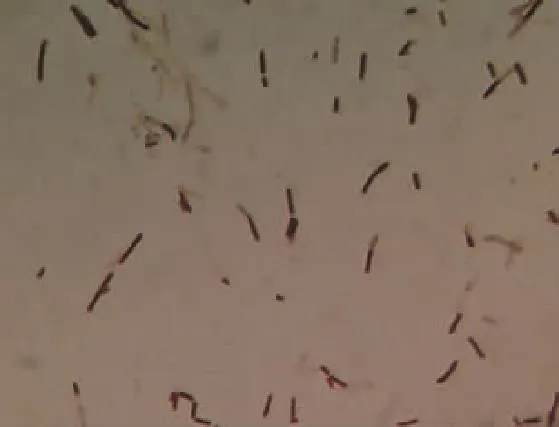
图2 菌株SD006显微形态特征Fig. 2 Micro-morphology of strain SD006
2)生理生化试验:菌株SD006的生理生化特征测定结果见表2。菌株SD006可分解葡萄糖、阿拉伯糖、木糖、麦芽糖、乳糖。甲基红试验、甘露醇试验、山梨醇试验为阳性。明胶水解试验、H2O2试验、吲哚试验、H2S产生试验、硝酸盐还原试验、淀粉水解试验、氧化酶试验、接触酶试验、鼠李糖试验、甘油试验呈阴性。
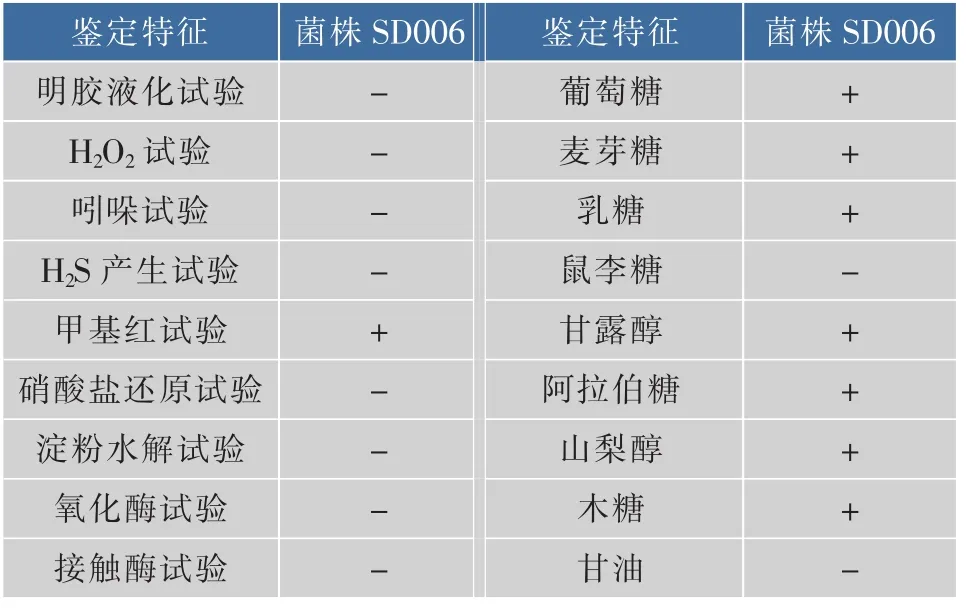
表2 菌SD006生理生化特征Table 2 Physiological and biochemical characteristics of strains SD006
3)菌株16sRNA序列分析:通过16sRNA序列分析菌株SD006含1 417 bp,将基因序列输入GenBank数据库进行比对,基于与SD006同源性较高的菌株构建系统发育树,见图3。其与Lactobacillus plantarum(NR 042394.1)同源性最高。SD006与Lactobacillus plantarum相似性达99%,结合生理生化特征,可确定SD006属于Lactobacillus plantarum。
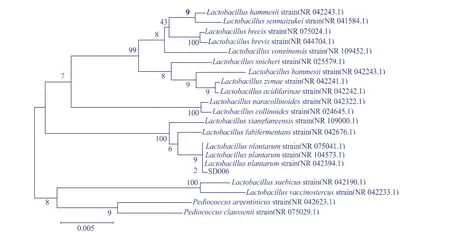
图3 植物乳酸杆菌SD006系统进化树Fig. 3 Phylogenetic tree showing the relationships of SD006 with the sequence of relating type
2.2 SOD纯化
经邻苯三酚自氧化法检测,粗酶液硫酸铵40% ~70%梯度盐析沉淀含有SOD酶活,其它梯度未检测出SOD酶活,因此选用40%~70%梯度盐析,见表3。将沉淀用pH 7.8磷酸缓冲液溶解,进行透析袋透析,超滤膜超滤除杂浓缩,浓缩液经Sephadex -G100凝胶柱层析,结果见图4。在整个洗脱过程出现4个蛋白质峰,分别测定各试管酶活,SOD酶活存在于第二个蛋白质峰(13~37管)内,收集第二个蛋白质峰内酶液。20℃预冷5 h,冷冻干燥浓缩。
将浓缩酶液用DEAE-Sepharose FF柱洗脱,结果见图5。在整个洗脱过程中出现3个蛋白质峰,分别测定各管酶活,SOD酶活主要存在于第三个蛋白质峰内,说明DEAE琼脂糖除去了一部分杂蛋白质。将第三个峰(31~56管)收集到的酶液,20℃预冷5 h,冷冻干燥浓缩。
2.3 SDS-PAGE结果
将分离纯化处理的酶液进行SDS-PAGE,结果见图6。粗酶液经过硫酸铵沉淀、透析袋透析、超滤膜超滤、Sephadex- G100凝胶柱和DEAE-Sepharose FF柱分离后的电泳得到了单一条带,说明纯化效果较好,根据相对迁移率相对分子质量关系,可以计算出该SOD的相对分子质量为39 290。
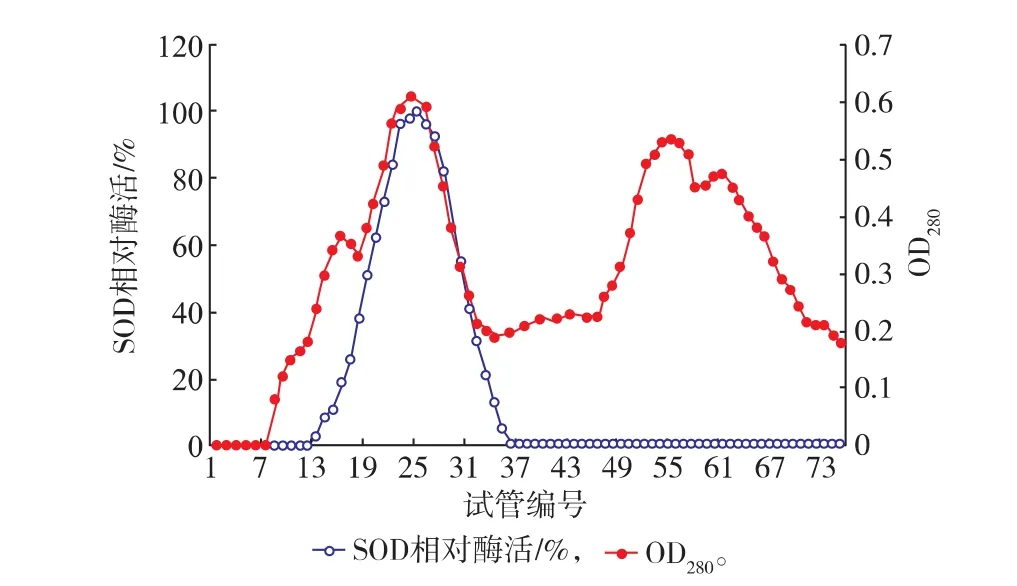
图4 葡聚糖凝胶G-100洗脱结果Fig. 4 Eluting result of Sephadex G -100 column chromatography
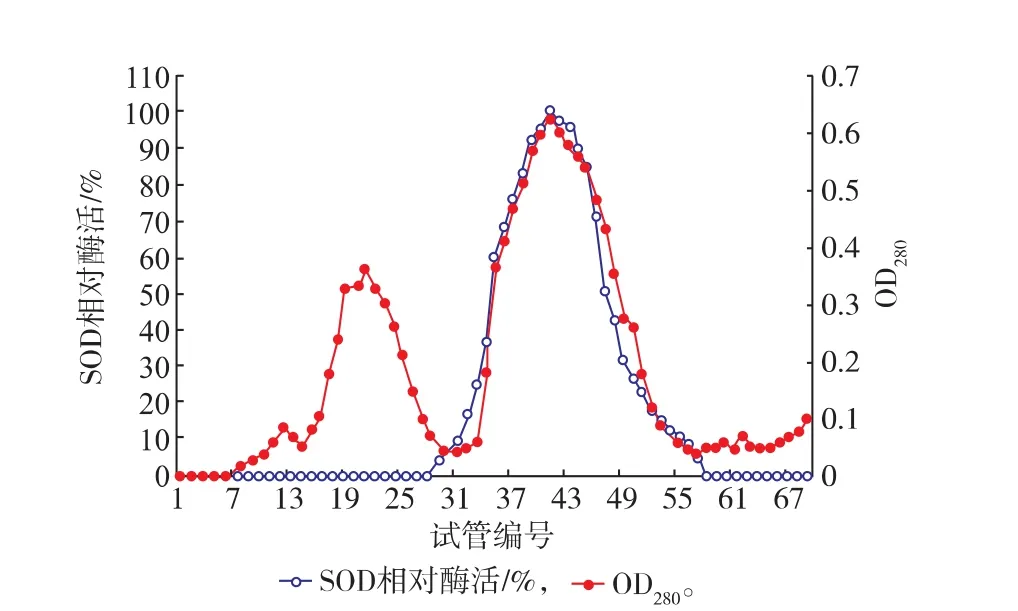
图5 DEAE-琼脂糖凝胶FF洗脱结果Fig. 5 Eluting result of DEAE -Sepharose FF column chromatography
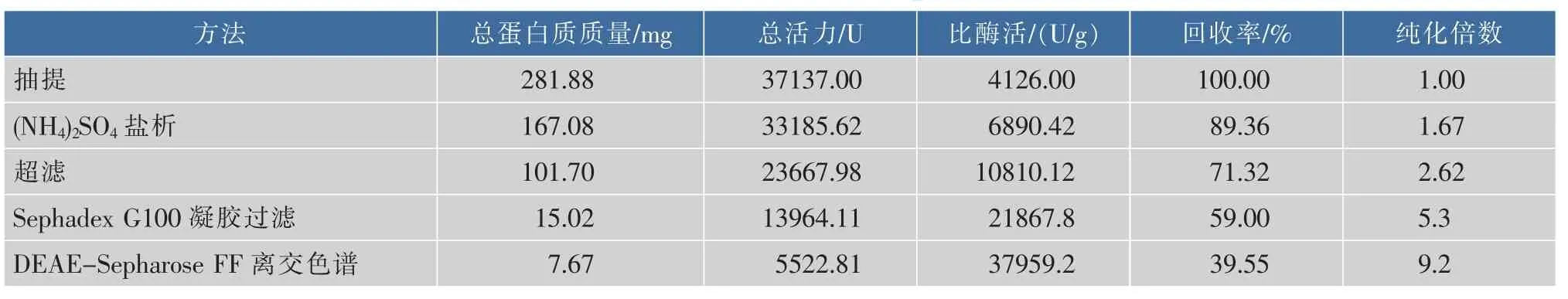
表3 SOD纯化结果Table 3 Result of isolation and purification

图6 不同纯化阶段酶液SDS-PAGE结果Fig. 6 SDS-PAGE of SOD solution at different stages of purification
3 结语
通过富集培养的方法从牛奶等分离得到57株菌,其中乳酸菌17株,从中筛选得到一株产SOD酶活相对较高的乳酸菌SD006,经生理生化实验和16SrDNA基因序列分析,鉴定为Lactobacillus plantarum。培养液经过硫酸铵沉淀、透析超滤、Sephadex-G100层析、DEAE-Sepharose FF离交柱色谱等步骤分离纯化,经SDS-PAGE得到单一条带,说明纯化效果较好,其纯化后酶活达到37 959.2 U/g。
目前世界各国对SOD应用的开发主要集中在医药领域,但随着人们生活水平的提高,人们对健康的观念从传统的药物治疗向食品保健方面转化,SOD在食品上的应用将越来越受人们的关注。但目前SOD食品种类还相对较少,尚不能满足人们对SOD食品的需求。因此应加强SOD在食品领域的应用研究。近年微生物SOD成为研究热点,但对产SOD乳酸菌的菌种选育研究相对较少,乳酸菌是一种人体益生菌,同时是一种重要的工业微生物,其用途广泛,尤其是在食品领域,因此乳酸菌SOD菌种选育有利于SOD在食品领域的应用开发。
参考文献:
[ 1 ] McCord J M,Irwin Fridovich. Superoxide dismutase:an enzymatic function for erythrocuprein(hemocuprein)[J]. J Biol Chem,1969,2(44):6049-6055.
[ 2 ]陈惠芳,王琦,付学池,等.超氧化物歧化酶(SOD)的分子生物学[J].生命的化学,2003,23(4):291-293. CHEN Huifang,WANG Qi,FU Xuechi,et al. Molecular biology of superoxide dismutase[J]. Chemistry of Life,2003,23(4):291-293.(in Chinese)
[ 3 ]朱秀敏.超氧化物歧化酶的生理活性[J].当代医学,2011,17(15):26-27. ZHU Xiumin. Physiological activity of superoxide dismutase[J]. Contemporary Medicine,2011,17(15):26-27.
[ 4 ] Muscoli C,Cuzzocrea S,Riley D P,et al. On the selectivity of superoxide dismutase mimetics and its importance in pharmacological studies[J]. British Journal of Pharmacology,2003,40(1):445-460.
[ 5 ]王素芳,蒋琳兰,赵树进.微生物超氧化物歧化酶研究进展[J].药物生物技术,2002,9(6):378- 380. WANG Sufang,JIANG Linlan,ZHAO Shujin. The development of research in the superoxide dismutase of microorganism[J]. Pharmaceutical Biotechnology,2002,9(6):378-380.(in Chinese)
[ 6 ] Yun Y S,Lee Y N. Purification and some properties of superoxide dismutase from Deinococcus radiophilus,the UV-resistant bacterium[J]. Extremophiles,2004,32(8):237-242.(in Chinese)
[ 7 ]杨明琰,张晓琦,沈俭,等.微生物产超氧化物歧化酶的研究进展[J].微生物学杂志,2004,24(1):49-52. YANG Mingyan,ZHANG Xiaoqi,SHEN Jian,et al. Research progress in extrating superoxide dismutase from microorganism[J]. Journal of Microbiology,2004,24(1):49-52.(in Chinese)
[ 8 ]田春美,钟秋平.超氧化物歧化酶现状研究进展[J].中国热带医学,2005,8(5):1730-1732. TIAN Chunmei,ZHONG Qiuping. Advance in current research of superoxide dismutase[J]. China Tropical Medicine,2005,5 (8):1730-1732.(in Chinese)
[ 9 ]王小英,马文丽,郑文岭.乳酸菌超氧化物歧化酶基因的克隆与特性分析[J].海南医学院学报,2009,15(6):548-552. WANG Xiaoying,MA Wenli,ZHENG Wenling. Clone and characteristic analysis of superoxide dismutase(SOD)in lactic acid bacteria[J]. Journal of Hainan Medical College,2009,15(6):548-552.(in Chinese)
[10]谢继清,李玉华,杨春梅,等.超氧化物歧化酶的药理作用[J].中国生化药物杂志,2009,30(1):72-74. XIE Jiqing,LI Yuhua,YANG Chunmei,et al. Pharmacology activities of superoxide dismutase [J]. Chinese Journal of Biochemical Pharmaceutics,2009,30(1):72-74.(in Chinese)
[11] Abe M,Nishidai T,Yukawa Y,et al. Studies on the radioprotective effects of superoxide dismutase in mice[J]. Int J Radiat Oncol Biol Phys,1981,16(7):205-209.
[12] Chikanza I,Fernandes L. Novel strategies for the treatment of os-teroarthritis[J]. Expert Opin Invest Drugs,2000,9(7):1499-1503.
[13] Khan M A,Van D J,Yeung I W,et al. Partial volume rat lung irradiation,assessment of early DNA damage in different lung regions and effect of radical scavengers[J]. Radiother Oncol,2003,66(1):95-102.(in Chinese)
[14]彭丹,孙材江,周江南.一氧化氮在实验性骨关节炎软骨细胞凋亡中的作用[J].中华风湿病学杂志,2000,4(4):232-234. PENG Dan,SUN Caijiang,ZHOU Jiangnan. The regulation effect of NO in the apoptosis of chondrocytes in experimental OA[J]. China Journal of Rheumatology,2000,4(4):232-234.(in Chinese)
[15]丁克祥.对邻苯三酚自氧化法实验影响因素的研究[J].海军工程学院学报,1986,36(3):109-113. DING Kexiang. Research on influence factors of pyrogallol autoxidation method [J]. Journal of Naval University of Engineering,1986,3(36):109- 113.(in Chinese)
[16]严万里,陈晓明,郭丽艳,等.超氧化物歧化酶活性测定的影响因素研究[J].生物学通报,2011,46(3):50-53. YAN Wanli,CHEN Xiaoming,GUO Liyan,et al. Research on influencing factors of superoxide dismutase activity assay[J]. Bulletin of Biology,2011,46(3):50-53.(in Chinese)
[17]黎瑞珍,杨庆建,陈贻锐.超氧化物歧化酶(SOD)活性的测定及其应用研究[J].琼州大学学报,2004,28(5):34-37. LI Ruizhen,YANG Qingjian,CHEN Yirui. Study of determination of superoxide dismutase(SOD)activation and application[J]. Journal of Qiongzhou University,2004,28(5):34-37.(in Chinese)
Isolation,Identification and Enzyme Purification of a SOD High Producing Strain of Lactic Acid Bacteria
XING Deming2,3,LI Xinhua2,YUAN Shenliang1,3,WANG Xiaohui*1,3,CHI Naiyu1,3,ZHANG Qingfang1,3
(1. College of Life Science and Technology,Dalian University,Dalian 116622,China;2. College of Food Science,Shenyang Agricultural University,Shenyang 110866,China;3. Liaoning Technology of Marine Microbiological Engineering Research Center,Dalian 116622,China)
Abstract:One SOD high-producing strain was screened and identified from lactic acid bacteria. The SOD enzyme was purified. The microbial enrichment,Gram staining and Pyrogallol autoxidation determination method were used in the screening. Morphological characteristics,physiology and biochemistry experiments,16S-rDNA sequencing were used for the strain identification. The SOD enzyme was purified by ammonium sulfate precipitation,ultrafiltration,sephadex-G100,DEAE-Sepharose FF etc. A SOD high-producing strain(SD006)was obtained and identified as Lactobacillus plantrum. The activity of purified enzyme reached 37 959.2 U/g SD006 is a SOD high-producing probiotics strain of Lactobacillus plantrum. The SOD purified from Lactobacillus is valuable and can be developed and applied in the food industry.
Keywords:Lactobacillus,SOD,identification,purification
*通信作者:王晓辉(1981—),女,辽宁大连人,工学博士,讲师,主要从事微生物与酶工程方面的研究。E-mail:wangxiaohui@dlu.edu.cn
基金项目:国家863计划项目(2007AA021306)。
收稿日期:2014-05-05
中图分类号:Q 939.99
文献标志码:A
文章编号:1673—1689(2016)02—0156—06

