国产FDG模块半自动合成18F-氟乙基胆碱
周 明,张晓军,刘 健,李云钢,张锦明
(1.中南大学湘雅医院 PET中心,湖南 长沙 410008;
2.中国人民解放军总医院 核医学科,北京 100853)
国产FDG模块半自动合成18F-氟乙基胆碱
周明1,张晓军2,刘健2,李云钢2,张锦明2
(1.中南大学湘雅医院 PET中心,湖南 长沙410008;
2.中国人民解放军总医院 核医学科,北京100853)
摘要:(18)F-氟乙基胆碱((18)F-FECH)是(18)F-FDG的重要补充,在脑瘤转移和前列腺癌及转移的诊断方面有重要的应用价值。利用国产单次PET-FDG-TI-I CPCU型FDG合成模块,未改变硬件,通过更改试剂与耗材,半自动合成(18)F-FECH,并在产品收集瓶前增加C18纯化柱,减少K(2.2.2)杂质的含量。合成时间约30 min,放化产率42.0% (未时间校正,n=5),放置6 h后放化纯度>99.0%,体外稳定性良好;合成时间和产率与国内外模块结果相近。结果表明,在国产单次PET-FDG-TI-I CPCU型FDG模块上可半自动合成(18)F-FECH,合成效率及放化纯度较高。
关键词:(18)F-氟乙基胆碱((18)F-FECH);PET;显像剂
胆碱是合成细胞膜组成成分卵磷脂的起始原料,在肿瘤细胞中能特异性的高聚集和代谢,用同位素标记的胆碱衍生物作为PET显像剂在多种恶性疾病的诊断中有广泛应用,如肺癌、食管癌、结肠癌、膀胱癌等[1-2]。特别在脑肿瘤和前列腺肿瘤研究方面,由于传统显像剂FDG摄取高、灵敏度低以致易出现假阳性诊断[3-4],同位素标记的胆碱衍生物已成为这两类肿瘤的诊断显像剂[5]。11C-胆碱是第一个基于胆碱的肿瘤显像剂,虽然其对脑肿瘤和前列腺肿瘤表现出良好的诊断效果,但是半衰期20 min,不仅限制了每天患者的检查数量,而且也限制了该药物的异地配送使用。因此,较长半衰期(109 min)的18F标记的胆碱类显像剂成为替代11C-胆碱的较好选择。目前,18F标记的胆碱类显像剂主要有18F-氟甲基胆碱(18F-FCH)和18F-氟乙基胆碱(18F-FECH)等[6-7],其中18F-FCH标记困难,产率和放化纯度不高、且不稳定[8],而18F-FECH产率和纯度较高,稳定性较好[9],成为取代11C-胆碱用于脑肿瘤和前列腺肿瘤PET显像的首选药物。
已报道的用于生产18F-FECH的合成方法和合成模块较多,如部分国产派特(北京)的PET-MF-2V-IT-I型F多功能模块[9-10]、美国GE公司的Tracelab FXFN多功能模块[11]和德国Simens的Explora FDG4合成模块[12]均以1,2-乙二醇二对甲苯磺酸酯和N,N-二甲基乙醇胺为原料,只是反应条件(包括温度、时间、反应物用量比例等)和纯化方式不同,最终产率也不同,一般放化产率在30%~37%之间;德国Raytest的Rayrest SynChrom型模块以及德国 Scintomics的 HotboxIII型模块以2-溴乙基-4-硝基苯磺酸酯为起始原料,将第一步反应产物中间体[18F]-2-溴-1-氟乙基固相纯化后再与N,N-二甲基乙醇胺反应[13],放化产率在28%~42%之间。如果为了生产18F-FECH而去购买价格昂贵的进口模块成本压力大,即使是购买相对便宜的国产氟多功能模块,还需配套相关热室等防护设备,同样性价比不高。鉴于此,本工作拟采用国产PET-FDG-TI-I单功能正电子药物合成仪为基础,不更改硬件,仅更换部分配件与合成原料生产18F-FECH,为无多功能合成器的机构进行18F-FECH临床应用和研究提供参考。
1主要仪器和材料
1.1试剂和材料
N,N-二甲基乙醇胺(纯度≥99.5%)、1,2-乙二醇二对甲苯磺酸酯(纯度> 97%)、无水K2CO3(纯度>99.995%):美国Aldrich 公司产品;无水乙腈(纯度99.9%)和K2.2.2(纯度98%):中国百灵威公司产品;HPLC乙腈(色谱纯):德国LiChrosolv公司产品;其余试剂均为国产分析纯;C18(Sep Pak Plus)、QMA(Sep pak Light)、CM柱(Sep Pak Plus)、IC-PakTMCation 色谱柱(3.9 mm×150 mm):美国Waters公司产品; 60F254薄层层析硅胶板:德国Merck公司产品;Millex GS 0.22 μm除菌过滤器:美国Millipore公司产品。
1.2仪器
HM-20型回旋加速器:日本住友重机械株式会社产品;PET-FDG-TI-I CPCU型正电子药物合成模块:派特(北京)科技公司产品;高效液相色谱仪:配Biocan Flow Count放射性检测器和515泵,2487紫外检测器,美国Waters公司产品;Bioscan system 2000型薄层色谱扫描仪:美国Bioscan公司产品 。
2实验方法
2.118F-FECH的半自动合成
利用PET-FDG-TI-I CPCU型正电子药物合成模块单管法半自动合成18F-FECH,在单向阀与V10之间接一个SEP-PAK C18纯化柱,将原来水解的NaOH注射器更改为5 mL 生理盐水,原来用于淋洗产品的10 mL注射用水更改为10 mL 50%乙醇。
改装后PET-FDG-TI-I型模块合成如图1所示。18F-FECH的半自动合成方法的合成原料与路线同参考文献[9]相比,在产品淋洗出之前,增加了一个C18柱。18F-FECH合成路线如图2所示,通过1,2-乙二醇二对甲苯磺酸酯与18F-进行亲核反应生成中间体18F-氟乙基对甲苯磺酸,再与N,N-二甲基乙醇胺反应得到产品化合物18F-FECH,最后反应体系通过CM柱和C18柱的分离纯化得到可供注射的终产品溶液。操作步骤如下。
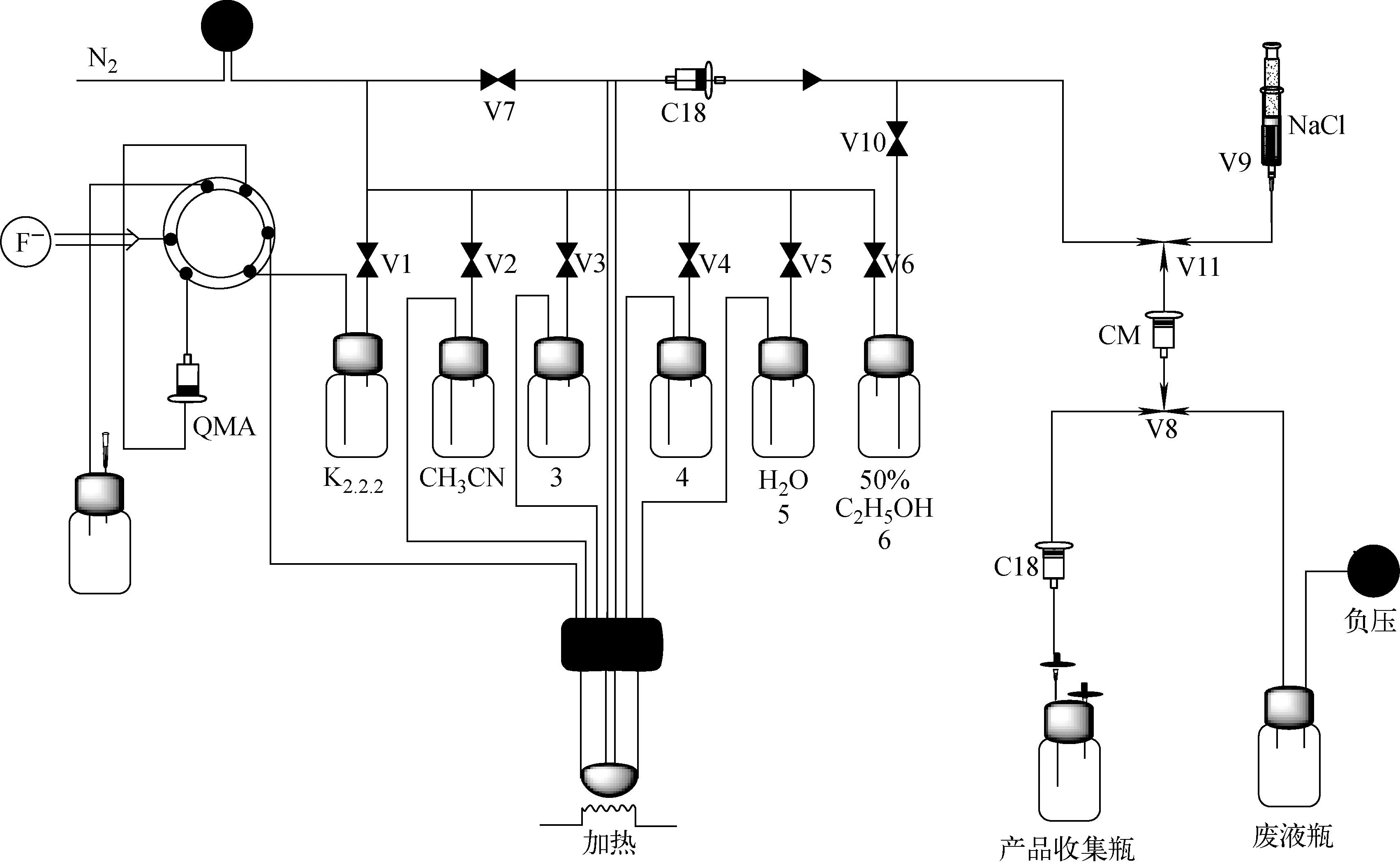
图1 改装后PET-FDG-TI-I型模块合成示意图Fig.1 Schematic diagram of modified PET-FDG-TI-I synthesizer
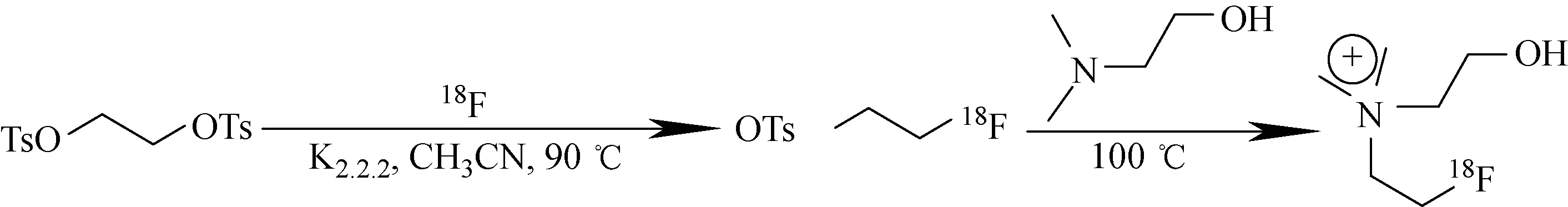
图2 18F-FECH的合成路线Fig.2 Synthesis route of 18F-FECH
1) 通过住友加速器利用18O(p,n)18F核反应生产18F-。
2)用N2将18F-从加速器靶内传出并用QMA柱捕获,随后使用1号瓶中的1 mL K2.2.2/K2CO3溶液将18F-洗脱至反应管中,加热蒸干溶剂后加入2号瓶中的2 mL乙腈再次干燥。
3) 将3号瓶中溶于1 mL乙腈的20 mg 1,2-乙二醇二对甲苯磺酸酯加入反应管中,85 ℃下反应5 min得中间体18F-氟乙基对甲苯磺酸,随后升温至115 ℃蒸除溶剂至剩余约0.1 mL。
4) 将4号瓶中溶有0.2 mL N,N-二甲基乙醇胺的0.4 mL乙腈溶液加入到反应管中,115 ℃蒸除溶剂至剩余约0.3 mL后85 ℃加热反应10 min,生成产品化合物18F-FECH。
5) 将5号瓶中的5 mL去离子水加入到反应管中并负压转移,经C18纯化柱和CM柱后产品被CM柱吸附。随后用6号瓶中的50%乙醇溶液进一步清洗CM柱,最后用5 mL 0.9%的NaCl溶液将18F-FECH从CM柱上洗脱下来,洗脱液经第二个C18柱和0.22 μm除菌滤膜进入产品收集瓶中得无色澄清的18F-FECH注射液。
2.2质量控制
1) 用精密pH试纸测定18F-FECH注射液的pH,并目测产品的颜色和澄清度[9]。
2) 高效液相色谱法(IC-PakTMCation,3.9 mm×150.0 mm,10.0 μm)和薄层层析法(Bioscan system 2000)检测18F-FECH注射液的体外稳定性和放化纯度,其中HPLC的条件中流动相为5 mol/L HCl溶液,流速为1.0 mL/min,检测器为放射检测器。TLC展开剂为5%的醋酸溶液。
3) 室温下测定产品三个半衰期(6 h)内的放化纯度,观察产品的稳定性。
4) 根据参考文献[15],采用碘铂酸盐试剂硅胶板显色法检测产品中K2.2.2的含量。制备0.010、0.025、0.050 g/L K2.2.2的标准溶液作为对照,分别制备未用C18柱纯化和用C18柱纯化的18F-FECH,对其中K2.2.2杂质进行半定量检测。
5) 参照中国药典2010年版对产品注射液进行无菌和细菌内毒素检查。
3结果与讨论
3.118F-FECH的半自动合成
18F-FECH的合成方法较多,不同的合成模块合成前体也不完全一样[11,13],改造后半自动合成全过程时间约为30 min,最终产品放化纯度为99.0%、放化产率为42.0%。该方法将合成时间从常规的50 min左右缩短至30 min左右,放化产率与其他合成方法相似[9-14]。通过固相萃取分离纯化代替HPLC分离纯化,不仅节省了时间,而且减少了上柱和HPLC纯化柱的吸附损失;改装后的模块简化合成线路,可减少产品在管线和反应管中的损失。但由于PET-FDG-TI-I为开放体系,反应管直接与大气相通,管内压力为大气压,合成18F-FECH时亲核和烷基化若用100 ℃加热反应,乙腈溶剂将在5 min内蒸干,不利于反应的进行。因此本工作亲核和烷基化均采用85 ℃反应。氟多功能模块采取密闭体系反应,加热至100 ℃时,由于反应管密闭,反应管内处于高压状态,乙腈温度可达100 ℃,有利于反应进行。该反应路径利用C-18柱除去前体1,2-乙二醇二对甲苯磺酸酯、中间体18F-氟乙基对甲苯磺酸和与K2.2.2络合的K离子,对合成效率有关键的作用,CM柱为弱阳离子交换柱,可吸附产品18F-FECH,利用10 mL 50%的乙醇水溶液清洗CM柱,将未反应前体N,N-二甲基乙醇胺及氟离子等其他杂质除去,此外在产品接收瓶前增加C18纯化柱能够降低产品中K2.2.2杂质的含量。
3.218F-FECH注射液的质量控制
1) 产品注射液无色澄清,pH约为7.0。
2) 对产品溶液进行薄层色谱法(TLC)检测,分析产品和游离的F-的保留时间,结果如图3所示。产品18F-FECH的Rf约为0.3,未见游离F-的放射性峰(原点),放化纯度大于99.0%。
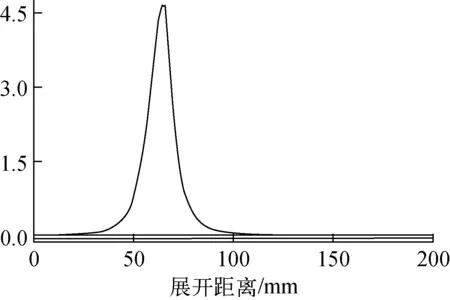
图3 18F-FECH注射液的TLC谱图(Rf=0.3)Fig.3 TLC chromatogram of 18F-FECH
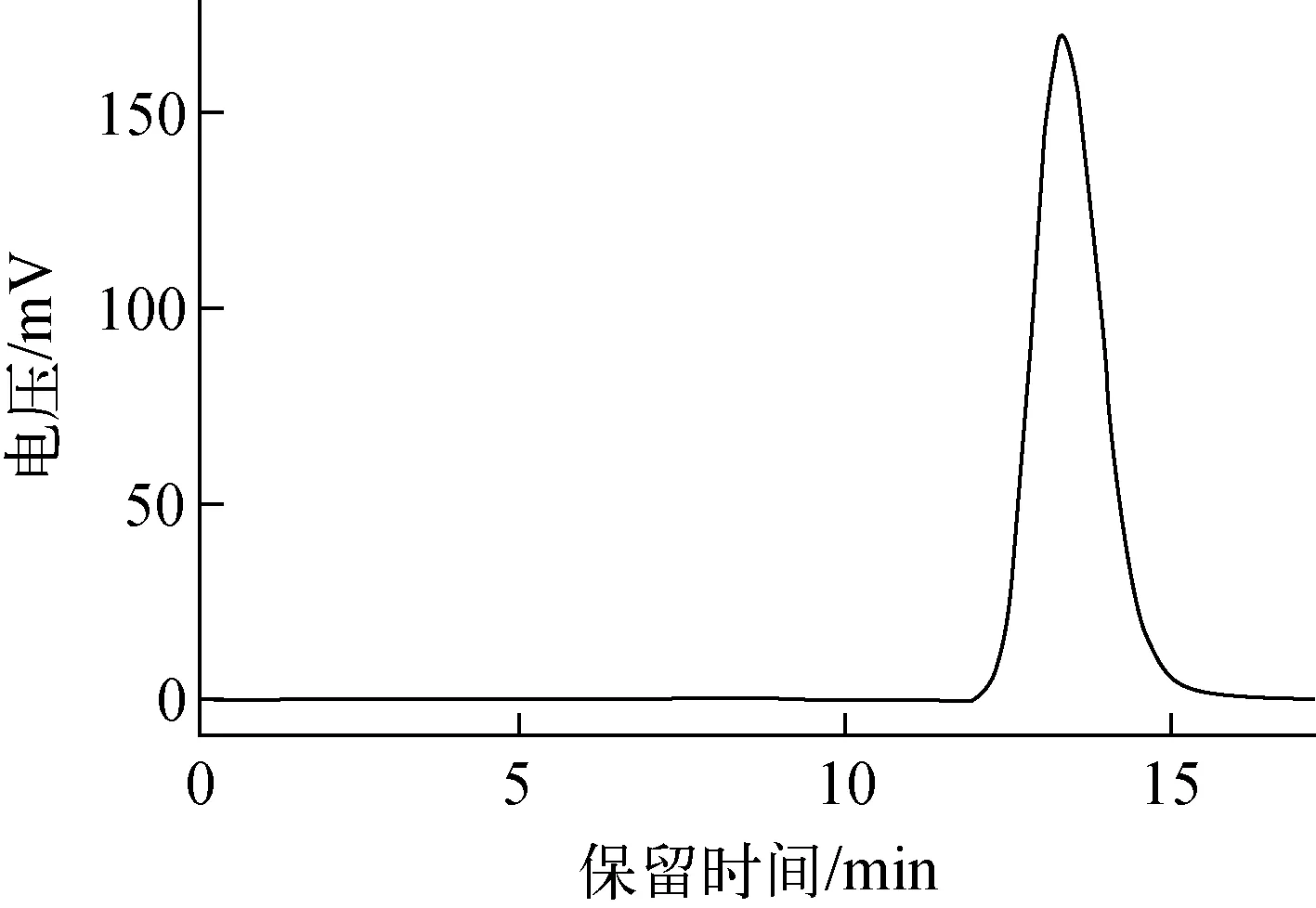
图4 18F-FECH注射液的HPLC放射性谱图Fig.4 HPLC chromatogram of 18F-FECH
3) 为了进一步分析产品溶液的放化纯度和稳定性,继续对其进行HPLC分析,结果如图4所示。18F-FECH放射性峰保留时间约为12.5 min,放化纯度大于99.0%。6 h后再次进样检测,放化纯度仍大于99.0%,表明产品体外稳定性较好。
4) 通过与0.010、0.025、0.050 g/L K2.2.2标准溶液在氯铂酸盐硅胶板上显色的蓝斑颜色深度对比,未采用C18柱纯化的产品中K2.2.2的含量高于0.050 g/L,而利用产品收集瓶前C18柱纯化过的产品中K2.2.2的含量介于0.010 g/L与0.025 g/L之间。可见,由于该合成路线采用10 mL 50%乙醇水溶液清洗CM柱,清洗液体的量太少,导致生理盐水直接淋洗的产品K2.2.2含量超标,而增加C18吸附K2.2.2后,产品K2.2.2含量下降并低于0.025 g/L。因此,产品收集前利用C18柱对产品进行再纯化可以得到化学纯度更高的产品,并且可将5号试剂瓶更换为30 mL西林瓶,加入30 mL 50%乙醇水溶液对CM柱进行清洗,以降低产品K2.2.2杂质的含量。
5) 无菌和细菌内毒素检查结果为18F-FECH注射液72 h细菌培养结果呈阴性,细菌内毒素含量小于规定的每毫升15 EU,符合中国药典标准要求。
18F-FECH注射液的质控结果表明,利用PET-FDG-TI-I CPCU型FDG单次合成模块通过半自动方法合成的18F-FECH符合临床注射质量要求。
4结论
本工作基于对PET-FDG-TI-I CPCU型FDG单次合成模块的合理改装,采用单管法反应,半自动合成了肿瘤显像剂18F-FECH,增加的C18纯化柱有效降低了产品K2.2.2杂质的含量。总合成时间约30 min,产品放化产率约为42.0%(未时间校正,n=5),放化纯度大于99.0%,其余各项指标也均符合国家标准。本工作丰富了PET-FDG-TI-I CPCU型合成模块的功能,使其能够生产18F-FDG以外的放射性药物。
参考文献:
[1]郭喆,张锦明.11C-胆碱在PET肿瘤显像中的应用[J]. 同位素, 2005,18(3):178-182.
Guo Zhe, Zhang Jinming. Application of11C-choline PET in tumors imaging[J]. J Isot, 2005, 18(3): 178-182(in Chinese) .
[2]Zhu A, Shim H. Current molecular imaging positron emitting radiotracers in oncology[J]. Nucl Med Mol Imaging, 2011, 45(1): 1-14.
[3]DeGrado T R, Baldwin S W, Wang S, et al. Synthesis and evaluation of18F-labeled choline analogs as oncologic PET tracers[J]. J Nucl Med, 2001, 42: 1 805-1 814.
[4]Hara T, Kondo T, Hara T, et al. Use of18F-choline and11C-choline as contrast agents in positron emission tomography imaging-guided stereotactic biopsy sampling of gliomas[J]. J Neuros, 2003, 99: 474-479.
[5]Bauman G, Belhocine T, Kovacs M, et al.18F-fluorocholine or prostate cancer imaging: A systematic review of the literature[J]. Prostate Cancer Prostatic Dis, 2012, 15: 45-55.
[6]Spaeth N, Wyss M T, Weber B, et al. Uptake of18F-fluorocholine,18F-fluoroethyl-L-tyrosine and18F-FDG in acute cerebral radiation injury in the rat: implications for separation of radiation necrosis from tumor recurrence[J]. J Nucl Med, 2004, 45: 1 931-1 938.
[7]Shao X, Hockley B G, Hoareau R. Fully automated preparation of [11C]choline and [18F] fluoromethylcholine using Tracer Lab synthesis modules and facilitated quality control using analytical HPLC[J]. Appl Radiat Isot, 2011, 69(2): 403-409.
[8]吴战宏,王世真,周前,等.18F标记氟甲基胆碱的半自动合成及其生物分布[J]. 核化学与放射化学,2005,3:185-189.
Wu Zhanghong, Wang Shizhen, Zhou Qian, et al. Semi-automatic synthesis and animal imaging of18F-FCH[J]. J Nucl Radiochem, 2005, 3: 185-189(in Chinese).
[9]党永红,李方,吕京桥,等. PET肿瘤显像剂18F-氟乙基胆碱的自动化合成[J]. 同位素,2010,23(2):81-85.
Dang Yonghong, Li Fang, Lv Jingqiao, et al. Automatic synthesis of tumor imaging agent18F-fluoroethyl-choline[J]. J Isot, 2010, 23(2): 81-85(in Chinese).
[10]王红亮,黄婷婷,梁祥,等. (N-[18F]氟甲基)-胆碱的半自动合成和无菌型炎症PET显像评价[J]. 同位素,2011,24(4):198-204.
Wang Hongliang, Huang Tingting, Liang Xiang, et al. Semi-automatic synthesis and PET imaging evaluation of18F-fluoramethylcholine with the aseptic inflammation modal[J]. J Isot, 2011, 24(4): 198-204(in Chinese).
[11]郭莘,戴红峰,陈国宝,等.18F-氟乙基胆碱的自动化合成、质量控制及初步应用[J]. 中国实用医药,2011,(16):11-13.
Guo Shen, Dai Hongfeng, Chen Guobao, et al.Automatic synthesis, quality control and preliminary clinical use of18F-fluoroethylcholine[J]. China Prac Med, 2011, (16): 11-13(in Chinese).
[12]王明伟,章英剑,张勇平,等. 肿瘤分子显像剂18F-氟乙基胆碱的自动化合成[J]. 核技术,2008,31(11):859-866.
Wang Mingwei, Zhan Yingjian, Zhang yongping, et al. Automatic synthesis of the tumor imaging agent18F-fluoroethylcholine[J]. Nucl Tech, 2008, 31(11): 859-866(in Chinese).
[13]Schmaljohann J, Schirrmacher E, Wängler B. Fully automated SPE-based synthesis and purification of 2-[18F]fluoroethyl-choline for human use[J]. Nucl Med Biol, 2011, 8(2): 165-170.
[14]Mock B H, Winkle W, Vavrek M T. A color spot test for the detection of kryptofix 2.2.2 in18F-FDG preparation[J]. Nucl Med Biol, 1997, 24(2): 193-195.
[15]Pascali G, D'Antonio L, Bovone P. Optimization of automated large-scale production of [18F] fluoroethylcholine for PET prostate cancer imaging[J]. Nucl Med Biol, 2009, 36(5): 569-574.
The Semi-automatic Synthesis of18F-fluoroethyl-choline by Domestic FDG Synthesizer
ZHOU Ming1, ZHANG Xiao-jun2, LIU Jian2,LI Yun-gang2, ZHANG Jin-ming2
(1.PETCenter,DepartmentofNuclearMedicine,XiangYaHospital,CentralSouthUniversity,Changsha410008,China;2.DepartmentofNuclearMedicine,thePLAGeneralHospital,Beijing100853,China)
Abstract:As an important complementary imaging agent for (18)F-FDG, (18)F-fluoroethyl-choline ((18)F-FECH) has been demonstrated to be promising in brain and prostate cancer imaging. By using domestic PET-FDG-TI-I CPCU synthesizer, (18)F-FECH was synthesized by different reagents and consumable supplies. The C18 column was added before the product collection bottle to remove K(2.2.2 ). The (18)F-FECH was synthesized by PET-FDG-IT-I synthesizer efficiently about 30 minutes by radiochemical yield of 42.0% (no decay corrected, n=5), and the radiochemical purity was still more than 99.0% after 6 hours. The results showed the domestic PET-FDG-IT-I synthesizer could semi-automatically synthesize injectable (18)F-FECH in high efficiency and radiochemical purity.
Key words:(18)F-fluoroethyl-choline ((18)F-FECH); PET; imaging agent
doi:10.7538/tws.2016.29.01.0019
中图分类号:TL92+3
文献标志码:A
文章编号:1000-7512(2016)01-0019-06
作者简介:周明(1986—),男,湖北省荆州人, PET化学师
收稿日期:2014-10-27;修回日期:2015-06-25

