99mTc -帕米膦酸盐的制备及骨分布
罗洪义,沈浪涛,梁积新,杨春慧,张文辉,秦少鹏,卫成军,刘海春, 王建华,李洪玉
(1.中国原子能科学研究院 同位素研究所,北京 102413;
2.原子高科股份有限公司,北京 102413;3.核工业401医院 核医学科, 北京 102413)
99mTc -帕米膦酸盐的制备及骨分布
罗洪义1,沈浪涛2,梁积新1,杨春慧2,张文辉2,秦少鹏1,卫成军1,刘海春3, 王建华3,李洪玉2
(1.中国原子能科学研究院 同位素研究所,北京102413;
2.原子高科股份有限公司,北京102413;3.核工业401医院 核医学科, 北京102413)
摘要:为观察(99m)Tc标记的帕米膦酸盐(Pamidronate,PAM)的骨分布特点,以氯化亚锡为还原剂,优化(99m)Tc直接标记PAM的条件,研究SnCl2(Ⅱ)含量、配体用量、pH及反应时间对标记率的影响,确定了优化的标记条件;考察(99m)Tc-PAM的体外稳定性;评价(99m)Tc-PAM在正常鼠体内的生物分布,尤其是骨摄取情况,比较(99m)Tc-PAM与(99m)Tc-MDP在正常小鼠体内的骨摄取。实验结果表明,PAM的(99m)Tc标记方法简单,标记率大于95%,标记物体外稳定性好。正常鼠体内分布实验发现,(99m)Tc-PAM骨摄取很高,且滞留时间长,在血液中清除快,在体内主要通过肾代谢;正常大鼠SPECT显像骨组织清晰可见,具有很好骨显像效果。与(99m)Tc-MDP在正常小鼠体内的生物分布结果比较表明,(99m)Tc-PAM的骨放射性摄取及骨与血放射性摄取比在不同时相均优于(99m)Tc-MDP。研究表明,(99m)Tc-PAM具有理想的骨显像性能,可用于骨显像、骨损伤探测以及肿瘤骨转移检测等应用研究。
关键词:骨显像剂;(99m)Tc-帕米膦酸盐;生物分布;SPECT显像;(99m)Tc-亚甲基二膦酸盐
自20世纪70年代初99mTc标记的亲骨显像剂问世以来,放射性核素骨显像已在临床得到广泛应用,并成为核医学科中的一个重要分支。目前临床上使用的骨显像剂主要是99mTc标记的磷酸盐类和膦酸盐类,其中以锝[99mTc]亚甲基二膦酸盐(99mTc-MDP )使用最广泛[1]。99mTc-MDP主要用于各种骨骼系统疾病的早期诊断,包括骨代谢病、骨肿瘤与骨转移瘤等,尤其是早期诊断恶性肿瘤有无骨转移,在临床实践中起到了非常重要的作用。由于99mTc-MDP从血液和软组织中清除相对较慢,药物注射和骨显像之间等待时间较长,临床应用有一定局限性[2]。
帕米膦酸二钠(3-amino-1-hydroxypropylidene-1-biophosphonic acid,PAM)是德国Henkel公司研发的第二代二膦酸盐类药物,1989年首次在英国上市,临床用于恶性肿瘤并发的高钙血症和溶骨性癌转移引起的骨痛[3-4]。由于此类药物对乳腺癌骨转移病灶的良好效果,已被美国FDA批准用于乳腺癌骨转移病灶治疗。帕米膦酸二钠的化学结构是3-氨基-1-羟基丙叉-1,1-双膦酸盐,与中心碳原子相连的一端侧链为羟基(-OH),可以显著提高其对骨的亲和力;另一端侧链为伯氨基(-CH2CH2NH2),可以提高与99mTc的络合能力[5]。Kumar等[6-7]发现99mTc标记帕米膦酸盐在正常骨与骨损伤中骨摄取均高于99mTc-MDP,肾脏与软组织清除均较99mTc-MDP快。
近年来,99mTc的同质异能体99Tc标记的亚甲基二膦酸盐即99Tc-MDP(商品名为云克)在类风湿性关节炎等自身免疫性疾病及骨科疾病治疗方面取得了突破进展,已广泛用于类风湿性关节炎、强直性脊柱炎、股骨头坏死与骨关节炎等疾病的治疗,其疗效已经在临床上得到了肯定[8-9]。99Tc-MDP是一种我国自主开发研制的放射性标记药品,其成功研制促进了对新一代二膦酸盐类治疗药物的探索。
本研究拟通过99mTc直接标记PAM,评价标记物的体外稳定性以及动物体内的生物分布情况,并与99mTc-MDP进行对比,探讨99mTc-PAM作为骨显像剂的特点,以期得到一种更理想的骨显像剂,并为进一步开发具有自主知识产权的、可用于类风湿性关节炎治疗等的新一代放射性标记药物99Tc-PAM提供参考。
1实验部分
1.1实验材料
99Mo-99mTc发生器:原子高科股份有限公司;FH463A自动定标器、FT-603型闪烁探头:北京核仪器厂;CRC15R放射性活度计:美国CAPINTEC公司;BS124S电子天平:德国Sartorius公司;BFX4-320低速自动平衡离心机:白洋离心机厂;1470自动伽玛计数器:Perkin Elmer公司;N2-522 E. CAM双探头SPECT:德国西门子公司。
帕米膦酸钠(Pamidronate,PAM):自行合成,结构经核磁共振、质谱分析等确认[10];MDP药盒:原子高科股份有限公司;SnCl2·2H2O:美国阿尔法试剂公司;盐酸,丙酮,氢氧化钠,甲醇,丁酮,无水乙醇,乙腈等均采用国产分析纯试剂;实验用水均为二次去离子水。
昆明种小白鼠:雌性,(20±2.0) g,45只,清洁级;Wistar大鼠:雌性,(220±20) g,24只,清洁级。均由中国医学科学院实验动物研究所提供。
1.2实验方法
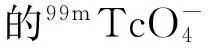
1.2.299mTc-PAM的标记率及放化纯度99mTc-PAM的标记率和放化纯度采用快速薄层层析法(ITLC)测定,以快速薄层硅胶板(ITLC-SG)为支持体,展开体系1为丁酮,体系2为盐酸与甲醇的混合液V(HCL)∶V(甲醇)=5∶95,采用上行色谱法,展开距离为10 cm。放射性计数采用γ计数器测定。
1.2.3体外稳定性取1.2.1节所得0.1 mL99mTc-PAM溶液(约37 MBq)加入至0.9 mL 10%的胎牛血清(用pH=7.4的PBS稀释)中,震荡摇匀,37 ℃下温育,分别于0、1、2、4、6 h后,取出0.1 mL混合液加入离心管中,再加入0.2 mL乙腈,常温4 000 r/min离心5 min,取上清液,用1.2.2方法测定其放化纯度(RCP),并与标记物在生理盐水中的稳定性进行比较。
1.2.499mTc-PAM及99mTc-MDP在正常小鼠体内生物分布取雌性昆明小白鼠45只,随机分组,每组5只。经尾静脉注射0.1 mL99mTc-PAM或99mTc-MDP溶液(约0.74 MBq),于注射后30 min、1 h、2 h、3 h、4 h(没有做99mTc-MDP的4 h体内生物分布实验)断颈处死,取血、心、肝、脾、肺、肾、胃、肠、肌肉、头盖骨、股骨等组织,称重,测量其放射性计数并进行衰减校正,计算每克组织的放射性摄取占总注射量的百分数(%ID/g)。并对99mTc-PAM和99mTc-MDP在正常小鼠体内的生物分布进行比较。
1.2.5正常大鼠的体内生物分布取雌性Wistar大鼠20只,随机分组,每组5只。经尾静脉注射0.1 mL99mTc-PAM溶液(约5.5 MBq),于注射后30 min、1 h、2 h、3 h断颈处死,取血、心、肝、脾、肺、肾、胃、肠、肌肉、股骨及头盖骨等称重,测量其放射性计数并进行衰减校正,计算每克组织的放射性摄取占总注射量的百分数(%ID/g)。
1.2.6正常大鼠的SPECT显像取雌性Wistar大鼠4只,经尾静脉注射0.1 mL99mTc-PAM溶液(约18.5 MBq)。分别于注射2 h、4 h后进行SPECT显像,于显像前10 min经腹腔注射1 mL 10%水合氯醛溶液行全身麻醉。显像时,99mTc能窗采用140 keV,显像数据在计算机系统128× 128矩阵中进行记录与分析。放大倍数为1;采集放射性计数:300 000/只。
2结果与讨论
2.1PAM的99mTc标记条件
还原剂SnCl2对99mTc-PAM标记率的影响示于图1。
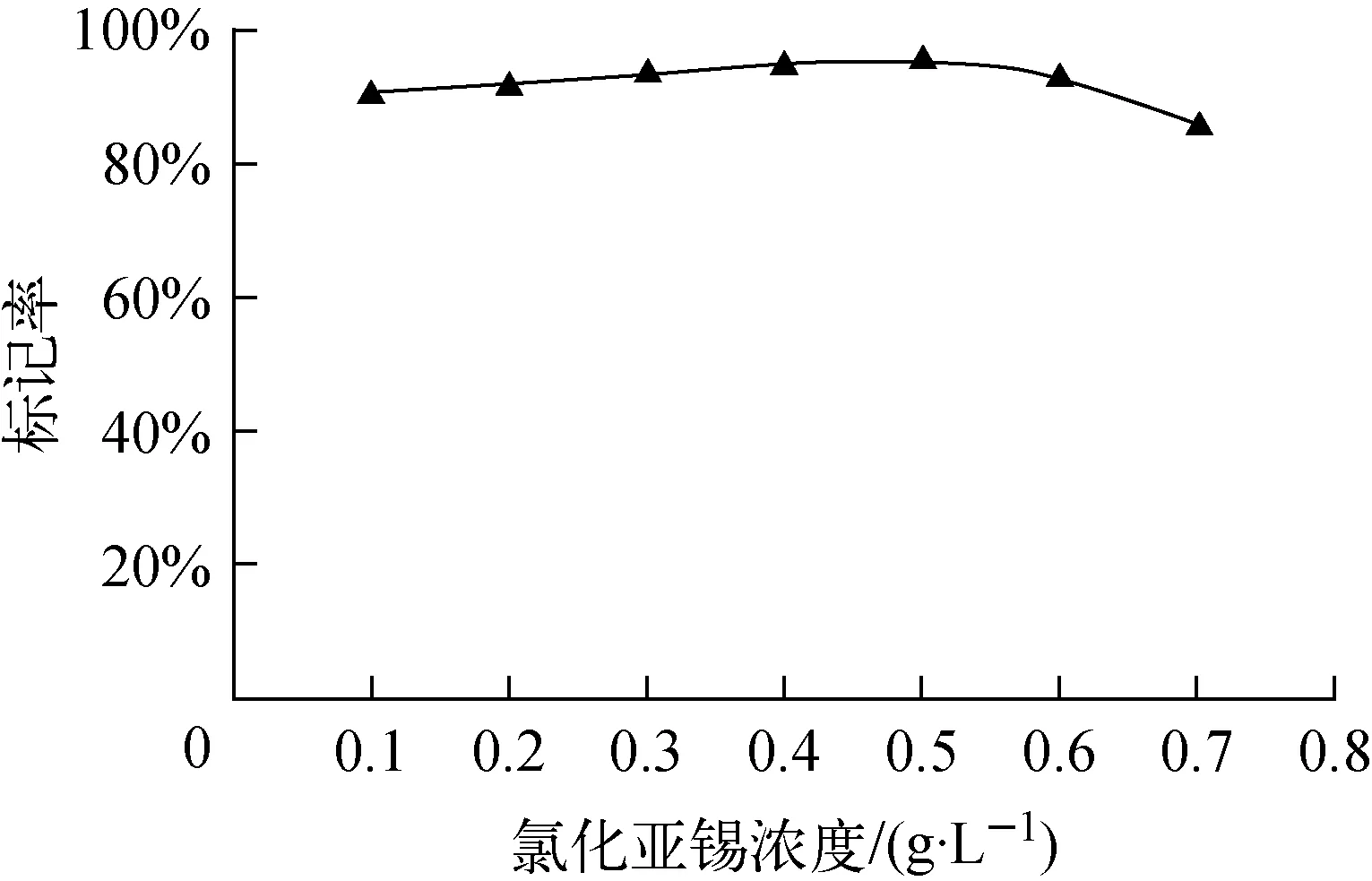
图1 SnCl2浓度对标记率的影响Fig.1 Influence of SnCl2 concentration on radiolabeling yield of 99mTc-PAM
从图1中可以看出,当SnCl2的浓度在0.1~0.6 g/L范围内,标记率均在90%以上,而当浓度增大到0.7 g/L时,标记率下降至80%左右。可能原因是SnCl2含量过高时,容易生成99mTcO2胶体,造成标记率偏低。SnCl2浓度为0.5g/L时,99mTc-PAM标记率达95%以上,本实验中均采用SnCl2浓度为0.5 g/L。
配体PAM用量对99mTc-PAM标记率的影响示于图2。由图2可知,标记率随PAM浓度的增大而增加,当PAM浓度为5.0 g/L时,标记率达97.2%。
pH对99mTc-PAM标记率的影响如图3所示,从图3中可以看出,当pH为5~8时,标记率均大于90%。但当pH继续增大时,标记率显著降低,考虑到实际应用,本实验中选择pH为6.0。
反应时间对标记率的影响见图4。由图4可知,反应15 min时,标记率即达到95%以上。时间延长,标记率基本保持不变。时间不是影响标记率的主要因素,该标记反应在短时间内即可达到很高的标记率。因此将反应时间定为15 min。

图2 配体PAM浓度对标记率的影响Fig.2 Influence of PAM concentraiont on radiolabeling yield of 99mTc-PAM
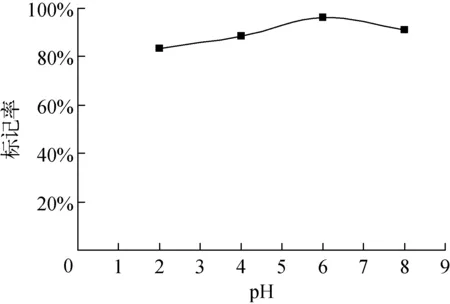
图3 pH对标记率的影响Fig.3 Influence of pH value on radiolabeling yield of 99mTc-PAM
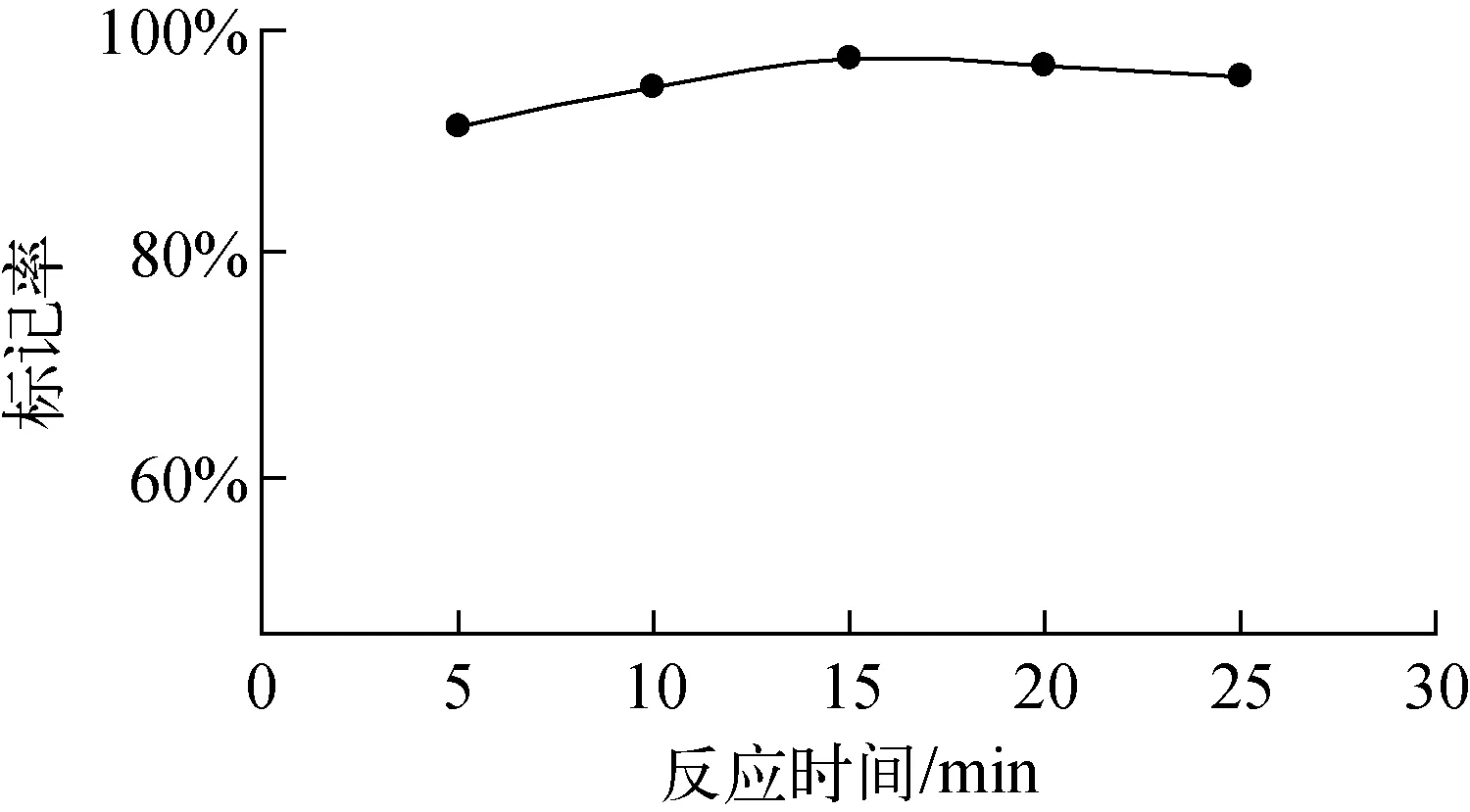
图4 反应时间对标记率的影响Fig.4 Influence of reaction time on radiolabeling yield of 99mTc-PAM
2.299mTc-PAM标记率及放化纯度
2.3体外稳定性
99mTc-PAM在生理盐水与10%胎牛血清中的体外稳定性结果示于图5。
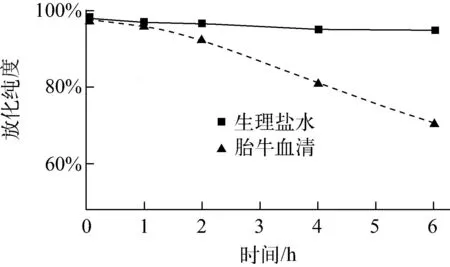
图5 99mTc-PAM在生理盐水与小牛血清中的体外稳定性Fig.5 In vitro stability of 99mTc-PAM in saline and calf serum
由图5可知,99mTc-PAM在生理盐水中具有良好的稳定性,于室温下放置6 h后,标记物未见明显分解,放化纯度仍在95%以上。99mTc-PAM在10%胎牛血清中具有较好的稳定性,2 h后放化纯度仍高于90%,但随着时间延长缓慢分解,6 h后其放化纯度约为70%。
2.499mTc-PAM在正常鼠体内的生物分布
2.4.1在正常鼠体内的生物分布及与99mTc-MDP的比较99mTc-PAM在正常小鼠体内生物分布结果见图6。由图6可知,99mTc-PAM骨摄取很高,在给药后2 h时,达到峰值为(41.20±6.87)%,骨中滞留时间长,在给药后4 h时,仍高达(30.30±2.31)%;血清除很快,在给药后4 h,骨与血放射性摄取比高达303;标记物在肾中有少量的摄取,这由标记物具有较高水溶性的药物性质决定(经测量,99mTc-PAM的脂水分配系数P=0.004 65,logP=-2.33)。心、肝、肺等重要脏器放射性摄取非常少,几乎可以忽略不计,提示重要脏器的放射性受累很小。
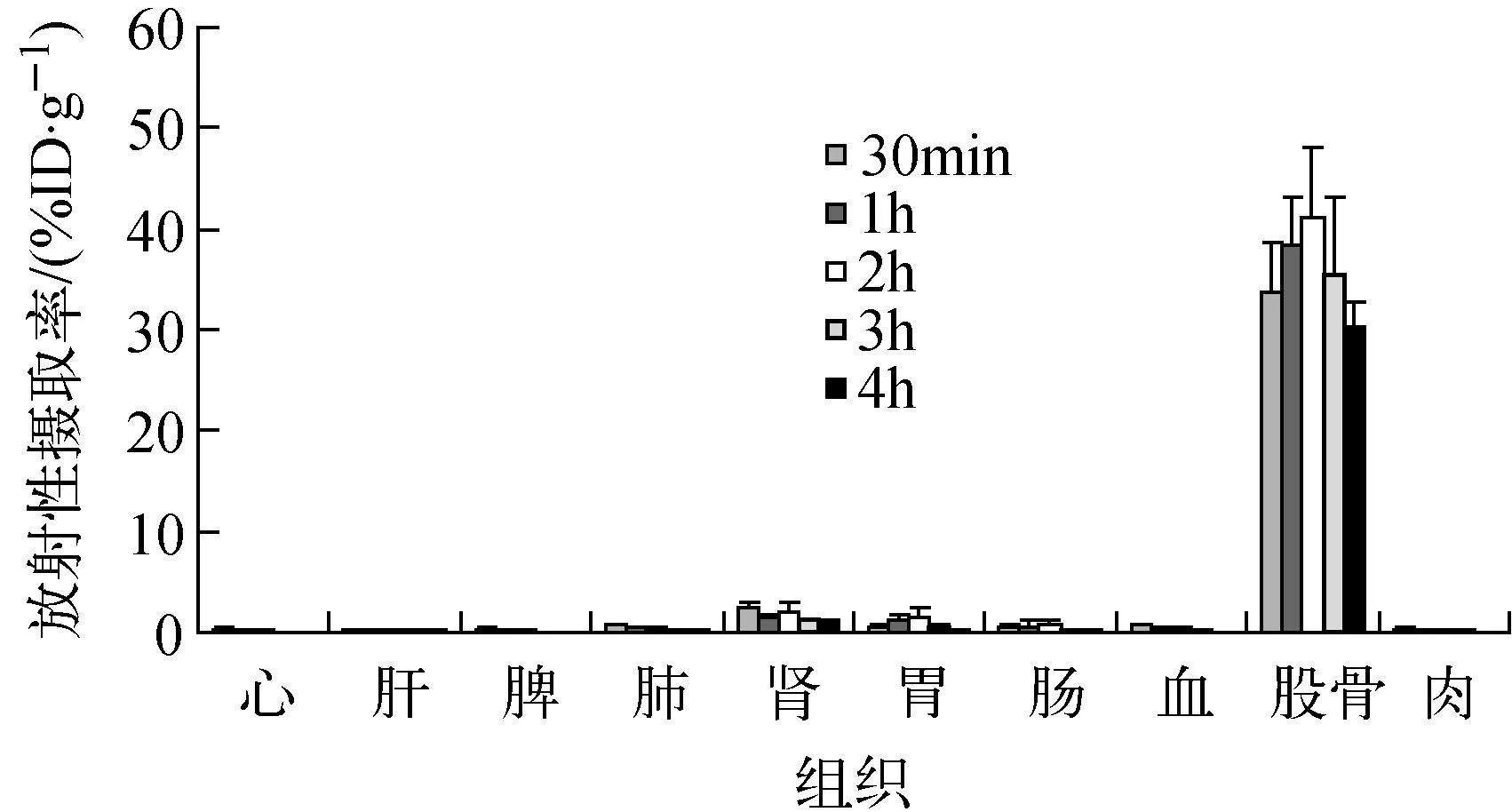
图6 99mTc-PAM在正常昆明种小鼠体内分布Fig.6 Biodistribution of 99mTc-PAM
99mTc-PAM在正常Wistar大鼠体内生物分布结果见图7。99mTc-PAM在Wistar大鼠中同样表现很高骨摄取,给药后3 h,骨摄取为(12.93±2.84)%。而且放射性摄取在重要脏器如心、肝脏、肺中比在昆明小鼠中清除更快(显著性差异,p<0.05)。
99mTc-PAM和99mTc-MDP在小鼠骨骼内放射性摄取率随骨与血放射性摄取比随时间变化示于图8。综合比较99mTc-PAM和99mTc-MDP在小鼠体内的生物分布,结果显示,99mTc-PAM的骨摄取比99mTc-MDP高,血与软组织清除速度更快,在肝肾等重要脏器中放射性浓集更少,脏器放射性受累低。各个时间点的骨与血、骨与肉放射性摄取比均高于99mTc-MDP,具有较明显的骨显像优势。
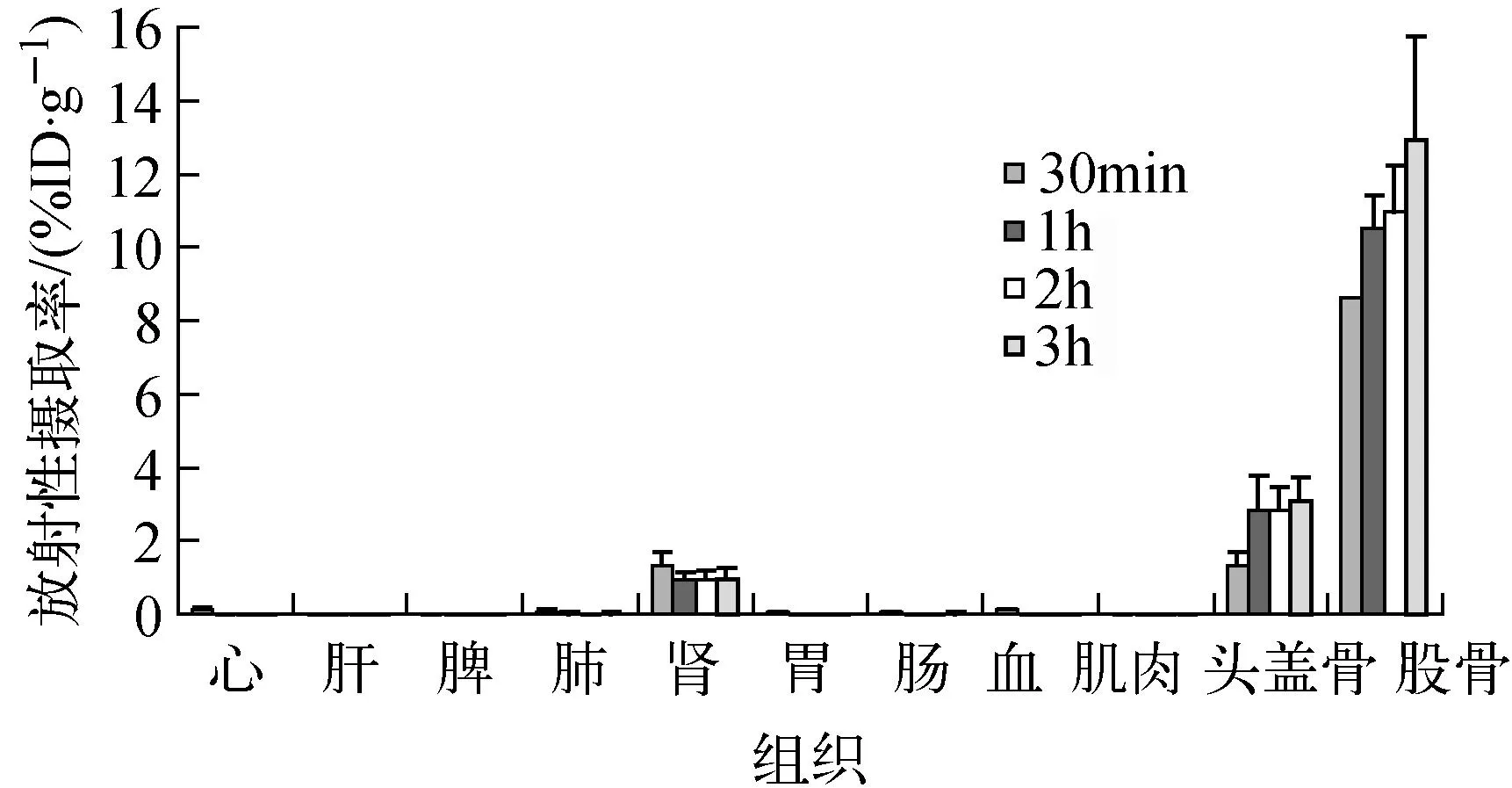
图7 99mTc-PAM在正常Wistar大鼠体内的生物分布Fig.7 Biodistribution of 99mTc-PAM
2.4.2大鼠SPECT骨显像正常大鼠在给药2 h、4 h后全身SPECT显像图示于图9。
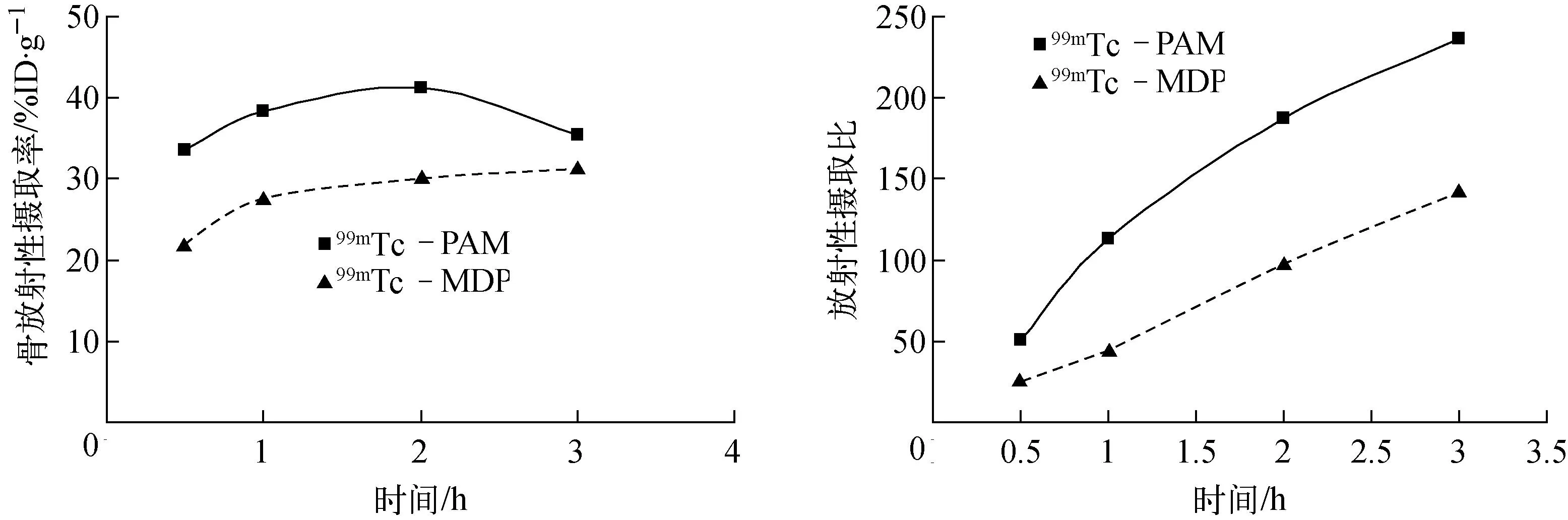
图8 99mTc-PAM和99mTc-MDP在小鼠体内骨摄取及骨与血放摄性摄取比Fig.8 Comparison of bone uptake 99mTc-PAM and 99mTc-MDP in mice
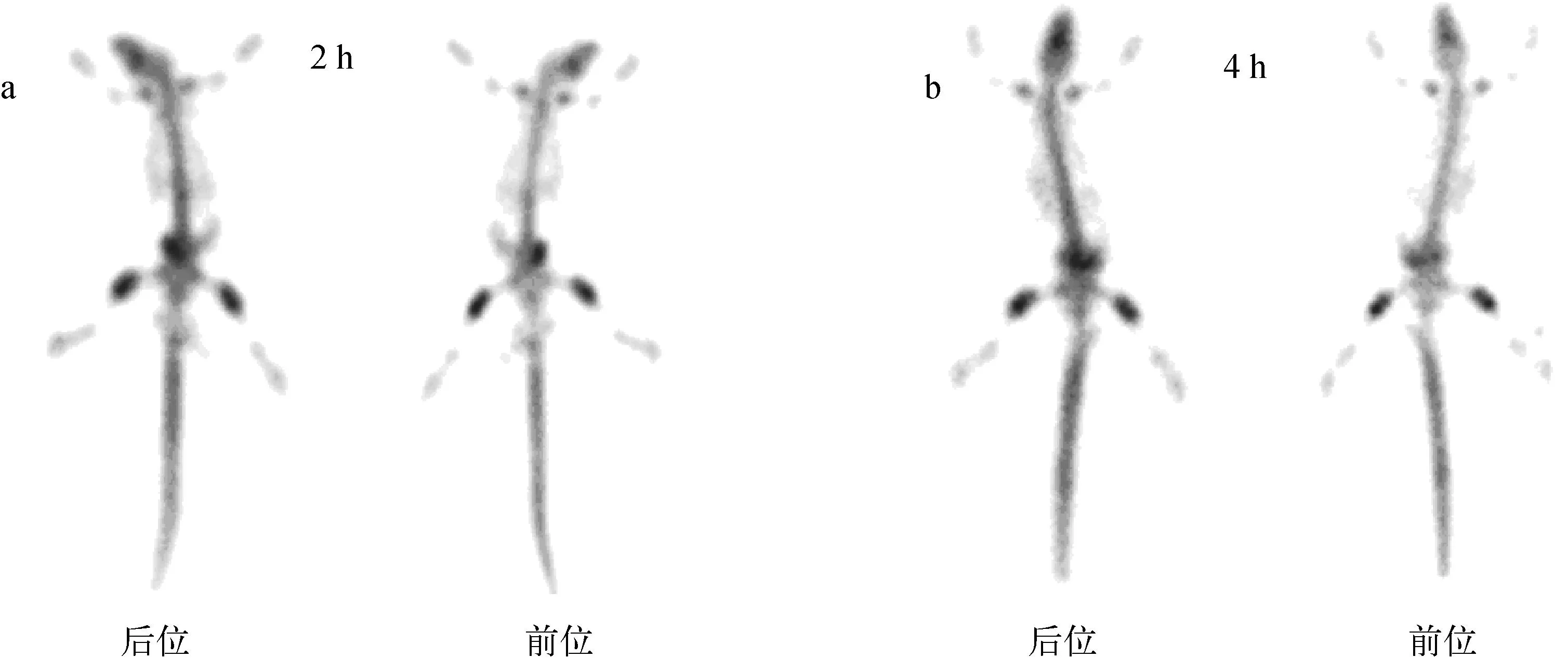
图9 99mTc-PAM在正常大鼠的全身SPECT显像图Fig.9 SPECT image of 99mTc-PAM in Wistar rats
从图9结果可见,99mTc-PAM注射2 h后骨显像图像清晰,尤其是骨关节处放射性浓集强;给药后4 h,由于99mTc-PAM在血中清除快速,其他软组织摄取低,此时大鼠骨骼显像更加清晰,图像质量好。
3小结
采用独立变量法研究了99mTc-PAM制备过程中各种影响因素对标记率的影响,优化了制备99mTc-PAM的标记条件。
正常小鼠体内生物分布结果表明,99mTc-PAM 骨摄取很高,血清除快,在肝脾等重要脏器中浓集少,在体内主要经肾代谢且代谢速度快,具备了作为理想骨显像剂的体内分布特点及药代动力学性质;与99mTc-MDP比较,99mTc-PAM的骨摄取高,血清除快,重要脏器的放射性摄取低,放射性受累小。99mTc-PAM在大鼠体内的生物分布及SPECT显像结果与在小鼠体内分布结果一致,提示其可作为性质优良的骨显像剂。
以上实验结果表明,99mTc-PAM可以作为骨显像剂用于骨骼疾病以及与骨代谢相关疾病的诊断。同时其骨分布特点提示,与99Tc-MDP类似,可以研发99Tc-PAM用于类风湿性关节炎类等自身免疫疾病的治疗,有望开发新一代放射性标记药物。
参考文献:
[1]Subramanian G, Mcafee J G, Blair R J, et al. Technetium-99m-methylene diphosphonate-a superior agent for skeletal imaging: comparison with other technetium complexes[J]. Journal of Nuclear Medicine, 1975, 16(8): 744-755.
[2]郭海波,孙达.99mTc-MDP骨显像时正常和异常的骨外放射性聚集[J]. 同位素,2011,24(4):246-251.
Guo Haibo, Sun Da. Normal and abnormal extraosseous uptake of99mTc-MDP on bone scintigraphy[J]. Journal of Isotopes, 2011, 24(4): 246-251(in Chinese).
[3]张树成,畅志华,刘巍. 帕米磷酸二钠(博宁)的特性及临床应用[J]. 河北医药,2004,26(1):75-76.
ZHang Shucheng, CHang Zhihua, LIU Wei. The characteristics and clinical application of Pamidronate Disodium (Bonin)[J]. Hebei Medical Journal, 2004, 26(1): 75-76(in Chinese).
[4]Kieczykowski G R, Jobson R B, Melillo D G, et al. Preparation of (4-amino-1-hydroxybutylidene) bisphosphonic acid sodium salt, MK-217 (alendronate sodium). An improved procedure for the preparation of 1-hydroxy-1, 1-bisphosphonic acids[J]. Journal of Organic Chemistry, 1995, 60(25): 8 310-8 312.
[5]Palma E, Correia Joa o D G, Campello M P C, et al. Bisphosphonates as radionuclide carriers for imaging or systemic therapy[J]. Molecular Biosystems, 2011, 7: 2 950-2 966.
[6]Kumar D, Kumar V, David G, et al. Evaluation of biodistribution by local versus systemic administration of99mTc-labeled pamidronate[J]. Journal of Orthpaedic Science, 2006, 11: 512-520.
[7]Kumar V, Howman G, Robert B, et al. Is99mTc-labeled pamidronate a better agent than99mTc-medronate for bone imaging?[J]. Nuclear Medicine Communications, 2007, 28(2): 101-107.
[8]杨南萍,左川,陈永涛,等.99Tc-亚甲基二膦酸盐注射液的临床新应用[J]. 中华风湿病学杂志,2003,7(12):752-754.
Yang Nanping, Zuo Chuan, CHen Yongtao, et al. Clinical application in the therapy of rheumatoid arthritis99mTc methylenediphosphona-te injection[J]. Chinese Journal Rheumatol, 2003, 7(12): 752-754(in Chinese).
[9]李心欣,李成浩.99锝-亚甲基二膦酸盐在类风湿性关节炎中的应用[J]. 实用药物与临床,2010,13(1):69-70.
Li Xinxin, Li Chenghao. Application of99Tc-MDP in the rheumatoid arthritis[J]. Practical Pharmacy And Clinical Remedies, 2010, 13(1): 69-70(in Chinese).
[10]李鹏. 帕米膦酸二钠的合成[J]. 中国医药工业杂志,2009,40(6):406-407.
Li Peng. Preparation of Pamidronate Disodium[J]. Chinese Journal of Pharmaceuticals, 2009, 40(6): 406-407(in Chinese).
Preparation and Biodistribution of99mTc-Pamidronate as Bone Imaging Agent
LUO Hong-yi1, SHEN Lang-Tao2, LIANG Ji-xin1, YANG Chun-hui2, ZHANG Wen-Hui2,QIN Shao-peng1, WEI Cheng-jun1, LIU Hai-Chun3, WANG Jian-Hua3, LI Hong-yu2
(1.DepartmentofIsotopes,ChinaInstituteofAtomicEnergy,Beijing102413,China;2.HTACO.,LTD.,Beijing102413,China;3.ChinaNuclearIndustryBeijing401Hospital,Beijing102413,China)
Abstract:Labeling of Pamidronate (PAM) with (99m)Tc was studied by a direct labeling method in the presence of SnCl2·2H2O as reducing agent. The influences of the concentration of SnCl2·2H2O, PAM concentration and pH value, reaction time on labeling yield were investigated. The optimum labeling was determined. The results showed that the radiochemistry purity of (99m)Tc-PAM was more than 95%. Biodistribution studies in normal mice and rats showed very high uptake of (99m)Tc-PAM and long retain in bone. (99m)Tc-PAM was washed out from the blood very quickly. In addition, considerable uptake in the kidneys indicated this complex was excreted mainly by renal pathway. On the other hand, the radioactivity in liver, lung and heart was negligible. It could be known from SPECT images that (99m)Tc-PAM would be an excellent bone-imaging agent. Bone uptake of (99m)Tc-PAM was higher than that of (99m)Tc-MDP in mice. This study suggested that (99m)Tc-PAM was a promising bone imaging agent and further study was worthwhile.
Key words:bone imaging agent; (99m)Tc-PAM; biodistribution; SPECT imaging; (99m)Tc-MDP
doi:10.7538/tws.2016.29.01.0006
中图分类号:R817.9
文献标志码:A
文章编号:1000-7512(2016)01-0006-06
作者简介:罗洪义(1980—),湖南长沙人,高级工程师,放射性药物专业通信作者:梁积新,研究员,E-mail: 772821209@qq.com
收稿日期:2014-10-15;修回日期:2016-01-06

