11C标记雷氯必利合成效率的影响因素
李海峰,陈志军,张晓军,李云钢,张锦明
(1.江西省肿瘤医院 核医学科,江西 南昌 330029;2.中国人民解放军总医院 核医学科,北京 100853)
11C标记雷氯必利合成效率的影响因素
李海峰1,陈志军1,张晓军2,李云钢2,张锦明2
(1.江西省肿瘤医院 核医学科,江西 南昌330029;2.中国人民解放军总医院 核医学科,北京100853)
摘要:本文以(11)C-Triflate-CH3为甲基化试剂,使用国产模块 PET-CM-3H-IT-I合成(11)C标记化合物雷氯必利((11)C-Raclopride),研究其合成过程中的碱量、溶剂、反应温度、前体量及产品淋洗条件对合成效率的影响,优化(11)C-Raclopride的合成条件。优化后的合成条件为:以0.2 mL丙酮为溶剂,前体浓度1.5~3.0 g/L,反应温度为室温(25 ℃),碱量0.30~1.25 eq,(11)C-Raclopride的合成效率(64.82±4.74)% (n=46,以(11)C-Triflate-CH3计校正效率),产品的放化纯度大于97%,比活度为(423.61±13.43) GBq/g,从收集(11)C-CO2至得到(11)C-Raclopride终产品的总合成时间为23 min,产量(6.9±0.87) GBq(n=46)。通过优化合成工艺,实现了稳定性和重复性良好的全自动化合成(11)C-Raclopride,且产品满足临床使用需要。
关键词:(11)C-雷氯必利;合成效率;PET/CT
11C-Raclopride是多巴胺D2特异PET显像剂,与D2受体亲和力高、选择性好。国内外将11C-Raclopride用于帕金森氏病(PD)的鉴别诊断[1-2],缺血缺氧脑损伤和干细胞移植的监测[3-4]以及精神分裂症病因、发病机制及疗效等方面的研究[5-6],可见11C-Raclopride已成为神经系统疾病诊断与鉴别诊断及研究的重要工具。
通常采用11CH3I或11C-CH3-Triflate与去甲基前体发生甲基化反应得到11C-Raclopride,合成效率不尽相同,活性较高的11C-Triflate-CH3可以减少前体用量,提升合成效率[7-9]。本研究拟采用国产碳-11多功能合成模块,经优化合成、纯化及淋洗等条件,实现稳定、重复性好的自动合成方法,并使产品满足PET/CT的需求。
1仪器与试剂
1.1仪器
自动化碳-11多功能合成模块PET-CM-3H-IT-I:内置半制备HPLC系统,派特(北京)科技有限公司;分析型HPLC仪:美国Waters公司;Endosafe-PTS细菌内毒素快速检测仪:美国 Charles River公司;CRC-15R活度计:美国 Capintec公司;分析天平:AB104G型号,Switzerland Mettler Toledo公司;Sep-PakC-18:美国Waters公司。
1.2试剂
去甲基Raclopride、Raclopride标准品:德国ABX公司;无水乙醇、氢氧化钠、甲酸铵、乙酸:AR级,国药集团;1 mol/L的四氢锂铝四氢呋喃溶液、57%氢碘酸:美国Sigma Aldrich公司;二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF):AR级,J&K百灵威公司;乙腈、丙酮:HPLC级,美国TEDIA公司;灭菌注射用水:石家庄四药有限公司;0.9%生理盐水:青岛华仁药业公司。
2实验方法
2.111C-CH3-Triflate的合成
参考文献[9],采用液相法合成(11)C-CH3I,并在线转化成(11)C-CH3-Triflate。用HM-20加速器经(14)N(P,α)(11)C核反应在靶内产生(11)CO2,将(11)CO2传送到自动化碳-11多功能合成模块,与0.15 mL l mo1/L的四氢锂铝四氢呋喃溶液反应, 随后加热除去THF,再加入0.3 mL 57% 的氢碘酸,生成的(11)C-CH3I再通过Triflate转化炉转换成活性更高的(11)C-CH3-Triflate,通入反应管。
2.211C-Raclopride的合成与纯化
将11C-CH3-Triflate通入含去甲基Raclopride前体的溶剂中,溶剂含适量NaOH溶液,反应结束后经半制备HPLC分离,分离柱为反相Grace C-18柱(10 mm×250 mm),流动相为V(乙腈)∶V( AcOH)∶V(0.06 mol/L甲酸铵溶液)=40∶0.5∶59.5,流速6 mL/min,收集产品峰,将产品转移到Sep-PakC-18柱上,经固相萃取得到11C-Raclopride[10]。
2.3影响11C-Raclopride合成因素
2.3.1溶剂对合成效率的影响反应保持11C-Raclopride前体量0.5 mg,3.5 μL 0.2 mol/L NaOH溶液,反应温度为室温,反应时间1 min不变,选择丙酮、乙腈、丙酮和乙腈混合溶剂(1∶1)、DMSO及DMF不同溶剂各0.2 mL作为甲基化溶剂,比较不同溶剂的合成效率。
2.3.2碱用量对合成效率的影响0.2 mL丙酮溶解0.5 mg前体,分别加入不同碱当量的NaOH,室温下反应1 min,比较反应结果,不同碱用量对合成效率的影响。
2.3.3温度对合成效率的影响使用0.5 mg11C-Raclopride,3.5 μL 0.2 mol/L NaOH溶液,反应时间1 min不变,改变不同的反应温度,比较不同温度时的合成效率。
2.3.4前体用量对合成效率的影响不同前体量(0.3~1.1 mg)溶于0.2 mL丙酮中,碱当量固定为0.7 eq,分别与在线产生的11C-CH3-Triflate在室温下反应,比较不同前体量对合成效率的影响。
2.3.5Sep-PakC-18柱洗脱方法的影响粗产品富集至Sep-PakC-18柱,用8 mL水清洗C-18柱的无机杂质,研究富集在C-18柱上产品的淋洗条件,以最大程度减少产品在C-18柱上的残留。
2.4产品的质量控制
目测产品的颜色和澄明度,精密pH试纸测定产品pH,使用Endosafe-PTS细菌内毒素快速检测仪检测终产品的热原,按中国药典2015年版的标准进行细菌内毒素检测。利用HPLC测量产品化学纯度、放化纯度和比活度;分析柱为反相Nova-ParkC-18柱(3.9 mm×150 mm),流动相为V(乙腈)∶V(AcOH)∶V(0.06 mol/L甲酸铵溶液)=40∶0.5∶59.5,流速为1 mL/min。
3结果与讨论
3.111C-Raclopride合成因素分析
3.1.1溶剂对合成效率的影响
11C-Raclopride在丙酮、乙腈、丙酮与乙腈(体积比为1∶1)、DMSO及DMF不同溶剂中的合成效率列于表1。由表1可知,在乙腈、DMSO、DMF等溶剂中的反应效率均低于丙酮溶剂,可见丙酮溶剂更适合11C-Raclopride的合成,Shao等[11]以Loop环法合成11C-Raclopride,甲基化溶剂为2-丁酮,合成效率较高但需要特殊前体。将2-丁酮作为甲基化溶剂,但收率仅为43.1%;为了减少产品中有机溶剂的残留,本研究还利用乙醇为反应溶剂,收率仅为4.5%,与Shao等[12]所描述的结果相近,低效率的方法不能满足临床使用需求。
合成反应中,11C-Raclopride前体与11C-CH3-Triflate发生的是SN2反应,受溶剂影响较大,溶剂极性越大,越有利于SN1反应,而对SN2反应不利。SN2反应过程中,由原来电荷比较集中的亲核试剂变成电荷比较分散的过渡态,溶剂极性的增加使电荷集中的亲核试剂溶剂化,降低反应效率。在这几类反应溶剂中,丙酮溶剂的极性最小,因而选用丙酮作为反应溶剂。
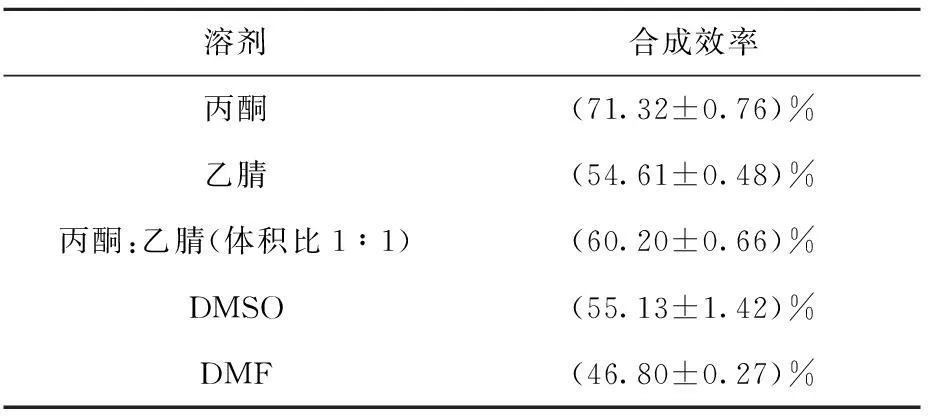
表1 溶剂对11C-Raclopride合成效率的影响(n=3)
3.1.2碱用量对合成效率的影响
11C-Raclopride在不同碱量下的合成效率见表2(n=3),半制备HPLC放射性图谱示于图1。NaOH的用量相对于前体用量小0.2 eq(eq为化学当量),合成效率约为33%,主峰为11C-CH3-Triflate(图1a);碱当量为0.33~2.0 eq时,合成收率在56%~74%,在此范围内增大NaOH碱当量,合成效率变化不大,但放射性峰1渐渐变小,而峰2的面积逐渐变大;碱当量大于2.0 eq,随碱量增加,合成效率逐渐下降;碱当量为8.3 eq,合成收率仅为31%(图1c);碱当量增至16.7 eq,所得产品收率为18%,主要为副产品,约占73%。
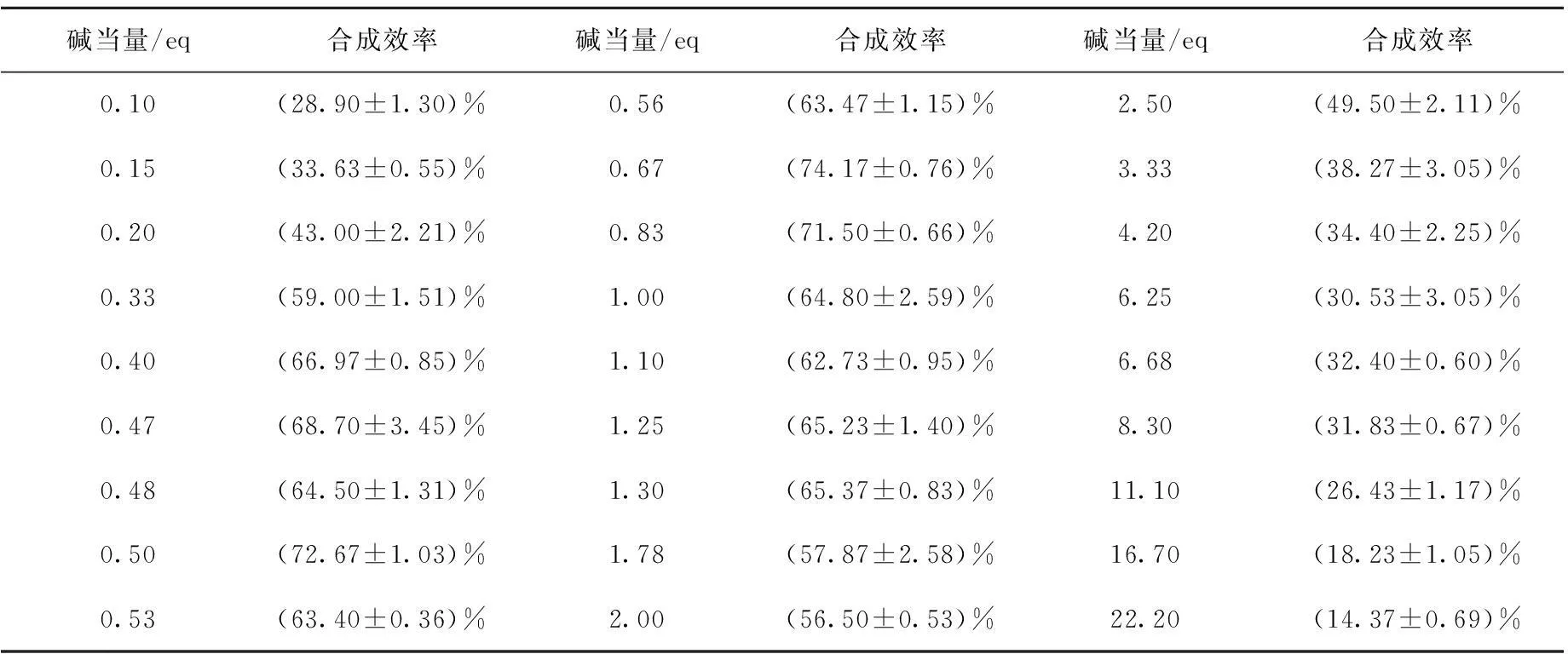
表2 碱当量对11C-Raclopride合成效率的影响(n=3)

a——0.1 eq; b——0.6 eq;c——8.3 eq图1 半制备HPLC放射性图谱a——0.1 eq;b——0.6 eq;c——8.3 eqFig.1 The radioactivity trace of 11C-Raclopride from Semi-HPLC
NaOH与11C-Raclopride前体发生反应生成中间体酚钠,再与活性较高的11C-CH3-Triflate发生SN2取代反应,而前体有三个可以发生取代的位置,苯环上两个酚羟基(-OH),支链上有一个氮氢键(-NH),前体可发生反应的位置较多,如果碱当量过大,即pH较大,则会增加副产品的生成。为了提高11C-CH3-Triflate利用率,同时控制甲基化位置,本文对NaOH的碱当量进行了研究。实验表明,碱量增加使甲基化更容易发生,碱量在0.33~2.0 eq,合成效率比较稳定,而碱量大于2.0 eq时,副反应比例也逐渐增加。
3.1.3温度对合成效率的影响
将0.5 mg 前体溶于0.2 mL丙酮溶液中,加入3 μL NaOH溶液(0.2 mol/L),分别在0 ℃、室温(25 ℃)、50 ℃和80 ℃下与11C-CH3-Triflate反应。反应完毕,加入4 mL流动相终止反应,用半制备型HPLC分离,结果示于图2。

a——0 ℃;b——25 ℃;c——50 ℃;d——80 ℃图2 温度对合成效率的影响 a——0 ℃;b——25 ℃;c——50 ℃;d——80 ℃Fig.2 Effect of temperature on the synthesis efficiency
图2中tR=7~9.2 min为产品,tR=2~3.4 min为未反应的Triflate,不同温度下最终反应收率分别为:(36.12±1.53)%,(68.65±2.14)%,(67.61±0.78)%,(58.62±0.83)%(n=3,EOB)。0 ℃与室温下的合成效率差别较大,50 ℃合成效率与室温合成效率差别不大;而温度为80 ℃的合成效率有所下降,这可能是丙酮溶剂在较高温度时挥发较多甚至蒸干,影响合成效率。合成过程中尽量避免过温现象,为保证足够的体积一般是室温条件下将前体溶于0.2 mL丙酮。
3.1.4前体用量对合成效率的影响
将0.2~1.1 mg11C-Raclopride前体药分别溶于0.2 mL丙酮中,碱量为0.7 eq,分别与11C-CH3-Triflate反应,不同前体量下的合成效率见图3。由图3可知,前体量为0.3~1.1 mg时合成效率均超过57%,降低前体量到0.2 mg时合成效率低于50%,1 mg11C-Raclopride前体量生产的产品,合成效率约62.6%。如果前体量较大(≥1 mg),产品的合成效率并没有太大的提高,并造成半制备HPLC分离效率降低,得到的产品化学纯度较低,浪费前体。

图3 前体用量对合成效率的影响Fig.3 Effect of the precursor on the synthesis efficiency
前体量为1 mg的产品HPLC图谱示于图4。由图4可知,高效液相色谱检测产品化学纯度约84.2%(tR=6.0 min为产品峰)。本研究的反应为SN2反应,其合成效率与前体浓度呈正相关,提高前体浓度可提升合成效率;但前体量过大时产物难以分离。为了保证合成效率,控制产品中前体含量,同时降低合成成本,故认为使用0.3~0.6 mg的11C-Raclopride前体为宜。

图4 前体量1 mg的产品HPLC图谱Fig.4 HPLC of the precursor (1 mg)
3.1.5Sep-PakC-18柱洗脱方法的影响
将含有HPLC流动相的粗产品经50 mL水稀释后转移到Sep-PakC-18柱上,用8 mL水清洗Sep-PakC-18柱,再用1.2 mL乙醇将产品从C-18柱上洗脱,加注射用水稀释,过无菌滤膜。发现C-18柱上残留约40%的产品不易洗脱,对C-18柱进行正常处理,同一批次的C-18柱对11C-PIB、11C-MET等的吸附及洗脱均正常可见,C-18柱对产品11C-Raclopride的吸附性太强,以致难以完全洗脱。利用乙醇、丙酮、乙腈、2-丁酮、DMSO和DMF等溶剂淋洗C-18柱上残留的产品,均只能洗脱极少量的产品(仅作为实验,不用于临床研究)。而在乙醇淋洗产品前,先以10 mL生理盐水处理C-18柱,能有效减少产品在C-18柱上的残留,其残留量降低至5%~10%。
对于此现象推测原因如下:Sep-PakC-18柱是以硅胶基质为主要吸附剂进行固相吸附和富集产品。硅胶表面主要是以硅氧烷键(-Si-O-Si-)形式存在,硅氧烷键在吸附、富集产品时起到了关键作用;同时硅胶表面还存在着少量未完全反应的硅醇键(-Si-OH),-Si-OH具有较强的反应活性,可以将产品非特异性吸附,吸附后难以淋洗,预先以离子类的缓冲液对C-18进行润湿处理,可以避免此类现象;已经与-Si-OH键吸附的产品可以使用离子性更强的溶剂脱附;考虑到合成的产品用于临床研究,生理盐水则是较为合适的选择。
3.2自动化合成及质量控制
优化的11C-Raclopride自动化合成条件如下:在自动合成器的反应瓶中将含有0.3 mg的11C-Raclopride前体溶于0.2 mL丙酮中,加入3.5 μL 0.2 mol/L NaOH,通入在线转化的11C-CH3-Triflate,待放射性不再提高停止通气,室温静置反应1 min。用4 mL流动相将反应液带入半制备HPLC进行分离,其流动相为V(乙腈)∶V( AcOH)∶V(0.06 mol/L甲酸铵溶液)=40∶0.5∶59.5,流速6 mL/min,收集6.8~9.0 min的产品。将经稀释后的溶液转移到Sep-PakC-18柱上,用10 mL生理盐水处理Sep-PakC-18柱,最后用1.2 mL乙醇将产品从C-18柱上洗脱,并加生理盐水稀释,过无菌滤膜。最终产品的化学纯度均大于95%,放化纯度大于97%。11C-CO2传至Loop环后,开启合成器的自动程序,从11C-CO2到11C-CH3-Triflate、甲基化反应、纯化至最后得到产品,总计用时23 min。最终产品的质量控制结果均符合静脉注射要求,其结果列于表3。

表3 11C-Raclopride的质控结果(n=5)
4小结
本研究优化了11C-Raclopride的合成条件,通过对不同的反应溶剂进行比较,选用极性较小的丙酮溶液为反应溶剂。研究碱量的使用范围,碱当量在0.33~1.25 eq时合成效率比较稳定,可控制在59%~74%,同时减少了副产物的生成。讨论不同的反应温度对合成效率的影响,室温与50 ℃反应的合成收率差别不大,本实验采用室温作为反应温度。确定较为合适的前体用量为0.3~0.6 mg,降低了合成成本,并保证了产品的化学纯度。改善文献[9] C-18柱产品残留的问题,并提出可能的作用机制,使合成效率稳定提高至(64.82±4.74)% (n=46,11C-CH3-Triflate校正效率)。通过优化合成的11C-Raclopride质量控制结果均符合静脉注射药物的要求。
[1]Politis M, Piccini P, Pavese N, et al. Evidence of dopamine dysfunction in the Hypothalamus of patients with Parkinson’s disease: an invivo11C-raclopride PET study[J]. Exp Neurol, 2008, 214(1): 112-116.
[2]Kim J Y, CHung E J, Lee W Y, et al. Therapeutic effect of repetitive transcranial magnetic stimulationin Parkinson’s disease: analysis of11C-raclopride PET study[J]. Mov Disord, 2008, 23(2): 207-211.
[3]王瑞民,郭喆,张锦明,等. 帕金森病大鼠模型细胞移植的PET在体显像研究[J]. 中华核医学杂志,2008, 28(2):113-116.
Wang Ruimin, Guo Zhe, Zhang Jinming, et al. In vivo imaging of implanted cells in a Parkinson’s disease rat model[J]. Chin J Nucl Med, 2008, 28(2): 113-116(in Chinese).
[4]李红,王晓明,曹礼,等.11C-雷氯必利的自动化制备及其在新生猪脑PET/CT显像的应用[J]. 医学影像学杂志,2012,22(5):816-819.
Li Hong, Wang Xiaoming, Cao Li, et al. Automatic perparation of11C-raclopride and its application in PET/CT brian imaging of newborn pigets[J]. J Med Imaging, 2012, 22(5): 816-819(in Chinese).
[5]Pruessner J C, Frances C, Meaney M J, et al. Dopamine release in response to a psychological stress in humans and its relationship to early life matemal care: a positron emission tomography study using11C-raclopride[J]. J Neurosci, 2004, 24(11): 2 825-2 831.
[6]Houston G C, Hume S P, Hirani E, et al. Temporal characterisation of amphetamine induced dopamine release assesssd with11C-raclopride in anaesthetised rodents[J]. Synapse, 2004, 51(3): 206-212.
[7]张锦明,田嘉禾,姚树林,等.11C-Raclopride的快速制备及生物学分布[J]. 中华核医学杂志,2008,28(4):227-230.
Zhang Jinming, Tian Jiahe, Yao Shulin, et al. Fast synthesis of11C-Raclopride and its initial PET study on animal modle[J]. Chin J Nucl Med, 2008, 28(4): 227-230(in Chinese).
[8]Van L N, Kersemans K, De M D, et al. Improved HPLC purification strategy for11C-raclopride and11C-DASB leading to high radiochemical yields and more practical high quality radiopharmaceutical formulations[J]. Appl Radiat Isot, 2013, 78: 62-67.
[9]张锦明,田嘉禾,王武尚,等. 在线制备11C-Triflate-CH3I[J]. 同位素,2006,(02):124-128.
Zhang Jinming, Tian Jiahe, Wang Wushang, et al. Preparation of11C-Triflate-CH3I on-line[J]. Journal of Isotopes, 2006, (02): 124-128(in Chinese).
[10]张锦明,张晓军,李云钢,等. 自动化合成11C-Raclopride及质量控制[J]. 同位素,2014,27(4):231-235.
Zhang Jinming, Zhang Xiaojun, Li Yungang, et al. Automatic synthesis and quality control of11C-Raclopride for clinical use[J]. Journal of Isotopes, 2014, 27(4): 231-235(in Chinese).
[11]Shao X, Kilbourn M R. A simple modification of GE tracerlab FX C Pro for rapid sequential preparation of11C-carfentanil and11C-raclopride[J]. Appl Radiat Isot, 2009, 67(4): 602-605.
[12]Shao X, Schnau PL, Fawaz MV, et al. Enhanced radiosynthesis of11C-raclopride and11C-DASB using ethanolic loop chemistry[J]. Nucl Med Biol, 2013, 40: 109-116.
Optimization for the Synthesis Efficiency of the11C-Raclopride
LI Hai-feng1, CHEN Zhi-jun1, ZHANG Xiao-jun2, LI Yun-gang2, ZHANG Jin-ming2
(1.DepartmentofNuclearMedicine,JiangXiCancerHospital,nanchang330029,China;2.DepartmentofNuclearMedicine,ThePLAGeneralHospital,Beijing100853,China)
Abstract:The synthesis conditions of the (11)C-Raclopride with domestic PET-CM-3H-IT-I synthesis module and (11)C-Triflate-CH3I as methylation agent were studied, which included the alkali equivalent, solvents, temperature, the amount of precursor and elution conditions for the product. The optimum condition was 1.5-3.0 g/L of precursor in acetone (0.2 mL), alkali equivalent (0.30-1.25 eq) and at room temperature (25 ℃) for synthesis of (11)C-Raclopride. It could be got with radiochemical yield of (64.82±4.74)% (n=46, EOB of (11)C-Triflate-CH3). The radiochemical purity was over 97% and the specific activity was at (423.61±13.43) GBq/g. It took 23 minutes from (11)C-CO2to (11)C-Raclopride, and the production radioactivity was (6.9±0.87) GBq (n=46). The synthetic process was reliable and reproducible, and the product synthesized by this process was suitable for clinical use.
Key words:(11)C-Raclopride; synthesis efficiency; PET/CT
doi:10.7538/tws.2016.29.01.0012
中图分类号:TL92+3
文献标志码:A
文章编号:1000-7512(2016)01-0012-07
作者简介:李海峰(1981—),男,南昌人,主要从事放射性药物的合成与标记通信作者:张锦明(1965—),博士,E-mail: zhangjm301@163.com
基金项目:军队医疗机构制剂标准提高项目(14ZJZ2101)
收稿日期:2015-10-21;修回日期:2015-12-03

