硅胶表面罗红霉素分子印迹聚合物的制备及选择性吸附性能
唐志民,马新宾(天津大学化工学院,天津 300072)
硅胶表面罗红霉素分子印迹聚合物的制备及选择性吸附性能
唐志民,马新宾
(天津大学化工学院,天津 300072)
摘要:以γ-氨丙基三甲氧基硅烷(AMPS)为硅胶表面改性剂,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,罗红霉素(ROX)为模板分子,制备得到罗红霉素分子印迹硅胶材料(ROX-MIP-PMAA/SiO2),采用红外、扫描电镜和粒径测定等方法对其进行了表征。通过静态和动态吸附实验研究了ROX-MIP-PMAA/SiO2对罗红霉素的吸附性能,并以红霉素为竞争底物,研究其选择吸附性能。结果显示,ROX-MIP-PMAA/SiO2对罗红霉素的吸附能力明显大于非印迹硅胶(NIP-PMAA/SiO2),其对罗红霉素和红霉素的分离因子为1.21,说明其对罗红霉素具有较好的选择吸附性能。
关键词:二氧化硅;表面;罗红霉素;表面分子印迹;吸附
第一作者:唐志民(1970—),男,博士研究生,研究方向为功能高分子材料。E-mail zhimin.tang@hotmail.com。联系人:马新宾,教授,博士生导师,研究方向为绿色化学和一碳化工。E-mail xbma@tju. edu.cn。
罗红霉素(roxithromycin,ROX)属于第二代大环内酯类抗生素,是将红霉素分子中C9位的羰基转化为甲氧基乙氧基甲肟基得到的红霉素衍生物。罗红霉素的抗菌谱和抗菌作用与红霉素相似,但其体内抗菌作用是红霉素的1~4倍,具有重要的临床意义[1]。罗红霉素在畜牧业得到广泛应用,但是如果作为兽用药或者饲料的添加剂长期使用,会在家畜体内累积,最终危害人们的身体健康。目前,动物源性食品中抗生素(如红霉素)残留量的检测方法主要有高效液相色谱和液相色谱-质谱联用技术,检测前需要对样品进行必要的处理,而使用的固相萃取材料没有特异选择性,对于残留物质的富集倍数不高[2-4]。
分子印迹聚合物(MIP)是一种对模板分子具有特异识别选择性的高分子材料,已经在色谱分离、固相萃取、手性分离、传感器以及膜分离等领域得到应用[5-8]。将MIP应用于固相萃取领域用于罗红霉素的分离富集,有助于克服目前固相萃取材料对ROX没有选择性、富集倍数不高的缺陷。
目前有关ROX-MIP的研究报道不多[9]。本文以硅胶为载体,罗红霉素作为分子模板,甲基丙烯酸作为功能单体,乙二醇二甲基丙烯酸脂作为交联剂,通过接枝聚合,制备了硅胶表面分子印迹聚合物,考察了其对罗红霉素的选择性吸附性能,为其作为固相萃取材料应用于罗红霉素的检测提供实验依据。
1 材料与方法
1.1实验材料与仪器
罗红霉素,93%,利君集团镇江制药有限公司;红霉素,99%,浙江国邦药业有限公司;硅胶,200~300目,青岛世纪海洋干燥剂有限公司;γ-氨丙基三甲氧基硅烷,AMPS,南京创世化工助剂有限公司;甲基丙烯酸,MAA,上海和发实业有限公司;乙二醇二甲基丙烯酸酯,EDMA,天津科密欧化学试剂开发中心;对二甲胺基苯甲醛,Sigma公司;过硫酸铵、硝酸、乙酸、盐酸、甲醇等均为分析纯试剂。
傅里叶红外光谱仪,IR Prestige-21,日本岛津公司;激光粒度分析仪,Mastersizer2000,英国马尔文公司;环境扫描电子显微镜(ESEM),Quanta200E,荷兰FEI公司;紫外可见分光光度计,T6-1650E,北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1硅胶的活化
将硅胶(SiO2)加入50%的硝酸溶液中,室温下充分搅拌后静置24h,过滤,用蒸馏水洗涤至中性,真空干燥得活化硅胶。
1.2.2硅胶的表面改性
将0.3g SiO2和5mL AMPS加入50mL无水甲苯中,在氮气保护下加热回流反应24h,无水甲苯洗涤,真空干燥得氨基修饰的SiO2(AMPS-SiO2)。
1.2.3甲基丙烯酸在硅胶表面的接枝聚合
将1.5g AMPS-SiO2和5mL单体MAA加入100mL水中,通氮气30min。然后加入0.055g过硫酸铵,在40℃、N2保护下反应10h。聚合结束后,抽滤,用索式提取器以乙醇抽提PMAA/SiO224h,真空干燥。
1.2.4罗红霉素表面分子印迹硅胶材料(ROX-MIP-PMAA/SiO2)的制备
称取1.0g PMAA/SiO2,加入100ML 1.0g/L的ROX-甲醇溶液中,常温震荡4h,然后过滤,真空干燥。将1.0g饱和吸附罗红霉素的接枝硅胶,加入50mL ROX-乙醇/水混合溶液(1∶1,ROX浓度为1.0g/L)中,将pH值调节为9,然后于45℃下加入0.2mL EDMA搅拌反应8h。抽滤,用甲醇/冰乙酸溶液(9∶1)、蒸馏水反复洗涤固体微粒,直至中性为止,以除去罗红霉素,真空干燥。
在不加模板分子的情况下,采用上述相同的步骤制备空白表面分子印迹硅胶(NIP-PMAA/SiO2)。
1.2.5表征
采用溴化钾压片法,采用IR Prestige-21傅里叶红外光谱仪对硅胶AMPS-SiO2和PMAA/SiO2进行红外色谱分析。将硅胶、AMPS-SiO2和ROXMIP-PMAA/SiO2进行表面喷金后,采用Quanta200E环境扫描电子显微镜观察形貌。采用Mastersizer2000激光粒度分析仪进行粒径和分布测定。
1.2.6建立标准曲线
在冰乙酸中,罗红霉素可被浓盐酸降解,降解后的产物可以与对二甲胺基苯甲醛反应生成有色物质,在486nm波长处有最大紫外吸收,利用这一特性可以使用紫外分光光度法对罗红霉素进行测定。
准确量取罗红霉素标准溶液(0.8mg/mL)0.5mL、1.0mL、1.5mL、2.0mL、2.5mL、3.0 mL,分别加入50mL量瓶中。在每一个容量瓶中加冰乙酸20mL、0.5%(质量分数)对二甲胺基苯甲醛的冰乙酸溶液5.0mL,再用盐酸-冰乙酸溶液(体积比2∶1)稀释至刻度,然后于25~35℃放置15 min,使其充分反应。在486nm波长处,分别测定上述溶液的紫外吸光度,以浓度对吸光度制作标准曲线并进行线性回归。
1.2.7ROX-MIP-PMAA/SiO2的静态吸附性能
准确量取ROX-MIP-PMAA/SiO2各14份,分别放置在5mL的离心管中,编号1~14,在1号中加入3mL甲醇作为对照组,另外2~14号中分别加入0.2g/L、0.4g/L、0.6g/L、0.8g/L、1.0g/L、1.2g/L、1.5g/L、2.0g/L、2.5g/L、3.0g/L、4.0g/L、6.0g/L和8.0g/L的罗红霉素溶液各3mL。将1~16号样品放入振荡器中震荡24h,离心后取上清液测定罗红霉素的浓度。采用相同方法测定NIP-PMAA/SiO2的吸附性能。
1.2.8 ROX-MIP-PMAA/SiO2的动态吸附性能
准确称取10mg MIP-PMAA/SiO2各9份,分别加入5mL小试管中,然后在每一个小试管内加入相同浓度的罗红霉素溶液3mL,在振荡器中充分混合均匀。分别于10min、30min、60min、90min、120min、150min、180min、210min、240min、270min和300 min收取上清液,测定罗红霉素的浓度。
1.2.9选择性吸附实验
为了表征ROX-MIP-PMAA/SiO2的选择吸附性能,选择与罗红霉素结构类似的红霉素作为竞争底物进行选择性吸附实验。分别量取1mmol/L的罗红霉素和红霉素各3mL,分别加入10mg ROX-MIP-PMAA/SiO2和NIP-PMAA/SiO2,振荡器震荡24h,收取上清液,测定罗红霉素和红霉素的浓度。通过静态分配系数KD以及分离因子α来表示其选择性吸附性能。静态分配系数KD和分离因子α的表示式分别为式(1)、式(2)。

式中,Cp是溶质在分子印迹聚合物上的浓度,µmol/g;Cs是溶质在溶液中的浓度,µmol/mL;KD'是模板分子的静态分配系数;KD″ 是竞争底物的静态分配系数。一般情况下,分离因子α越大,表示对模板分子的选择性越高。
2 结果与讨论
2.1红外光谱分析
在图1的SiO2红外光谱图中,1100cm−1是Si—O—Si 和Si—O—H的伸缩振动峰,966cm−1和803cm−1是Si—O—H的伸缩振动峰,3445cm−1和1637cm−1是—OH的伸缩振动峰。在AMPS-SiO2的红外光谱图中,3445cm−1的—OH伸缩振动峰明显变小,966cm−1的Si—O—H的伸缩振动峰基本消失,新出现了3750cm−1、1583cm−1和1482cm−1的—NH伸缩振动峰,以及2940cm−1的—CH伸缩振动峰,说明硅胶表面大部分羟基已经反应,AMPS已经接枝到SiO2表面。在PMAA/SiO2的红外光谱图中,新出现了700cm−1的游离—COOH的特征吸收峰,且3445cm−1的—OH特征峰明显增强,说明PMAA已成功接枝到改性SiO2上。

图1 SiO2、AMPS-SiO2和PMAA/SiO2的红外光谱图

图2 硅胶、AMPS-SiO2和ROX-MIP-PMAA/SiO2的ESEM照片
2.2扫描电镜和粒径分析
图2分别是硅胶、AMPS-Si O2和ROX-MIP-PMAA/SiO2的扫描电镜照片。由ESEM照片可知,活化硅胶颗粒表面比较光滑、干净,而接枝AMPS和MIP后,硅胶表面明显有附着物,表面变得粗糙,这是因为AMPS和MIP聚合物接枝在硅胶表面造成的。
如图3所示,经用粒度测定仪测定,未经修饰的硅胶颗粒平均粒径(d5 0)为56.4µm,ROX-MIP-PMAA/SiO2的平均粒径(d50)为66.9µm。在表面接枝和聚合之后,硅胶颗粒表面形成了聚合物的薄膜层,而且表面聚合物层也会造成颗粒粘连,从而使得粒径增大。
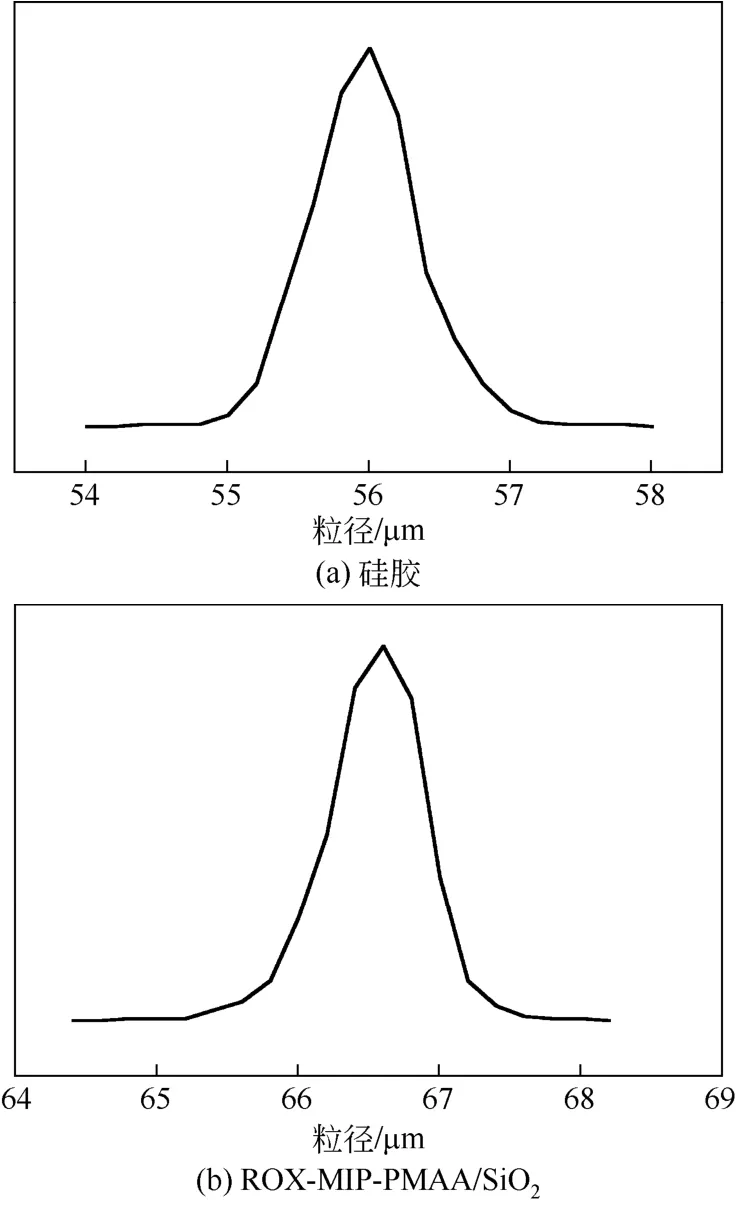
图3 硅胶和ROX-MIP-PMAA/SiO2的粒径分布
2.3标准曲线
按照1.2.6节的方法,绘制罗红霉素标准曲线如图4以吸光度对浓度进行线性回归,得回归方程为y = 0.0210x –0.03598,R2= 0.9996(n=5)。
2.4ROX-MIP-PMAA/SiO2的静态吸附性能
从图5中的吸附等温曲线可以看出,随着罗红霉素溶液浓度的增加,ROX-MIP-PMAA/SiO2和NIP-PMAA/SiO2对罗红霉素的吸附量呈现快速增大趋势,随后逐渐达到平衡。由图5可知,ROX-MIP-PMAA/SiO2和NIP-PMAA/SiO2对罗红霉素的吸附平衡浓度分别为1.9g/L和1.3g/L,饱和吸附量分别为106mg/g和71mg/g,ROX-MIP-PMAA/SiO2的饱和吸附量明显大于NIP-PMAA/SiO2。在ROX-MIP-PMAA/SiO2和 NIP-PMAA/SiO2的制备中都加入功能单体甲基丙烯酸以及交联剂乙二醇二甲基丙烯酸酯等物质,均含有羟基、羧基等功能基团,对模板分子具有一定的物理作用,可形成非印迹的结合作用位点,因此NIP-PMAA/SiO2对罗红霉素也具有一定的非印迹物理吸附作用,但是这种吸附作用是非特异性的。对于ROX-MIP-PMAA/SiO2,除了存在非特异性的物理吸附,还存在因模板分子洗脱后留下的印迹空穴产生的特异性吸附,因此其对罗红霉素的吸附量明显增大,明显大于NIP-PMAA/SiO2。
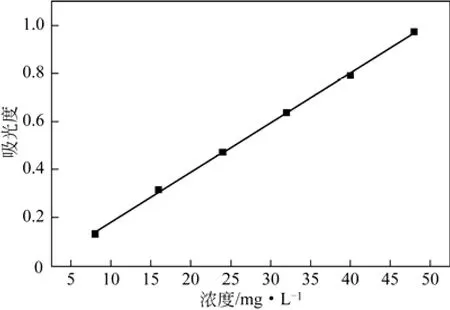
图4 罗红霉素标准曲线

图5 ROX-MIP-PMAA/SiO2(A)和NIP-PMAA/SiO2(B)的吸附等温线
2.5ROX-MIP-PMAA/SiO2的动态吸附性能
从图6可知,在前60min,ROX-MIP-PMAA/SiO2的吸附量增加较快,60min后吸附量增加速度减缓,直至达到吸附平衡。一般认为,在印迹聚合物对模板分子的吸附过程中,存在非特异性物理吸附和特异性吸附。在吸附初期,印迹聚合物对模板分子的吸附以非特异性物理吸附为主,吸附速度较快。当非特异性吸附部位逐渐被占据后,则以特异性吸附为主,此时罗红霉素分子需要克服一定的空间位阻效应向深孔的特异性吸附部位扩散传质,所以传质速度较慢,吸附速度较小,因此吸附量增加减慢,最后缓慢平衡。ROX-MIP-PMAA/SiO2对罗红霉素分子的吸附在200min左右达到饱和。

图6 ROX-MIP-PMAA/SiO2的动态吸附曲线
2.6选择性吸附性能
由表1可知,ROX-MIP-PMAA/SiO2对罗红霉素的分配系数明显大于红霉素,其分离因子为1.21,这说明其对罗红霉素具有较好的选择吸附性能。ROX-MIP-PMAA/SiO2对竞争底物的分配系数也大于NIP-PMAA/SiO2。而NIP-PMAA/SiO2对罗红霉素和红霉素的分配系数基本相同,分离因子仅为1.01,基本没有选择吸附性能。ROX-MIP-PMAA/SiO2对模板分子不仅存在非特异性物理吸附,还存在印迹空穴产生的特异性吸附,因此其对模板分子具有选择性,具有一定的分子识别性能。而NIP-PMAA/SiO2对两种底物仅具有物理吸附作用,没有选择性。
3 结论
(1)以AMPS为硅胶表面改性剂,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,采用表面接枝聚合法制备得到罗红霉素分子印迹硅胶材料,利用红外、扫描电镜和粒径测定等方法初步表征了其结构。
(2)静态和动态吸附实验研究表明,ROXMIP-PMAA/SiO2对罗红霉素的吸附性能明显大于NIP-PMAA/SiO2。
(3)选择性吸附实验结果表明,ROX-MIPPMAA/SiO2对罗红霉素和红霉素的分离因子为1.21,说明其对罗红霉素具有较好的选择吸附性能,而NIP-PMAA/SiO2对罗红霉素和红霉素基本没有选择性。

表1 MIP和NIP对罗红霉素和红霉素的选择吸附性能
参考文献
[1]RONALD A Y,JOHN P G,EUGENE M S. Roxitliromycin,a review of antibacterial activity. pharmacokinetics properties and clinical efficacy[J]. Drugs,1989,37(1):2-4.
[2]汪泓,张全英,施爱民. HPLC法测定人血浆中罗红霉素的含量[J].抗感染药学,2005,2(1):25-26.
[3]CANNAVAN A,ARMATRONG H S,BLANCHFLOWER W J,et al. Gas chromatographic-mass spectrometric determination of sulfamethazine in animal tissues using a methyl/trimethylsilyl derivative[J]. Analyst,1996,121:1457-1461.
[4]HILTON M,THOMAS K V. Determination of selected human pharmaceutical compound in effluent and surface water sample by high-performance liquid chromatography-electrospray tandem mass spectrometry[J]. J. Chromatogr. A,2003,1015(1/2):129-141.
[5]CHAPUIS F,MULLOT J U,PICHON V,et al. Molecularly imprinted polymers for the clean-up of a basic drug from environmental and biological samples[J]. J. Chromatogr. A,2006,1135(2):127-134.
[6]ARIMM M,MILLER E I,COMRMAEK P. Molecularly imprinted solid-phase extraction of iazepam and its metabolites from samples[J]. Anal. Chem.,2007,79(1):256-262.
[7]WULFF G. Enzyme-like catalysis by molecularly imprinted polymers[J]. Chem. Rev.,2002,102(1):1-28.
[8]HAUPT K,MOSBACH K. Molecularly imprinted polymers andtheir use in biomimetic sensor[J]. Chem. Rev.,2000,100(7):2495-2504.
[9]贾宝秀,孙晓业,李玉琴,等. 罗红霉素分子印迹聚合物的合成及其特性研究[J]. 中国现代应用药学,2010,27(5):441-444.
综述与专论
Preparation of roxithromycin molecularly imprinted layer-coated silica and its selective adsorption properties
TANG Zhimin,MA Xinbin
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
Abstract:Roxithromycin molecularly imprinted silica was prepared by using AMPS as the silica surface modifier,methacrylic acid as the functional monomer,ethylene glycol dimethacrylate as the crosslinker,and roxithromycin as the template molecule. Its structure was characterized by infrared spectroscopy,scanning electron microscope and particle size analysis. The adsorption properties of ROX-MIP-PMAA/SiO2on roxithromycin were studied by static binding test and dynamic binding test,and its selective adsorption properties was investigated by selective binding test with erythromycin as the competing substrate. Results showed that the roxithromycin adsorption capacity of ROX-MIP-PMAA/SiO2was better than that of NIP-PMAA/SiO2. The separation factor of roxithromycin and erythromycin for ROX-MIP-PMAA/SiO2was 1.21,showing that ROX-MIPPMAA/SiO2displayed high recognition ability to the template molecule.
Key words:silicone; surface; roxithromycin; molecularly imprinted; adsorption
中图分类号:R 927.2
文献标志码:A
文章编号:1000–6613(2016)04–1162–05
DOI:10.16085/j.issn.1000-6613.2016.04.031
收稿日期:2015-12-11;修改稿日期:2016-01-13。

