碳酸乙烯酯与甲醇酯交换工艺及产物分布研究
刘孟,刘绍英,王公应
(1.中国科学院成都有机化学研究所,四川成都610041;2.中国科学院大学,北京10049)
碳酸乙烯酯与甲醇酯交换工艺及产物分布研究
刘孟1,2,刘绍英1*,王公应1
(1.中国科学院成都有机化学研究所,四川成都610041;2.中国科学院大学,北京10049)
分别采用GC-MS和气相色谱内标法对以甲醇钠为催化剂的碳酸乙烯酯与甲醇酯交换反应产物进行定性和定量分析,研究了物料比、催化剂用量、温度、时间等工艺条件与反应产物分布的关系及发生副反应的原因,推测了可能的反应历程。研究表明:物料的物质的量比和催化剂用量是影响酯交换反应产物分布的主要因素。通过工艺参数的调整,可减少或控制副反应发生。
碳酸乙烯酯;甲醇;酯交换;碳酸二甲酯;乙二醇
碳酸二甲酯(DMC)是备受关注的绿色化学品,用途广泛[1]。DMC传统的光气法生产工艺已基本被淘汰,代之以多种非光气法技术,包括甲醇氧化羰基化法、酯交换法、尿素醇解法和CO2直接合成法等,其中甲醇氧化羰基化法、酯交换法和尿素醇解法已实现工业化生产[1-5]。酯交换法制备DMC工艺路线成熟、投资小,被我国大多数生产企业采用,该工艺联产的1,2-丙二醇受产品质量和市场影响很大[6]。碳酸乙烯酯(EC)与甲醇酯交换工艺联产乙二醇(EG),相比传统的环氧乙烷直接水合法EG工艺,酯交换法利用了CO2[7-9],EG选择性高,工艺清洁,是替代传统工艺极具发展潜力的新工艺[10-11]。我国EG需求量大,2014年消费量达14425kt,自给率仅为33.7%[12]。聚酯级乙二醇纯度要求非常高,反应中带入的杂质会影响产品质量。Bayer公司专利[13]报道,以碱金属化合物为催化剂时,适当减少催化剂用量,降低反应温度可以减少副产物聚乙二醇的产生。Abimanyu等[14]以MgO-CeO2为催化剂,研究了催化剂碱性对EC与甲醇酯交换反应的影响,发现反应与催化剂的碱强度及其分布有关,催化剂表面强碱性位的增加将增大副产物的总量。目前对EC酯交换反应的研究主要集中在新型催化剂的开发,对反应过程中副产物产生原因及如何减少副反应发生的研究较少。
本文以甲醇钠为催化剂,系统研究了物料比、催化剂用量、温度、时间等工艺条件对碳酸乙烯酯与甲醇酯交换反应产物分布的影响,推测了反应历程,分析了反应过程中副产物产生的原因,为碳酸乙烯酯与甲醇酯交换工艺控制副反应发生、提高产物选择性提供了参考依据。
1 实验部分
1.1 试剂
碳酸乙烯酯、碳酸二甲酯、乙二醇,≥99.5%,百灵威科技有限公司;甲醇,≥99.5%,广东光华科技股份有限公司;甲醇钠(≥98.5%)、二甘醇(≥99%),成都市科龙化工试剂厂;乙二醇单甲醚,AR,天津天泰精细化学品有限公司;三甘醇,≥99.5%,天津市光复精细化工研究所。
1.2 工艺条件研究
将碳酸乙烯酯和甲醇按设计的物质的量比加入烧瓶中,开启搅拌,加热至实验预定温度后将计量的催化剂CH3ONa加入反应器,并开始计时,反应一定时间后取样分析。
1.3 分析方法
定性分析采用GC-MS联机技术,HP6890/5973气相色谱-质谱仪,Wax 50m×0.25mm×0.25μm气相色谱柱。
定量分析采用气相色谱内标法,以正丁醇为内标,岛津GC-14B气相色谱仪,N-2000色谱数据工作站,DB-FFAP色谱柱(60m×0.32mm×0.5μm),FID检测器。主产物的分析样品经丙酮稀释后进样,副产物的分析未经稀释,加大进样量进样。
2 结果与讨论
2.1 反应产物分析
通过GC-MS分析方法对不同工艺条件下EC和甲醇酯交换反应液组成进行了定性分析,分析结果表明:在研究的工艺条件下,产物组成基本一致,只是含量多少有差异。图1和图2是具有代表性的n(MeOH)/n(EC)=2及n(MeOH)/n(EC)=9反应液的GC-MS总离子流图。
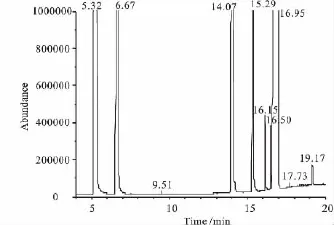
图1n(MeOH)/n(EC)=2酯交换反应液总离子流图

图2n(MeOH)/n(EC)=9酯交换反应液总离子流图
根据图1、图2,结合NIST、Willey谱图库联机自动检索分析结果表明,EC与甲醇酯交换反应液组成为:甲醇(5.4min)、碳酸二甲酯(6.7min)、乙二醇单甲醚(EGME,9.5min)、乙二醇(14.1min)、二甘醇(DEG,16.5min)、碳酸乙烯酯(16.7min)、二甲基二甘醇碳酸酯(Dimethyl diglycol carbonate,DMDC,17.7 min)、三甘醇(TEG,19.2min)。根据吴芳等[15]研究结果,出峰时间15.3min为2-羟乙基甲基碳酸酯(2-Hydroxyethyl methyl carbonate,HEMC)。对比SDBS谱图库,出峰时间16.1 min为2,5-二氧杂己二酸二甲酯(Dimethyl 2,5-dioxahexanedioate,DMDH)。
2.2 工艺条件对反应的影响
2.2.1 催化剂用量对反应的影响
在n(MeOH)/n(EC)=9,反应温度60℃、时间60 min的条件下,考察催化剂用量对反应的影响,结果如表1所示。
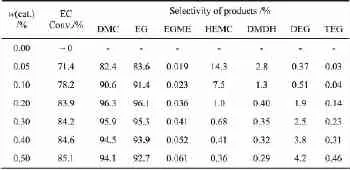
表1 催化剂用量对反应的影响
由表1可见,无催化剂时反应很难进行,随着催化剂用量的增加,EC转化率增加,DMC和EG的选择性先增大后减少,HEMC和DMDH量降低,EGME、TEG的量略有增加,DEG量增加较明显。当w(cat.)<0.2%时,HEMC含量较高,DMC和EG选择性较低,且EG的选择性略高于DMC。w(cat.)为0.2%时,DMC与EG的选择性最高,副产物的比例较低。继续增加催化剂用量,EC转化率略有增加,HEMC及DMDH的量基本不变,而EG聚合产物明显增多,DMC和EG选择性降低。这是因为当催化剂(CH3O-)量较低时,反应(1)和(3)是速度控制步骤,中间体HEMC含量较高,可能发生反应式(5)所示的副反应,使EG的选择性高于DMC。而当催化剂量较大时,在强碱性条件下,EG聚合速度加快,聚合生成的水导致EC、DMC微量水解,使EC转化率略有增加,DMC、EG选择性降低。
2.2.2 物料比对反应的影响
在w(cat.)为0.2%,反应温度60℃、时间30 min的条件下,考察了MeOH/EC物质的量比对反应的影响,结果如表2所示。

表2 物料比对反应的影响
由表2可见,n(MeOH)/n(EC)比对反应影响较大,随着甲醇比例的增大,EC的转化率增加,DMC与EG的选择性提高,HEMC及DMDH、DEG、TEG的量减少。当n(MeOH)/n(EC)≤2时,反应产物中HEMC含量较高,可能会发生反应式(7)所示的副反应,生成DMDC。当n(MeOH)/n(EC)<6时,EC转化率增加较快,DMC和EG选择性较低,且EG的选择性高于DMC,HEMC、DMDH和DEG的量较大。n(MeOH)/n(EC)>6以后,EC转化率增加较小,反应液中HEMC及DMDH的含量较低,DMC与EG的选择性相近,DEG的量变化较小。这说明当甲醇量小时,反应式(2)、(4)是速度控制步骤,反应体系中中间体HEMC和HOCH2CH2O-(Ⅱ)含量较高,易发生式(5)、(6)、(8)所示的副反应,使EG选择性明显高于DMC,DEG的比例较高。n(MeOH)/n(EC)在9~10较适宜。
2.2.3 温度对反应的影响
在n(MeOH)/n(EC)为9,w(cat.)为0.2%,反应时间60 min的条件下,考察温度对反应的影响,结果如表3所示。
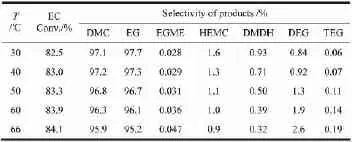
表3 温度对反应的影响
由表3可见,随着温度升高,EC转化率略有增大,DMC和EG的选择性稍有下降。当从30℃升至50℃时,反应液中HEMC及DMDH含量明显降低,此后继续升高温度HEMC及DMDH含量略有降低,DEG的量增加较明显,TEG、EGME略有增加,DMC和EG选择性下降。这是由于给电子诱导效应,CH3O-与HEMC的亲核反应比EC难,适当升高温度能有效加快速度控制步骤反应(3)的进行[16-17],使HEMC能很快速地与甲醇反应,减少了由中间体HEMC引起的副反应(5)的发生。但温度升高,也将导致EG聚合反应的加剧,使EG选择性下降。EG聚合产生的水致使DMC、EC微量水解,使得EC转化率略有增加,DMC选择性略有降低。较适宜的温度为30~40℃。
2.2.4 时间对反应的影响
在n(MeOH)/n(EC)为9,w(cat.)为0.2%,反应温度40℃条件下,考察时间对反应的影响,结果如表4所示。
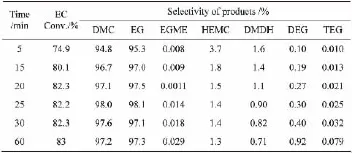
表4 反应时间的影响
由表4可见,在该工艺条件下,EC与甲醇的反应速度很快,5min时EC的转化率已达74.9%,随着时间延长,EC转化率略有增加,HEMC及DMDH的量逐渐降低,DEG的量明显增加,TEG和EGME的量略有增加,DMC和EG的选择性先增大后减小。这是因为在强碱性条件下,EG可能发生聚合反应,随着时间延长,EG聚合反应的量增加,聚合产生的水致使EC、DMC微量水解,使DMC和EG选择性降低。反应时间在25 min时,DMC和EG的选择性较高,为较适宜的条件。
2.3 反应历程
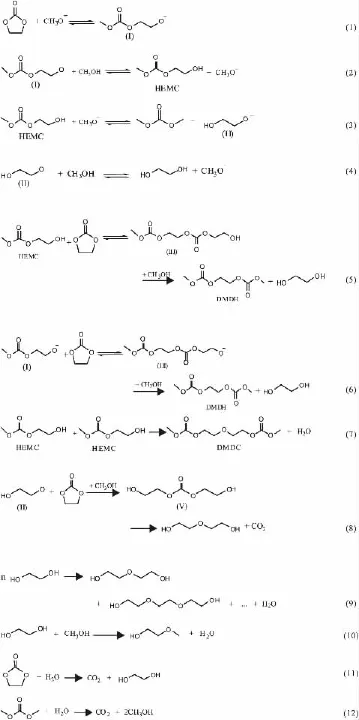
根据GC-MS分析结果及工艺研究结果,推测了以CH3ONa为催化剂时碳酸乙烯酯与甲醇酯交换反应可能的反应历程。
首先CH3O-对EC的羰基碳亲核进攻,生成反应式(1)所示的CH3OCOOCH2CH2O-(I)中间体,中间体很快与甲醇质子交换生成反应式(2)所示的反应中间体HEMC,释放CH3O-。CH3O-与HEMC进一步发生反应式(3)所示的亲核反应,生成DMC与HOCH2CH2O-(Ⅱ),HOCH2CH2O-(Ⅱ)与甲醇发生反应式(4)所示的质子交换生成EG,释放CH3O-。
当催化剂的量较低时,存在式(5)所示的副反应。当甲醇比例较低时,存在式(5)、(6)、(7)、(8)[18]所示的副反应。
在碱性较强或反应温度较高时,产物EG发生缩合反应,生成DEG、TEG等多聚体,同时也与甲醇醚化生成极少量的EGME,如式(9)、(10)所示。
聚合时生成的H2O有可能导致EC、DMC的微量水解,如方程式(11)、(12)所示。
EC与甲醇酯交换反应历程:
3 结论
甲醇钠为催化剂时,EC与甲醇酯交换反应首先是EC和甲醇亲核取代生成中间体HEMC,HEMC再进一步与甲醇亲核取代生成DMC与EG,生成HEMC的速度很快。MeOH/EC物质的量比和催化剂用量是影响反应的主要因素。当催化剂质量分数<0.2%时,HEMC与甲醇亲核反应是速度控制步骤,HEMC含量较高,易发生HEMC与EC反应生成DMDH的副反应。当n(MeOH)/n(EC)<6时,反应中间体不能及时与甲醇反应,导致中间体与EC反应生成DMDH、DEG等副反应的发生。强碱性或高温易导致EG聚合、醚化生成DEG、TEG、EGME等,聚合生成的水会导致EC和DMC的水解。在催化剂质量分数为0.2%,n(MeOH)/n(EC)为9~10,反应温度30~40℃,反应时间25min左右的工艺条件下,EC转化率和DMC、EG选择性均很高。通过调控MeOH/EC比、催化剂用量、反应温度和时间可提高DMC和EG的选择性。
[1]王宝荣,林民,朱斌,等.碳酸二甲酯的合成与应用研究进展[J].天然气化工(C1化学与化工),2014,39(6):90-96.
[2]Peng W,Zhao N,Xiao F,et al.Recent progress in phosgene-freemethodsforsynthesisofdimethyl carbonate[J].Pure Appl Chem,2012,84:603-620.
[3]Keller N,Rebmann G,Keller V.Catalysts,mechanisms and industrial processes for the dimethyl carbonate synthesis[J].J Mol Catal A,2010,317:1-18.
[4]王公应,刘绍英,王越,等.碳酸二甲酯及其下游产品研究进展[J].精细化工中间体,2007,37(3):1-9.
[5]武生,刘绍英,雷永诚,等.尿素醇解合成碳酸二甲酯研究进展[J].天然气化工(C1化学与化工),2008,33(1):57-63.
[6]李玲,杨晓霞,程伟,等.酯交换法联产的1,2-丙二醇中微量杂质的气相色谱-质谱分析[J].色谱,2004,22(3): 284-284.
[7]成卫国,孙剑,张军平,等.环氧乙烷法合成乙二醇的技术创新[J].化工进展,2014,33(7):1740-1747.
[8]周玮,马中义,石大川,等.环氧乙(丙)烷与二氧化碳环加成制备碳酸乙(丙)烯酯的催化剂研制进展[J].天然气化工(C1化学与化工),2009,34(2):70-80.
[9]North M,Pasquale R,Young C.Synthesis of cyclic carbonates from epoxides and CO2[J].Green Chem, 2010,12:1514-1539.
[10]庞纪峰,郑明远,姜宇,等.乙二醇生产和精制技术研究进展[J].化工进展,2013,32(9):2006-2014.
[11]Yue H,Zhao Y,Ma X,et al.
Ethylene glycol:properties,synthesis,and applications [J].Chem Soc Rev,2012,41:4218-4244.
[12]谭捷.国内外乙二醇的供需现状及发展前景[J].石油化工技术与经济,2014,30(6):10-15.
[13]Buysch H J,Krimm H,Rudolph H.Process for the preparation of dialkyl carbonates[M].US:4181676,1980.
[14]Abimanyu H,Kim C S,Ahn B S,et al.Synthesis of dimethyl carbonate by transesterification with various MgO-CeO2mixed oxide catalysts[J].Catal Lett,2007, 118:30-35.
[15]吴芳.有机碳酸酯的绿色合成方法探讨[D].天津:南开大学,2010.
[16]Xu J,Long K-Z,Chen T,et al.Mesostructured graphitic carbon nitride as a new base catalyst for the efficient synthesis of dimethyl carbonate by transesterification[J]. Catal Sci Technol,2013,3:3192-3199.
[17]Wang J Q,Sun J,Cheng W G,et al.Synthesis of dimethylcarbonatecatalyzedbycarboxylic functionalized imidazolium salt via transesterification reaction[J].Catal Sci Technol,2012,2:600-605.
[18]Harris R F,McDonald L A.Structural features of poly (alkylene ether carbonate)diols and intermediates formed during their preparation[J].J Appl Poly Sci,1989,37: 1491-1511.
A study on process and product distribution of the transesterification reaction of ethylene carbonate with methanol
LIU Meng1,2,LIU Shao-ying1,WANG Gong-ying1
(1.Chengdu Institute of Organic Chemistry,Chinese Academy of Sciences,Chengdu 610041,China; 2.University of Chinese Academy of Sciences,Beijing 10049,China)
By using GC-MS and GC internal standard method to analyze the products of the transesterification reaction of ethylene carbonate(EC)and methanol catalyzed by sodium methoxide qualitatively and quantitatively,respectively,the effects of feed molar ratio,catalyst dosage,reaction temperature and time on the product distribution and the reasons causing the side reactions were investigated,and a tentative reaction mechanism was proposed.The results showed that the feed molar ratio and the catalyst dosage affected the product distribution more than others.The side reaction could be controlled by adjusting the reaction parameters.
ethylene carbonate;methanol;transesterification;dimethyl carbonate;ethylene glycol
TQ225.5;TQ223.1
A
1001-9219(2016)02-15-04
2015-04-10;作者简介:刘孟(1989-),男,硕士研究生,电话15657599328,电邮liu_m@outlook.com;*联系人:刘绍英,研究员,电话028-85250005,电邮syliu@cioc.ac.cn

