运用手持技术探究铁的吸氧腐蚀
庞玉玺 汪嵘 唐其生

摘要:以初高中学段铁的吸氧腐蚀实验为切入点,比较了不同学段此实验的教学功能;并就此部分内容的教学,尝试利用数字化动态实验进行实验改进,探究铁的吸氧腐蚀的微观原理,促进学生在微观和宏观之间建立起一座“桥梁”,逐步建构微粒观思维。
关键词:吸氧腐蚀;数字化;微观;教育解释
文章编号:1008-0546(2016)05-0095-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.05.037
铁的吸氧腐蚀是中学化学的常见实验之一。在初中学段,此实验是金属性质和探究金属腐蚀与防护的实验载体;高中学段,则是氧化还原反应知识的延伸,是电化学知识在生产生活中的应用。不同学段的教学需求使得两个学段对此实验的要求和目的不同。初中学段需通过一组对比实验比较铁钉在不同实验条件下的锈蚀情况 [1]了解铁的腐蚀是氧气和水共同作用的结果,即“是什么”造成了铁的锈蚀;高中学段则需运用电化学相关知识理解吸氧腐蚀的微观原理[2],即“为什么”铁会锈蚀。传统上,对此部分内容的教学利用反应消耗氧气而使装置内气压减少、导管内液体倒吸的实验现象 [3]结合钢铁吸氧腐蚀的示意图进行微观解释。此实验操作不确定影响因素多、现象不明显且未对反应产物进行检验,这种教学方法更多关注的是用微观过程对宏观现象进行解释,学生在思维上延续着初中宏观思维的方式,如何从微观层面上理解吸氧腐蚀的原理尚显不足。
鉴于此,教师可以尝试改进实验装置,利用手持技术——威尼尔数字气压、温度传感器,动态监测反应过程中气压和温度的变化,并在实验前加入滴有铁氰化钾、酚酞溶液[4]的小片滤纸以此来检验产物Fe2+和OH-,以期能将此实验的初高中学段教学更加有效地衔接,通过精确的实验数据及对产物的检验使学生从微观本质角度理解宏观现象,更好地理解吸氧腐蚀的原理,从而促进学生在微观和宏观之间建立起一座“桥梁”,逐步建构微粒观思维。
一、铁的吸氧腐蚀实验装置改进
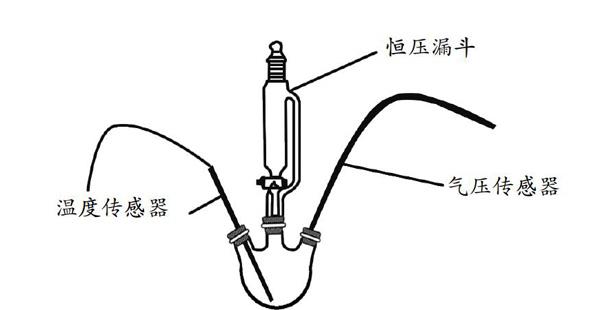
装置说明:仪器接口处用封口膜密封,向250mL的三颈烧瓶依次加入分别滴有铁氰化钾、酚酞的小片滤纸和固体粉末,利用恒压漏斗向三颈烧瓶中滴加氯化钠溶液。
二、教学设计片段
师:初中已经学过了铁的锈蚀,铁锈是什么?铁在什么情况下容易锈蚀?
生1: 铁在有氧气和水的情况下易锈蚀生成Fe2O3·xH2O。
生2:若环境中存在酸溶液或者盐溶液则更容易生锈。
师:这是什么原因造成的呢?我们向还原铁粉和炭粉滴加氯化钠溶液来代替水以增加实验效果模拟铁的锈蚀过程。Fe2+可使铁氰化钾变蓝。
[演示实验]将分别滴有铁氰化钾、酚酞溶液的小片滤纸置于250mL三颈烧瓶中,再将10g还原铁粉与5g炭粉混合均匀后加入,采集数据,通过恒压漏斗加入5mL氯化钠溶液。
[展示实验曲线]
[分组实验1]将10g还原铁粉置于250mL三颈烧瓶中,采集数据,通过恒压漏斗加入5mL氯化钠溶液。
[分组实验2]将5g炭粉置于250mL三颈烧瓶中,采集数据,通过恒压漏斗加入5mL氯化钠溶液。
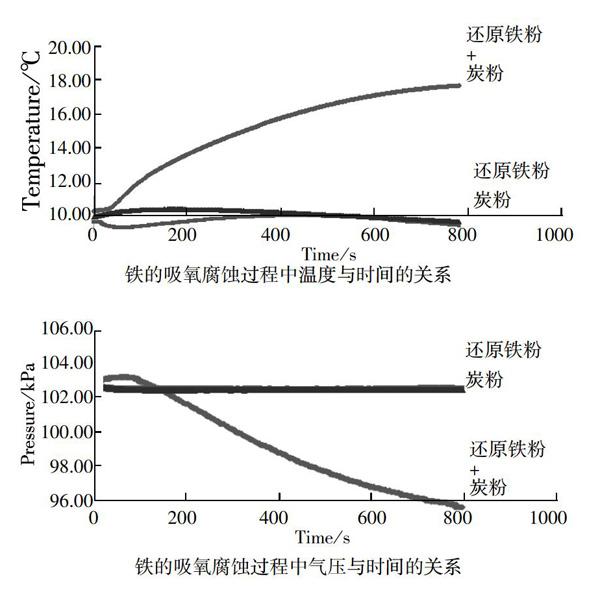
师:将各小组的对比实验与吸氧腐蚀数据进行整合,得到了这样的图。
[讨论]从图中可以获取哪些信息?
生:分析曲线,讨论分析,得出结论。(还原铁粉或炭粉中滴加氯化钠溶液基本不反应,而在还原铁粉和炭粉混合粉末中滴加氯化钠溶液则会发生化学反应。)
师:在模拟铁的锈蚀的反应过程中出现了温度和气压的变化,说明了什么?
生:根据实验数据,讨论分析,得出结论。(随反应的进行,温度升高说明铁的锈蚀是个放热反应;温度升高,但气压反而减小说明空气中氧气参与了反应。)
师:观察三颈烧瓶内滴有铁氰化钾、酚酞溶液的小片滤纸的变化,又说明了什么?
生:根据滤纸上实验现象,得出结论。(滤纸上滴有铁氰化钾的部位呈蓝色,说明生成了Fe2+,滴有酚酞的部位呈微红,说明生成了OH-。)
师:同学们根据初中化学的学习知道铁在有氧气和水的情况下易锈蚀。在实验模拟铁的锈蚀过程中,我们清楚地“看到了”因氧气减少而造成的气压减少,又通过铁氰化钾和酚酞溶液检验了反应产物有Fe2+和OH-的生成。如何使用化学语言从氧化和还原两个角度来描述这个反应呢?
生:讨论分析,得出结论。(氧化反应:Fe→Fe2+,还原反应:O2+H2O→OH-。)
师:考虑电荷守恒和元素守恒将两个过程配平。
生:讨论分析。(氧化反应:Fe-2e→Fe2+,还原反应:O2+4e+2H2O→4OH-。)
师:通过监测反应过程中温度变化,我们知道了这个氧化还原反应是个放热的自发反应。能否从电化学角度进一步去分析这两个过程呢?
生:讨论分析,得出结论。(原电池,负极:Fe-2e→Fe2+,正极:O2+4e+2H2O→4OH-。)
师:我们将此过程称为铁的吸氧腐蚀。
生:我们知道铁生锈产生氧化铁,可现在实验又告诉我们产生了Fe2+和OH-,这是怎么回事呢?
师:这个问题非常有价值。在铁的锈蚀过程中,铁和碳构成了原电池的两极,生成了Fe2+和OH-,这两种离子又是如何形成铁锈的呢?同学们可以根据所学知识试着用化学方程式或离子方程式表示出来。
生:思考、讨论。(Fe2++2OH-→Fe(OH)2↓;4Fe(OH)2+O2+2H2O→4Fe(OH)3;2Fe(OH)3+(x-3)H2O→Fe2O3·xH2O。)
三、教学设计思考
铁的吸氧腐蚀实验是氧化还原反应原理的在电化学中的应用之一,其反应微观过程中电子转移守恒观和变化观是氧化还原反应理论的核心思维。如何将反应的微观变化尽可能通过技术手段呈现出来成为本教学设计的主要思想,手持技术的应用使得一些原本不明显的现象更加明显和可测。在具体的教学设计中,运用压力传感器监测反应过程中气体压力变化以说明氧气参与了化学反应,用铁氰化钾溶液测定反应的产物Fe2+,使用酚酞试液检测反应的另一产物OH-,并且用温度传感器动态测定反应过程中温度变化以说明其是一个自发的氧化还原反应。学生们通过实验、讨论分析和思考自然地掌握了铁的吸氧腐蚀的相关知识。
初中学段注重化学基本概念及理论的常识性和启蒙性,在此实验的具体实施上需观察到铁钉在不同条件下锈蚀的现象,实验时间较长;高中学段的知识内容则更为系统化、整体化和应用化,需通过对实验现象的思考分析去了解反应的抽象微观原理,从而进一步理解氧化还原反应和电化学知识。根据高中学段教学需要改进的实验装置,引导学生从关注反应现象转移到关注反应的原理和过程,通过监测反应过程中各种数据的变化,多角度去认识铁的吸氧腐蚀微观原理,拓展了学生的思维空间。
教育解释学认为教师不是知识守望者和旁观者,教师是经验建构者。教师应精于把课程知识与自己、学生的经验结合起来,敢于重构教参和教材,乐于和学生发展共有知识,善于引领学生进行有意义的经验互动[5]。高中阶段的学生对金属腐蚀并非一无所知,他们有着丰富的生活经验和在初中学习过程中获得的知识,他们不是“空的容器”而是具有不同经验的经验者,但他们对此概念的认识往往停留在初中阶段而可能存在许多错误的或不完善的理解。如何将他们的这些前概念或者说前经验转化为科学概念[6],将生活常识转变为科学认识,由表及里,由对现象的感性认识上升到对本质的理性认识?如何有效利用化学实验的衔接实现知识的衔接、思维的衔接?如何将学生从经验拥有者转变到经验建构的建构者?这些问题是初高中化学教师要共同面对的课题。随着认知水平的不断深入,学生对此实验的认识经历了由初中学段的“是什么”造成了铁的锈蚀,到高中学段原电池相关内容学习后进一步认识“为什么”铁会锈蚀,最终认识到铁在“怎么样”锈蚀,体现了认知过程由宏观现象到微观本质,由理论学习到知识应用的过程。在经验建构的过程中学生的前经验和新认识产生了认知冲突,而这些认知冲突又变成了促进学生再次研究认识的“催化剂”,引导他们追根究底,不断探索。这不正是科学研究的雏形吗?
参考文献
[1] 王晶.九年义务教育课本九年级下册·化学[M].北京:人民教育出版社,2012:17-18
[2] 姚子鹏.高级中学课本·化学拓展型课程[M].试用本.上海:上海科学技术出版社,2009:81-82
[3] 王祖浩.普通高中课程标准实验教科书:化学反应原理[M].第四版,南京:江苏教育出版社,2009:23-24
[4] (美)菲利普等.化学概念与应用下册[M].杭州:浙江教育出版社,2009:577
[5] 邓友超.教育解释学[M].北京:教育科学出版社,2009
[6] 王祖浩.化学课堂教学行为研究及案例[M].南昌.江西教育出版社,2009:303

