决明子水提液对大鼠肝脏CYP450酶的影响
许龙龙 汤响林 马增春 王宇光 梁乾德 谭洪玲 肖成荣 李桦 原梅 高月


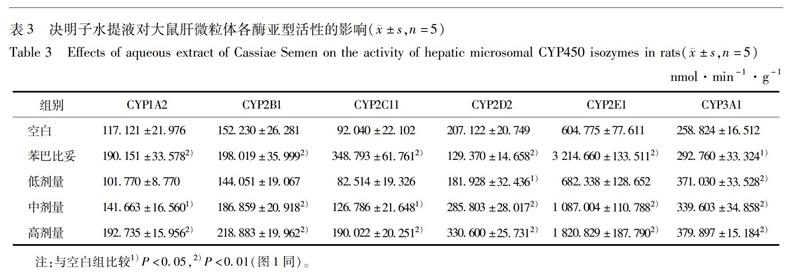
[摘要]该文研究决明子水提液对大鼠肝脏CYP450酶酶活性、mRNA及蛋白表达水平的影响。取SD大鼠,口服灌胃受试药物后,处死,用冰冷生理盐水灌流肝脏,提取大鼠肝脏微粒体、肝脏总RNA和总蛋白,采用 Cocktail体外孵育法结合液质联用(LCMS)技术对大鼠肝脏中CYP1A2,2B1,2C11,2D2,2E1,3A1各亚酶的酶活性进行测定,并应用荧光定量PCR技术和Western blot对上述亚型的 mRNA和蛋白表达水平进行检测。结果表明,酶活性方面,决明子水提液组与空白组比较可明显诱导CYP1A2,2B1,2C11,2D2,2E1,3A1的酶活性,其中决明子低剂量组对CYP2D2有明显的抑制作用,中、高剂量组对CYP2D2有明显的诱导作用,且都呈剂量依赖性增加,但对CYP3A1的诱导不呈剂量依赖性;mRNA表达方面,决明子水提液对CYP1A2,2C11,2D2,2E1 mRNA的表达具有显著诱导作用,其中对CYP1A2,2D2,2E1诱导作用呈剂量依赖性,与酶活性水平具有一致性,对CYP2B1,3A1没有明显作用;蛋白表达方面,决明子水提液对CYP2C11,2E1的表达也具有诱导作用,但没有统计学差异。决明子水提液对CYP450同工酶不同程度诱导或抑制作用,特别是对于CYP2C11,2E1亚型酶,酶活性与mRNA,蛋白表达水平具有一致性,提示当与这些酶底物合并用药时,尤其是与CYP2C11,2E1代谢有关的药物合用时,应充分考虑到潜在的有益和不利的药物相互作用。
[关键词]决明子;细胞色素P450酶;Cocktail探针法;荧光定量PCR技术;Western blot
[Abstract]To study the effect of aqueous extract of Cassiae Semen on the activity, mRNA and protein expressions of cytochrome P450(CYP450) system in rat liver microsomes, microsomes of rat liver were prepared after the oral administration with aqueous extract of Cassiae Semen for 14 days The enzyme activity was quantified by Cocktail method Meanwhile, the mRNA and protein expressions of CYP1A2, CYP2B1, CYP2C11, CYP2D2, CYP2E1 and CYP3A1 in the livers were detected by RTPCR and Western blot The result of this experiment was that aqueous extract of Cassiae Semen obviously induced the enzyme activities of CYP1A2, CYP2B1, CYP2C11, CYP2D2, CYP2E1 and CYP3A1 Low dose of aqueous extract of Cassiae Semen significantly reduced the activity of CYP2D2, but the activity of CYP2D2 was significantly induced by middle dose and high dose of aqueous extract of Cassiae Semen These subtypes were increased in a dosedependent manner except for CYP3A1 The mRNA levels of CYP1A2, CYP2C11, CYP2D2 and CYP2E1 were also induced in rats treated with aqueous extract of Cassiae Semen, but with no significant effect in CYP2B1 and CYP3A1 mRNA expressions The protein levels of CYP2C11 and CYP2E1 were also induced in rats treated with aqueous extract of Cassiae Semen, but with no significant difference Since the enzyme activity, mRNA and protein expressions of CYP450, particularly CYP2C11and2E1subtypes, were induced or inhibited by aqueous extract of Cassiae Semen to varing degrees, suggesting the potential drugdrug interactions should be concerned
[Key words]Cassiae Semen;cytochrome P450;Cocktail probe method;QPCR; Western blot
doi:10.4268/cjcmm20160823
决明子为豆科植物Cassia obtusifolia L或小决明C tora L的干燥成熟种子,始载于《神农本草经》列为上品药,为我国药典收载的常用中药[1],其性味甘、苦、咸,微寒,归肝、大肠经,具清热明目、利水通便的功效。决明子具有多种药理作用,主治目赤涩痛、羞明多泪、头痛、眩晕、小便不利、习惯性便秘等。现代药理研究证明决明子具有降血压、降血脂、保肝、抗菌等活性,同时又可作为保健饮品的原料[2]。
目前国内外对决明子的研究主要集中在化学成分、保肝降脂机制[34]等研究,决明子作为传统的中药材,其一直既是食品又是药品的物品,可以长期使用,周宇红等[5]研究决明子长期服用,可引起肾、肠系膜淋巴结、睾丸等靶器官病理改变,提示决明子不宜长期大量服用,因此决明子主要成分蒽醌衍生物的潜在不良反应应引起足够的重视,而药物相互作用是临床上产生严重不良反应甚至死亡的主要原因之一。细胞色素P450(cytochrome P450)作为人体重要I相药物代谢酶系统,其对药物代谢和药物之间的相互作用有着重要影响[6]。在临床应用中,决明子与其他药物联合应用,有发生药物相互作用的可能,并由此改变相关药物的血药浓度,甚至引起不良反应的发生。此前关于决明子对药物代谢酶影响的研究相对较少,缺乏该药物对药物代谢酶影响的基础数据。
根据本实验室已经建立的混合探针的测定方法,选择了大鼠体内相对应的6种亚型进行研究,利用液质联用技术[7]测定了决明子水提液对大鼠CYP450亚酶酶活性的影响,同时利用荧光定量PCR技术、Western blot对大鼠 CYP450同工酶mRNA和蛋白表达进行了检测,从3个层面发现了决明子水提液对药物代谢酶亚型的影响,为临床合理使用该药提供参考[8]。
1材料
决明子购自北京同仁堂,产地安徽,批号20150201,由军事医学科学院放射与辐射医学研究所马百平研究员鉴定;非那西丁/对乙酰氨基酚(phenacetin/paracetamol),甲苯磺丁脲/4羟基甲苯磺丁脲(tolbutamide/4hydroxytolbutamide),右美沙芬/右啡烷(dextromethorphan/dextrorphan),氯唑沙宗/6羟基氯唑沙宗(chlorzoxazone/6hydroxychlorzoxazone)均购自Sigma 或 BD Genetest公司;安非他酮/4羟基安非他酮(bupropion/4hydroxybupropion),咪达唑仑/1羟基咪达唑仑(midazolam/1hydroxymidazolam)购自中国食品药品检定研究院;NADPH购自瑞士Roche公司;超纯总RNA快速提取试剂盒购自中国博迈德(Biomed)公司;反转录聚合酶链式反应试剂盒及QPCR扩增试剂盒购自北京全式金(TransGen)公司;甲醇和乙腈为色谱纯,购自美国SigmaAldrich公司;实验用水为超纯水。
Agilent 1290型超高效液相色谱仪(UHPLC,美国Agilent公司);Agilent 6410B型三重四级杆串联质谱仪(美国Agilent公司);Agilent ZORBAX EclipseC18色谱柱(21 mm×100 mm,35 μm,美国Agilent公司);ImageQuant LAS 500显影仪;RE52CS型旋转蒸发仪(上海亚荣生化仪器厂);电热恒温水浴锅(北京长安科学仪器厂);SHBⅢA循环水式多用真空泵(郑州长城科工贸有限公司);Optima LXP超高速低温离心机(美国Beckman);DY891匀浆机(中国宁波新芝生物科技有限公司);Labofuge 400R高速低温离心机(德国Heraeus);ABI Step One Plus 荧光定量PCR仪;BS223S电子天平(德国Sartorious公司);pH计(METTLER TOLEDO);QM20型制冰机;纯水仪(Millipore Simplicity)。
雄性SD大鼠,SPF级,体重180~220 g,由军事医学科学院实验动物中心提供,动物生产许可证号SYXK(军)2015004,动物合格证号SCXK(军)2015004。动物随机分为5组,每组9只,分别为空白组,苯巴比妥组,决明子低剂量组、中剂量组、高剂量组。
2方法
21给药方案
苯巴比妥组腹腔注射给予80 mg·kg-1·d-1苯巴比妥钠,第12天开始注射,连续3 d,第15天制备肝微粒体;决明子低剂量组(15 g·kg-1·d-1,根据《中国药典》,由人临床剂量换算成大鼠等效剂量),决明子中剂量(5 g· kg-1·d-1,相当于3倍人临床剂量),决明子高剂量(15 g· kg-1·d-1,相当于9倍人临床剂量),连续灌胃14 d,第15天脱臼处死动物制备肝微粒体;空白组给予等量生理盐水,连续14 d,第15天制取肝微粒体。
22供试样品的制备
决明子水提液的制备: 取决明子500 g,置圆底烧瓶中,加水4 000 mL浸没药材,浸泡30 min 后,加热至煮沸,保持微沸60 min,分离煎出液,药渣加水2 000 mL依法再次煎煮30 min,合并 2 次煎出液,放置于50 ℃ 水浴锅中缓慢蒸发,浓缩至500 mL(按生药算,质量浓度相当于1 g·mL-1),冷藏于4 ℃冰箱备用。
23Cocktail探针法测定决明子水提液对大鼠肝脏CYP450酶活性水平的影响
231肝微粒体的制备各组大鼠给药结束后,禁食12 h,脱臼处死,迅速打开腹腔和胸腔,用注射器以4 ℃生理盐水由门静脉灌洗,结扎上腔静脉,灌洗至肝脏呈土黄色。将肝脏剪碎,按1∶4加入TMS缓冲液,冰浴中匀浆。匀浆液4 ℃,12 000×g离心20 min,弃沉淀。上清液4 ℃,105 000×g离心60 min,弃上清,沉淀部分即肝微粒体。按初始匀浆时每1 g肝组织加入1 mL TrisHCl储存液(4 ℃),重悬微粒体,冰浴,玻璃匀浆器手动研磨,使微粒体均匀分散。分装微粒体,-80 ℃保存。采用康为公司的BCA法测定肝微粒体蛋白浓度,按试剂盒说明书进行操作。
232肝微粒体孵育体系将肝微粒体与CYP450同工酶探针药物共同孵育,测定探针药物代谢产物的生成量来反映决明子水提液对CYP450同工酶的诱导或抑制作用。孵育体系包括肝微粒体(05 g·L-1),NADPH(1 mmol·L-1),CYP特异性探针底物非那西丁(10 μmol·L-1)、甲苯磺丁脲(25 μmol·L-1)、安非他酮(25 μmol·L-1)、右美沙芬(5 μmol·L-1)、氯唑沙宗(25 μmol·L-1)和咪达唑仑(25 μmol·L-1),K2HPO4/KH2PO4缓冲液(005 μmol·L-1,pH 74)补足体系至200 μL。37 ℃水浴预孵育5 min后加入同样预孵育5 min的NADPH启动反应,37 ℃水浴温孵育30 min,加入200 μL预冷的终止剂(普萘洛尔100 μg·L-1,大黄素1 μmol·L-1,溶剂为甲醇乙腈1∶1)终止反应。混悬5 min后,4 ℃,13 000×g离心10 min,取上清液进样定量分析各底物的代谢产物生成率,测得酶活性。
决明子水提液中、高剂量组可明显诱导CYP1A2,2B1,2C11,2D2,2E1和3A1酶活性,在mRNA水平对CYP1A2,2C11,2D2,2E1 mRNA的表达具有显著上调作用,因此选择了CYP2C11,2E1进行蛋白表达分析。分析结果显示决明子水提液仅对CYP2C11,2E1蛋白表达有诱导作用,见图2。
4讨论
细胞色素P450(cytochrome P450,CYP)又称混合功能氧化酶和单加氧酶,为一类亚铁血红素硫醇盐蛋白的超家族,是一种单链的B族细胞色素蛋白。在动物、植物、微生物的各种组织中广泛存在,包括许多同工酶,是微粒体混合功能氧化酶系中最重要的一族氧化酶,主要存在于成人肝脏中,在内源和外源化合物的代谢过程中有重要作用[9]。
中药多组分和多靶点的特性决定了其作用机制的复杂性,对主要有效成分的酶活性评价可以为深入认识中药合理应用及机制提供科学依据[10]。一般而言,酶抑制作用所致的代谢性相互作用的临床意义远大于酶促作用,约占该酶系统全部相互作用的70%。中药有效成分对 CYP450酶的抑制能降低合用的其他中药成分或化学药物的体内代谢消除,打破合用药物与其代谢产物之间的平衡,增高血药浓度或引起蓄积,可能导致药物的药效增强乃至不良反应或毒性反应的发生。因此,评价中药有效成分对 CYP450 酶活性的影响,对于临床安全用药、降低药物药物相互作用[11]的风险有重要的意义。
本文就从药物代谢酶的角度,主要对CYP各亚型在酶活性、mRNA和蛋白水平的影响进行了研究和比较。本研究结果显示,决明子水提液高剂量组对主要CYP酶的诱导作用最显著,故初步推测决明子具有肝药酶诱导作用,可与一些治疗窗口比较窄、有明显毒副作用的药物合用,可加快其代谢反应,缓解临床不良反应[12]。大鼠CYP1A2酶与人类CYP1A2酶同源,CYP1A2主要存在于肝脏中,约占肝脏CYP酶总量的13%,仅次于CYP3A和CYP2C亚家族,居肝脏各CYP酶含量的第3位[13],临床上,如茶碱、他克林、硝苯地平等多环芳烃类致癌物以及咪唑喹啉派生物等20多种药物经CYP1A2酶代谢,决明子可以诱导CYP1A2的酶活性,加快药物的代谢导致药效降低,因此应注意决明子与这些药物之间可能的相互作用,尤其是对于治疗窗窄的药物,比如茶碱类,更应注意使用剂量。大鼠CYP2B1酶与人类CYP2B6酶同源,CYP2B6参与代谢的临床药物如氯氨酮、非核苷类的逆转录酶抑制剂依法韦仑等[14],决明子诱导CYP2B6酶活性,能使某些药物(代谢产物无活性)药效降低,或产生耐药;而另一些药物(代谢产物有活性)在常规剂量下导致中毒。大鼠CYP2C11酶与人类CYP2C9酶同源,临床上经CYP2C9酶代谢的药物有塞来考希昔、格列吡嗪、华法林等,当决明子与CYP2C9的底物合用时[15],这些底物在体内代谢速率可能会加快,其中华法林是现在临床上使用最广泛的抗凝血药,治疗窗窄,决明子可能会使华法林血药浓度降低,造成凝血危险,因此在使用过程中应注意观察,合理使用安全剂量。大鼠CYP2D2酶与人类CYP2D6同源,CYP2D6含量虽比其他 CYP450 亚家族低,但参与了市场上20%~25%临床药物的代谢,包括精神安定药、抗心律失常药、镇痛药、抗抑郁药、止吐药以及一些抗癌药等[16],临床上经CYP2D6酶代谢的药物有丙咪嗪、多柔比星、地塞米松等,推测决明子有可能加速这些药物的体内代谢。大鼠CYP2E1酶与人类CYP2E1同源,并且有很好的相关性,CYP2E1是一种非常重要的CYP450酶,它不仅参与了药物代谢,而且能够催化许多前致癌物质和前毒物转化为致癌物质和有毒物质,还可催化大量的普通毒物的代谢,其中包括氯化的小分子有机化合物如四氯化碳、乙醇类、乙酰氨基苯等,决明子诱导CYP2E1可能会与CYP2E1前毒物类底物产生不利的药物相互作用,诱导前毒物转化为毒性物质,加大不良反应的发生几率;决明子也可能会加速经CYP2E1代谢的有毒药物的代谢,生成没有毒性的代谢产物[17]。大鼠CYP3A1酶与人类CYP3A4同源,临床上经CYP3A4酶代谢的药物有阿托伐他汀、辛伐他汀、地高辛等,CYP3A4主要存在于人类的肝脏及肠道中,其中它在肝脏中占P450酶总量的25%左右,临床中约有50%的药物经由CYP3A4酶代谢,CYP3A4为辛伐他汀的主要代谢酶之一,在调节血脂过程中,决明子可能会加速辛伐他汀的体内代谢,应进行调整药物用量,在药效最大的同时将不良反应降到最低限[18]。
决明子作为一种常用的中药材,临床上常与枸杞子、桑葚、红花、山楂等中药配伍,当患者长期服用含有决明子的中成药和复方时,应考虑到临床上可能潜在的药物相互作用,所以下一步研究会重点关注决明子与上述中药配伍使用产生的相互作用,从整体去阐述其在机体内的变化。决明子水提液对大鼠CYP450酶的研究表明,其临床剂量对CYP450酶的整体影响较小,高剂量主要表现为诱导作用,临床代谢性相互作用上属于相对安全的药物,这与其被列入既是药品又是食品的物品相符。本实验优化决明子给药方案,能为合理选用同类药品提供依据,避免具有临床意义的药物代谢性相互作用的发生,从而提高临床用药的有效性和安全性。此外,体外实验不能全面的反应体内实验和临床实验的结果。因此研究中药药理作用的分子机制,中药间及中西药间相互作用的机制、解释中药合理应用的科学内涵还要进行更加深入的研究[19]。由于CYP450存在一定的种属差异性,虽然大鼠的CYP450亚型与人的接近程度较高,但并不能代替人的所有CYP450亚型代谢模式,因此,研究决明子对人体CYP450亚型酶活性的作用,仍需进一步的人体试验。
[参考文献]
[1]中国药典. 一部[S]. 2010:135.
[2]韩亚萍. 决明子现代药理研究概述[J]. 环球中医药,2009,2(6):461.
[3]骆宜,张乐,刘斌,等. 高效液相色谱离子阱飞行时间质谱鉴定决明子化学成分[J]. 药物分析杂志,2015,35(8):1408.
[4]Xie W D, Zhao Y N, Du L J. Emerging approaches of traditional Chinese medicine formulas for the treatmentof hyperlipidemia[J]. J Ethnopharmacol,2012,140(2):345.
[5]周宇红,汪会玲,高芃,等. 决明子亚慢性毒性病理实验[J]. 毒理学杂志,2005, 19(3):265.
[6]Zhou X, Chan K, Yeung J H. Herbdrug interactions with Danshen (Salvia miltiorrhiza): a review on the role of cytochrome P450 enzymes[J]. Drug Metabol Drug Interact, 2012, 27(1):9.
[7]Julia Dinger, Markus R Meyer, Hans H Maurer. Development and validation of a liquidchromatography highresolution tandem mass spectrometry approach for quantification of nine cytochrome P450(CYP) model substrate metabolites in an in vitro CYP inhibition cocktail[J]. Anal Bioanal Chem,2014,406(18):4453.
[8]张云燕,汤响林,高月,等. 热毒宁注射液对大鼠肝脏CYP450酶的影响[J]. 中国中药杂志,2015,40(14):2737.
[9]李晓宇,刘皋林. CYP450 酶特性及其应用研究进展[J]. 中国临床药理学与治疗学,2008,13(8):942.
[10]Li M, Chen P Z, Wang H. Pungent ginger components modulates human cytochrome P450 enzymes in vitro[J]. Acta Pharmacol Sin, 2013, 34: 1237.
[11]Overholser B R, Foster D R. Opioid pharmacokinetic drugdrug interactions[J]. Am J Manag Care,2011,11:s276.
[12]张红曦,王宇光,高月,等. 参麦注射液对大鼠肝脏CYP450酶的影响[J]. 中国新药杂志, 2013,22(21):2529.
[13]周宏灏. 遗传药理学[M]. 北京:人民军医出版社,2003:53.
[14]王晋朝,周宏灏. 细胞色素P450重要成员CYP2B6研究进展[J]. 医学综述,2008,14(4):483.
[15]He N, Edeki T. The inhibitory effects of herbal components on CYP2C9 and CYP3A4 catalytic activities in human liver microsomes[J]. Am J Ther,2004,11(3):206.
[16]Thshiro N, Norie M, Yamazaki H. Comparison of cytochrome P450 2D6 and variants in terms of drug oxidation rates and substrate inhibition [J]. Curr Drug Metab, 2011, 12: 412.
[17]刘晨晖,乐江. 细胞色素P450 CYP2E1酶构型特征及其表达调控机制的研究进展[J]. 中药药理学与毒理学杂志,2010,24(2):155.
[18]魏晓东,张峰,李娟,等. CYP3A4基础与临床研究进展[J]. 现代生物医学进展,2014,14(11):2179.
[19]梁淼,马增春,高月,等. 四物汤及其配伍对大鼠肝脏P450酶活性及mRNA表达的影响[J]. 中国中药杂志,2013,38(21):3720.
[责任编辑马超一]

