探讨EGF基因多态性与食管癌淋巴结转移风险的相关性
孙涛 陆静 顾海勇 尹俊 唐巍峰 陈锁成
摘要:目的 研究表皮生长因子(epidermal growth factor,EGF)单核苷酸多态性与中国汉族人群食管癌患者淋巴结转移风险的关系。方法 采用SNPscanTM高通量基因分型技术,分析380例食管癌患者淋巴结转移组(n=85)和无淋巴结转移组(n=270)EGF rs3756261 T>C和EGF rs11568835 G>A两位点各基因型频率,并计算各基因型的食管癌淋巴结转移风险及其95%可信区间。结果 EGF rs3756261 T>C基因型分布频率在食管癌淋巴结转移组和无淋巴结转移组之间没有显著差异(P=0.657)。在多因素Logistic回归分析中,在调整了年龄、性别、吸烟及饮酒状况后,没有发现EGF rs3756261 CC基因型与食管癌淋巴结转移风险存在相关性(调整OR=1.10,95%CI=0.34-3.56,P=0.88)。在隐性模型中,调整了年龄,性别,吸烟及饮酒状况后,没有发现CC基因型的个体淋巴结转移风险发生明显改变(调整OR=0.99,95%CI=0.31-3.14,P=0.98)。对EGF rs11568835 G>A多态性位点进行相同的单基因位点及logistic回归分析,没有发现其基因型分布频率在组间存在差异,结果也未显示其突变基因型与食管癌淋巴结转移易感性存在统计学意义的关联。结论 EGF rs3756261 T>C和EGF rs11568835 G>A基因多态性与食管癌淋巴结转移易感性之间无相关性。
关键词:食管癌;淋巴结转移;表皮生长因子;单核苷酸多态性
高淋巴结转移率是食管癌的特征之一[1]。Tachikawa等人[2]研究指出淋巴结转移模式能反映食管癌进展程度且是影响患者总体生存期的决定性因素,因此可以作为判断患者预后的重要标志并指导个体化治疗。目前的检查技术很难发现小的淋巴结转移灶,术前检查未发现有淋巴结转移的食管癌患者中,超过40%的患者术后病理发现局部淋巴结转移为阳性[3]。因此我们需要一种新颖并且精确的方法来评估预测淋巴结转移情况。
表皮生长因子(epidermal growth factor,EGF)是一种重要的细胞分裂剂,可促进细胞增殖、分化、恶性转化和转移[4],但正常生理水平量的EGF并不会导致消化道肿瘤的发生。人体EGF基础分泌水平部分取决于遗传因素,其基因的单核苷酸多态性(single nucleotide polymorphism,SNP)可引起EGF表达量的改变[5],最终可能改变机体某些恶性肿瘤的易感性。已有文献报道EGF的过表达在促进食管癌局部浸润和远处转移的过程中扮演了重要的角色[6]。在EGF基因5'端非编码区(5'-UTR)存在三个SNP位点:EGF rs444490A>G,EGF rs3756261 T>C和EGF rs11568835 G>A。目前对于EGF rs444490A>G的研究已较多较深入,但关于EGF rs3756261 T>C和EGF rs11568835 G>A的研究还比较少。因此,在本次实验中,我们研究了EGF rs3756261 T>C和EGF rs11568835 G>A基因多态性与食管癌淋巴结转移易感性之间是否存在关联。
1 资料与方法
1.1一般资料 病例是自2008年10月~2009年11月从江苏大学附属人民医院胸外科、江苏大学附属医院胸外科收集的380例食管癌患者,均由纤维胃镜及胃镜病理诊断,且术后病理均确诊为鳞状细胞癌。淋巴结转移情况由术中取淋巴结进行病理检查确定。其中有完整淋巴结转移信息的食管癌病例为355例,85例有淋巴结转移,270例无淋巴结转移。所有患者均来自江苏省镇江市及周边地区,为汉族人群。
1.2流行病学调查 对患者使用统一设计的生活状况与健康调查表进行调查,调查内容包括:一般情况、吸烟史、饮酒史、身体状况及疾病史、职业史和家族史、胃镜及手术标本病理以及食管癌淋巴结转移情况等。调查员分别为镇江市第一人民医院工作人员和江苏大学临床医学院外科学专业的研究生,经培训后使用统一调查表对研究对象进行逐一访问调查。
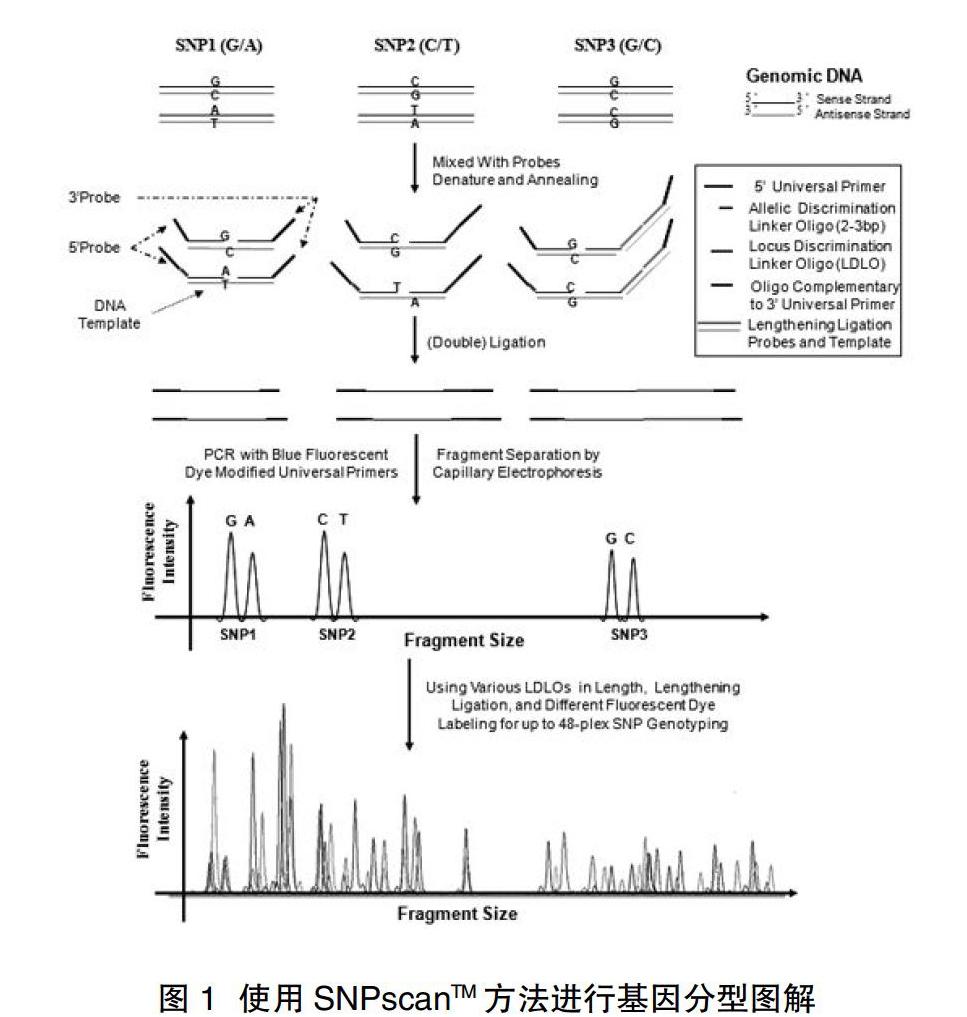
1.3实验方法 在获得书面的知情同意书后,空腹采集2mL EDTA抗凝血,1h内用4000r/min离心10min,分离白细胞层,采用Qiagen DNA提取试剂盒提取DNA。基因分型采用上海天昊生物技术有限公司自主专利开发的2x48位SNPscanTM高通量SNP分型技术。基于5'端及3'端双侧探针连接反应及多重荧光PCR扩增、电泳分离从而获取各SNP位点的基因型(见图1)。实验条件根据制造商说明书来设定。首先,将100-200ng DNA样本置于10μl含有1xDNA裂解缓冲液的反应体系中98℃,5min变性裂解,然后将其与10μl含有2μl 10x连接酶缓冲液、0.5μl连接酶、1μl混合探针以及7.5μl Mili-Q水的连接预混液充分混合。连接反应在ABI 2720热循环仪内完成,采用以下反应条件:4个循环(94℃1min,58℃4hr),94℃2min,温度控制在4℃并且立即加入20μl 2x终止缓冲液停止反应体系。每一个连接产物都采用2x48位荧光PCR反应扩增。PCR反应体系为20μl混合液,其中包括了1xPCR预混液,1μlPCR引物和1μl连接产物。PCR反应体系为:95℃2min;94℃20s 9个循环,65℃-0.5℃/40s循环,72℃1.5min;94℃20s 25个循环,57℃40s,72℃1.5min;60℃1hr;最后恒温在4℃。PCR产物分离和检测由毛细管电泳法在ABI3730XL测序仪上检测,原始数据分析和基因型判别由GeneMapper4.0完成。
1.4统计学方法 用SPSS13.0统计软件包进行统计学处理。食管癌淋巴结转移组和无淋巴结转移组基本特征比较采用χ2检验或/和t检验。单因素和多因素Logistic回归分析计算优势比(odds ratio,OR)及其95%可信区间(Confidence Interval,CI)表示EGF rs444490A>G,EGF rs3756261 T>C和EGF rs11568835 G>A基因多态性与食管癌淋巴结转移易感性的关系。
2 结果
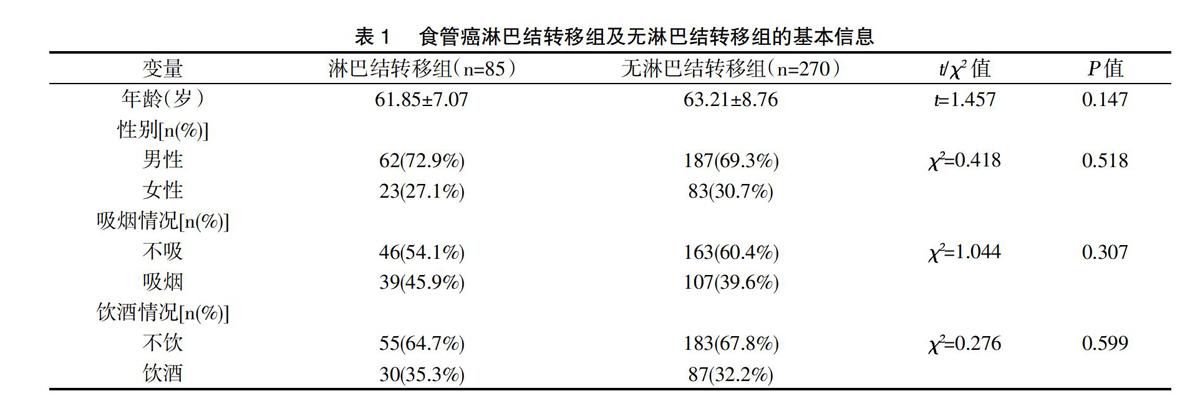
2.1食管癌淋巴结转移组及无淋巴结转移组的基本信息比较(表1):380例食管癌患者中中355例(93.4%)有完整淋巴结转移信息。术后病理证实有局部淋巴结转移的患者为85例(23.9%),270例(76.1%)患者无淋巴结转移。淋巴结转移组平均年龄(61.85±7.07)岁,72.9%为男性,无淋巴结转移组平均年龄为(63.21±8.76)岁,69.3%为男性,结果提示两组年龄与性别匹配良好,P值分别为0.147和0.518。吸烟及饮酒状况在淋巴结转移组和无淋巴结转移组之间无明显差异,P值分别为0.307和0.599。
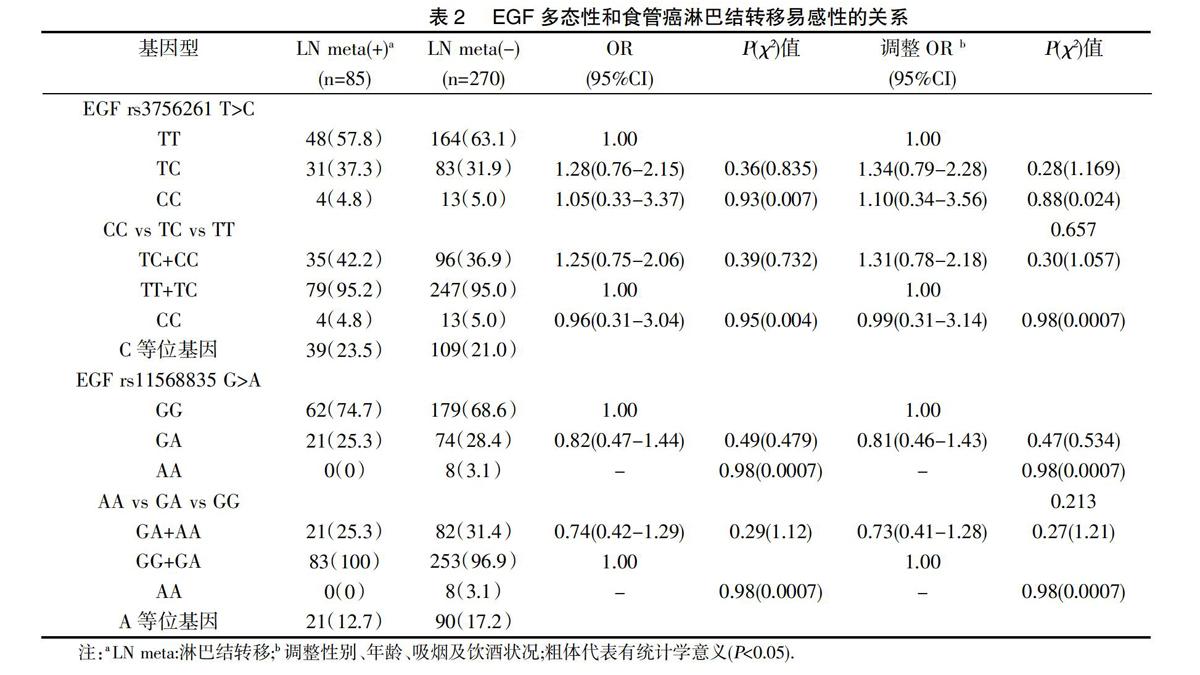
2.2EGF基因多态性和食管癌淋巴结转移易感性的关系(表2):EGF rs3756261 T>C三种基因型TT、TC、CC在食管癌淋巴结转移组和无淋巴结转移组的频率分布分别为57.8%,37.3%,4.8%和63.1%,31.9%,5.0%,两组基因型分布频率未发现有明显差异(P=0.657)。在多因素Logistic回归分析中,以EGF rs3756261 TT基因型作为参照,在调整了年龄、性别、吸烟及饮酒状况后,没有发现EGF rs3756261 TC基因型(调整OR=1.34,95%CI=0.79-2.28,P=0.28)和CC基因型(调整OR=1.10,95%CI=0.34-3.56,P=0.88)与食管癌淋巴结转移风险存在相关性。在隐性模型中,相对于TT+TC基因型而言,EGF rs3756261 CC基因型与食管癌淋巴结转移易感性无统计学意义的相关性(OR=0.96,95%CI=0.31-3.04,P=0.95);隐性模型中调整了年龄,性别,吸烟及饮酒状况后,以EGF rs3756261 TT+TC基因型作为参照,CC基因型的个体淋巴结转移风险无明显改变(调整OR=0.99,95%CI=0.31-3.14,P=0.98)。对EGF rs11568835 G>A多态性位点进行相同的单基因位点及logistic回归分析,没有发现其基因型分布频率在组间存在差异,结果也未显示其突变基因型与食管癌淋巴结转移易感性存在统计学意义的关联。
3 讨论
转移是导致癌症患者死亡的根本原因[7],大约50%~60%的食管鳞癌患者死于淋巴结转移和/或远处转移[8-9]。目前常用的CT、EUS和PET-CT等检查对于诊断较小的淋巴结转移灶准确性较低,经常出现假阴性结果,因此我们需要从分子水平深入的了解食管癌淋巴结转移机制,以期能尽早准确的对患者淋巴结转移作出诊断,评估患者预后并制定合理的个体化治疗方案。
Motoyama等人[3]指出食管鳞癌淋巴结转移模式可能和遗传因素有关。他们在研究中发现C-反应蛋白(C-reactive protein,CRP)SNP位点CRP 1846C>T基因多态性可能作为一个独立因素影响着食管鳞癌患者淋巴结转移的易感性。EGF是食管癌恶性进展的一个促进因子[10]。综上,我们在实验中选择了EGF rs3756261 T>C和EGF rs11568835 G>A这两个基因多态性位点作为研究靶点,探讨了两者基因多态性与食管癌淋巴结转移风险之间的相关性。
我们的实验尚存在以下不足:①并未对组间EGF表达水平进行比较,基因多态性是否会引起EGF表达水平的改变以及食管癌淋巴结易感性与EGF的异常表达是否存在直接关联,在我们的实验中都缺乏相关数据说明,因此还需对基因多态性和蛋白进行进一步的功能学研究;②没有进行单倍型分析:因为单基因位点并不能完全代表该基因启动子区的功能,单倍型分析对个体易感性有更准确的评价;③研究结果为阴性可能是由于样本量有限、统计学效能较低引起,因此我们还需对多态性位点进行多中心的大样本研究。
综上,EGF rs3756261 T>C和EGF rs11568835 G>A基因多态性与食管癌淋巴结转移易感性之间无相关性,我们还需进行进一步的功能学研究以及大样本前瞻性研究。
参考文献:
[1]Chen J,Pan J,Zheng X,et al.Number and location of positive nodes,postoperative radiotherapy,and survival after esophagectomy with three-field lymph node dissection for thoracic esophageal squamous cell carci-noma[J].Int J Radiat Oncol Biol Phys,2012,82:475-482.
[2]Müller JM,Erasmi H,Stelzner M,Zieren U,Pichlmaier H.Surgical ther-apy of oesophageal carcinoma[J].Br J Surg,1990,77:845-857.
[3]Motoyama S,Mori K,Kamei T,et al.Evaluation of the Risk of Lymph Node Metastasis Using CRP 1846C>T Genetic Polymorphism in Submucosal Thoracic Esophageal Squamous Cell Carcinoma[J].Ann Surgical Oncology,2012.
[4]Cai Z,Wang Q,Zhou Y,et al.Epidermal growth factor-induced epithelial-mesenchymal transition in human esophageal carcinoma cells-A model for the study of metastasis[J].Cancer Letters,2010,(296):88-95.
[5]Zhu J,Meng X,Yan F,et al.A functional epidermal growth factor(EGF)polymorphism,EGF serum levels and renal cell carcinoma risk in a Chinese population[J].J Hum.Genet,2010,55:236-224.
[6]Yoshida K,Kuniyasu H,Yasui W,et al.Expression of growth factors and their receptors in human esophageal carcinomas:regulation of expression by epidermal growth factor and transforming growth factorα[J]. Cancer Res Clin Oncol,1993,119:401-407.
[7]D.Hanahan,R.A.Weinberg.The hallmarks of cancer[J].Cell,2000,100:57-70.
[8]G.P.Stathopoulos,N.Tsiaras.Epidemiology and pathogenesis of esophageal cancer:management and its controversial results[J].Oncol.Rep,2003,10:449-454.
[9]G.D.Stoner,A.Gupta.Etiology and chemoprevention of esophageal squamous cell carcinoma[J].Carcinogenesis,2001,22:1737-1746.
[10]di Pietro M.,Fitzgerald R.C.Barrett's oesophagus:an ideal model to study cancer genetics[J].Hum.Genet,2009,126:233-246.
编辑/周芸霏

