普伐他汀联合紫杉醇、顺铂对人前列腺癌细胞PC—3的影响
张敏
[摘要] 目的 探讨普伐他汀联合紫杉醇、顺铂对人前列腺癌细胞PC-3增殖的影响。 方法 将人前列腺癌细胞PC-3进行体外培养24~72 h,普伐他汀、紫杉醇、普伐他汀联合紫杉醇作用细胞48 h,普伐他汀、顺铂、普伐他汀联合顺铂作用细胞48 h,采用MTT比色法检测各组对细胞的增殖抑制作用,测定吸光度(A)值,并按公式计算相互作用指数。 结果 普伐他汀、紫杉醇和顺铂分别作用PC-3细胞,均可抑制细胞增殖,且此作用呈时间-剂量依赖性;(2、5、10)μmol/L普伐他汀分别联合紫杉醇、顺铂作用PC-3细胞48 h,可将两种抗癌药物的IC50值降低,此作用呈剂量依赖性;普伐他汀和紫杉醇、顺铂的相互作用指数均小于1。 结论 普伐他汀联合紫杉醇、顺铂对PC-3细胞均具有协同抗瘤作用,且普伐他汀联合紫杉醇的协同抗瘤作用较强。
[关键词] 普伐他汀;前列腺癌;紫杉醇;顺铂;PC-3
[中图分类号] R737.25 [文献标识码] B [文章编号] 1673-9701(2016)09-0065-03
[Abstract] Objective To discuss the effects of combining pravastatin with paclitaxel and cisplatin on the human prostate cancer cell PC-3. Methods PC-3 cells were cultured in vitro for 24-72 hours. After PC-3 cells were treated with pravastatin,paclitaxel,combining pravastatin with paclitaxel for 48 hours,and similarly,with pravastatin,cisplatin,combining pravastatin with cisplatin for 48 hours, the cell proliferation was examined by MTT test, the A values were computed, the combination indexes were performed according to the formula. Results After PC-3 cells were treated with pravastatin,paclitaxel and cisplatin respectively,the cell proliferation was inbibited,and it worked in a dose-dependent and time-dependent manner. The IC50 values of paclitaxel,cisplatin were reduced after the two drugs combining with 2 μmol/L, 5 μmol/L, 10 μmol/L pravastatin on PC-3 cells for 48 h,and this worked also in a dose-dependent manner. The combination indexes of combining pravastatin with paclitaxel,cisplatin were both less than 1. Conclusion Combining pravastatin with paclitaxel,cisplatin show synergistic antitumor effects on PC-3 cells,and the synergistic effect of combining pravastatin with paclitaxel seemed more powerful.
[Key words] Pravastatin; Prostate cancer; Paclitaxel; Cisplatin; PC-3
在欧洲和北美,前列腺癌是最常见的实体性恶性肿瘤之一,致死率仅次于肺癌[1]。与大部分亚洲国家一样,我国前列腺癌发病率并不高[2],但由于居住环境的恶化、饮食结构调整及人口老龄化加速等因素,我国前列腺癌的发病率有明显上升趋势[3]。由于缺乏PSA筛查,患者就诊时前列腺癌多已发生进展或转移。国内多中心研究数据显示,初诊前列腺癌患者远处转移的发生率高达68%,而对于此类晚期进展性前列腺癌患者,内分泌治疗是主要治疗手段。前列腺癌具有雄激素依赖性,内分泌治疗通过阻断雄激素使得激素依赖性前列腺癌细胞凋亡而达到治疗目的。但随着内分泌治疗进程中雄激素受体信号通路的持续激活,前列腺癌往往会从激素依赖性转化为非激素依赖性,最终发生激素抵抗。而对于这些内分泌治疗耐受或无效的前列腺癌,化疗成为重要的治疗手段,但化疗药物的有效率偏低。因此如何提高化疗药物的疗效成为非激素依赖性或激素抵抗性前列腺癌治疗领域中亟待解决的问题。
目前,他汀类药物在临床上普遍用于降低血胆固醇水平从而治疗高脂血症、降低心肌梗死及脑血管卒中的发生。近年来研究显示,他汀类药物能通过阻滞胆固醇生物合成过程中的甲羟戊酸途径而具有抑制肿瘤细胞增殖的作用[4,5],进而一些学者报道了他汀类药物对化疗药物的增敏作用[6]。本文通过MTT法观察了普伐他汀联合紫杉醇、顺铂对激素非依赖性前列腺癌细胞PC-3的相互作用,发现普伐他汀和紫杉醇、顺铂具有协同抗瘤作用。
1 材料与方法
1.1 细胞和试剂
普伐他汀为美国Sigma公司产品,将普伐他汀标准品用无水乙醇溶解,NaOH激活,盐酸滴定,加无菌蒸馏水至终浓度为1 mmol/L,备用。紫杉醇为市售扬子江制药公司产品,顺铂为市售齐鲁制药集团产品,均溶解于无菌0.9%生理盐水,按实验设定用培养基稀释配制成所需终浓度。人前列腺癌细胞株PC-3由河北医科大学附属第四医院科研研究中心惠赠。
1.2 操作方法
将对数生长期的PC-3细胞进行消化、离心、重悬、计数,制成单细胞悬液,以1×105/mL的密度接种于96孔板上。待细胞贴壁生长成熟后,加入含普伐他汀、紫杉醇、顺铂的培养基继续培养48 h。实验设细胞对照组(单细胞悬液)、药物组1(紫杉醇和普伐他汀不同浓度单药组及两药联合组)、药物组2(顺铂和普伐他汀不同浓度单药组及两药联合组)。收集细胞前,每孔加入MTT液,继续培养4 h后加入DMSO,振荡后上机测定570 nm处的吸光度值(A值)。所有实验重复3次,根据测得的A值计算细胞生长抑制率:
1.3 统计学处理
应用SPSS 17.0统计学软件包进行数据分析,计量资料以均数±标准差(x±s)表示,行AVOVA方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 细胞生长抑制率结果
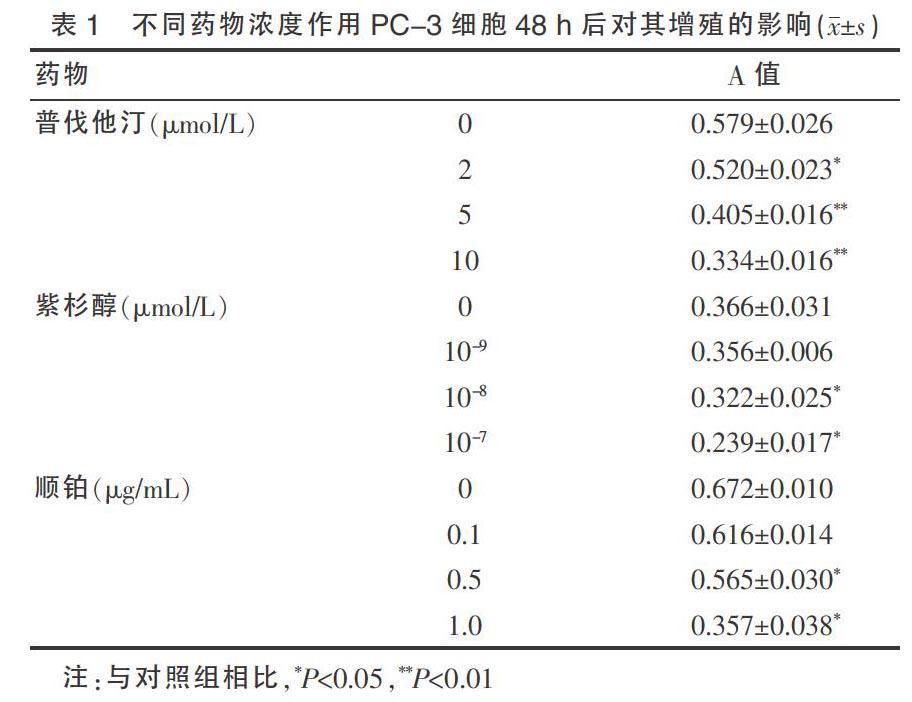
应用MTT比色法分析普伐他汀、紫杉醇、顺铂对PC-3细胞增殖的作用,结果显示(2、5、10)μmol/L普伐他汀分别作用细胞48 h后,吸光度A值显著低于对照组(F=343.850,P<0.05),10-9、10-8、10-7 mol/L紫杉醇作用细胞后,A值亦显著低于对照组(F=98.516,P<0.05),(0.1、0.5、1.0)μg/mL不同浓度顺铂分别作用细胞后亦呈此种趋势(F=399.766,P<0.05)(见表1)。根据公式计算出普伐他汀联合紫杉醇作用PC-3细胞后的生长抑制率及其联合顺铂后的生长抑制率。根据生长抑制率图(封三图1、封三图2)计算出联合不同浓度(2、5、10)μmol/L普伐他汀可将紫杉醇的IC50值分别降低至10-6.40 mol/L、10-6.61 mol/L、10-7.40 mol/L(单药紫杉醇的IC50值为10-6.13 mol/L),可将顺铂的IC50值分别降低至1.15 μg/mL、0.92 μg/mL、0.52 μg/mL(单药顺铂的IC50值为1.44 μg/mL)。我们发现随着普伐他汀联合用药浓度的增加,紫杉醇、顺铂的IC50值降低越明显,即普伐他汀对两种抗癌药物的协同作用随着其浓度的增大而增强。
2.2 相互作用指数结果
我们计算了普伐他汀联合化疗药物达到细胞生长抑制率为50%时的CI值。普伐他汀联合紫杉醇的CI值均值为0.63;普伐他汀联合顺铂的CI值均值为0.95,二者均<1。按照文献报道,CI值<1.0表明两药具有协同作用,CI值越小协同作用越强;CI值=1.0表明两药具有相加作用;CI值>1.0表明两药具有拮抗作用,CI值越大拮抗作用越强。因此我们得出结论:普伐他汀和紫杉醇、顺铂具有协同抗瘤作用。此外,我们发现两组别药物联合的CI值不同,普伐他汀联合紫杉醇的CI值均值为0.63,远远小于其和顺铂联合的CI值均值,由此可推断出普伐他汀和紫杉醇的协同作用相对较强。
3 讨论
羟甲基戊二酸单酰辅酶A(HMG-CoA)在HMG-CoA还原酶的作用下还原成甲羟戊酸(MVA),此为体内合成胆固醇的关键步骤。他汀类药物通过抑制HMG-CoA还原酶而发挥阻滞胆固醇的生物合成的作用,是临床上治疗高胆固醇血症重要的一类药物[7]。他汀类药物阻滞胆固醇合成的同时由于抑制了胆固醇合成途径中的中间产物[8],从而干扰了细胞信号传递、细胞增殖及凋亡和细胞分化等多种生物学效应。近年来,他汀类药物的抑制肿瘤细胞生长[9-11]、降低肿瘤细胞粘附、侵袭与转移[12]、影响肿瘤细胞信号传导、逆转耐药[13]等作用越来越受到国内外学者的关注。
阻滞胆固醇合成所需的他汀类药物浓度与抑制肿瘤细胞增殖所需的药物浓度不同,后者远远大于前者,而大剂量使用他汀类药物会产生一定的副作用如高血糖、肝酶升高、肌病等。因此恶性肿瘤临床治疗领域中他汀类药物的应用和推广受到一定限制。为了解决这一实际问题,许多学者研究了联合应用他汀类药物和化疗药物以期达到增效减毒的作用。Yandong Shi等[14]报道,对于乳腺癌细胞和肺癌细胞,洛伐他汀能通过作用于细胞DNA损伤和氧化应激而强化顺铂的抗肿瘤效应。杨士杰[15]对肝癌细胞SMMC-7721进行细胞毒实验,发现辛伐他汀和化疗药物吡喃阿霉素具有协同细胞毒作用。本实验中,按iobolanalysis公式,我们计算出普伐他汀联合紫杉醇的CI值及其联合顺铂的CI值都小于1,且前者小于后者,说明普伐他汀联合化疗药物后可协同这两种化疗药物的抑瘤作用并且对紫杉醇的协同作用较强。因此,普伐他汀联合紫杉醇、顺铂治疗激素非依赖性前列腺癌有望减少化疗药物的剂量,达到增效减毒的作用,这种作用在协同紫杉醇时更明显。但是,本实验只是体外实验结果,其临床应用有待进一步深入研究。
[参考文献]
[1] Siegel R,Naishadham D,Jemal A. Cancer statistics 2012[J].Cancer J Clin,2012,62:10-29.
[2] Ferlay J,Shin HR,Bray F,et al. Estimates of worldwide burden of cancer in 2008:Globocan 2008[J]. International Journal of Cancer,2010,127(2):2893-917.
[3] 唐志柳,白洁,顾丽娜,等. 2000~2010年我国前列腺癌和乳腺癌流行状况的系统性综述[J]. 中国肿瘤,2013, 22(4):260-265.
[4] Liu H,Wan g Z,Li Y,et al. Pravastatin prevents proliferation and bone metastases of lung adenocarcinoma in vitro and in vivo[J]. Neoplasma,2013,60(3):240-246.
[5] Shen YY,Yuan Y,Du YY,et al. Molecular mechanism underlying the anticancer effect of pravastatin on MDA-MB-231 human breast cancer cells[J]. Molecular Medicine Reports,2015,12(1):623-630.
[6] Osmak M. Statins and cancer:Current and future prospects[J].Cancer Lett,2012,324(1):1-12.
[7] Reboulleau A,Robert V,Vedie B,et al. Involvement of cholesterol efflux pathway in the control of cardiomyocytes cholesterol homeostasis[J]. J Mol Cell Cardiol,2012,53: 196-205.
[8] Garcia-Ruiz C,Morales A,Fernandez-Checa JC. Statins and protein prenylation in ancer cell biology and therapy[J].Anticancer Agents Med Chem,2012,12:303-315.
[9] W. Gibson Wood,Urule lgbavboa,Walter E. Muller,et al. Statins,Bcl-2 and Apoptosis:Cell Death or Cell Protection? [J]. Mol Neurobiol,2013,48(2):308-314.
[10] Chen J,Liu B,Yuan J,et al. Atorvastatin reduces vascular endothelial growth factor(VEGF) expression in human non-small cell lung carcinomas (NSCLCs) via inhibition of reactive oxygen species (ROS) production[J]. Molecular Oncology,2012,6(1):62-72.
[11] Zhu Y,Casey PJ,Kumar AP. Deciphering the signaling networks underlying pravastatin-induced apoptosis in human cancer cells:Evidence for non-canonical activation of RhoA and Rac1 GTPases[J]. Cell Death Dis,2013, 4(4):e568.
[12] Al-Haidaril AA,Syk l,Thoriacius H. HMG-CoA reductase regulates CCL17-induced colon cancer cell migration via geranylgeranylation and RhoA activation[J]. Bio-chem Biophys Res Commun,2014,446(1):68-72.
[13] Jeon CY,Pandol SJ,Wu B,et al. The association of statin use after cancer diagnosis with survival in pancreatic cancer patients:A SEER-Medicare analysis[J]. PLoS One,2015,10(4):e0121783.
[14] Yandong Shi,Felley-Bosco E,Marti TM,et al. Differential effects of lovastatin on cisplatin responses in normal human mesothelial cells versus cancer cells:implication for therapy[J]. PLoS One,2012,7(9):e45354
[15] 杨士杰. 辛伐他汀联合吡喃阿霉素对肝癌SMMC-7721细胞的协同抑制作用[J]. 现代肿瘤医学,2012,20(7):1343-1344.
(收稿日期:2015-12-03)

