蛇床子素对大鼠心室肌细胞钠通道的影响
许正新, 郑 雪, 朱 磊
(扬州大学医学院, 江苏 扬州, 225001)
蛇床子素对大鼠心室肌细胞钠通道的影响
许正新, 郑雪, 朱磊
(扬州大学医学院, 江苏 扬州, 225001)
摘要:目的探讨蛇床子素对大鼠心室肌细胞钠离子通道电流(I(Na))的影响。方法采用Langendorff 装置,恒压恒温灌流及酶解消化等方法对大鼠心肌细胞进行分离和处理。应用膜片钳技术,观察给予不同浓度蛇床子素(Ost)后钠离子通道电流特征的变化。结果Ost(>100 μmol/L)能明显抑制钠电流,其作用呈浓度依赖性(500 μmol/L几乎完全阻断)和时间依赖性(10 min左右抑制力达到最强)。100 μmol/L和300 μmol/L Ost使钠电流I-V曲线明显上移,峰值钠电流(-29.8±4.21) pA/pF分别降为(-20.1±3.7) pA/pF和 (-17.7±5.7 ) pA/pF (P<0.05),但激活电位和峰电位没有改变。对于钠通道失活曲线,不同浓度的Ost能使其向超级化方向移动,V(1/2)(空白,100 μmol/L,300 μmol/L)分别为(-81.10±0.35)、(-91.62±1.06)、(-100.60±0.21) mV (P<0.01)。Ost还能显著延长钠通道失活后恢复时间,τ(空白,100 μmol/L,300 μmol/L)分别为(15.09±0.78)、(23.41±1.23)、(31.62±0.97) ms (P<0.01)。结论Ost对大鼠心室肌钠通道电流有明显的抑制作用。
关键词:蛇床子素; 钠通道; 心室肌; 大鼠; 膜片钳
蛇床子素,又名甲氧基欧芹酚 (Ost),是从伞形科蛇床子属植物蛇床的果实中提取的一种香豆素类化合物,化学名称为7-甲氧基-8-异戊烯基香豆素,是蛇床子中含量最高(约1%)的一种烃基香豆素类有效化学成分[1]。研究[2-4]报道, Ost具有降低血压、抗心律失常、抑制心脏、扩张血管等一系列心血管药理作用。此外,该药对免疫系统、神经系统也能产生一定影响[5-6],同时具有抗菌[7-8]、止痒[9-12]等效应。本研究探讨蛇床子素对大鼠心室肌细胞钠离子通道电流(INa)的影响,现报告如下。
1材料与方法
1.1动物
SD大鼠(200~300 g),扬州大学比较医学中心提供,雌雄不拘。
1.2药品与试剂
蛇床子素购自成都普思生物科技有限公司,HEPES、牛磺酸、葡萄糖购自美国Sigma公司,胶原酶Ⅱ购自Worthington公司,其余均为国产分析纯。
1.3溶液配制
台氏液(mM): NaCl 135; KCl 5.4; MgCl21; CaCl21.8; HEPES 5; NaH2PO40.33; glucose 10; pH值用 NaOH调至7.30~7.40。无钙台氏液:台氏液中去除CaCl2即可。酶液: 无钙台氏液中加入0.4 g/L胶原酶Ⅱ, 1g/L的BSA和30 μmol/L的CaCl2。
KB液(mM): L-glutamic acid 70; KCl 25;taurine 10; NaH2PO410;
HEPES 5; glucose 11; EGTA 0.5(用KOH 调pH至7.30~7.40)。
细胞外液(mM): NaCl 5; CsCl 140; MgCl21; CaCl21; CoCl21; glucose 10; HEPES 10 (用CsOH调pH至7.30)。电极内液(mM): CsCl 133; NaCl 5; TEACl 20; EGTA 10; HEPES 10; MgATP 5 (用CsOH调pH至7.2)。
1.4大鼠心室肌细胞分离
整个大鼠心室肌细胞分离过程参照文献[13]并略作改进。大鼠腹腔注射肝素2 000 IU/kg, 约15 min后继续腹腔注射2%戊巴比妥钠(8 mL/kg)。麻醉成功后开胸迅速取下心脏置于预先以100% O2饱和的4℃台式液中,常规整理、清洗、固定,经主动脉行Langendorff 灌流。其程序为:先用台式液经主动脉逆行灌流约1 min,使心脏复跳排出心腔残留血液,继之以无钙台氏液灌流心脏约8 min,直至心脏停跳为止。最后用预先以纯氧饱和的酶溶液50 mL循环灌流20~30 min,直至心脏变得柔软、松弛,流出液浑浊并呈拉丝状。整个灌流过程在37℃恒温、灌流液中持续通纯氧的条件下进行。酶解消化结束后分离并剪碎心室组织,在KB液中轻轻吹打以游离出单个心室肌细胞,过滤得到细胞混悬液,贮存于KB液中,静置2 h后待用。期间重复换液3次。
1.5全细胞膜片钳记录
将细胞置于培养皿中静置10~20 min,待其贴壁后换用细胞外液进行灌流以除去残存的KB液。使用P-97水平拉制仪拉制玻璃微电极,电极入液电阻保持在2~3 MΩ,选用边缘完整、横纹清晰、表面光滑无颗粒感的细胞进行实验。串联电阻补偿60%。
1.6统计学方法
采用PatchMaster软件采集所记录电流,结合使用Origin70和graphpadprism5.1对数据进行转换分析以及拟合。以SPSS 16.0软件对实验数据进行统计处理,所有数据均以均数±标准差表示。显著性检验的标准为P<0.05。
2结果
2.1Ost对大鼠心室肌细胞INa影响的时间依赖性
保持电位-80 mV,给予指令电压为-30 mV,脉宽50 ms,频率0.5 Hz的方波单刺激,记录钠电流。由于电流记录之初(0~5 min),电流大小不稳定,所以不采集此段的数据。5~10 min后电流趋于稳定后观察给药前后INa峰值的大小。当100 μmol/L蛇床子素作用10 min之后,INa即明显减弱(降低31.6%)(图1A);随着药物剂量的增加,当300 μmol/L蛇床子素作用10 min之后,INa减弱更加明显(降低58.2%)(图1B)。使用正常的细胞外液灌流5 min,INa可部分恢复。由此证明,INa的减小是Ost对电流的抑制作用。
2.2Ost对大鼠心室肌细胞INaI-V曲线的影响
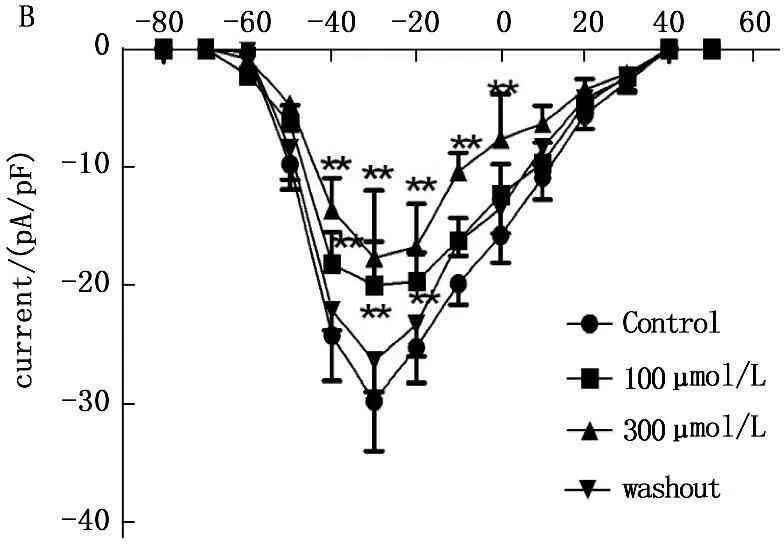
在电压钳模式下,保持电位-80 mV,给予-70~+40 mV、阶跃5 mV、持续时间30 ms的方波串刺激,刺激频率0.5 Hz,记录给药前后的INa(图2A),以电流密度对相应的电压作图,绘制出INa的I-V曲线(图2B)。Ost 可使INa的 I-V曲线显著上移,100 μmol/L和300 μmol/L蛇床子素使峰值钠电流(-29.8±4.21) pA/pF分别降为(-20.1±3.7) pA/pF and (-17.7±5.7 ) pA/pF (P<0.01), 但I-V曲线的形状、激活电位、峰电位和反转电位不改变。
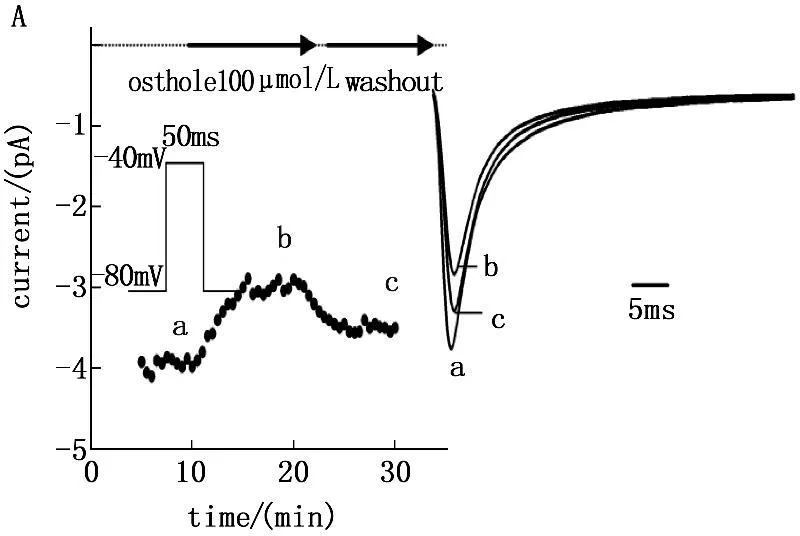
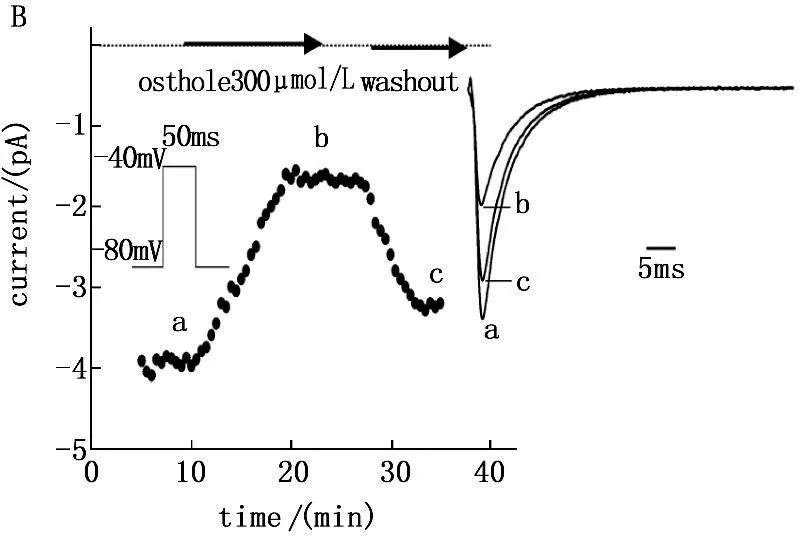
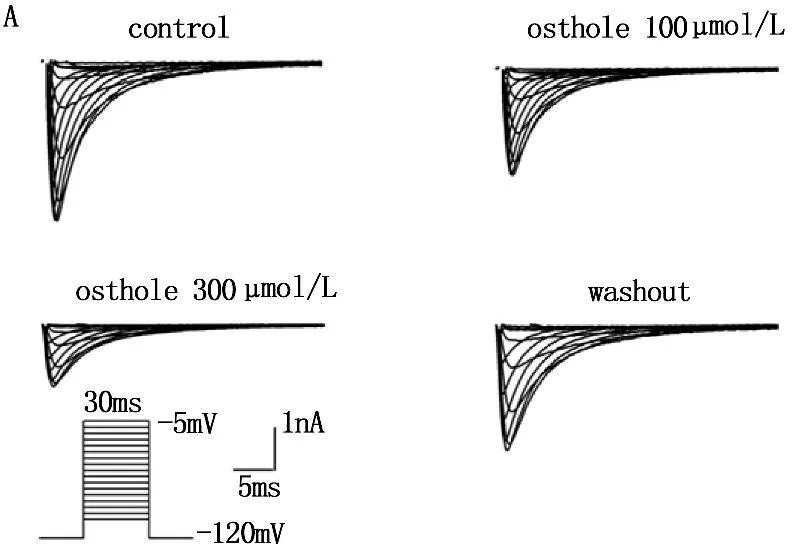
图1 100 μmol/L 和300μmol/L蛇床子素对INa抑制作用的时间依赖性
与对照组加药前比较, **P<0.01。
图2100μmol/L 和300μmol/L蛇床子素对INa影响的原始曲线及I-V曲线
2.3Ost对大鼠心室肌细胞INa影响的浓度
依赖性
刺激方案同2.1。采用累积加药法,分别观察 10、50、100、200、300、400、500 μmol/L Ost对大鼠心室肌细胞INa的影响(图3)。当Ost浓度为10 μmol/L和50 μmol/L时,其对INa无明显作用,但当浓度大于此值时,随着药物浓度的增加,对电流的抑制作用也随之增强,表现出明显的浓度依赖性抑制现象。
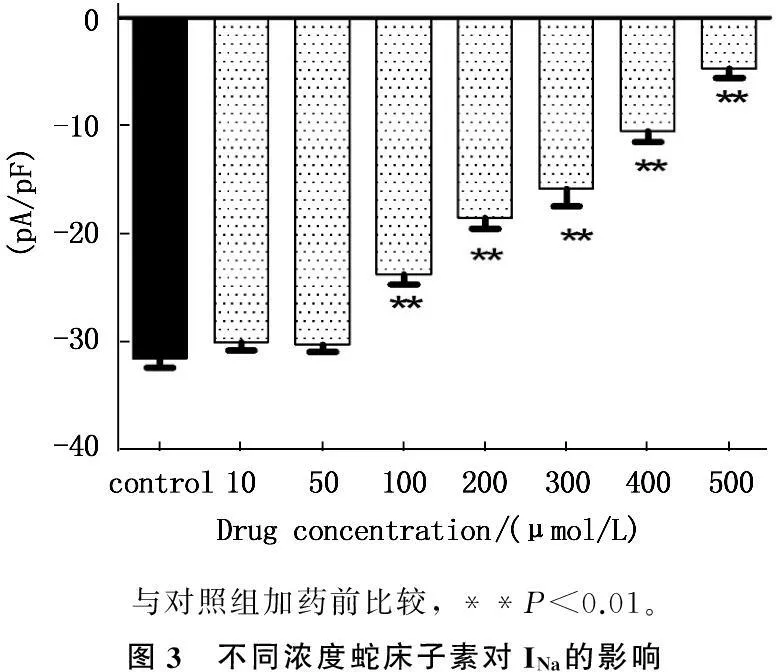
与对照组加药前比较,**P<0.01。图3 不同浓度蛇床子素对INa的影响
2.4蛇床子素对INa失活动力学的影响
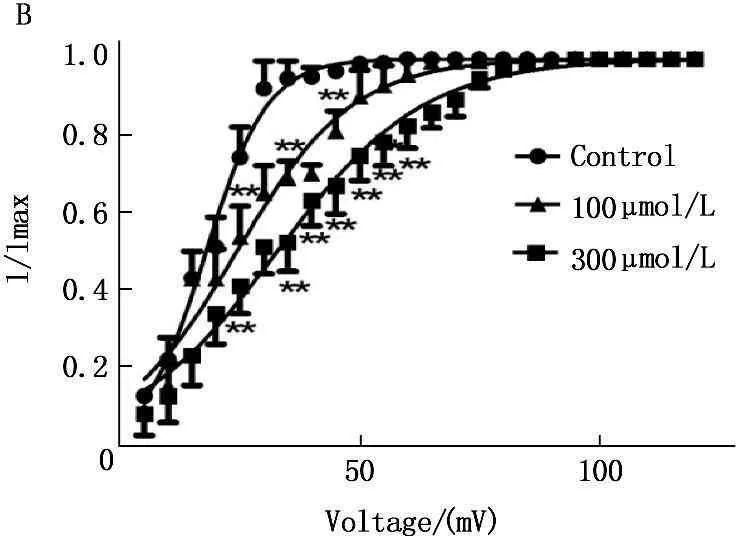
在电压钳模式下,采用双脉冲刺激法。保持电位-80 mV, 条件脉冲从-140 mV开始逐步去极化至+30 mV,阶跃10 mV,持续时间50 ms, 然后再给予去极化至-30 mV, 持续时间25 ms的测试脉冲,分别引导出给药前后INa的失活电流,以相对电流I/Imax对各膜电位作图,采用Boltzmann方程I/Imax =1/{ 1 + exp [ (V-V1/2)/k ] }进行拟合,得到稳态失活曲线,其中V1/2代表50 %通道失活时的条件脉冲电压, k为斜率因子。Ost能使INa的失活曲线显著左移,即向超极化方向移动,100 μmol/L 和300 μmol/L蛇床子素使V1/2由用药前的(-81.10±0.35) mV分别变为(-91.62±1.06) mV和 (-100.60±0.21) mV (n=10,P<0.01),k从(9.95±0.31) mV变为(9.93±0.18) mV(n=10,P>0.05)和(12.70±0.94 ) mV (P<0.01)。所以,Ost可明显改变INa的失活动力学特征,加快INa的失活。见图4和表1。
2.5蛇床子素对INa失活后恢复动力学的影响
在电压钳模式下,采用双脉冲刺激法,保持电位为-80 mV, 给予去极化至-30 mV的刺激,持续30、5 ms后,再给予去极化至-30 mV、30 ms的刺激,前后2个脉冲的间隔时间以5 ms的幅度逐渐增加,共20个脉冲。分别引出用药前后INa的复活电流,以相对电流I/Imax对时间间隔作图,用指数方程I/Imax=1-exp(-t/)拟合。t为两脉冲之间的时间间隔,为灭活后再激活(61.8%)的时间常数。Ost能使INa的失活后恢复曲线显著右移,由给药前的(15.09±0.78) ms变为(23.41±1.23) ms和(31.62±0.97) ms(P<0.01)。Ost可明显改变INa的失活后恢复动力学特征,使INa从失活态向激活态转变的时间延长。见图5和表1
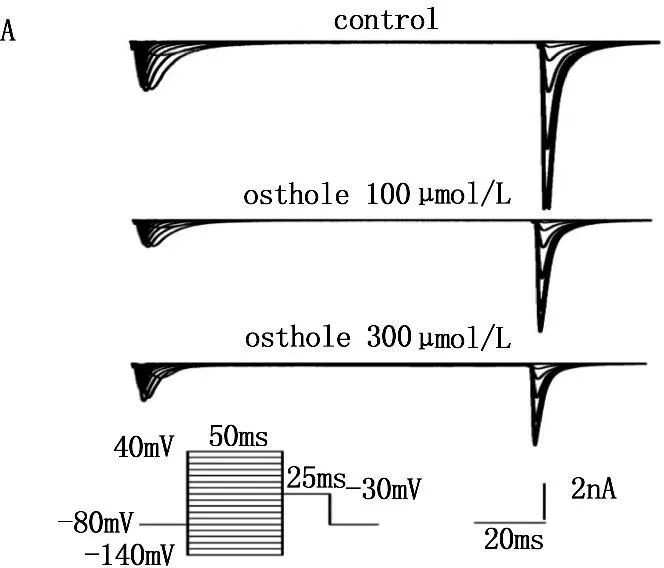
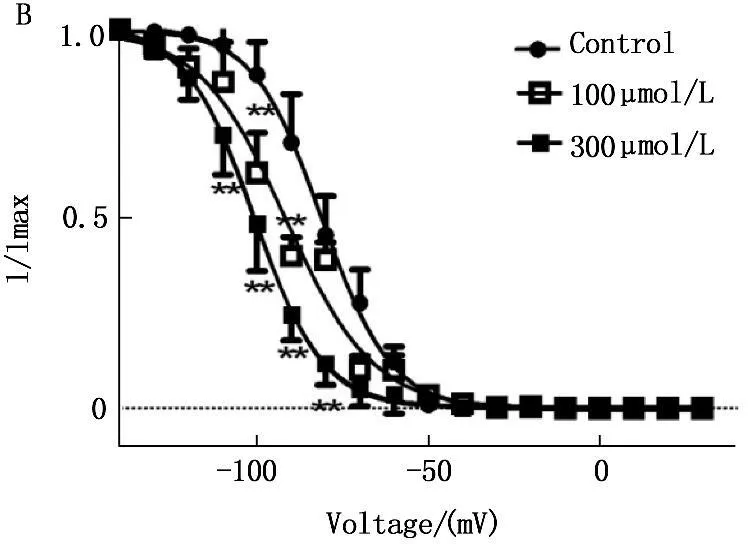

图4 蛇床子素对INa失活曲线的影响
与空白相比, *P<0.05, **P<0.01。
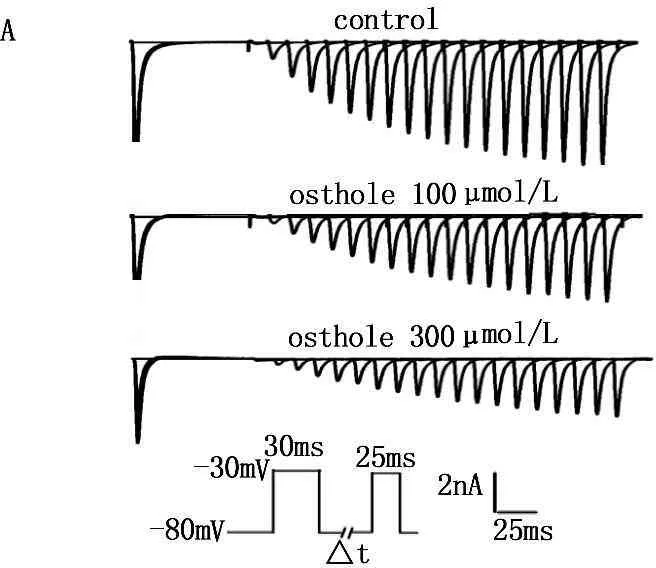
与对照组加药前比较, **P<0.01。
图5蛇床子素对INa失活后恢复曲线的影响
3讨论
目前有关Ost对离子通道影响的报道还较少,袁春华等[10]证实了Ost能抑制多种钙通道亚型并表现出不同的亲和力。近年来,随着电生理技术的发展,尤其是膜片钳技术的应用,使人类有能力从分子水平来探讨离子通道的结构和功能,以及其与疾病的关系。研究表明,心肌细胞上离子通道与很多心血管系统疾病有相关性。
钠通道是选择性允许Na+跨膜通过的离子通道,主要是电压门控离子通道,其功能是维持细胞兴奋性及其传导。在心脏、神经和肌肉细胞,动作电位始于快钠通道的激活,钠离子内流引起动作电位的0期去极化。INa异常会导致一系列的心律失常。本实验采用全细胞膜片钳技术观察了蛇床子素(Ost)对大鼠心室肌细胞INa幅值、I-V曲线及其失活和恢复动力学的影响。结果表明,Ost可以浓度依赖性地抑制钠电流。其中,100 M Ost可使INaI-V曲线明显上移,但并不改变I-V曲线的激活电位、峰电位和反转电位,提示Ost在不同膜电位水平对INa具有均匀一致的抑制作用。Ost使INa的失活曲线显著左移,即向超极化方向移动,加快钠通道的失活。而对失活后恢复曲线则使其显著右移,使INa从失活态恢复的时间延长。此外,Ost对钠电流的抑制作用还具有浓度依赖性,在100~500 μmol/L范围内,随着药物浓度的增加,抑制作用逐渐增强。此分子水平的实验结果与整体实验[3,14]中Ost的作用相一致,可以部分解释其抗心律失常效应的作用基础,从而为该药及其同类药物的进一步开发、应用及指导临床合理用药提供相应的理论依据。
关于受Ost影响的钠通道的状态,综合整个实验结果,作者发现Ost对激活、失活、失活后恢复等过程均有影响。说明该药不仅作用于钠通道的静息状态或激活状态,对通道的失活也有抑制作用,故Ost对钠通道的不同状态都是存在一定的抑制作用,只是亲和力不同或者结合与解离的速度不同[15]。作者通过直接在细胞外液中加入药物来观察Ost对钠通道的影响,还可以考虑通过在电极内液中加入同样浓度的Ost来比较内、外部给药作用的差别,以此来判断药物与通道的结合位点是更靠近膜内侧还是外侧。
Ost为中国传统中药蛇床子中的提取物,研究发现其对心血管系统的影响,包括其抗心律失常作用。Ost对氯仿诱发的小鼠室颤、CaCl2诱发的大鼠室颤均有明显的预防作用,对乌头碱诱发的大鼠心律失常也有疗效。Fabio F等[16]实验结果表明,Ost对血管平滑肌细胞的Ca2+通道具有抑制作用。关于Ost的确切作用机制或其对离子通道的直接影响尚不清楚。由于心律失常发生的机制非常复杂,有众多的离子通道参与,临床上的一系列抗心律失常药物可分别从钠通道、钾通道和钙通道等途径发挥相关的作用。因此,本研究从心肌钠离子通道方面探讨Ost对该通道的影响具有重要的现实意义。
参考文献
[1]张开臣, 李 梅. 蛇床子总香豆素组分的含量测定[J]. 中国中医药信息杂志2010, 17(5): 45.
[2]Yao L, Lu P, Li Y, et al. Osthole relaxes pulmonary arteries through endothelial phosphatidylinositol 3-kinase/Akt-eNOS-NO signaling pathway in rats[J]. Eur J Pharmacol, 2013, 699 (1/2/3): 23.
[3]沈丽霞, 金乐群, 张丹参, 等. 蛇床子素的抗实验性心律失常作用[J]. 张家口医学院学报, 2001, 18(1): 9.
[4]Zhou F, Zhong W, Xue J, et al. Reduction of rat cardiac hypertrophy by osthol is related to regulation of cardiac oxidative stress and lipid metabolism[J]. Lipids 2012, 47(10): 987.
[5]杨大朋, 王海啸, 彭延延, 等. 蛇床子素对人乳腺癌细胞增殖、细胞周期及凋亡的影响[J]. 南京师大学报, 2010, 33(2): 76.
[6]宋美卿, 冯玛莉, 贾力莉, 等. 蛇床子的镇静催眠作用、宿醉反应和耐受性[J]. 现代药物与临床, 2010, 25(1): 41.
[7]冯 锋, 杨建宏, 张俊威. 蛇床子提取物抗解脲支原体作用的研究[J]. 时珍国医国药, 2008, 19(9): 2105.
[8]李 宁, 杨小红. 蛇床子有效成分对金黄色葡萄球菌凝固酶活性的影响[J]. 广东医学, 2007, 28(6): 876.
[9]刘明平, 吴依娜, 韦品清, 等. 蛇床子止痒有效组分筛选及作用机制研究[J]. 中医药导报, 2009, 15(7): 66.
[10]Yuan C H, Li B X, Sun LR, et al. Effect of Osthole on L-and N-type Calcium Channels[J]. Progress Modern Biomedcine, 2011, 11(15): 2806.
[11]Nikolaidou T, Cai XJ, Stephenson RS, et al. Congestive Heart Failure Leads to Prolongation of the PR Interval and Atrioventricular Junction Enlargement and Ion Channel Remodelling in the Rabbit[J]. PLoS One, 2015, 10(10): 1.
[12]刘泰摇. 心肌细胞电生理学[M]. 北京: 人民卫生出版社, 2005: 2.
[13]Monika S S, Bartosz G, Adam S, et al. Isolated heart perfusion according to Langendorff—Still viable in the new millennium [J]. Journal of Pharmacological and Toxicological Methods, 2007, 55(2): 113.
[14]Li SJ, Sun LR, Yuan C H. Effects of osthole on sodium channel in rat ventricular cardiomyocytes [J]. Journal of mathematical medicine, 2011, 24(3): 286.
[15]Hondeghem L M, Katzung B G. Time and voltage-dependent interactions of antiarrhythmic drugs with cardiac sodium channels[J]. Biochim Biophys Acta, 1977, 472(3/4): 373.
[16]Fabio Fusi, Giampietro Sgaragli, Le MH, et al. Mechanism of osthole inhibition of vascular Cav1. 2 current[J]. European Journal of Pharmacology, 2012, 680(1/2/3): 22.
Effect of osthole on sodium channels of ventricular myocytes in rat
XU Zhengxin, ZHENG Xue, ZHU Lei
(MedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
ABSTRACT:ObjectiveTo explore the effect of osthole on sodium channel current of ventricular myocytes in rats. MethodsCardiomyocytes were enzymatically dissociated from SD rats by Langendorrf with constant pressure and temperature. Whole-cell patch clamp techniques were used to evaluate the changes of sodium channel current characteristics at different concentrations of osthole. ResultsOsthole (>100 μmol/L) inhibited sodium current in a concentration-dependent (500 μmol/L almost blocked completely) and time-dependent manner (it blocked sodium current quickly and the strongest inhibition appeared 10 minutes later). The I-V curves of the sodium current raised obviously with the peak current density from (-29.8±4.21) pA/pF to (-20.1±3.7) pA/pF and (-17.7±5.7 ) pA/pF (P<0.01) at concentration of 100 μmol/L and 300 μmol/L, but the activation potential and peak potential did not change. In addition, osthole at different concentration caused significant hyperpolarizing shifts in voltage-dependent channel inactivation of I(Na). 100 μmol/L and 300 μmol/L Ost shifted the V(1/2) of I(Na) from (-81.10±0.35) mV in control to (-91.62 ±1.06) mV and (-100.60±0.21) mV. Ost could significantly prolong the sodium channel recovery time from inactivation with τ increasing from (15.09±0.78) ms in control to (23.41±1.23) ms and (31.62±0.97) ms (n=10, P<0.01). ConclusionOsthole can significantly inhibit sodium current of ventricular myocytes in rat.
KEYWORDS:osthole; sodium channel; ventricular myocytes; rats; patch clamp
中图分类号:R 542.2
文献标志码:A
文章编号:1672-2353(2016)07-001-05
DOI:10.7619/jcmp.201607001
基金项目:国家自然科学基金资助项目(NO. 31071171)
收稿日期:2015-11-20

