生脉处方小鼠抗应激试验及最佳提取工艺
肖 燕,陈莉萍,陈玲琳,何 兴,何宇新
(西华大学食品与生物工程学院,四川 成都 610039)
·生物工程·
生脉处方小鼠抗应激试验及最佳提取工艺
肖燕,陈莉萍,陈玲琳,何兴,何宇新*
(西华大学食品与生物工程学院,四川 成都 610039)
摘要:研究生脉处方不同提取方式的提取液药效差异,确定最优提取工艺。以人参皂苷Rg1、Re含量,干膏收率,小鼠抗应激反应试验药效差异,比较生脉处方提取方式差异,再根据实际选择适宜提取方法;通过正交试验与验证,结合HPLC法含量测定,确定所选提取方法的最佳提取工艺。结果表明:生脉醇提1与生脉醇提2相比较,在小鼠的常压耐缺氧试验、游泳试验下,统计结果均无显著差异,但是与生理盐水组比较,生脉醇提组中、大剂量都具有显著差异;主药含量及干膏收率生脉醇提2均高于生脉醇提1;确定提取方法为直接乙醇回流提取,因素由主到次为ACDB,即影响因素由大到小顺序为乙醇倍量>提取次数>乙醇体积分数>提取时间,最佳组合为A3C3D2B1,根据生产实际优化提取条件为A2C3D2B2,验证试验稳定可靠,最终确定醇提条件为65 %乙醇8倍量回流提取3次,每次1.5 h。可知生脉制剂的五味子挥发油工艺可选择性省去,以简化工艺步骤,具有社会性与经济性意义,可为解决生产实际问题和后续研究提供参考依据。
关键词:生脉;提取工艺;抗应激试验
生脉散起源于《内外伤辨惑论》,以人参、麦冬、五味子为方,具有益气生津,敛阴止汗的功效,疗效显著,是中医治疗气阴两虚证的基本方[1]。现代生脉制剂是以这3味药材为基加减配方,运用现代提取工艺制成,具有辨证论治、随证加减的优点,又克服了汤剂煎汤麻烦、保存不便的缺点[1-2]。经查找相关文献,已有成熟标准的生脉制剂提取方法有水煎煮法、水提纯沉法、乙醇渗漉法与回流提取法,部分醇提法涵括水蒸气蒸馏提取五味子挥发油并进行包合[3-5]等工艺,耗时耗能,乳化严重,提取率低,在大工艺生产中尤为显著。五味子挥发油药理药效报道中,其主要药效为镇咳,并无相关文献对其在生脉制剂中的挥发油提取必要性进行对比研究;因此笔者对生脉制剂中五味子挥发油提取必要性进行初步抗应激药效及主要有效成分含量变化考察,并比较、优选最佳提取工艺,以期简化工艺步骤,在保证疗效的前提下,为生脉制剂适宜实际生产等问题提供技术支持。
1材料与方法
1.1仪器与材料
仪器:Waters e2695-2487高效液相色谱仪(美国Waters公司);Sartorius BT 125D电子天平(鹤壁市鑫运仪器设备有限公司);RE-52C旋转蒸发器(上海亚荣生化仪器厂);HH-S数显恒温水浴锅(江苏省金坛市医疗仪器厂) ;KQ超声波清洗仪(东莞嘉劲机械有限公司)。
药效试验提取液:水提生脉散(含生药约0.65 g·mL-1)、醇提生脉散1(挥发油包合[3-4],含生药约0.65 g·mL-1)、醇提生脉散2(直接提取,含生药约0.97 g·mL-1)。药液组提取工艺为:药材240 g;溶媒纯水、65 %乙醇;第1次8倍量1.5 h,第2次6倍量1 h,第3次4倍量1 h提取;滤过后浓缩至相对密度(60 ℃)1.1~1.2,定容至250 mL而得。参照文献[3-4]进行挥发油提取包合。
试剂:人参皂苷对照品Rg1、Re(中国药品生物制品检定研究院,批号:110703-201128;110754-200822),甲醇、乙腈为HPLC纯,超纯水,磷酸、正丁醇为分析纯。
动物:健康KM小鼠(由成都中医药大学动物实验中心提供),体质量(20±2) g,雌雄各半。在温度为(22±2) ℃,湿度40 %~60 %,12 h光照交替的环境中进行适应性喂养,自由进食标准饲料、摄水。
1.2试验方法
1.2.1色谱条件与系统适应性
色谱柱:Cromasil C18柱(250 mm×4.6 mm,5 μm),检测波长203 nm,流速1.0 mL/min,柱温30 ℃,进样量10 μL。流动相:乙腈-0.1 %磷酸溶液(21∶79)[6]。系统适用性:以人参皂苷对照品Rg1色谱峰计,理论塔板数不小于6 000。
1.2.2溶液配制
对照品混合溶液:取人参皂苷Rg1、Re对照品适量,精密称定,加甲醇稀释定容制成每1 mL各含0.25 mg的混合对照溶液,冷藏备用[7]。
供试药液的制备:各量取待测提取药液10 mL,加水饱和正丁醇振摇提取4次(15、15、10、10 mL);合并正丁醇提取液,瓷坩埚内水浴蒸干,残渣加甲醇溶解,转移至25 mL量瓶,瓷坩埚用甲醇淌洗3次,转移至量瓶用甲醇稀释定容[7],备用;进样前用0.45 μm有机微孔滤器滤过,进样10 μL于色谱系统进行主要有效成分测定。
1.2.3方法学考察
按照上述方法配制混合对照溶液,于HPLC进样记录系统适应性,根据要求适当调节流动相比例至所记录的色谱图满足规定的理论踏板数要求。
1)系统适应性与线性关系试验。根据适应性要求取对照溶液进样,调整色谱系统以使理论踏板符合要求;再重复进样混合对照溶液,记录系列进样体积下的色谱结果,以峰面积对进样量作线性回归曲线并得出回归方程,以考察线性相关性是否良好。
2)精密度与稳定性考察。取上述对照品混合溶液,记录不同时间点进样的色谱结果,并分析各次进样峰面积的RSD值;再取对照品混合溶液连续重复进样得到色谱结果,计算RSD值,以判断所用实验条件是否良好。
1.2.4药物组提取液干膏收率及主药含量测定
1)主要含量测定:按照1.2.2节所述方法制备待测供试样品溶液后,采用系统适应性下相同色谱方法,精密进样并记录主药有效成分峰面积。
据统计,目前单个GenBank数据库中的流感数据就超过25万条,并且这个数据随着时间的推移,将不断增长。病毒序列的字段信息一般由数千个字符组成,最长可达百万个字符。为降低单个数据表的大小,这里将各种序列信息单列成为与其基本表关联的单表。
2)干膏收率:取空坩埚于105 ℃烘干至恒重,记录恒重的空坩埚质量m。量取一定体积待测提取药液于恒重的空坩埚,置于水浴锅蒸干;再放入105 ℃烘箱烘干约5~6 h,取出放入干燥器约20 min,称量并记录称量数据,再多次重复直至恒重(两次称重差异小于0.003 g),记录最后称重数据M;干膏收率为(M-m)×定容体积/(取用体积×生药量)×100%。
1.2.5小鼠抗应激反应药效试验
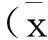
1)对小鼠常压耐缺氧时间影响试验。给药结束6 h后,按每瓶1只将小鼠分别放入250 mL广口瓶内(内装25 g钠石灰),以凡士林密封瓶口,加盖立即计时,直至小鼠呼吸停止[8-10]。以小鼠在广口瓶内窒息时间作为耐缺氧时间,比较供试组小鼠耐缺氧时间差异[9-10],以生理盐水作空白对照。
2)对小鼠游泳时间的影响试验。将小鼠放入室温28 ℃,水温18 ℃,90 cm×45 cm×30 cm深水池中游泳,记录小鼠放入水池游泳至鼻子不能露出水面游不动并开始下沉的时间。
1.2.6优选提取方法下的最佳提取工艺试验
处方比例:人参∶麦冬∶五味子=3∶3∶2(质量比)。由抗应激药效试验确定采用的提取方法:乙醇直接回流提取,药材粉碎过10目。参照药典标准及相关文献,选定提取因素为:乙醇体积分数、乙醇倍量、提取次数设计因素水平表,L9(34)如表1所示。选用干膏收率和人参皂苷Rg1、Re含量作为评价指标,权重系数分别按0.4、0.6来计算,确定最优提取工艺。再对优化的最佳工艺条件验证,进行3次重复提取,以考察工艺稳定性。
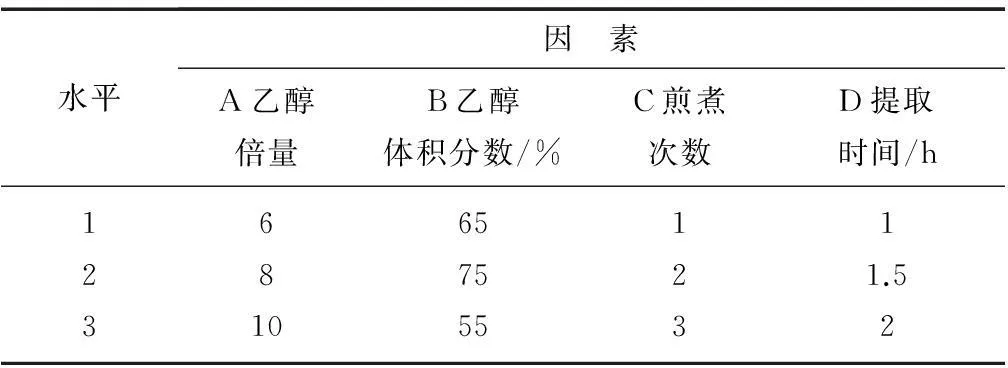
表1 乙醇回流提取工艺因素水平表
2结果与讨论
2.1系统适应性与方法学试验结果及分析
2.1.1色谱系统适应性结果与线性关系结果
试验所用色谱系统,在符合理论塔板数要求的前提下,要保证尽可能大的分离度,而保留时间又不至于太长,最终调整流动相比例为21∶79,得到系统适应性理论塔板数均为规定数的2倍以上,远高于6 000,如表2所示。
用峰面积对进样量作线性回归,得到人参皂苷Rg1在0.392~2.352 μg与峰面积线性方程为y=105x+4 257.7,相关系数R2=0.999 5,R=0.999 7;人参皂苷Re在0.4~2.4 μg与峰面积线性方程为y=69 403x-5 748.6,相关系数R2=0.999 9。说明对照品在该方法系统下,各自进样量范围内均具有较好的线性相关性,条件可靠稳定,如表3所示。
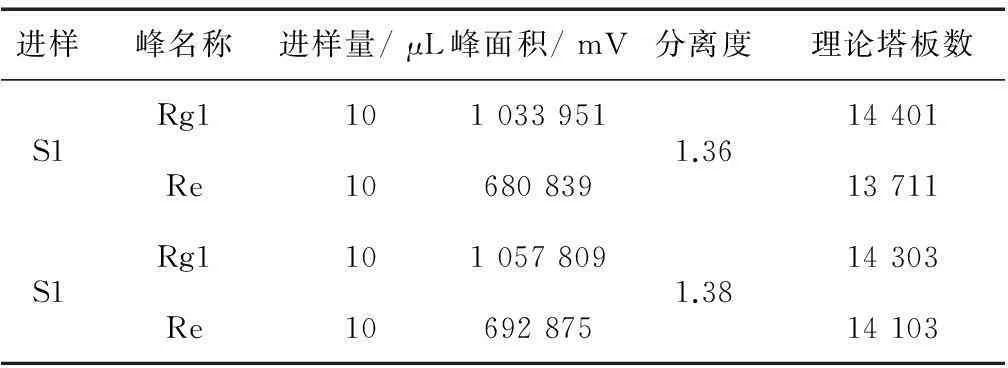
表2 色谱系统适应性结果
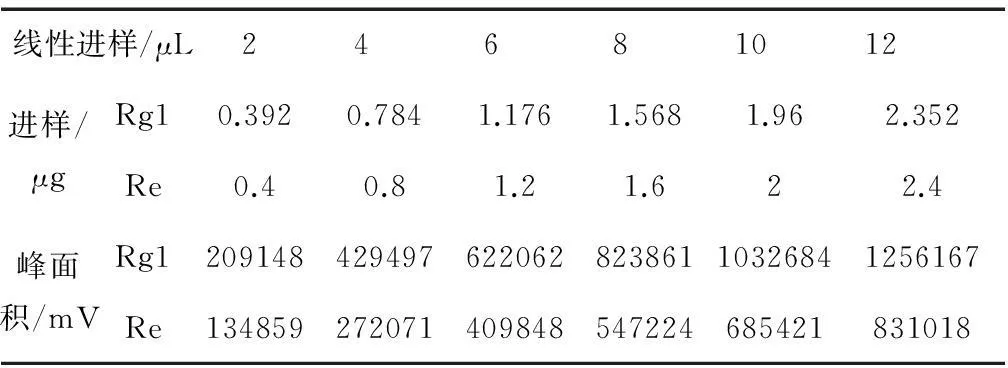
表3 线性关系考察
2.1.2对照品稳定性试验与精密度试验结果
2.2药物组提取液干膏收率及主药含量结果分析
由表5干膏收率得知,水提方法干膏收率高,因为胶质、鞣质类水溶性杂质成分较多,有效成分提取率低,由主药色谱峰高很低可知,也证实文献相关报道的醇提优于水提的结论。醇提2总体优于醇提1,干膏收率合适,主药含量Rg1高,Re略低,确定生脉处方适宜提取方法为直接乙醇回流提取,五味子挥发油提取步骤可省去,简化工艺流程。
2.3小鼠抗应激反应药效试验结果分析
由提取挥发油并包合制成的生脉提取液与直接提取的生脉醇提液的小鼠抗应激反应药效试验(结果见表6)可知:试验药物组中、高剂量与阴性对照组有明显统计差异,说明药物具有耐缺氧,提高耐力作用;剂量组由小到大,中剂量优于小剂量,高剂量略高于或低于中剂量,可能高剂量使小鼠适应性不良或剂量超过正常承受导致不良反应所致;醇提1与醇提2在小鼠的耐缺氧试验、游泳试验比较下,时间亦无明显差异,醇提2稍优于醇提1。以简化生产工艺操作又不失药效作用为前提,可以考虑合并五味子共提,省去挥发油提取包合步骤。
2.4醇提工艺最佳条件试验结果与分析
由表7可知,以极差大小确定因素主次为ACDB,即乙醇倍量>提取次数>乙醇体积分数>提取时间。按评分最高为优,可得出最优组合为A3C3D2B1。综合各能源生产因素,A2、A3差异不大,为节约溶剂,选择A2;乙醇体积分数不是影响最大因素,从节约成本出发,选择B2。因此优选出组合A2C3D2B2为最佳提取条件。由最佳工艺条件的验证结果(见表8)可知,与表7中最优工艺条件所得试验结果基本一致,本试验中所得最佳提取工艺稳定可靠,具有重复可操作性。最终确定本试验生脉处方最佳醇提工艺为8倍量65%乙醇回流提取3次,每次1.5 h。
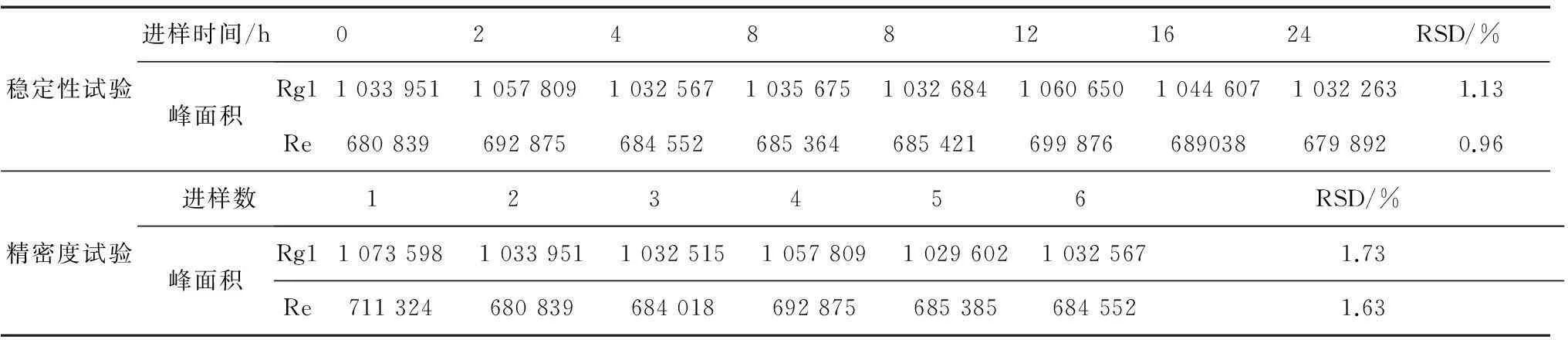
表4 稳定性与精密度试验结果
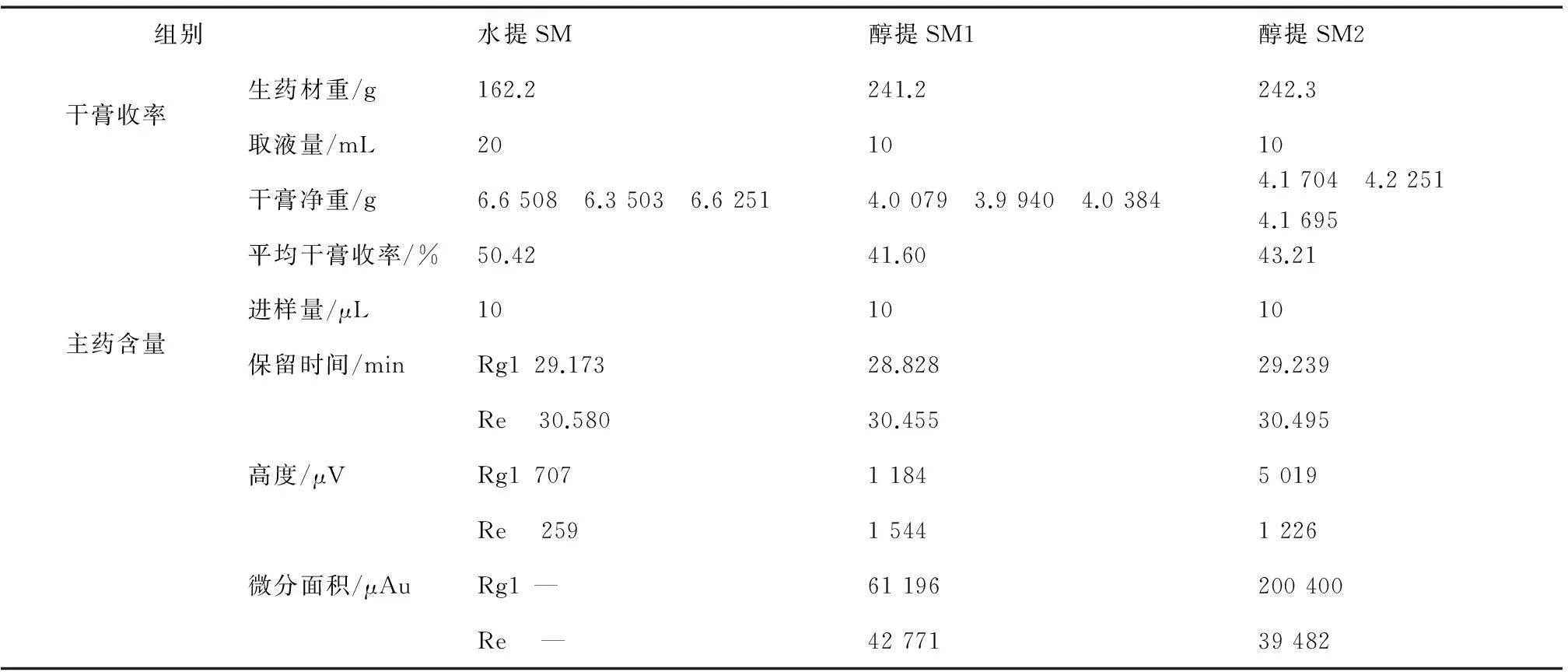
表5 不同提取方式生脉药液干膏收率与主药含量比较
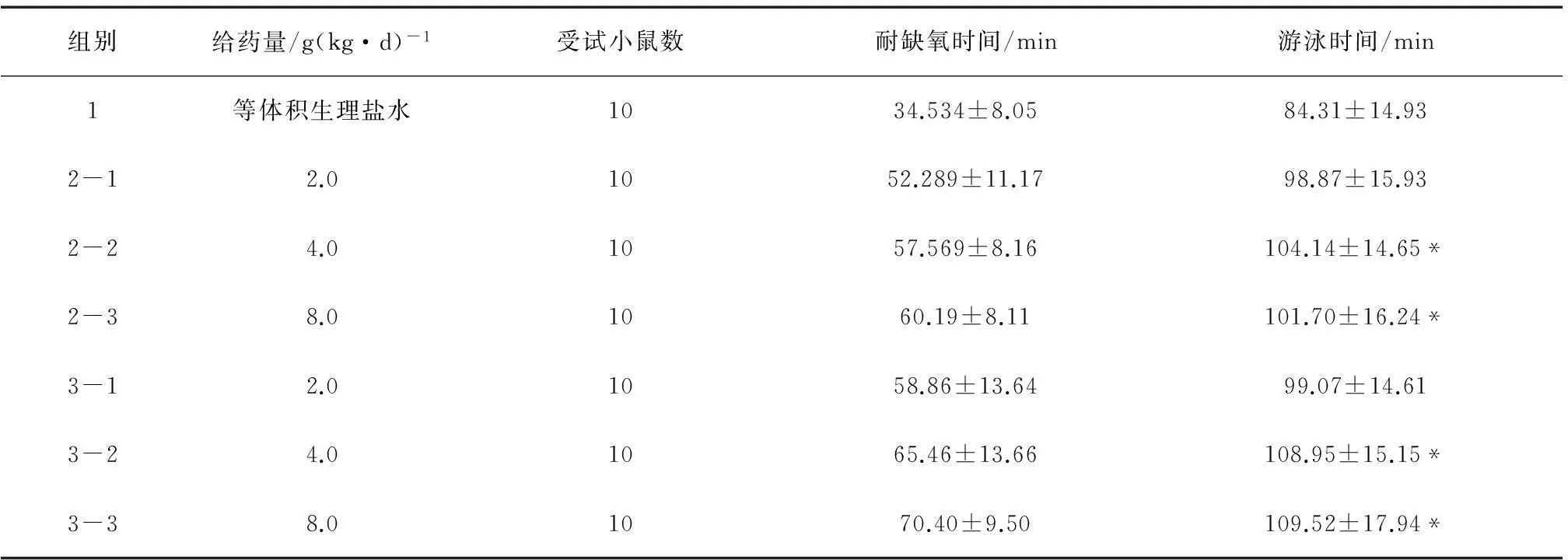
表6 两种生脉提取液的抗应激试验结果
注:与生理盐水组对照,抗应激试验统计结果以P<0.05具有显著性差异,标注*;P<0.01具有极显著差异,标注**。
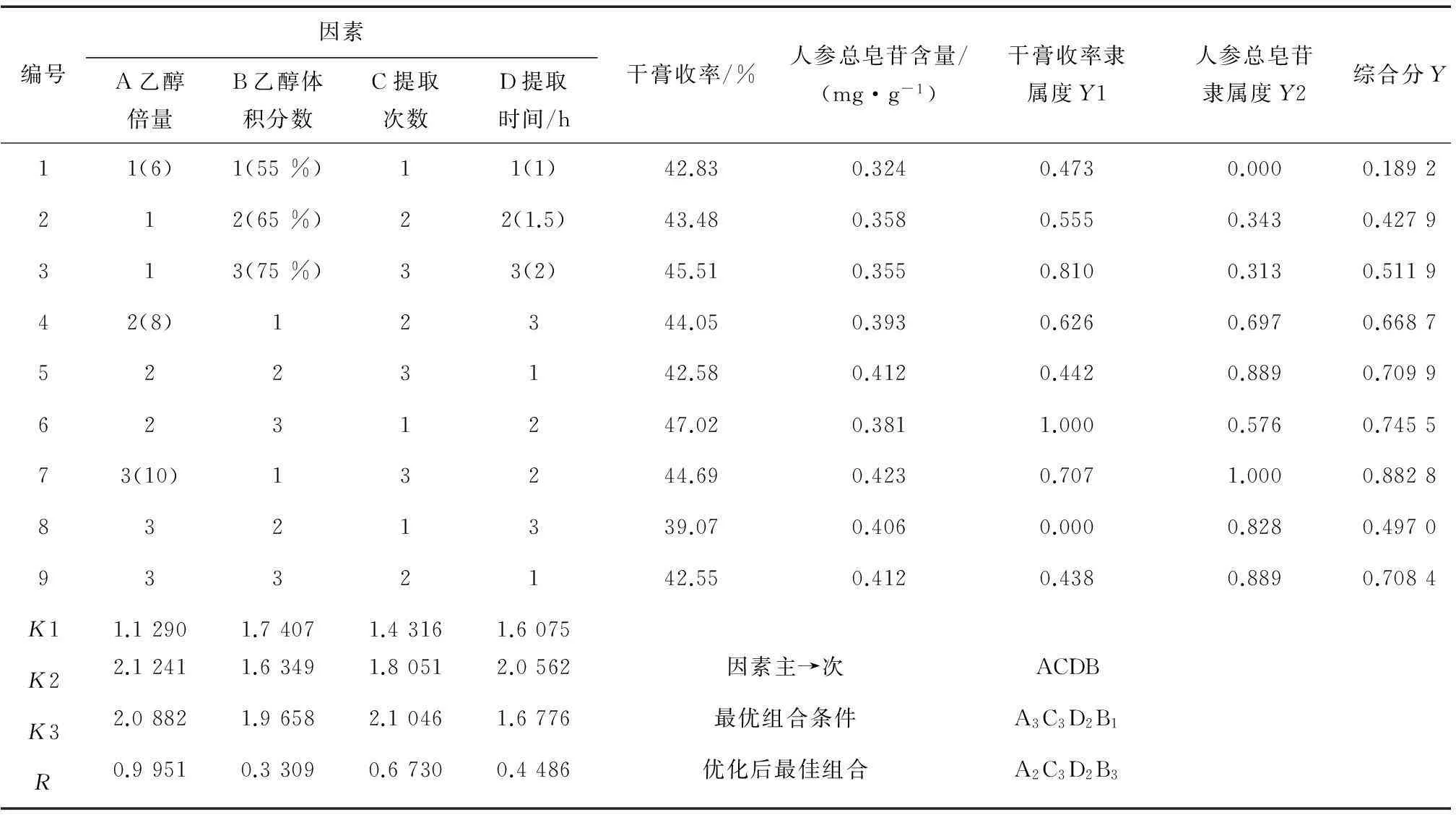
表7 醇提工艺最佳条件优选结果
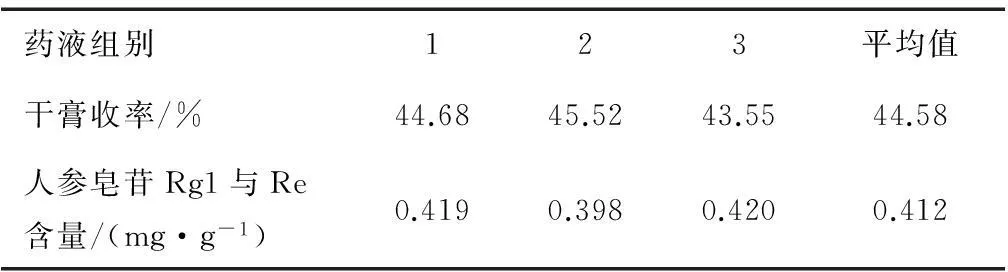
表8 最佳醇提工艺验证试验结果
3结论
本试验小鼠抗应激反应药效对比试验中,生脉制剂与空白生理盐水组比较有显著差异,说明生脉制剂可以提高抗应激反应水平;但挥发油提取后的生脉制剂与不提挥发油的生脉制剂无明显的药效差异,主要有效成分含量也无明显差异。据此生脉制剂中的五味子挥发油提取包合工艺可根据适用症差异辩证选择,可以简化工艺步骤,可为解决生决生产实际问题提供参考。所选出的最优提取工艺条件具有一定稳定性,可以为后续放大生产试验以及配方颗粒制剂工艺试验提供参考。
参考文献
[1]张加雄,王凌.生脉散配方颗粒的提取工艺研究[J].西南国防医药,2010,20(4):359.
[2]胡昌江,刘俊达,李兴华,等.理中汤配方颗粒提取工艺研究[J].中国药业,2006,15(6):27.
[3]姜宁华,吴素香,宋晓筠. β-环糊精包合五味子挥发油的工艺研究[J]. 浙江中医杂志,2009(6):460.
[4]肖学凤,高敏燕,高岚,等. β-环糊精包合五味子挥发油工艺的研究[J]. 天津中医药,2007(6):512-514.
[5]何宇新,李玲,米之金,等. 川芎挥发油的质量标准研究[J]. 西华大学学报(自然科学版),2009,28(3):72.
[6]付娟,李家春,张海弢,等. HPLC-ELSD法同时测定益心舒片中人参皂苷Rg1、Re、Rb1的含量[J]. 广东药学院学报,2015(1):62.
[7]国家药典委员会.中华人民共和国药典2010年版:一部[S].北京:中国医药科技出版社,2010.
[8]张宝香,杨秀芬.鹿茸软胶囊抗应激作用研究[J].特产研究,2006,28(4):49.
[9]李富盛.淫羊藿总黄酮的抗缺氧药理作用及机制研究[D].兰州:兰州大学,2009.
[10]焦士蓉,唐远谋,冯慧,等. 石榴皮提取物对实验性糖尿病小鼠肝脏抗氧化防御功能的影响研究[J]. 西华大学学报(自然科学版),2014,33(1):35.
(编校:叶超)
Research of Shengmai Prescription on Anti-stress Test and Optimum Extraction Technology
XIAO Yan,CHEN Liping,CHEN Linglin,HE Xing,HE Yuxin*
(SchoolofFoodandBioengineering,XihuaUniversity,Chengdu610039China)
Abstract:Objective to investigate the pharmacodynamic action contrast of pulse-activating prescription extracted in different extraction methods and then determine the optimal extraction process. Method 1)content of active ingredients ginsenosides Rg1,Re,dry ointment yield and mouse anti-stress reaction test was conducted to study pharmacodynamic differences between the two alcohol extraction then preferably extraction method was chose;2) orthogonal test and HPLC method were adopted to determine the optimum extraction process of preferred extraction method. Result with alcohol extraction 1 and 2 under normal pressures anti-anoxia ability, swimming test , the content and the reaction were no significantly difference; by comparison of main drug content and dry ointment yield, the content and the reaction of alcohol extraction 2 were higher than that of alcohol extraction 1;extraction method was direct ethanol reflux extraction, influence factors from the main to the secondary was ACDB, namely influence factors in descending order was the amount of ethanol times, extraction times, volume fraction of ethanol and extraction time. The best combination was A3C3D2B1, under actual production condition the optimization was A2C3D2B2, and verification tests results show the stability and reliability, and final extraction process was 8 times the amount of 65% ethanol, extracted three times and 1.5 hours for each time. Conclusion Schisandra volatile oil extraction process of pulse-activating preparation can be selectively eliminated to simplify the whole processing steps with social and economic significance and this work can provide a reference and basis for solving practical problems in production and further study.
Keywords:pulse-activating; extraction process; anti-stress test
doi:10.3969/j.issn.1673-159X.2016.02.014
中图分类号:R284.1;R285.5
文献标志码:A
文章编号:1673-159X(2016)02-0072-5
*通信作者:何宇新(1976—),男,教授,博士后,硕士研究生导师,主要研究方向为天然药物制剂及功能性保健食品药品研究与开发。E-mail:524225843qq.com.
基金项目:“西华杯”大学生科技创新项目训练计划(2014129)。
收稿日期:2015-03-20

