应用PCR-反向点杂交技术快速检测结核分枝杆菌耐药突变基因
彭亦平 宗佩兰 辛茶香 熊国亮 胡群芳 袁小兰 史安良 姚琳 王小路 万赞燕 吴娟
·论著·
应用PCR-反向点杂交技术快速检测结核分枝杆菌耐药突变基因
彭亦平 宗佩兰 辛茶香 熊国亮 胡群芳 袁小兰 史安良 姚琳 王小路 万赞燕 吴娟
目的 评价PCR-反向点杂交技术在检测结核分枝杆菌耐药突变基因中的应用价值。方法 选取2014年8月至2015年12月江西省胸科医院住院的部分肺结核患者作为研究对象,共1071例。研究对象均送检了痰液标本,共1071份。所有患者均经病原学或病理学证实,或符合菌阴肺结核诊断标准。采用PCR-反向点杂交技术对研究对象痰标本进行异烟肼(H)、利福平(R)、链霉素(S)、乙胺丁醇(E)耐药基因检测,并以痰培养阳性标本的药物敏感性试验(简称“药敏试验”)检测结果作为金标准,来验证检测结果的可靠性及评价其检测效能。结果 PCR-反向点杂交检测的1071例患者中,596例结核分枝杆菌阳性,阳性率为55.65%。其中,218例(36.58%)检出H、R、S、E耐药基因突变,分布于所测13个位点。H、R、S、E最常见突变位点分别位于KatG的315M(82.53%,137/166)、rpoB的S531L(69.50%,98/141)、rpsl的43M(78.65%,70/89)、embB的306M2(55.13%,43/78)和306M1(39.74%,31/78)。433例患者标本同时行结核分枝杆菌培养,培养阳性且同时PCR-反向点杂交检测阳性157例。以培养及药敏试验结果为金标准,PCR-反向点杂交法对H、R、S、E的耐药检测经Kappa检验具有较好的一致性(Kappa值分别为0.77、0.73、0.66、0.49);敏感度分别为88.89%(40/45)、79.66%(47/59)、67.57%(25/37)、63.16%(12/19);特异度分别为91.07%(102/112)、91.84%(90/98)、95.00%(114/120)、91.30%(126/138)。结论 PCR-反向点杂交技术用于结核分枝杆菌耐药基因检测较为可靠,对早期临床用药具有较好的指导作用。
聚合酶链反应; 分枝杆菌,结核; 抗药性,细菌; 基因
PCR-反向点杂交技术是将PCR技术的高敏感度、反向斑点杂交技术的高特异性和膜芯片技术的高通量3种成熟技术的优势有效结合的快速基因诊断手段。它可同时检测4种一线药物的5个常见耐药相关基因上13个位点的突变,且简便快速,可直接采用痰标本进行检测,8 h即可得出结果。本研究采用PCR-反向点杂交技术,对江西省胸科医院住院肺结核患者的痰标本进行一线抗结核药物[异烟肼(H)、利福平(R)、链霉素(S)、乙胺丁醇(E)]的5个常见耐药突变基因中的13个位点进行检测,以了解这些基因突变的发生频率及分布特点,并以药物敏感性试验(简称“药敏试验”)作为金标准进行比较,分析其敏感度、特异度、符合率、阳性预测值、阴性预测值等指标,评价其在结核分枝杆菌快速耐药检测中的价值。
对象和方法
1.对象:选取2014年8月至2015年12月江西省胸科医院住院的部分肺结核患者作为研究对象,共1071例。其中,男723例,女348例,年龄19~85岁。研究对象均送检了痰液标本,共1071份。所有患者均经病原学或病理学证实,或符合菌阴肺结核诊断标准。
2.仪器与试剂:DA7600基因扩增仪由中山大学达安基因股份有限公司提供;HR40-ⅡA2生物安全柜由青岛海尔公司提供;恒温杂交仪由亚能生物技术(深圳)有限公司提供;PCR-反向点杂交试剂由亚能生物技术(深圳)有限公司提供;分离培养专用酸性罗氏培养基由江西省胸科医院检验科结核分枝杆菌培养室自制。
3.PCR-反向点杂交:(1)DNA提取及PCR扩增:取痰标本3~5 ml,加等量4%NaOH液化20 min,离心半径5 cm,13 000 r/min,离心5 min,弃上清;向沉淀中加入1 ml的磷酸盐缓冲液,混匀,离心半径5 cm,10 000 r/min,离心2 min;向沉淀中加入50 μl裂解液,打匀,沸水浴10 min,离心半径5 cm,10 000 r/min,离心2 min,留上清液。取出PCR反应管,在管壁上做好标记,离心半径5 cm,5000 r/min,离心10 s,加入已提取的待测样品DNA 4 μl。同时取两管PCR反应管分别加入阳性质控品和阴性质控品DNA,作为产品使用过程的质量控制。按说明书要求进行扩增。(2)杂交、洗膜、显示:取15 ml塑料离心管,放入标有患者编号的膜条,加入AT液(依说明书,由氯化钠、柠檬酸钠、十二烷基硫酸钠按一定比例配置) 5~6 ml及所有(25 μl)PCR 产物,将盖拧紧,混匀。将离心管放入沸水浴中加热10 min,取出离心管,放入分子杂交箱59 ℃杂交1.5 h。取50 ml塑料管,加入40 ml B液(依说明书,由氯化钠、柠檬酸钠按一定比例配置)于分子杂交箱或水浴箱中预热至59 ℃。取出膜条,移至装有预热至59 ℃ B液的50 ml管中,于59 ℃轻摇洗涤15 min。按AT液∶POD(链霉亲和素辣根过氧化物酶)=2000∶1配制孵育液,室温轻摇孵育30 min,弃去POD 溶液。用AT 液室温轻摇洗2次,每次5 min。用C 液(柠檬酸钠)室温洗膜2 min,同时配制显色液。将膜条浸泡于显色液中避光显色5~10 min即可观察结果。
4.细菌培养及药敏试验:按照《结核病诊断实验室检验规程》[1],采用改良罗氏培养法及比例法药敏试验。
5.统计学分析:采用SPSS 13.0软件进行分析,PCR-反向点杂交检测与药敏试验对研究对象耐药检测结果的比较采用McNemar检验,以P<0.05为差异有统计学意义。对PCR-反向点杂交检测与药敏试验检测结果进行Kappa一致性检验,Kappa值≥0.75为两者的一致性较好,Kappa值为0.4~0.75为一致性一般,Kappa值<0.4为一致性差。符合率=(真阳性例数+真阴性例数)/检测对象总例数×100%;敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。
结 果
1.PCR-反向点杂交检测结果:1071例患者中,596例结核分枝杆菌阳性,阳性率为55.65%。其中,378例(63.42%)未检出H、R、S、E耐药基因突变,218例(36.58%)检出H、R、S、E耐药基因突变,分布于所测13个位点。检测显示,R耐药140例,耐药率为23.49%(140/596);H耐药160例,耐药率为26.85%(160/596),其中6例同时出现315M和-15M突变;S耐药88例,耐药率为14.77%(88/596),其中1例同时出现43M和88M突变;E耐药76例,耐药率为12.75%(76/596),其中2例同时出现306M1和306M2突变。各突变基因位点分布情况见表1。
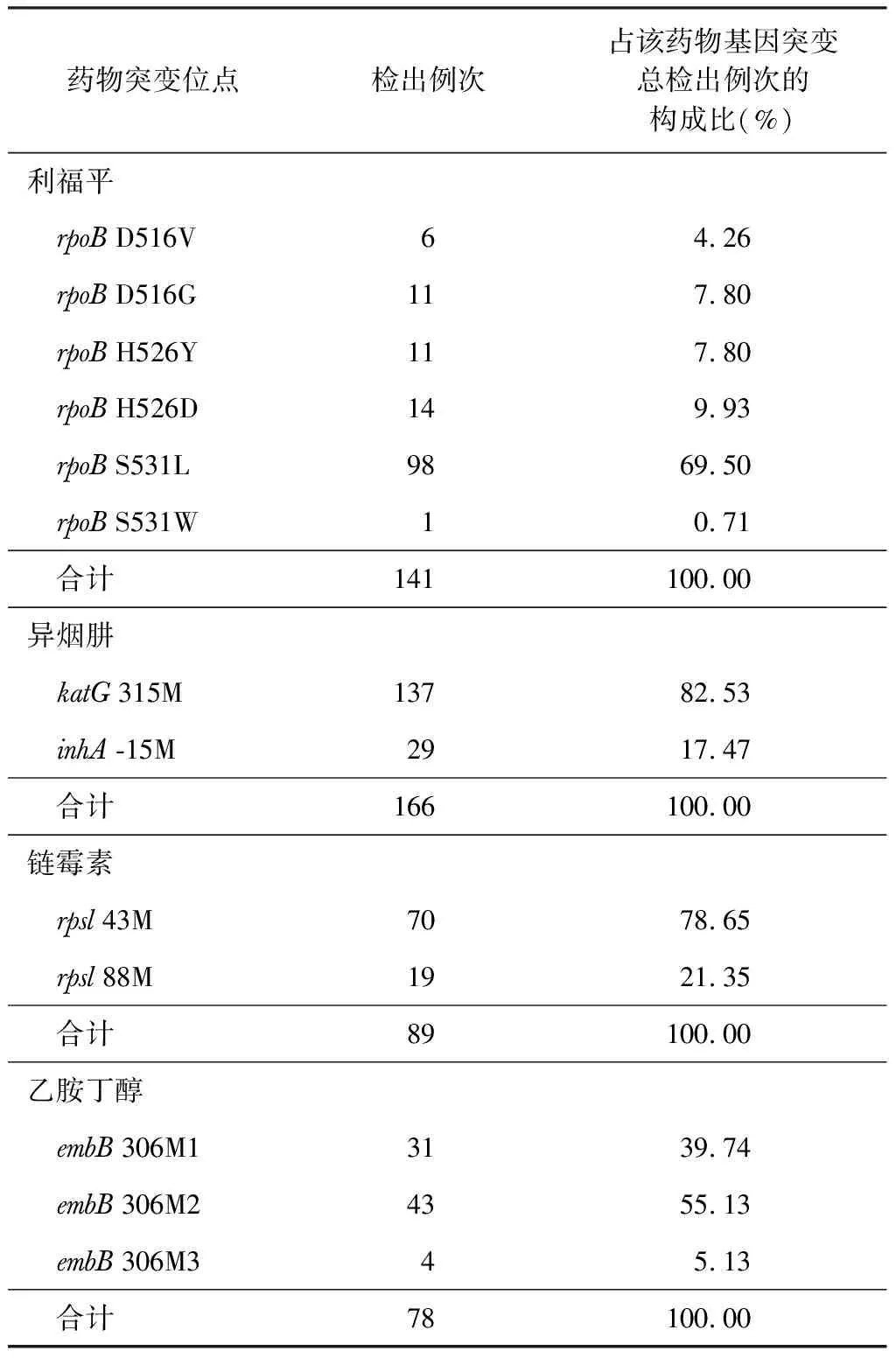
表1 218例经PCR-反向点杂交检测发生耐药基因突变患者突变位点分布情况
注 D516V表示rpoB基因第516密码子的D突变为V,即天冬氨酸突变为缬氨酸。其他氨基酸含义:G-甘氨酸、H-组氨酸、Y-酪氨酸、S-丝氨酸、L-亮氨酸、W-色氨酸、T-苏氨酸、N-天冬氨酸。315M及-15M 分别表示katG基因第315密码子和inhA基因第-15密码子的突变。43M和88M分别代表rpsL基因第43和88密码子发生突变。306M1、306M2和306M3代表embB基因第306密码子发生不同类型的突变
2. PCR-反向点杂交法与固体药敏耐药情况比较:433例患者标本同时行结核分枝杆菌培养,培养阳性且同时PCR-反向点杂交检测阳性157例,药敏试验结果显示耐药者74例,其中R耐药59例,耐药率为37.58%(59/157);H耐药45例,耐药率为28.66%(45/157);S耐药37例,耐药率为23.57%(37/157);E耐药19例,耐药率为12.10%(19/157)。以培养及药敏试验结果为金标准,经检验两种不同方法对H、R、S、E的耐药检测情况差异无统计学意义,经Kappa一致性检验,两种方法具有较好的一致性。结果见表2。
讨 论
目前,临床上用于结核分枝杆菌耐药检测的主要方法是培养法及药敏试验,被誉为 “金标准”。但此方法操作复杂、费时,一般需要4~8周,诊断周期长,且培养困难,敏感度低,不能及时指导用药。随着分子生物学诊断技术的不断进步,结核分枝杆菌的耐药突变基因检测得到了很快发展。PCR-反向点杂交技术是将PCR技术的高敏感度,反向斑点杂交技术的高特异性和膜芯片技术的高通量3种成熟技术的优势有效结合的快速基因诊断手段,可同时检测4种一线药物的5个常见耐药相关基因上13个位点的突变。并且,其与培养法及药敏试验相比,简便快速,8 h即可得出结果。
研究表明,大部分结核分枝杆菌耐药性产生的主要原因是药物作用靶点的基因发生突变。目前已知的结核分枝杆菌针对一线药物的耐药相关基因突变包括:针对R耐药的rpoB耐药核心区各碱基;针对H的katG、inhA、ahpC和oxyR基因;针对E的embA、embB和embC基因;针对S的rrs、rpsl和strA基因等[2-4]。
本研究应用PCR-反向点杂交法检测1071例肺结核患者痰标本,596例结核分枝杆菌基因检测阳性,阳性率为55.65%;其中,218例发生耐药基因突变,分布于所测13个位点。H、R、S、E等4种药物最常见的突变位点分别位于KatG的315M、rpobB的S531L、rpsl的43M、embB的306M2和306M1,与文献[5-7]报道的基本相符。
在实际应用中,基因芯片技术的结核分枝杆菌耐药性检测结果具有较高的可靠性,相关文献表明其敏感度达85.5%~100%,特异度达100%[8-10],但所示文献均以PCR-直接测序为金标准。本研究采用PCR-反向点杂交技术,同时检测H、R、S、E等4种药物,并以培养法及药敏试验为金标准进行对比。结果显示,两种方法检测结果差异无统计学意义;

表2 PCR-反向点杂交法与药敏试验对157例结核分枝杆菌检测阳性患者耐药检测的比较
kappa一致性分析显示具有中高度一致性,其符合率均在87%以上。由此说明,PCR-反向点杂交技术用于结核分枝杆菌耐药基因检测具有可靠性。另外,PCR-反向点杂交技术检测耐药基因的特异度均较高(均>90%),说明其造成耐药菌误诊的可能性小;但敏感度偏低,尤其是S(67.57%)与E(63.16%),说明其造成耐药菌漏诊的概率较高。究其原因,可能为每种药物均有多个耐药基因及位点,本研究仅针对常见耐药基因及位点进行了检测。
综上所述,PCR-反向点杂交技术用于结核分枝杆菌耐药基因检测具有快速、可靠的优点,对早期临床用药具有指导作用;但限于检测基因的不足,造成诊断敏感度不够高。因此,有必要进一步研究尽可能包含更多突变基因的试验方法。
[1] 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程. 北京:中国教育文化出版社,2006.
[2] 张太松,李明. 分子诊断技术在耐多药结核分支杆菌检测中的应用进展. 分子诊断与治疗杂志,2009,1(2):129-134.
[3] 张军. 耐药结核病分子诊断技术研究进展.中国防痨杂志,2011,33(9):608-611.
[4] 伍静,师长宏.结核分枝杆菌的耐药基因及其相关分子机制. 现代生物医学进展,2011,11(22):4382-4385.
[5] 杨辉,张国良,张明霞,等.某地区结核分枝杆菌利福平和异烟肼耐药相关基因突变特征分析.重庆医学,2012,41(34):3591-3593.
[6] 周扬,欧喜超,乐军,等.基因芯片诊断耐多药结核病的临床多中心研究. 中华检验医学杂志,2011,34(9):793-799.
[7] 李芳芳,唐曙明,李爱敏,等.膜芯片技术对结核分枝杆菌耐药性检测的研究.国际检验医学杂志,2013, 34(21):2792-2794.
[8] 戎奇吉,吕火祥,孙爱华. 基因芯片快速检测结核分枝杆菌katG基因突变及其与异烟肼耐药相关性.中国人兽共患病学报,2011,27(3):233-237.
[9] 李锋,李枭坚,陈园园,等. 应用基因芯片快速检测结核分枝杆菌利福平耐药基因的研究.中国防痨杂志,2011,33(3):188-189.
[10] 张俊仙,吴雪琼,阳幼荣,等.应用基因芯片方法检测结核分枝杆菌利福平和异烟肼的耐药性.中国防痨杂志,2011,33(10):680-685.
(本文编辑:李敬文)
Rapid detection ofMycobacteriumtuberculosisresistant genes using PCR reverse dot blotting hybridization
PENGYi-ping,ZONGPei-lan,XINCha-xiang,XIONGGuo-liang,HUQun-fang,YUANXiao-lan,SHIAn-liang,YAOLin,WANGXiao-lu,WANZan-yan,WUJuan.
TheThirdDepartmentofInternal,JiangxiChestHospital,Nanchang330006,China
PENGYi-ping,Email:pyp74@126.com
Objective To explore the value of PCR reverse dot blotting hybridization in detecting drug-resis-tant gene mutation ofMycobacteriumtuberculosis. Methods A total of 1071 inpatients were enrolled from Jiangxi Chest Hospital in interval between August 2014 and December 2015. All patients were with positive pathology or positive pathogeny, or identified by the criteria of pulmonary tuberculosis with negative smear or culture. PCR reverse dot blot hybridization which was used to detectMycobacteriumtuberculosisdrug-resistant genes, which were included (isoniazid (H), rifampin (R), streptomycin (S) and ethambutol (E) in 1071 sputa samples). The results were compared with result of drug susceptibility test, which usually considered as golden standard, and the efficiency was evaluated. Results Of the 1071 cases were detected by using PCR reverse dot blot hybridization, 596 (55.65%) were TB positive, and H, R, S or E mutant genes distributing in 13 loci were found in 218 cases (36.58%). The most common mutant-gene of H, R, S and E wereKatG-315M (82.53%, 137/166),rpoB-S531L (69.50%, 98/141),rpsl-43M (78.65%, 70/89),embB-306M2 (55.13%, 43/78) andembB-306M1 (39.74%, 31/78), respectively. Additionally, 433 clinical samples were tested with TB culture, and 157 cases had obtained positive results in both of TB culture and dot blot hybridization. By using culture and drug sensitivity results as gold standard, PCR reverse dot blot hybridization had excellent consistency in detecting H, R, S and E compared by adoptingKappatest (Kappaindex were 0.77, 0.73, 0.66 and 0.49, respectively). The sensitities were 88.89% (40/45), 79.66% (47/59), 67.57% (25/37) and 63.16% (12/19), and the specificities were 91.07% (102/112), 91.84% (90/98), 95.00% (114/120) and 91.30% (126/138), respectively. Conclusion PCR reverse dot blot hybridization was reliable to detect the drug-resistant gene mutation ofMycobacteriumtuberculosis, and it was helpful in drug usage guidance.
Polymerase chain reaction;Mycobacteriumtuberculosis; Drug resistance, bacterial; Genes
10.3969/j.issn.1000-6621.2016.08.004
江西省科技计划(20151BBG70124)
330006 南昌,江西省胸科医院内三科(彭亦平、胡群芳、史安良、姚琳、王小路、万赞燕、吴娟),内一科(宗佩兰),检验科(辛茶香、熊国亮),科教科(袁小兰)
彭亦平,Email: pyp74@126.com
2016-04-29)

