硫酸铵法提取血吸虫感染兔血清IgG初探
兰炜明,姜唯声,谢曙英,徐银,戴坤教,高晓晖,曾小军(江西省寄生虫病防治研究所,江西南昌330046)
硫酸铵法提取血吸虫感染兔血清IgG初探
兰炜明,姜唯声,谢曙英,徐银,戴坤教,高晓晖,曾小军
(江西省寄生虫病防治研究所,江西南昌330046)
摘要:目的探索硫酸铵法提取血吸虫感染兔血清IgG用于制备阳性参考品的可行性。方法采用饱和硫酸铵溶液对感染兔血清中IgG进行沉淀分离,IHA试剂测定分离前后、冻干前后的抗体滴度以及冻干IgG复溶后的稳定性。结果滴度为1:320的血吸虫感染兔血清经硫酸铵沉淀法提取IgG,经透析、浓缩至原体积后抗体滴度为1:320,粗提IgG以阴性兔血清和蔗糖为冻干保护剂,冻干前、后滴度均为1:160;冻干IgG复溶0d、3d、6d和8d抗体滴度分别为1:160、1:80、1:40和1:40。结论硫酸铵沉淀法提取、冻干IgG不引起滴度改变,冻干保护剂的加入会使抗体滴度下降,冻干IgG复溶3d后滴度出现下降。因此,硫酸铵沉淀法可用于提取血吸虫感染兔血清IgG。
关键词:硫酸铵沉淀法;免疫球蛋白;血吸虫;IHA
血清学检查是血吸虫病防治工作中筛查病人的主要方法之一[1],江西省血吸虫病疫区现场查病常采用IHA试验进行初筛以确定化疗对象[2,3],而在IHA试验现场工作中,因操作或试剂的影响常有整块检测板呈现阳性或阴性的结果。为保证IHA试验结果的可靠性,在试验中使用阳性参考品进行质量控制显得非常必要[4,5]。但在IHA试剂盒中,配备的阳性参考品的量均较少,而使用各实验室自己保存的阳性血清在经过反复冻融后,亦易于出现抗体滴度下降及出现浑浊的现象[6],不能满足实际的使用要求。为避免上述的问题,本文探索一种简便的血吸虫感染兔血清免疫球蛋白(IgG)收集方法,以制备血吸虫病阳性对照血清。
1 材料与方法
1.1材料阳性兔血清,阴性兔血清,血吸虫IHA检测试剂(江西环鄱科技发展有限公司,批号:20140419,20130206,20140509);(NH3)2SO4,NaCl,蔗糖,Na2HPO4,KCl,BaCl2,以上试剂均为AR级(国药集团化学试剂有限公司),批号分别为20130307,20121022,20121120,20040718,2008101 0,F20100519;KH2PO4,聚乙二醇6000(上海精化科技研究所),批号分别为060916,20001120;透析袋MD77(Solarbio,进口分装,截留分子量8000~14000Da)。
1.1.2阳性兔血清健康家兔腹部去毛经皮肤人工感染1500条血吸虫尾蚴,人工喂养45d后截断颈动脉收集感染兔全血,室温自然凝固后3000r/min,离心8min,收集阳性兔血清,-20℃冰冻保存备用。
1.1.3阴性兔血清未感染家兔经截断颈动脉收集全血,室温自然凝固后3000r/min,离心8min,收集兔血清,-20℃冰冻保存备用。
1.2方法硫酸铵沉淀IgG法
1.2.1饱和硫酸铵溶液配制称取500g硫酸铵溶于500ml蒸馏水中,加热到40℃,趁热过滤,置室温过夜,即得饱和硫酸铵溶液。
1.2.2 pH7.0 PBS缓冲溶液的配制分别准确称取8.0g NaCl,2.9g Na2HPO4,0.2g KH2PO4和0.2g KCl,少量蒸馏水溶解后定容至1000ml。
1.2.3透析袋预处理将透析袋剪成15cm长,用沸水煮5~10min,再用蒸馏水洗净,置于4℃蒸馏水中备用。
1.2.4硫酸铵沉淀法收集IgG[7,8]阳性兔血清收集后混匀,取10ml于50ml离心管中,加10ml生理盐水混匀,再取5ml饱和硫酸铵溶液逐滴滴入,使硫酸铵成20%饱和度(振荡器边滴边混匀),4℃静置30min,3000r/min,离心20min,弃沉淀,于上清中逐滴加入25ml饱和硫酸铵溶液并振荡混匀,使硫酸铵成50%饱和度,4℃静置30min,3000r/min,离心20min,弃上清;于沉淀中加入适量生理盐水定容至10ml刻度,振荡器溶解,加入5ml饱和硫酸铵,使成33%饱和度,3000r/min,离心20min,弃上清;重复两次于沉淀中加适量生理盐水至10ml刻度,溶解后加5ml饱和硫酸铵,3000r/min,离心20min,弃去上清的操作;获得沉淀加生理盐水定容至10ml溶解。
1.2.5透析将沉淀溶解后装于透析袋中以自来水为透析液于4℃透析,不定期更换透析液,用1% BaCl溶液检查透析袋中SO42-以确定透析完成。
1.2.6测定将聚乙二醇6000以PBS配成30%溶液,将透析完成后透析袋浸入,4℃浓缩12h,取出后定容至10ml,获得IgG提取液(简称粗提IgG)。
1.2.4冷冻干燥以阴性兔血清和蔗糖作为冻干蛋白保护剂,加于获得的IgG提取液8ml中,使溶液中含有10%阴性兔血清和5%蔗糖(简称冻干前IgG),200μl/管分装,冷冻干燥后4℃保存(简称冻干后IgG)。
2 结果
2.1硫酸铵沉淀法粗提IgG前后抗体滴度变化对收集混匀后阳性兔血清及粗提IgG用不同批次血吸虫IHA试剂检测抗体滴度,抗体提取前后抗体滴度均为1:320,粗提IgG的抗体滴度与原血清抗体滴度一致,显示提取IgG过程不会降低抗体的滴度。见表1。

表1 粗提IgG前后抗体滴度变化
2.2粗提IgG冻干前后抗体滴度变化粗提IgG以阴性兔血清和蔗糖溶液为蛋白保护剂,分别对冻干前IgG和冻干IgG用不同批次IHA试剂测定抗体滴度,粗提IgG抗体滴度为1:320,冻干前IgG和冻干IgG抗体滴度分别为1:160和1:160,结果表明冻干前IgG较粗提IgG出现一个滴度下降,但冻干前后抗体滴度保持一致。见表2。

表2 粗提IgG、冻干前、后抗体滴度变化
2.4冻干IgG复溶后抗体滴度的变化冻干IgG以200μl蒸馏水复溶,置4℃冰箱保存,不同时间以不同批次IHA试剂对其抗体滴度变化进行小样本检测,第0d抗体滴度为1:160,第3d抗体滴度为1:80,第6d抗体滴度为1:40,第8d抗体滴度为1:40,结果显示冻干IgG在复溶后,第3d即下降1个滴度,第6d后下降2个滴度,其后滴度不变。见表3。
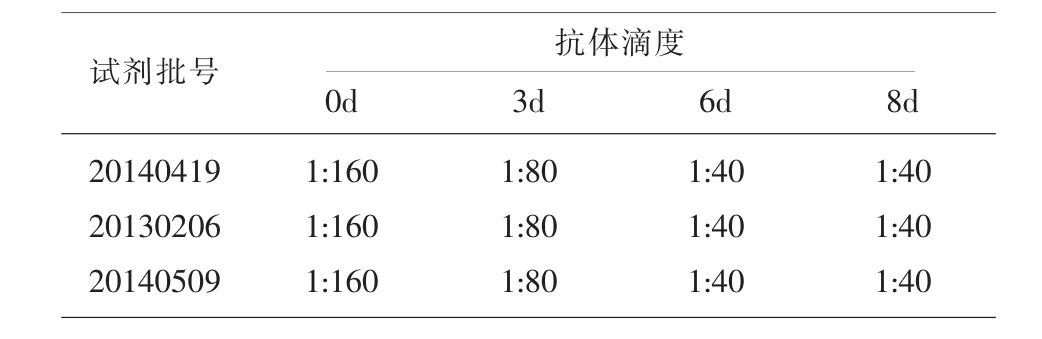
表3 冻干IgG复溶后抗体滴度的变化
3 讨论
血吸虫病免疫学诊断常以IHA试验为主,因其具有较高敏感性、特异性的特点,在疫区的现场工作中常作为初筛的手段[9-11]。由于近年来血吸虫病人群感染率和感染度均出现显著下降[12],IHA现场试验中亦常出现整块IHA反应板全部阴性的结果,因此在IHA试验过程中加入阳性质控血清,可为检验结果提供参考,以保证结果的可靠性。冻干质控血清是临床实验室进行室内质控和室间质评常用的参考物之一[13,14],为解决IHA试剂中阳性参照品量少或实验室自存阳性血清经反复冻融后出现浑浊的现象,探索一种简单的血吸虫感染兔阳性血清中IgG提取方法,以获得冻干IgG阳性参考品,对保证IHA实验质量具有重要意义。
本研究通过硫酸铵沉淀法提取血吸虫感染兔血清中的IgG,结果显示具有非常好的效果,硫酸铵沉淀法在收集IgG中具有较高的收率,在提取前、后抗体滴度未发生改变;冻干过程中抗体滴度亦未发生改变;但在制备IgG冻干液的过程中,抗体滴度会出现1个滴度的下降,因此应该选择抗体滴度较高的血清进行IgG的提取;对冻干IgG复溶后稳定性进行小样本研究发现,复溶后的抗体滴度第3d即出现1个滴度的下降,显示复溶后的抗体滴度下降较快,应在3d内用完,与报道的质控品复溶结果相似[15],但冻干IgG保存有效期的试验还需进一步研究。综上,硫酸铵法沉淀IgG是一种较方便且适宜的制备血吸虫病阳性参考血清的方法。
参考文献
[1]钟子静,曾小军,姜唯声,等.鄱阳湖沿湖居民血吸虫病血清流行病学调查分析[J].实验与检验医学,2009,27(2):141-142.
[2]李军宏,汪天平,肖祥,等.血吸虫病中度流行区化疗对象筛查方案的研究[J].中国血吸虫病防治杂志,2002,14(6):418-421.
[3]吴昭武,刘兆春,阳桂芬.采用间接血凝试验(IHA)确定湖区血吸虫病中度流行区化疗对象的可靠性分析[J].中国血吸虫病防治杂志,2000,12(1):21-23.
[4]高晓晖,姜唯声,兰炜明.溶血样本对血吸虫间接血凝试验检测结果的影响[J].实验与检验医学,2015,6(6):798-799.
[5]陈健康,肖祥.溶血等因素对血吸虫抗体检测影响的实验观察[J].安徽预防医学杂志,1999,5(4):374-375.
[6]王文英,俞年生,陈卫国,等.血清冻融次数对抗体效价影响的观察[J].中国卫生检验杂志,1993,3(1):22-23.
[7]张和平,岳喜庆,冯巧萍,等.饱和硫酸铵法提取血清中IgG最佳条件的研究[J].中国乳品工业,2006,34(1):4-8.
[8]王三虎,谢岩黎,张录华.猪血清中免疫球蛋白提取工艺[J].郑州粮食学院学报,1998,19(3):75-78.
[9]林丹丹,刘跃民,胡飞,等.中国日本血吸虫病常用诊断方法现场应用价值的分析与评估I. IHA筛查法评估血吸虫病疫区人群感染率的评价[J].中国血吸虫病防治杂志,2008,20(3):179-183. [10]陈年高,林丹丹,谢曙英,等.日本血吸虫间接血凝试验诊断试剂盒临床诊断效能[J].中国血吸虫病防治杂志,2011,23(4):377-379.
[11]佘有彬.四种血吸虫病检测方法在传播控制地区病情监测中的对比观察[J].实验与检验医学,2015,33(2):237-238.
[12]雷正龙,郑浩,张利娟,等. 2013年全国血吸虫病疫情通报[J].中国血吸虫病防治杂志,2014,26(6):591-597.
[13]杜安全,赵春杰.介绍一种冻干质控血清复溶方法[J].陕西医学检验,1999,14(4):14.
[14]张正飞.冰冻保存的复溶后冻干质控血清适用性观察[J].检验医学与临床,2009,6(20):1731-1733.
[15]叶章发,雷志华,杨桦.冰冻保存复溶后冻干质控血清标本对实验结果的影响[J].中国实用医药,2008,3(25):64.
·读者·作者·编者·
Extraction of IgG from serum of rabbit infected with Schistosoma japonicum by saturated ammonium sulphate
LAN Weiming,JIANG Weisheng,XIE Shuying,XU Yin,DAI Kunjiao,GAO Xiaojun,ZENG Xiaojun. Jiangxi Provincial Institute of Parasitic Disease,Nanchang 330046,China.
Abstract:Objective To explore the feasibility of preparing the schistosomiasis positive reference product by the method of ammonium sulfate precipitation to extract the IgG from the infected rabbits’serum of Schistosoma japonicum. Methods We used the saturated ammonium sulfate solution to precipitate and separate the IgG from the infected rabbits’serum. Compared the titer of infected rabbits’serum with the separated IgG,and compared unfreeze-drying titer of IgG with the freeze-drying by IHA,also studied the stability of freeze-drying IgG after we dissolve with water. Results The titer of the infected rabbits’serum was 1:320 used to extract IgG by the method of ammonium sulfate precipitation,we dialysised,concentrated the liquid of the extracted IgG to the original volume,the extracted IgG titer was 1:320. the negative rabbits’serum and sucrose as the protein protective agent added to the extracted IgG to freeze-drying,the extracted IgG titer of the unfreeze-drying and the freeze-drying were 1:160. The titer of the freeze-drying IgG dissolved in water changed with the time,the 0th,3rd,6th and 8th titer is 1:160,1:80,1:40 and 1:40 respectively. Conclusion All of the process of the ammonium sulfate precipitation method to extract the IgG and the freeze-drying can not chang the titer of the antibody,but the process adding the protein protective agent to the extracted IgG reduced the titer,the titer of freeze-drying IgG dissolve with water falled after the 3rd. The ammonium sulfate precipitation method is suitable for extracting the IgG from the infected rabbit serum.
Key words:Ammonium sulfate precipitation method;Immunoglobulin;Schistosoma;Indirect hemagglutination assay
(收稿日期2015-10-30;修回日期2016-03-23)
作者简介:兰炜明,男,1981年12月生,硕士学位,助理研究员,主要从事寄生虫病诊断与防治研究。
基金项目:江西省卫生厅科技计划项目(编号:20143190)
DOI:10.3969/j.issn.1674-1129.2016.02.009
中图分类号:R383.2+4,R446.62
文献标识码:A
文章编号:1674-1129(2016)02-0155-03

