丙肝检测单试剂阳性献血者的分析
陈红
(九江市中心血站,江西九江332000)
丙肝检测单试剂阳性献血者的分析
陈红
(九江市中心血站,江西九江332000)
摘要:目的分析九江地区献血者丙肝ELISA检测不合格标本,了解丙肝试剂的使用情况,探讨丙肝ELISA检测灰区设置的必要性和单试剂检测阳性献血者的回归问题。方法2013年1月-2015年12月本地区无偿献血标本用2种丙肝ELISA检测,阴性标本再进行核酸检测,单试剂阳性的标本进行核酸检测和丙肝确认试验。结果2种抗-HCV ELISA试剂不相符合率高达53.88%(125/232),但2种试剂无统计学差异;125份单试剂阳性的标本中有5份(4.0%)确认试验为阳性。结论丙肝ELISA检测灰区设置有必要性,但设置的范围有待于进一步的探讨;抗-HCV ELISA检测单试剂阳性标本假阳性高,我们应根据本站的实际情况,制定反应性献血者屏蔽和回归的方案,既最大限度地保证血液安全,同时减少不必要的血液资源浪费。
关键词:献血者;丙肝;ELISA检测;确证试验;回归
丙型病毒性肝炎(viral hepatitis type C,HC简称丙型肝炎),系丙型肝炎病毒(HCV)感染所引起的疾病,临床表现与感染途径和乙型肝炎相似,除了性传播和母婴传播外,主要是经血源性传播,如输血、血透析、静脉注射毒品、移植等。丙肝对人类健康的威胁不亚于乙型肝炎,同时由于丙肝抗体不是中和性抗体,对人体无保护作用,所以人类对丙肝普遍易感。经初步调查,输血后非甲非乙型肝炎患者血清丙肝抗体(抗HCV)阳性率高达80%以上,已成为大多数输血后肝炎的原因[1]。所以严格筛查献血者,保证血液安全是血站的职责。目前丙肝的检测方法主要有酶联免疫吸附法(ELISA)和核酸检测法(NAT)。根据国家相关标准[2,3]规定献血者丙型肝炎病毒(HCV)感染标志物的检测方法:可采用2个不同厂家的ELISA试剂或1种ELISA试剂和1种NAT试剂。为了解丙肝试剂的使用情况,更好地保障血液安全,对本站2013年1月-2014年12月献血者,采用2个不同厂家的ELISA试剂检测丙肝抗体,ELISA检测阴性和单试剂阳性的样本再进行NAT检测,单试剂阳性的样本进行了丙肝的确证试验,现将检测情况分析、报告如下。
1 材料与方法
1.1样本来源2013年1月-2015年12月九江地区无偿献血者,体检合格后采血,同时留取2管5± 1ml样本,其中1管用EDTA-K2抗凝的真空采血
管,用于ELISA检测;1管用无菌、无DNA酶、无RNA酶、带分离胶的EDTA-K2抗凝BD真空采血管,用于核酸检测。采集样本共计131179份,所有样本在2~8℃保存,1600g离心20min,48h内完成ELISA和NAT检测。
1.2试剂与仪器
1.2.1 ELISA试验丙型肝炎病毒ELISA检测为检测丙肝抗体,使用厦门新创和北京万泰试剂,试剂都具有国家合格的批批检定证书,在规定的效期内使用;使用在校验期内的澳斯邦STAR全自动加样仪和FAME全自动酶免仪仪器完成检测。
1.2.2核酸试验试剂使用美国罗氏公司提供的乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒(1+2型)核酸联合检测试剂,在试剂的有效期内使用;使用在校验期内的美国罗氏Cobas S201全自动核酸检测系统完成检测。
1.2.3确证试验使用北京万泰丙肝重组免疫印迹确证试剂,在规定的效期内使用。
1.3方法
1.3.1 ELISA试验用2种ELISA试剂对131179份样本进行丙肝抗体检测,按照试剂的操作说明书进行严格的操作,试验结果阴阳性对照均成立,室内质控在可控范围内。任何1种试剂S/CO值≥1.0为反应性,0.85≤S/CO值<1.0为灰区,任一种试剂检测S/CO值≥0.85的,则重取血袋上血辫血双试剂双孔同时复试,复试后任1种试剂任1孔S/CO值≥的,判为阳性。
1.3.2核酸试验抗-HCV ELISA试验阴性和单试剂阳性的样本共131072份进行核酸检测,由全自动加样仪自动进行6份标本的混样,由罗氏Cobas S201全自动核酸检测系统使用相配套的罗氏核酸定性筛查试剂进行HBV-HCV-HIV NAT检测。每批核酸检测均设置1个阴性质控和5个阳性质控,每个反应池均含有内部对照。反应池检测为无反应性的,判定6份样本全合格;反应池检测为反应性,对该反应池中的6份样本进行单份拆分检测,拆分试验为无反应性的判定为NAT检测阴性,反之拆分试验为反应性的判定为NAT检测阳性。阳性的样本送罗氏公司委托做鉴别试验。
1.3.3确证试验125份HCV单试剂阳性的样本进行确证检测(重组免疫印迹法RIBA),至少出现2种HCV抗体特异条带(Core、NS3、NS4、NS5)强度1+及以上判为阳性,仅出现1种HCV抗体特异条带强度1+及以上判为不确定[4]。
1.4统计学分析采用SPSS 17.0软件进行统计学的数据分析,组间率采用χ2检验进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 3年抗-HCV ELISA检测,A、B试剂之间差异无统计学意义,结果见表1。
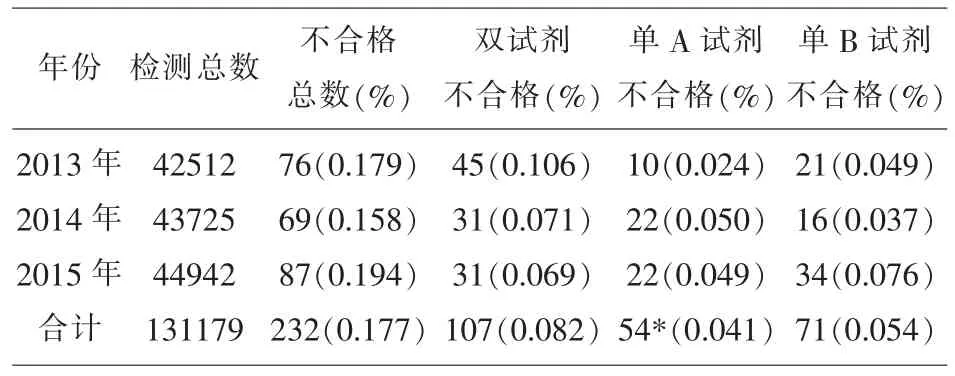
表1 2种HCV- ELISA试剂检测结果
2.2 125份单试剂不合格的样本确证试验有103份为阴性,22份为阳性或不确定。22份的结果及S/CO值的分布见表2、表3。
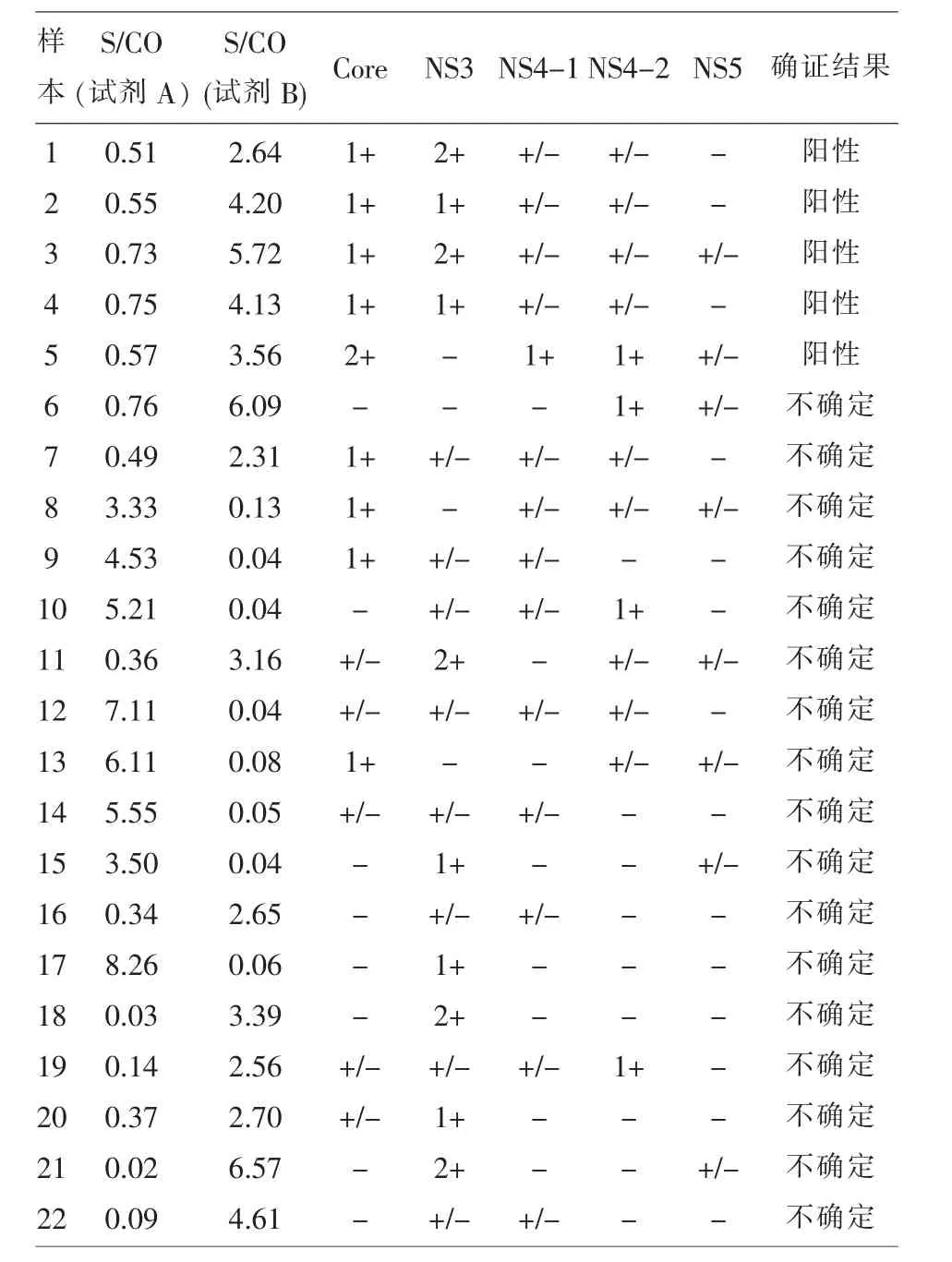
表2 22份确证阳性(不确定)结果
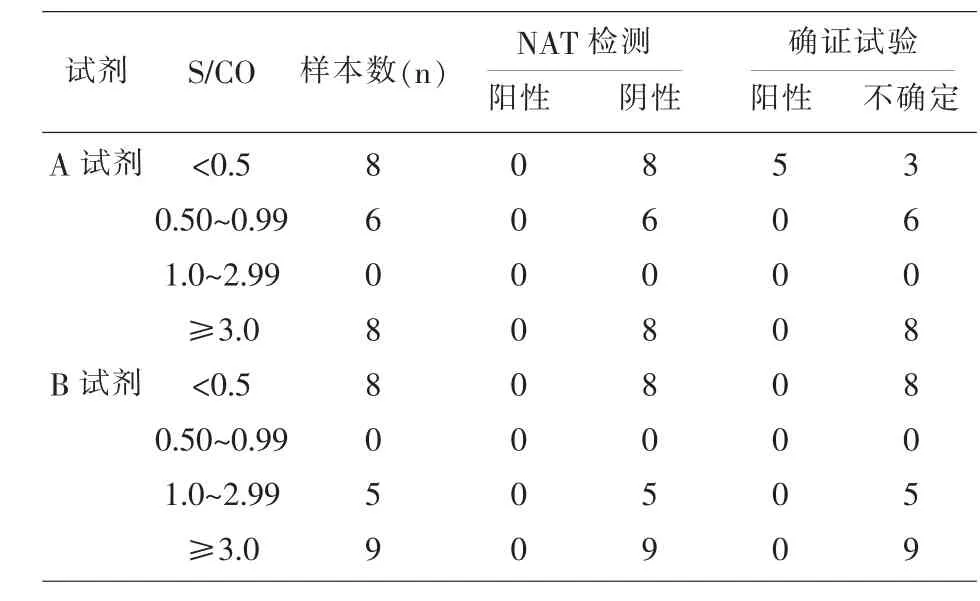
表3 22份确证阳性(不确定)样本S/CO值分布
3 讨论
用抗-HCV ELISA试剂检测131179份样本,不合格样本232份,不合格率0.18%,低于浙江温州0.27%[5]和河北承德0.42%[6]。虽然ELISA检测试剂具有价格便宜,操作简单,稳定性好,可自动化进行检测和结果分析等诸多的优点[7],但在实际工作中,导致ELISA检测结果假阳性的因素较多,如不同厂家试剂敏感性和特异性有差异、所选用的抗原或抗体组合不完全相同、内源性物质以及样本溶血等[8]。表1数据显示两种试剂不相符率达53.88%(125/232),低于河南安阳58.5%[9],但2种试剂无统计学差异。丙肝由于其病毒结构的特殊性,两种试剂的不相符率远高于梅毒ELISA法14.99%[10],因此笔者认为国产丙肝检测试剂的质量还有待于进一步的提高。随着核酸检测技术的推广和应用,使经血液传播疾病标志物的检测窗口期大为缩短,因此核酸检测在一些发达国家已经用于常规献血者血液筛查,我国部分地区也已经开展核酸检测[11,12]。125份丙肝单试剂阳性的样本进行核酸检测,未检出阳性,分析原因,可能有以下几方面:⑴本地区处于HCV的低流行区;⑵HCV是RNA病毒,对温度的变化较敏感,相对稳定性不够好,较易降解;⑶检测系统本身的灵敏度、样本病毒载量较低、病毒在样本中呈不规则的分布和核酸检测抓取病毒的随机性;⑷试验样本数量达不到足够的大等等。
有相关研究显示,ELISA检测丙肝抗体,单一试剂阳性的样本确证试验多为阴性[13,14],125份单试剂阳性的样本进行重组免疫印迹确证试验,仅有5份阳性,阳性率4.0%,低于河南安阳8.3%[9]。表2,3数据显示,确证试验为阳性的标本,ELISA检测1种试剂S/CO均在2.5以上,另1种试剂S/ CO均在0.5以上,提示如果用单试剂检测丙肝抗体存在漏检的风险,虽然大部分的血站实验室为了更好地保证血液安全,ELISA法检测都设置了灰区,但笔者建议乙肝、丙肝、艾滋和梅毒的灰区应分别设置,应结合本实验室近年的试验数据来确定,既最大限度地保证血液安全,同时减少不必要的血液资源浪费。
试验数据显示,丙肝单试剂阳性的样本假阳性高,这样既造成献血者对自己身体状况的担忧,还使其成为永久的淘汰者,不能再参加无偿献血,剥夺了他们为社会奉献爱心的权利,造成了固定献血者的流失和血液资源的不必要浪费。针对血液筛查假阳性的问题,国外除了对血液筛查反应性结果做确证试验外,还制定了关于献血者假阳性回归的相关政策,对某些献血者部分血液筛查不合格的,经过一段时间的屏蔽后进行再次检测,检测合格的献血者可以重新参加献血[15]。郭永健、葛红卫等国内专家也为我们提供了相应的回归策略[16,17],但由于确证试剂价格较高,一般血站难以长期开展,但我们可以结合本站工作实际和核酸试验,制定反应性献血者屏蔽和回归的方案,让假阳性者重新回归到献血者队伍中。
参考文献
[1]胡丽华.临床输血学检验[M].第3版.北京:人民卫生出版社,2013:222.
[2]卫生部.血站技术操作规程[S].卫医政发[2012]1号. 2012:13.
[3]卫生部.全血及成分血质量要求[S]. GB18469-2012. 2012:13.
[4]叶应妩,王毓三,申子瑜.全国临床检验存在规程[M].第3版.南京:东南大学出版社,2006:623-628.
[5]朱紫苗.温州地区2007-2012年无偿献血者血液感染性指标检测结果分析[J].中国输血杂志,2014,27(1):71-73.
[6]王天恒,董志伟,王淑香.承德地区无偿献血人群HBV、HCV、HIV感染情况调查[J].中国输血杂志,2013,26(1):68-69.
[7]田华. 4394例新生儿HIV、HCV、HBV、TP检测结果分析[J].实验与检验医学,2013,31(5):480-481.
[8]陈景芬,张员梅,刘殿香. ELISA检测抗HCV影响因素分析[J].中华医学实践杂志,2007,2(6):152.
[9]武丽娟.反应性献血者屏蔽与归队的探讨[J].临床输血与检验,2015,17(2):153-155.
[10]陈红.无偿献血者TP-ELISA检测不合格标本分析[J].实验与检验医学,2015,33(4):473-475.
[11]Stramer SL,Glynm SA,Kleinman SH,et al. Detection of HIV-1 and HCV infections among antibody-negative blood donors by nucleic acid-amplification testing [J]. N Engl J Med,2004,351(8):760-768.
[12]Soldan K,Davison K,Dow B. Estimates of the frequency of HBV,HCV,and HIV infectious donations entering the blood supply in the United Kingdom,1996-2003[J]. Euro Surveil,2005,10(2):17-19.
[13]Wu S,Liu Y,Cheng L,et al. Clinical evaluation of the signal-tocutoff ratios of hepatitis C virus anti-body screening tests used in China[J]. J Med Virol,2011,83(11):1930-1937.
[14]李雪梅,杨茂春,杨春晴,等.献血者HBsAg、抗-HCV、抗-HIV、抗-TP ELISA检测阳性与确证试验的对比研究[J].中国输血杂志,2013,26(6):541-543.
[15]Zou S,Musavi F,Notari EP,et al. Donor deferral and resulting donor loss at the American Red Cross Blood Services,2001 throu¯ gh 2006[J]. Transfusion,2008,48(12):2531-2539.
[16]郭永健,姚凤兰,林授,等译. HIV-1和HCV核酸检测、血液处置和献血者屏蔽与归队指引(上)[J].中国输血杂志,2011,24 (1):79-84.
[17]葛红卫,林授,汪德海,等译. HIV-1和HCV核酸检测、血液处置和献血者屏蔽与归队指引(下)[J].中国输血杂志,2011,24 (2):172-176.
(收稿日期2016-01-27;修回日期2016-02-15)
DOI:10.3969/j.issn.1674-1129.2016.02.045
中图分类号:R193.3,R457.1+2
文献标识码:A
文章编号:1674-1129(2016)02-0248-03

