ARF基因干扰表达对不同发育阶段和贮藏条件马铃薯酶活性的影响
周香艳,张宁,刘柏林,裴瑞芳,3,司怀军,3*,王蒂
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州 730070;3.甘肃省作物遗传改良与
种质创新重点实验室,甘肃省干旱生境作物学省部共建国家重点实验室培育基地,甘肃 兰州 730070)
ARF基因干扰表达对不同发育阶段和贮藏条件马铃薯酶活性的影响
周香艳1,2,张宁1,刘柏林2,3,裴瑞芳1,3,司怀军1,3*,王蒂2,3
(1.甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2.甘肃农业大学农学院,甘肃 兰州 730070;3.甘肃省作物遗传改良与
种质创新重点实验室,甘肃省干旱生境作物学省部共建国家重点实验室培育基地,甘肃 兰州 730070)
摘要:以前期研究获得的马铃薯栽培品种“甘农薯2号”ADP核糖基化因子(ARF)基因干扰表达转化植株为材料,用qRT-PCR法对转基因植株的ARF基因表达量进行了测定,结果表明,不同发育阶段转基因叶片中ARF基因的相对表达量先降低,生长后期略有增加,表明ARF基因干扰表达量随马铃薯生长发育发生改变。ARF基因干扰表达影响马铃薯叶片中酶活性,不同发育阶段转基因叶片与对照相比,多酚氧化酶(polyphenol oxidase, PPO)活性升高11.61%~27.84%,硝酸还原酶(nitrate reductase, NR)活性提高21.10%~41.32%,磷脂酶D(phospholipase D, PLD)活性降低2.88%~57.64%,蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)活性提高29.00%~39.57%;不同温度(4℃和室温)贮藏的块茎中ARF基因的相对表达量变化趋势一致:均先降低,再升高,但前者较后者ARF基因相对表达量显著降低。室温较4℃贮藏的转基因块茎PPO活性升高30.44%~56.28%,NR活性提高17.41%~40.92%,PLD活性降低24.39%~85.11%,SPS活性提高30.89%~45.78%。室温较4℃贮藏的非转基因块茎PPO活性升高25.11%~70.66%,NR活性提高36.07%~89.62%,PLD活性降低11.35%~72.64%,SPS活性提高27.31%~61.33%。本研究通过探讨ARF基因干扰表达对马铃薯生理生化特性的影响,为进一步研究ARF基因在马铃薯生长发育调控中的作用提供一定的理论基础。
关键词:马铃薯;ARF基因;干扰表达;转基因植株;酶活性
ADP核糖基化因子(ADP-ribosylation factor,ARF)是Ras基因超家族的成员,它们是大小约20 kDa的鸟嘌呤核苷酸结合蛋白,属于小G蛋白超家族中的ARF亚家族[1-2]。ARF于1982年被Kahn和Gilman[3]最早发现并纯化出该类细胞因子,将其命名为ARF,其普遍存在于真核生物细胞中,结构和功能在动植物演化发展中高度保守[4]。近年来,人们发现ARF的重要生理功能之一是作为磷脂酶D的激活剂[5-6]。马铃薯(Solanumtuberosum)具有产量高、营养丰富、适应性强等优良特性以及随着马铃薯产业的不断壮大和人们消费结构的变化,马铃薯品质育种工作正在受到重视[7]。
在前期研究中获得了ARF基因干扰表达转基因马铃薯植株[8],Zuk等[9]推测ARF基因的抑制表达会激活14-3-3蛋白基因,14-3-3蛋白基因对硝酸还原酶和蔗糖转化酶的活性有一定的影响,同时会使具有抗氧化能力的酚类物质含量降低。为此,本研究通过对马铃薯ARF干扰表达植株的ARF基因相对表达量、多酚氧化酶(polyphenol oxidase, PPO)、硝酸还原酶(nitrate reductase, NR)、磷脂酶D(phospholipase D, PLD)、蔗糖磷酸合成酶(sucrose phosphate synthase, SPS)活性进行测定,研究ARF基因干扰表达对以上酶活性变化的影响,以期阐明ARF基因对马铃薯生理生化特性影响的机理,从而为进一步研究ARF基因在马铃薯生长发育调控中的作用提供一定的理论基础。
1材料与方法
1.1材料
ARF基因干扰表达载体pHellsgatearf1(含组成型表达启动子CaMV35S)由甘肃农业大学刘柏林博士构建,抗性标记为卡那霉素(kanamycin,Kan)和壮观霉素(spectinomycin,Spe)。马铃薯品种“甘农薯2号”转ARF基因干扰表达载体转基因株系Z-12(干扰程度为93.22%)微型薯[8],由甘肃省作物遗传改良与种质创新重点实验室提供。于 2014 年6月5日,在甘肃农业大学温室将转基因和未转基因马铃薯微型薯种植于直径为18 cm的花盆中,每盆4株。采用自然光照,生长期间保证植株正常生长的水肥要求。
1.2方法
1.2.1转基因植株实时荧光定量PCR(qRT-PCR)检测对于温室种植的每个植株,生长30 d后,每15 d采取植株叶片,迅速用液氮冷冻,保存于-80℃冰箱中。收获后,每15 d采取不同贮存条件下(室温和4℃)的马铃薯块茎,迅速用液氮冷冻,保存于-80℃冰箱中。对不同发育阶段的马铃薯叶片和采收后不同贮存条件下(室温和4℃)的马铃薯块茎,分别提取植株的总RNA,用PrimeScript RT reagent Kit with gDNA Eraser反转录试剂进行反转录,具体操作按产品说明书进行。以马铃薯ef1a基因为内参(扩增引物为ef1a-F:5′-CAAGGATGACCCAGCCAAG-3′和ef1a-R:5′-TTCCTTACCTGAACGCCTGT-3′),以ARF基因序列设计1对特异性引物ARF-F:5′-GCCTTACCCTTCTTCACTCTCT-3′和ARF-R:5′-CCCATTCCAACATCAGACAC-3′。重复3次,利用SYBR荧光染料法进行转基因植株的qRT-PCR检测与分析,根据2-ΔΔCt方法[10]计算ARF基因的相对表达量。基因表达分析均以对照为参照进行相对表达比较[11]。计算公式为:RQ(相对表达量)=2-ΔΔCt,ΔΔCt=(ΔCt处理样品-ΔCtef1a)-(ΔCt对照样品-ΔCtef1a)。
1.2.2转基因植株酶活性测定测定不同发育阶段马铃薯叶片和不同贮存条件下(室温和4℃)马铃薯块茎的酶(PPO、NR、PLD和SPS)活性。PPO活性测定用比色法[12],NR活性测定用活体比色法[13],PLD活性测定用酶联比色法[14],SPS活性测定用蒽酮比色法[15]。

图1 转基因植株ARF基因表达的qRT-PCR检测Fig.1 Result of ARF gene expression in the transgenic plants by qRT-PCR assay A,B分别代表不同发育阶段叶片、室温和4℃储藏块茎ARF基因在不同时期的相对表达量。马铃薯ef1a基因作为内参,开始处理第0天基因的表达水平被设定为1,使用2-ΔΔCt法计算基因的相对表达量。误差线表示3个独立实验的标准偏差,使用邓肯氏新复极差法检验差异显著性,不同小写字母表示0.05水平差异显著。A,B represents relative expression quality of ARF gene of transgenic plants in different developmental stages and in storage tubers under different storage temperature (room temperature and 4℃). The ef1a gene was chosen as endogenous control for ARF gene.The expression level of each treatment in 0 day was set as 1, and the relative levels in the following days were quantified using the 2-ΔΔCt method. The error bars indicated the standard deviations obtained from three independent experiments.The assay was performed based on Duncan’s new multiple range test. The lower-case letters represent statistically significant differences at the 0.05 level.
1.3数据处理
所有试验均重复3次,采用Microsoft Excel 2003进行绘图与数据处理,采用SPSS 17.0软件进行差异显著性检验(P<0.05)。
2结果与分析
2.1转基因植株的qRT-PCR检测与分析
以马铃薯ef1a基因为内参,采用qRT-PCR法对马铃薯不同发育阶段的叶片和不同贮藏温度(室温和4℃)的块茎中ARF基因的相对表达量进行了检测。结果表明,不同发育阶段转基因和未转基因叶片中ARF基因的相对表达量均逐渐降低,转基因叶片较同一生长期未转基因叶片ARF基因相对表达量低(图1A)。室温贮藏的转基因微型薯块茎中ARF基因相对表达量先降低,75 d后逐渐升高,后期略有下降,而未转基因微型薯块茎中ARF基因相对表达量也先降低,贮藏60 d后开始增加(图1B);4℃与室温贮藏无论转基因还是未转基因微型薯中ARF基因相对表达量变化趋势一致,但前者相对表达量显著低于后者(图1B)。
2.2不同发育阶段转ARF基因与未转基因马铃薯叶片酶活性变化
马铃薯微型薯种植30 d 后,每15 d采取植株叶片进行相关酶活性的测定。结果表明,转基因与未转基因马铃薯叶片中,PPO和NR活性随生长发育不同,变化趋势一致,均为先升高后降低,但PPO在成熟期才开始降低,而NR在生长90 d左右开始降低(图2)。二者在对照中酶活性均低于基因干扰表达叶片中的酶活性。对照PLD活性先升高,后降低,再升高;转基因马铃薯叶片PLD持续升高,但其含量低于对照(图2)。SPS先升高后降低再升高,对照中酶活性均低于基因干扰表达叶片中的酶活性(图2)。不同发育阶段转基因叶片与对照相比,PPO酶活性升高11.61%~27.84%,NR活性提高21.10%~41.32%,PLD活性降低2.88%~57.64%,SPS活性提高29.00%~39.57%。
2.3贮藏温度对转ARF基因和未转基因马铃薯酶活性影响
收获后,每15 d采取不同贮存条件下(室温和4℃)的马铃薯块茎,测定其酶活性。结果表明,不同贮藏温度(室温和4℃)下, 转基因与非转基因马铃薯4种酶酶活性变化趋势基本一致。 室温和4℃贮藏的转ARF基因马铃薯PPO活性先升高, 生长75 d左右开始呈下降趋势(图3), 室温较4℃ 贮藏的转基因块茎PPO活性升高30.44%~56.28%,非转基因块茎PPO活性升高25.11%~70.66%; NR活性均呈下降变化趋势(图4), 转基因块茎NR活性提高17.41%~40.92%,非转基因块茎NR活性提高36.07%~89.62%;PLD活性均先增高后降低(图5),转基因块茎PLD活性降低24.39%~85.11%,非转基因块茎PLD活性降低11.35%~72.64%;SPS活性均先升高后降低再升高(图6),转基因块茎SPS活性提高30.89%~45.78%,非转基因块茎SPS活性提高27.31%~61.33%。
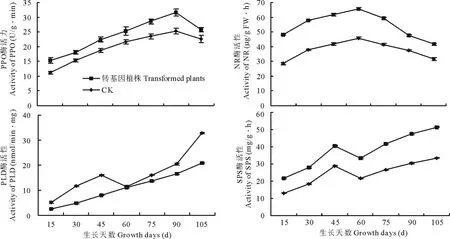
图2 不同发育阶段转ARF基因与未转基因(CK)马铃薯叶片酶活性变化比较Fig.2 Comparison of enzyme activity of transgenic and non-transgenic leaves of potato under different developmental stage
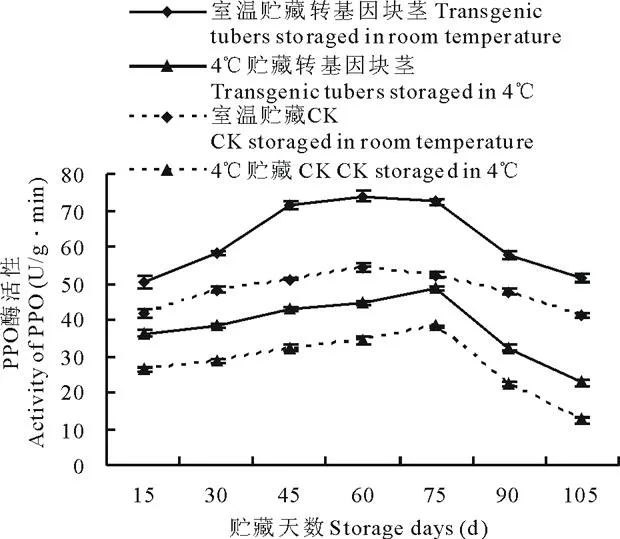
图3 室温和 4℃贮藏下转ARF基因与未转基因马铃薯PPO活性变化Fig.3 Comparison of PPO activity of transgenic and non-transgenic tubers under different storage temperature (room temperature and 4℃)
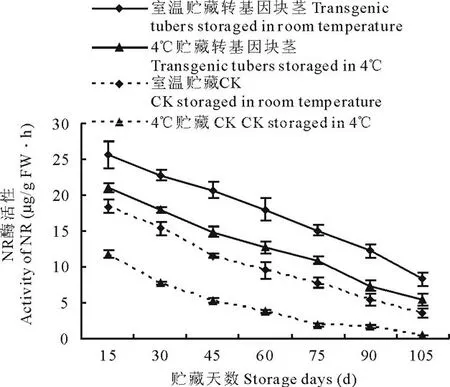
图4 室温和 4℃贮藏下转ARF基因与未转基因马铃薯NR活性变化Fig.4 Comparison of NR activity of transgenic and non-transgenic tubers under different storage temperature (room temperature and 4℃)
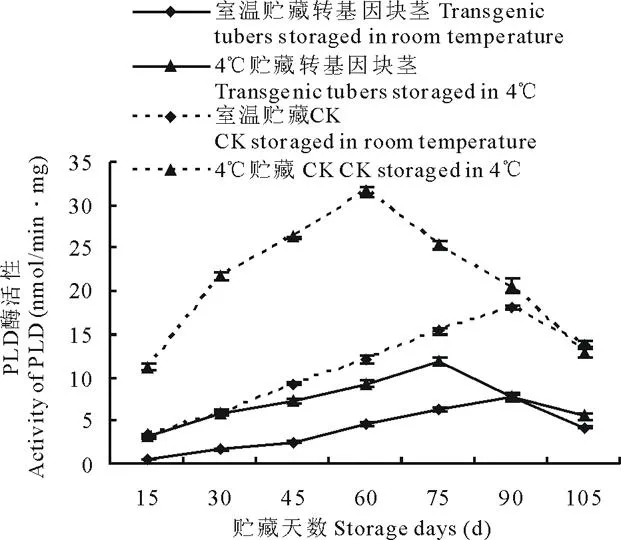
图5 室温和 4℃贮藏下转ARF基因与未转基因马铃薯PLD活性变化Fig.5 Comparison of PLD activity of transgenic and non-transgenic tubers under different storage temperature (room temperature and 4℃)
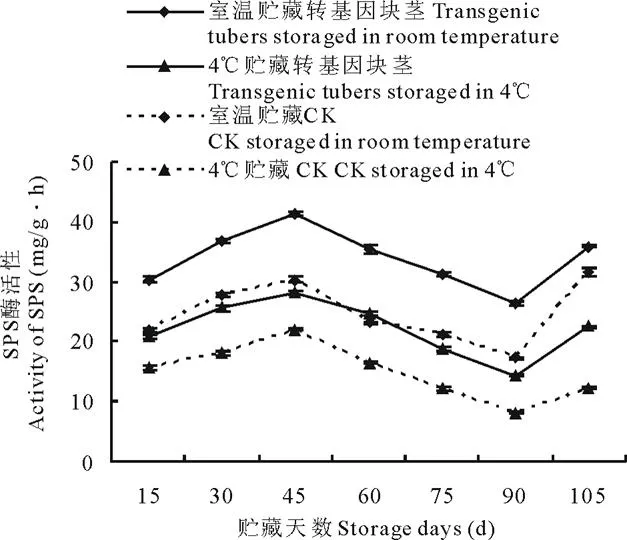
图6 室温和4℃贮藏下转ARF基因与未转基因马铃薯SPS活性变化Fig.6 Comparison of SPS activity of transgenic and non-transgenic tubers under different storage temperature (room temperature and 4℃)
3讨论
转基因技术是研究基因功能的基本手段,本研究测定了不同发育阶段叶片和不同贮藏温度微型薯ARF基因表达量和4种酶(PPO、NR、PLD和SPS)活性,与对照相比,转基因株系不同发育阶段叶片和不同贮藏温度试管薯的酶活性均有变化。不同发育阶段的叶片干扰相对表达量逐渐降低,说明干扰表达程度随着叶片的生长发育呈增强趋势。室温贮藏的转基因和未转基因微型薯块茎中ARF基因相对表达量主要呈先降低,后逐渐升高的趋势。4℃与室温贮藏无论转基因还是未转基因微型薯中ARF基因相对表达量变化趋势一致,但前者相对表达量显著低于后者。结果表明,贮藏温度会影响块茎中ARF基因的干扰表达程度,4℃贮藏时,干扰程度较明显,而室温贮藏时,随着时间的延续,干扰程度减弱。Liu等[16]研究分析表明ARF基因在马铃薯块茎中表达量最高,本研究也发现块茎中的表达量高于叶片。
酶是影响代谢的基本因素,是活细胞内能催化生化反应的生物催化剂,酶的活性变化是植物体内生理活性变化的具体反映。新收获的马铃薯块茎在整个贮藏期间,从休眠到休眠解除、顶芽萌发生长,要经过一系列的物质分解和合成,期间都是在相应酶的作用下引起的各种变化[17]。PPO仅在块茎休眠时活性较高,顶芽萌动后酶活性迅速下降,是块茎休眠期间分生组织呼吸作用的末端氧化酶系统[18]。SPS在蔗糖代谢中起着重要的作用,它不但是合成蔗糖的关键酶之一,还是光合产物向蔗糖和淀粉分配的调控关键点,所以它既影响植物生长发育,又调节光合产物在蔗糖和淀粉之间的分配,同时它还参与细胞分化与纤维细胞壁合成[19]。大量研究也证明了SPS活性对作物生育、抗老、物质分配等方面都有积极的影响。Doehlert和Huber[20]对大豆的研究表明SPS是大豆叶片中蔗糖合成的关键酶,也有研究指出SPS在小麦旗叶光合产物向蔗糖转化过程中也起到关键调节作用[21]。NR是高等植物氮代谢过程中的一个重要的调节酶和限速酶。土壤水分过低或过高都不利于硝酸还原酶活性和蔗糖转化酶活性的提高,在块茎形成、膨大期,马铃薯植株需水肥最多,吸收矿质营养也较多,因此,NR的活性逐渐加强,后期又有所下降[22]。
不同发育阶段,转基因与未转基因马铃薯叶片中, PPO和NR活性变化趋势一致,均先升高后降低,但PPO在成熟期才开始降低,而NR在生长90 d左右开始降低。二者在对照中酶活性均低于基因干扰表达叶片。对照PLD活性先升高,后降低,再升高;转基因马铃薯叶片持续升高,但其含量低于对照。SPS先升高后降低,再升高,对照中酶活性均低于基因干扰表达叶片。不同发育阶段转基因叶片与对照相比,PPO、NR和SPS活性均升高,PLD活性降低,这与Zuk等[9]的研究结果一致。Zuk等[9]证实,抑制马铃薯ARF基因的表达会导致14-3-3蛋白基因的激活,14-3-3蛋白基因对NR和SPS的活性有一定的影响,同时会使具有抗氧化能力的酚类物质含量降低。本研究中,ARF基因干扰表达时,PPO的活性升高,会催化更多的酚类物质转化为醌类物质,因此酚类物质含量降低。ARF的重要生理功能之一是作为PLD的激活剂[5-6],本研究中ARF基因的表达受到干扰,导致PLD 的活性降低。
贮藏温度会影响转基因和未转基因马铃薯酶活性,这与Zuk等[9]、Brown等[5]和Orci等[6]的研究结果相一致。不同贮藏温度(室温和4℃)下,转基因与非转基因马铃薯4种酶酶活性变化趋势基本一致。无论转基因还是非转基因植株,室温较4℃贮藏的块茎,PPO、NR和SPS活性均升高,只有PLD活性下降。研究表明,玉米[23]、菠菜、胡萝卜[24]、刺槐[25]等多种植物在冷害条件下,PLD 活性均升高。PLD活性在低温下升高的机理有待进一步研究。
4结论
马铃薯ARF基因干扰表达转基因植株中,在不同发育阶段和不同贮藏温度下ARF基因的干扰程度不同,导致转基因和未转基因植株PPO、NR、PLD和SPS活性均发生了不同程度的变化。研究结果为进一步研究ARF基因在马铃薯生长发育调控中的作用奠定了基础。
References:
[1]Moss J, Vaughan M. Structure and function ofARFproteins: Activators of cholera toxin and critical components of intracellular vesicular transport processes. Journal of Biological Chemistry, 1995, 270(21): 12327-12330.
[2]Yang Z. Small GTPases: versatile signaling switches in plants. Plant Cell, 2002, 14(suppl 1): 375-388.
[3]Kahn R A, Gilman A G. Purification of a protein cofactor required for ADP-ribosylation of the stimulatory regulatory component of adenylate cyclase by cholera toxin. Journal of Biological Chemistry, 1984, 259(10): 6228-6234.
[4]Hou L, Li J B, Luo X Y,etal. Cloning, expression and characterization of an ADP-ribosylation factor gene from cotton (GossypiumhirsutumL.). Agronomica Sinica, 2007, 33(8): 1226-1231.
[5]Brown H A, Gutowsk C, Moomaw C R,etal. ADP-ribosylation factor, a small GTP-dependent regulatory protein, stimulates phospholipase D activity. Cell, 1993, 75(6): 1137-1144.
[6]Orci L, Palmer D J, Amherdt M,etal. Coated vesicle assembly in the Golgi requires only coatomer andARFproteins from the cytosol. Nature, 1993, 364: 732-734.
[7]Gan L, Yu X X, Yu Z,etal. A study on main agronomic traits of yield and quality of clone lines ofSolanumtuberosumhybrids F1. Acta Prataculturae Sinica, 2013, 22(4): 312-318.
[8]Pei R F, Liu Y, Liu B L,etal. Genetic transformation using RNAi vector containing anARFgene in potato and effects on physiological characteristics of microtuber. Acta Prataculturae Sinica, 2015, 24(2): 142-147.
[9]Zuk M, Prescha A, Keüpczynaski J,etal. ADP ribosylation factor regulates metabolism and antioxidant capacity of transgenic potato tuber. Journal of Agricultural and Food Chemistry, 2003, 51(1): 288-294.
[10]Kong L F, Zhang J Y, Liu Z P,etal.Cloning of a S-adenosy methionine synthetase gene fromCleistogenessongoricaand its expression under drought stress. Acta Prataculturae Sinica, 2013, 22(1): 268-275.
[11]Wang X J, Li Z, Peng Y.The antioxidant enzyme activities and gene expression induced by spermidine in leaves of white clover. Acta Prataculturae Sinica, 2015, 24(4): 140-147.
[12]Zhu G L, Zhong H W, Zhang A Q. Plant Physiology Experiments[M]. Beijing: Beijing University Press, 1990: 37-40.
[13]Zhang Z L, Qu W J. Experimental Guide to the Study of Plant Physiology (Third Edition)[M]. Beijing: Higher Education Press, 2003: 41-43.
[14]Khatoon H, Talat S, Younus H. Phospholipase D fromAlliumsativumbulbs: a highly active and thermal stable enzyme. International Journal of Biological Macromolecules, 2008, 42(4): 380-385.
[15]Gao J F. Experimental Guide to the Study of Plant Physiology[M]. Beijing: Higher Education Press, 2006: 105-108.
[16]Liu B L, Zhang N, Wen Y K,etal. Identification of differentially expressed genes in potato associated with tuber dormancy release. Molecular Biology Reports, 2012, 39(12): 11277-11287.
[17]Potato Research Institute of Heilongjiang Academy of Agricultural Sciences. Chinese Potato Cultivation[M]. Beijing: Chinese Agricultural Press, 1994: 55-60.
[18]Bi Y R, Liang H G. Studies on polyphenol oxidase in tobacco callu cultures. Biologiae Experimentalis Sinica, 1988, 21(3): 257-263.
[19]Liu L X, Shen F F, Lu H Q,etal. Research advance on sucrose phosphate synthase in sucrose metabolism. Molecular Plant Breeding, 2005, 3(2): 275-281.
[20]Doehlert D C, Huber S C. Regulation of spinach leaf sucrose phosphate synthase by glucose-6-phosphate, inorganic phosphate, and pH. Plant Physiology, 1983, 73(4): 989-994.
[21]Li Y G, Yu Z W, Jiang D,etal. Studies on the dynamic changes of the synthesis of sucrose in the flag leaf and starch in the grain and related enzymes of high-yielding wheat. Agronomica Sinica, 2001, 27(5): 658-664.
[22]Wu X W. Effects of Different Soil Water Content in Early Growth Stage on Quality and Yield of No-Tillage Potato Covered with Straw[D]. Nanning: Guangxi University, 2007: 24.
[23]Pinhero R G, Paliyath G, Yada R Y,etal. Modulation of phospholipase D and lipoxygenase activities during chilling relation to chilling tolerance of maize seedlings. Plant Physiology and Biochemistry, 1998, 36(3): 213-224.
[24]Kim M J, Oh J M, Cheon S H,etal. Thermal inactivation kinetics and application of phospho-and galactolipid-degrading enzymes for evaluation of quality changes in frozen vegetables. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2241-2248.
[25]Yoshida S. Freezing injury and phospholipid degradation in vivo in woody plant cells. III. Effects of freezing on activity of membrane-bound phospholipase D in microsome-enriched membranes. Plant Physiology, 1979, 64(2): 252-256.
参考文献:
[4]侯磊, 李家宝, 罗小英, 等.棉花ADP-ribosylation factor基因(GhARF1)的克隆与表达分析. 作物学报, 2007, 33(8): 1226-1231.
[7]甘霖, 于肖夏, 于卓, 等. 马铃薯杂种F1无性株系产量品质等主要农艺性状研究. 草业学报, 2013, 22(4): 312-318.
[8]裴瑞芳, 刘英, 刘柏林, 等. 马铃薯ARF基因RNAi载体的遗传转化及对其试管薯生理特性的影响. 草业学报, 2015, 24(2): 142-147.
[10]孔令芳, 张吉宇, 刘志鹏, 等. 无芒隐子草SAMSl基因的克隆及干旱胁迫下的表达分析. 草业学报, 2013, 22(1): 268-275.
[11]王晓娟, 李州, 彭燕. NO参与Spd诱导白三叶抗氧化酶活性及其基因表达. 草业学报, 2015, 24(4): 140-147.
[12]朱广廉, 钟诲文, 张爱琴. 植物生理学实验[M]. 北京: 北京大学出版社, 1990: 37-40.
[13]张志良, 瞿伟菁. 植物生理学实验指导(第三版)[M]. 北京: 高等教育出版社, 2003: 41-43.
[15]高俊风. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 105-108.
[17]黑龙江省农业科学院马铃薯研究所. 中国马铃薯栽培学[M]. 北京: 中国农业出版社, 1994: 55-60.
[18]毕玉蓉, 梁厚果. 烟草愈伤组织多酚氧化酶研究. 实验生物学报, 1988, 21(3): 257-263.
[19]刘凌霄, 沈法富, 卢合全, 等. 蔗糖代谢中蔗糖磷酸合成酶(SPS)的研究进展. 分子植物育种, 2005, 3(2): 275-281.
[21]李永庚, 于振文, 姜东, 等. 冬小麦旗叶蔗糖和籽粒淀粉合成动态及与其有关的酶活性的研究. 作物学报, 2001, 27(5): 658-664.
[22]吴晓伟. 生育初期不同土壤水分对免耕稻草覆盖马铃薯产量及品质的影响[D]. 南宁: 广西大学, 2007: 24.
Effects of RNAi expression of theARFgene on enzyme activity at different developmental stages and storage temperatures in potato
ZHOU Xiang-Yan1,2, ZHANG Ning2, LIU Bai-Lin2,3, PEI Rui-Fang1,3, SI Huai-Jun1,3*, WANG Di2,3
1.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China; 3.GansuKeyLaboratoryofCropGeneticandGermplasmEnhancement,GansuProvincialKeyLaboratoryofAridlandCropScience,Lanzhou730070,China
Abstract:ADP ribosylation factor (ARF) gene expression interference in a transformed potato cultivar “Gannongshu 2” was evaluated. Real time fluorescence quantitative polymerase chain reaction (qRT-PCR) showed that the relative expression of the ARF gene varied in the transgenic plants at different developmental stages and increased slightly at latter growth stages, indicating that ARF gene interference expression varied with maturity.Enzyme activity in the leaves was effected by ARF gene interference expression. For leaves of transgenic plants at different development stages, PPO activity increased by 11.61%-27.84%, NR activity increased by 21.10%-41.32%, PLD activity decreased 2.88%-57.64% SPS activity increased by 29.00%-39.57% when compared with the control. Relative expression of the ARF gene in stored tubers under different storage temperatures (room temperature and 4℃)showed the same trend; initially decreasing and then increasing. For transgenic tubers stored at room temperature, the activity of PPO increased by 30.44%-56.28%, NR activity increased by 17.41%-40.92%, PLD activity decreased 24.39%-85.11%, SPS activity increased by 30.89%-45.78% when compared with transgenic tubers stored at 4℃. For non-transgenic tubers stored at room temperature, PPO activity increased by 25.11%-70.66%, NR activity increased by 36.07%-89.62%, PLD activity decreased 11.35%-72.64% and SPS activity increased by 27.31%-61.33%.This study investigated the effect of RNAi expression of ARF gene on physiological and biochemical characteristics in potato to provide a theoretical basis for further study of the regulation role of the ARF gene in potato of different growth and stage of development.
Key words:potato; ARF gene; interference expression; transgenic plants; enzyme activity
*通信作者
Corresponding author. E-mail: hjsi@gsau.edu.cn
作者简介:周香艳(1983-),女,内蒙古包头人,在读博士。E-mail: zhxy2008bj@163.com
基金项目:甘肃农业大学盛彤笙科技创新基金项目(GSAU-STS-1333),国家自然科学基金项目(31160298),甘肃省杰出青年基金项目(1308RJDA011)和甘肃省农业科技创新项目(GNCX-2012-49)资助。
*收稿日期:2015-04-14;改回日期:2015-07-06
DOI:10.11686/cyxb2015194
http://cyxb.lzu.edu.cn
周香艳, 张宁, 刘柏林, 裴瑞芳, 司怀军, 王蒂.ARF基因干扰表达对不同发育阶段和贮藏条件马铃薯酶活性的影响. 草业学报, 2016, 25(4): 133-139.
ZHOU Xiang-Yan, ZHANG Ning, LIU Bai-Lin, PEI Rui-Fang, SI Huai-Jun, WANG Di. Effects of RNAi expression of theARFgene on enzyme activity at different developmental stages and storage temperatures in potato. Acta Prataculturae Sinica, 2016, 25(4): 133-139.

