外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响
寇江涛,康文娟,苗阳阳,师尚礼
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续研究中心, 甘肃 兰州 730070)
外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响
寇江涛,康文娟,苗阳阳,师尚礼*
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续研究中心, 甘肃 兰州 730070)
摘要:为明确外源2,4-表油菜素内酯(2,4-epibrassinolide,EBR)诱导紫花苜蓿幼苗抗盐性的效果及其可能的生理调节机制,采用营养液水培法,以紫花苜蓿品种‘中苜3号’和‘陇中苜蓿’为材料,研究NaCl胁迫下施用外源EBR对紫花苜蓿幼苗光合色素含量、气体交换参数及离子吸收、运输和分配的影响。结果表明,1)150 mmol/L NaCl胁迫下,苜蓿幼苗叶片的光合色素含量显著降低,光合能力及地上、地下生物量显著下降,苜蓿幼苗体内无机离子的吸收、运输和分配等代谢过程失调。2)NaCl胁迫下,施用0.1 μmol/L外源EBR后,苜蓿幼苗叶片的Chla、Chlb、Chla+b、Chlx·c含量及Chla/Chlb显著提高,Chl/Car显著降低,Pn、Tr、Gs、WUE均显著提高,光合能力增强,促进了地上、地下生物量的积累。苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量及Cl-/Na+显著下降,K+、Ca(2+)、Mg(2+)含量及K+/Na+、Ca(2+)/Na+、Mg(2+)/Na+显著升高,体内无机离子的运输比及阳离子的运输选择性比率得到有效调控。3)说明外源EBR能够有效缓解盐胁迫对苜蓿幼苗造成的光抑制,增强有机物的合成和积累,促进对无机离子的选择性吸收和运输,维持体内的离子代谢平衡,提高苜蓿幼苗的耐盐性。
关键词:紫花苜蓿;NaCl胁迫;2,4-表油菜素内酯;光合作用;离子代谢
土壤盐渍化严重影响植物生长发育,是限制作物生长和产量的重要环境因素,已成为现代化农业生产所面临的严峻问题[1]。随着人类耕作活动的增加,盐渍化土壤面积呈逐年不可逆的形式增加[2],预计到2050年,可用耕地的50%将面临盐渍化[3]。盐胁迫下,植物正常的生理代谢发生紊乱,高浓度的Na+和Cl-会抑制根系对K+及其他必需元素的吸收[4-5],并引起失水亏缺造成生理干旱,进而引起氧化胁迫、渗透胁迫和离子毒害[6]。盐胁迫还直接损伤植物光合机构的功能,使得光合色素合成受阻并发生降解,光合电子传递受阻,降低碳同化效率和光合同化产物的持续供应,导致植物生长发育受到抑制[7-8]。
油菜素内酯(brassinosteroids,BRs)被公认为第六大植物激素,关于BRs提高植物逆境抵抗能力的研究日趋深入。研究表明,2,4-表油菜素内酯(2,4-epibrassinolide,EBR)能够促进碳水化合物从黄瓜(Cucumissativus)植株叶片向根系的分配,提高根系糖酵解代谢酶活性,增强其耐低氧胁迫能力[9]。EBR能够显著改善油菜(Brassicacampestris)幼苗的离子稳态和渗透调节能力,提高其光合、水分利用能力,降低气孔限制,从而促进光合作用和生物量积累,提高其耐盐性[10]。EBR可提高弱光下番茄(Lycopersiconesculentum)幼苗表观量子效率、暗呼吸速率、羧化效率和Rubisco含量,降低CO2补偿点和光补偿点,进而提高光合能力,有效缓解弱光胁迫对番茄幼苗的伤害[11]。因此,BRs在调控植物体碳水化合物同化、分配和光合作用中具有重要作用[12-13]。
我国的盐渍化土壤大多分布在西北、华北等干旱、半干旱区,其面积因不合理灌溉、化肥使用不当等原因不断扩大,已经成为发展高效、优质苜蓿草产业的重要限制因子之一。在植物的盐适应机制上,光合作用和离子稳态等代谢过程相互影响[14-15]。因此,本试验以紫花苜蓿‘中苜3号’(Medicagosativacv. Zhongmu No. 3)和‘陇中苜蓿’(M.sativacv. Longzhong)为材料,研究BRs对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的调节效应,以明确EBR诱导苜蓿幼苗抗盐性的效果及其可能的生理机制,为苜蓿的抗盐栽培以及应用BRs缓解苜蓿盐害提供更多的理论和实践依据。
1材料与方法
1.1材料培养
供试紫花苜蓿材料为‘中苜3号’和‘陇中苜蓿’,由甘肃农业大学草业生态系统教育部重点实验室提供。试验于2014年9-12月在甘肃农业大学草业生态系统教育部重点实验室进行。选取均匀、饱满、大小一致的供试苜蓿种子,用0.1% HgCl2溶液消毒5 min,去离子水漂洗 6次,用吸水纸吸干后播种于灭菌的蛭石培养钵中,出苗后每盆定植10株,转移至光照培养室中[光照14 h/d,光通量密度400 μmol/(m2·s),昼夜温度分别为(25±1)和(20±1)℃,相对湿度60%左右],每3 d浇灌1次1/2 Hoagland营养液,生长35 d后,挑选长势基本一致的幼苗洗净转入装有1/2 Hoagland营养液的水培盆中预培养,预培养3 d后开始处理。
1.2试验处理
通过预试验,筛选出150 mmol/L NaCl胁迫下能够促进苜蓿种子萌发及幼苗生长的最佳EBR浓度为0.1 μmol/L[16]。本试验设4个处理:1)CK(蒸馏水);2)150 mmol/L NaCl;3)0.1 μmol/L EBR;4)150 mmol/L NaCl+0.1 μmol/L EBR;每处理4次重复。各个处理的溶液均用1/2 Hoagland营养液配制,为保证处理液浓度稳定,每隔2 d更换1次处理液,营养液间歇通入空气。试验期间,每隔2 d按照试验设计将0.1 μmol/L EBR溶液(EBR和EBR+NaCl处理)及蒸馏水(CK和NaCl处理)均匀喷施于叶片正反面,喷到有液滴为止。于NaCl胁迫第10天时,测定各个处理幼苗的生物量、叶绿素含量、光合气体交换参数及无机离子含量,每个处理3次重复。
1.3测定项目及方法
1.3.1生物量测定每处理随机选取10株幼苗,将植株的地上部和地下部分开,用去离子水冲洗干净,吸干水分后置于烘箱内105℃杀青15 min,然后65℃烘干至恒重,称重求其平均值。
1.3.2光合色素含量测定参照Arnon[17]的方法测定,用80%丙酮溶液遮光浸泡提取。
1.3.3光合气体交换参数测定利用GFS-3000光合仪(Walz,Germany)的红蓝光源控制系统、CO2控制系统测定各个处理由上到下第3,4片完全展开的成熟叶片光合气体交换参数,测定时间为上午9:00-11:30,CO2浓度固定为370 μmol/mol,温度为(25±1)℃,光强设定为800 μmol/(m2·s)。测定指标包括:净光合速率(photosynthetic rate,Pn:μmol/m2·s)、蒸腾速率(transpiration rate,Tr:mmol/m2·s)、气孔导度(stomatal conductance,Gs:mmol/m2·s)、胞间CO2浓度(intercellular CO2concentration,Ci:μmol/mol),并计算水分利用效率(water use efficiency,WUE:μmol/mmol)。
1.3.4无机离子含量测定将植株根系、茎秆、叶片分开,用去离子水冲洗干净,并用吸水纸吸干水分,置于烘箱内105℃杀青15 min,然后65℃烘干至恒重,置于研钵中磨细并全部过圆孔直径为0.25 mm的筛。Na+、K+、Ca2+、Mg2+含量测定参照毛美飞等[18]方法用1 mol/L HCl溶液浸提,Na+、K+采用FP640火焰光度计测定,Ca2+、Mg2+采用TAS-990 Super原子吸收分光光度计测定。Cl-含量测定参照计小江等[19]方法,用去离子水浸提,并参照鲍士旦[20]的方法,采用硝酸银滴定法测定。
1.3.5离子运输比和运输选择性比率计算运输比(transport ratio,TR)是表示所有离子(包括阳离子、阴离子)的运输倍数,反映的是分布梯度,直接以阴、阳离子浓度计算得到,计算公式为[21]:
TR(X)=a器官(X)/b器官(X)
式中,X代表Na+、K+、Ca2+、Mg2+、Cl-的含量。
运输选择性比率(transport selectivity ratio,TS)是表示阳离子间在运输方面的协同或拮抗关系,是以离子间的浓度比值进行计算而得到,计算公式为[22]:
TS(Y, Na+)=a器官(Y/Na+)/b器官(Y/Na+)
式中,Y代表K+、Ca2+、Mg2+的含量,TS(Y, Na+)越大,说明a器官从b器官中选择性运输Y离子的能力越强。
1.4数据处理与分析
采用Microsoft Excel 2003进行数据处理和图表绘制,利用SPSS 16.0软件用Duncan多重比较法(P<0.05)对数据进行统计分析。
2结果与分析
2.1外源EBR对NaCl胁迫下紫花苜蓿幼苗生物量的影响
由图1可知,NaCl胁迫显著降低了中苜3号、陇中苜蓿幼苗的地上、地下生物量。和CK相比,2个品种苜蓿幼苗的地上、地下生物量分别降低38.72%和36.96%、46.50%和49.76%。NaCl胁迫下喷施外源EBR提高了2个品种苜蓿幼苗的地上、地下生物量,且中苜3号的地上、地下生物量(分别较NaCl处理提高30.32%,56.61%)和陇中苜蓿的地下生物量(较NaCl处理提高54.55%)显著高于NaCl处理。表明外源EBR能够有效缓解NaCl胁迫对紫花苜蓿幼苗及根系生长的抑制作用,促进幼苗生长,提高其地上、地下生物量。
2.2外源EBR对NaCl胁迫下苜蓿幼苗叶片光合色素含量及光合特性的影响
NaCl胁迫显著降低了苜蓿幼苗叶片的光合色素含量(表1),NaCl处理下中苜3号和陇中苜蓿幼苗叶片的Chla、Chlb、Chla+b、Chlx·c含量及Chla/Chlb值分别较CK下降了35.59%和41.64%、21.37%和27.09%、30.93%和37.00%、43.77%和53.76%、18.09%和19.96%;NaCl胁迫下,苜蓿幼苗叶片的Chl/Car值显著升高,2个品种苜蓿幼苗叶片的Chl/Car值分别较CK提高22.85%和36.24%。NaCl胁迫下施用外源EBR后,2个品种苜蓿幼苗叶片的Chla、Chlb、Chla+b、Chlx·c含量及Chla/Chlb值显著提高,分别比NaCl处理提高了27.28%和36.22%、12.52%和20.87%、21.77%和30.55%、37.77%和51.07%、13.12%和12.70%;2个品种苜蓿幼苗叶片的Chl/Car值显著降低,分别比NaCl处理降低了11.61%和13.58%。
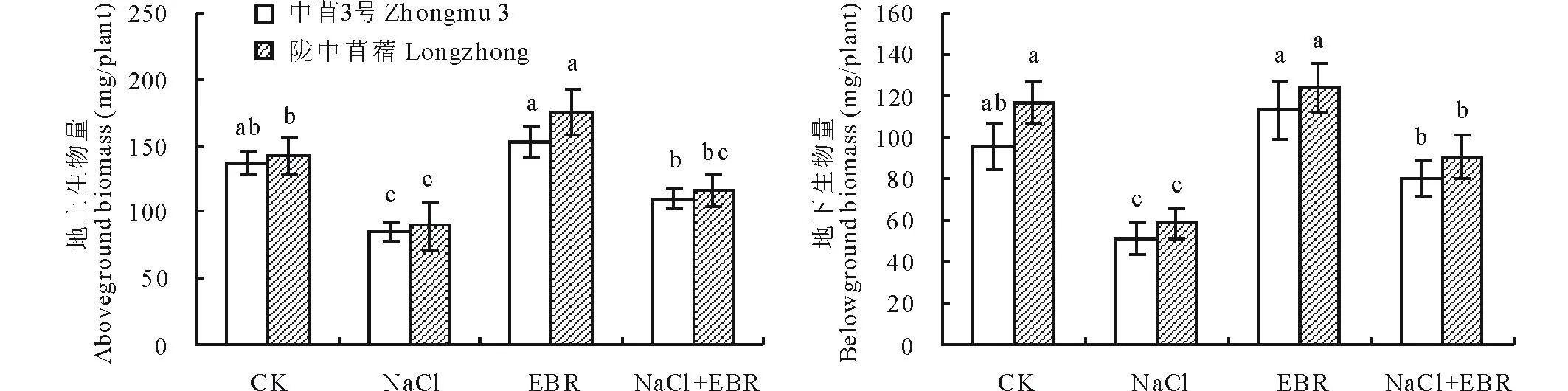
图1 外源EBR对NaCl胁迫下紫花苜蓿幼苗生物量的影响Fig.1 Effect of exogenous EBR on seedling biomass of NaCl stressed M. sativa CK: 对照(蒸馏水), Control (distilled water); NaCl: 150 mmol/L NaCl; EBR: 0.1 μmol/L EBR; NaCl+EBR (N+E): 150 mmol/L NaCl+0.1 μmol/L EBR。柱上不同小写字母表示各处理间差异达5%显著水平,下同。Different letters are significantly different at P<0.05, the same below.
注:表中数据为平均值±标准差, 同列不同字母表示差异显著(P<0.05)。下同。
Note: Data in the Table are mean±SD. Lowercase letters within the same column mean significant differences at 0.05 level. The same below.
NaCl处理下苜蓿幼苗的Pn、Tr、Gs、WUE显著降低,Ci显著升高(图2)。与CK相比,NaCl处理下中苜3号和陇中苜蓿幼苗叶片的Pn、Tr、Gs、WUE分别下降了40.20%和47.15%、20.57%和32.35%、56.66%和57.97%、24.76%和21.88%,Ci分别提高61.58%和66.76%。NaCl胁迫下施用外源EBR后,2个苜蓿品种幼苗的Pn、Tr、Gs、WUE分别比NaCl处理提高了35.02%和33.32%、14.13%和17.99%、84.90%和52.78%、18.28%和12.99%,Ci分别降低了16.98%和16.89%。说明外源EBR能够有效缓解NaCl胁迫对紫花苜蓿幼苗光合作用的抑制作用,提高其光合效率。
NaCl处理下苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量显著升高,K+、Ca2+、Mg2+含量显著降低(图3)。与CK相比,NaCl处理下中苜3号和陇中苜蓿幼苗叶片中的Na+、Cl-含量分别提高了89.06%和118.36%、135.71%和97.14%,K+、Ca2+、Mg2+含量分别降低了44.80%和56.14%、46.38%和44.97%、60.75%和64.27%;茎秆中的Na+、Cl-含量分别提高了175.06%和122.82%、65.95%和57.46%,K+、Ca2+、Mg2+含量分别降低了15.56%和37.03%、35.85%和50.18%、44.85%和57.57%;根系中的Na+、Cl-含量分别提高了424.05%和300.86%、86.12%和128.04%,K+、Ca2+、Mg2+含量分别降低了65.05%和65.08%、48.59%和62.70%、57.86%和57.06%。
NaCl胁迫下施用外源EBR后,苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量显著下降,K+、Ca2+、Mg2+含量显著升高(图3)。和NaCl处理相比,中苜3号和陇中苜蓿幼苗叶片中的Na+、Cl-含量分别降低了28.16%和22.24%、44.00%和24.86%,K+、Ca2+、Mg2+含量分别提高了35.62%和39.92%、36.27%和27.77%、62.44%和55.71%;茎秆中的Na+、Cl-含量分别降低了26.98%和15.34%、27.38%和18.17%,K+、Ca2+、Mg2+含量分别提高了8.42%和39.54%、32.14%和48.85%、52.31%和58.11%;根系中的Na+、Cl-含量分别降低了64.20%和48.90%、30.22%和24.19%,K+、Ca2+、Mg2+含量分别提高了135.63%和51.10%、36.31%和47.93%、104.37%和39.10%。
由表2可知,NaCl胁迫下,苜蓿幼苗不同器官(叶片、茎秆、根系)中的K+/Na+、Ca2+/Na+、Mg2+/Na+显著降低,Cl-/Na+显著升高。NaCl处理下中苜3号和陇中苜蓿幼苗叶片中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为CK的0.29和0.20倍、0.28和0.25倍、0.21和0.16倍,Cl-/Na+分别为CK的1.25和1.28倍;茎秆中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为CK的0.31和0.28倍、0.23和0.22倍、0.20和0.19倍,Cl-/Na+分别为CK的1.38和1.36倍;根系中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为CK的0.07和0.09倍、0.10和0.09倍、0.08和0.11倍,Cl-/Na+分别为CK的2.41和1.75倍。
NaCl胁迫下施用外源EBR后,苜蓿幼苗不同器官(叶片、茎秆、根系)中的K+/Na+、Ca2+/Na+、Mg2+/Na+显著升高,Cl-/Na+显著降低(表2)。施用外源EBR后,中苜3号和陇中苜蓿幼苗叶片中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为NaCl处理的1.89和1.80倍、1.90和1.64倍、2.27和2.00倍,Cl-/Na+分别为单独NaCl处理的0.86和0.80倍;茎秆中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为NaCl处理的1.48和1.65倍、1.81和1.76倍、2.09和1.86倍,Cl-/Na+分别为NaCl处理的0.81和0.82倍;根系中的K+/Na+、Ca2+/Na+、Mg2+/Na+分别为NaCl处理的6.60和2.96倍、3.81和2.90倍、5.75和2.72倍,Cl-/Na+分别为NaCl处理的0.53和0.84倍。
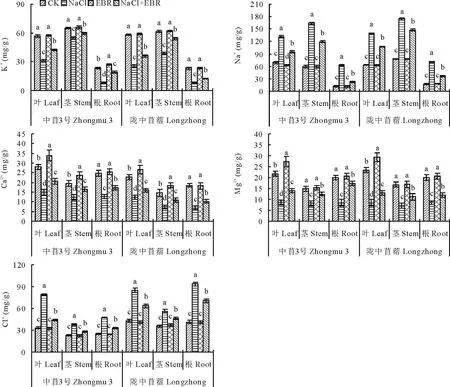
图3 外源EBR对NaCl胁迫下苜蓿幼苗中
2.4外源EBR对NaCl胁迫下苜蓿幼苗体内无机离子运输比的影响
由表3可知,NaCl胁迫下,中苜3号和陇中苜蓿幼苗体内K+、Ca2+、Mg2+由根部向茎秆的运输比显著提高,分别为CK的2.42和1.81倍、1.25和1.32倍、1.33和1.32倍,由茎秆向叶片的运输比显著降低,分别为CK的0.65和0.70倍、0.70和0.71倍、0.72和0.72倍。2个品种苜蓿幼苗体内Cl-、Na+由根部向茎秆的运输比显著降低,分别为CK的0.89和0.69倍、0.52和0.55倍;中苜3号幼苗体内Cl-、Na+由茎秆向叶片的运输比显著降低,分别为CK的0.74和0.69倍;陇中苜蓿幼苗体内Cl-由茎秆向叶片的运输比显著降低,为CK的0.67倍,而Na+由茎秆向叶片的运输比与CK无显著差异。
NaCl胁迫下施用外源EBR后,中苜3号和陇中苜蓿幼苗体内K+、Ca2+、Mg2+由根部向茎秆的运输比显著降低,分别为NaCl处理的0.46和0.71倍、0.76和0.72倍、0.74和0.83倍,由茎秆向叶片的运输比显著升高,分别为NaCl处理的1.25和1.15倍、1.22和1.32倍、1.15和1.16倍。中苜3号幼苗体内Cl-由根部向茎秆的运输比与NaCl处理无显著差异,陇中苜蓿幼苗体内Cl-由根部向茎秆的运输比显著升高,为NaCl处理的1.25倍;2个品种苜蓿幼苗体内Cl-由茎秆向叶片的运输比显著升高,分别为NaCl处理的1.21和1.27倍;2个品种苜蓿幼苗体内Na+由根部向茎秆的运输比显著升高,分别为NaCl处理的1.66和1.45倍;中苜3号幼苗体内Na+由茎秆向叶片的运输比显著升高,为NaCl处理的1.23倍,而陇中苜蓿幼苗体内Na+由茎秆向叶片的运输比与NaCl处理无显著差异。
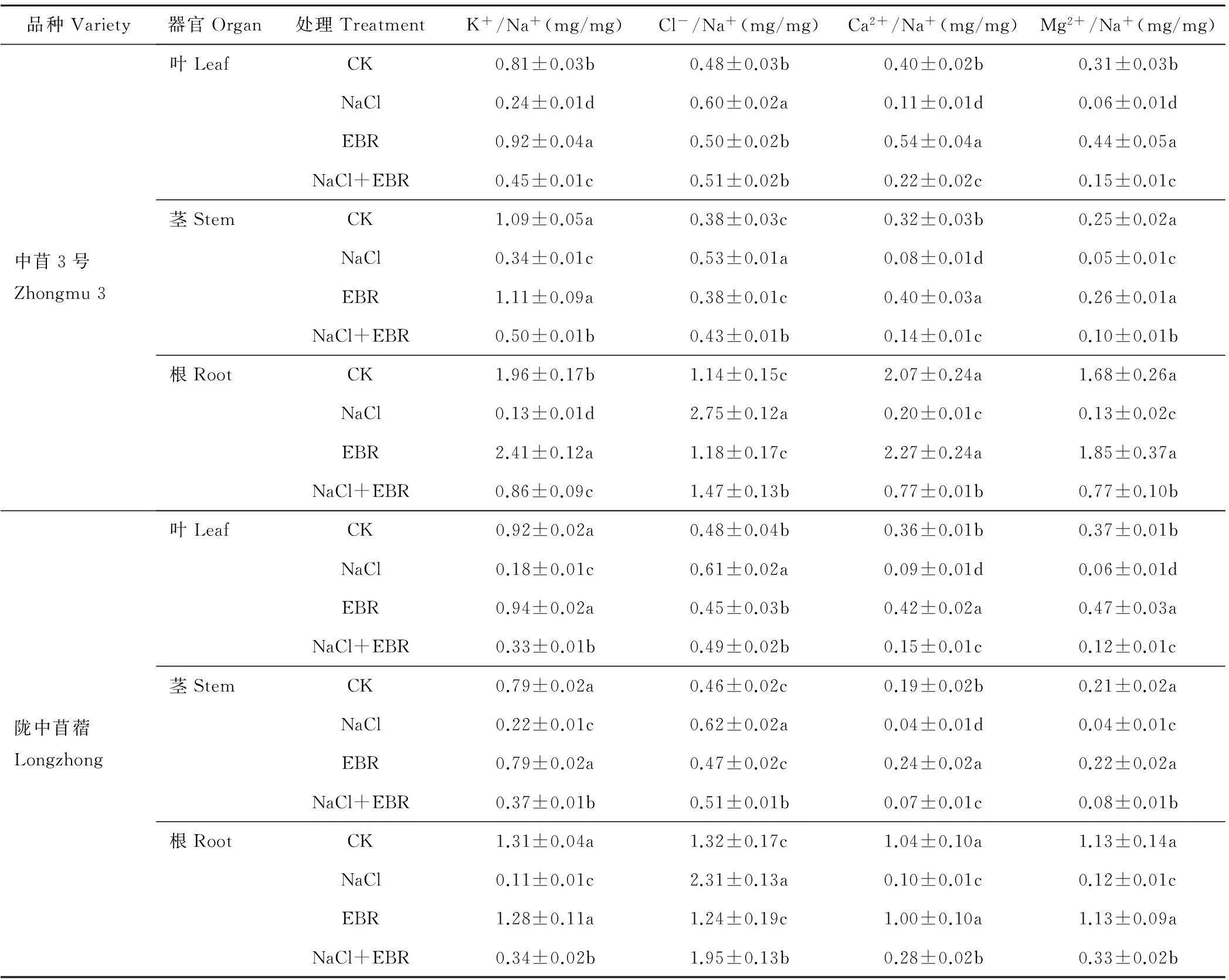
表2 外源EBR对NaCl胁迫下苜蓿幼苗中K+/Na+、Cl-/Na+、Ca2+/Na+、Mg2+/Na+的影响
2.5外源EBR对NaCl胁迫下苜蓿幼苗体内阳离子运输选择性比率的影响
BOOST电路控制方式有PFM模式和PWM模式,而本文设计选用PWM模式。利用状态空间平均法对BOOST电路进行数学模型建模的时候,需要满足以下 3 个假设条件[1-5,8-10]:
由表4可知,NaCl胁迫下,中苜3号和陇中苜蓿幼苗体内K+、Ca2+、Mg2+由根部向茎秆的运输选择性比率显著提高,分别为CK的4.62和3.26倍、2.38和2.38倍、2.51和1.80倍,K+、Ca2+由茎秆向叶片的运输选择性比率显著提高,分别为CK的1.35和1.68倍、1.43和1.52倍,而Mg2+由茎秆向叶片的运输选择性比率显著降低,分别为CK的0.75和0.71倍。NaCl胁迫下施用外源EBR后,2个品种苜蓿幼苗体内K+、Ca2+、Mg2+由根部向茎秆的运输选择性比率显著降低,分别为NaCl处理的0.61和0.56倍、0.74和0.61倍、0.63和0.68倍,K+、Ca2+由茎秆向叶片的运输选择性比率显著降低,分别为NaCl处理的0.89和0.80倍、0.87和0.84倍,而Mg2+由茎秆向叶片的运输选择性比率显著升高,分别为NaCl处理的1.15和1.23倍。
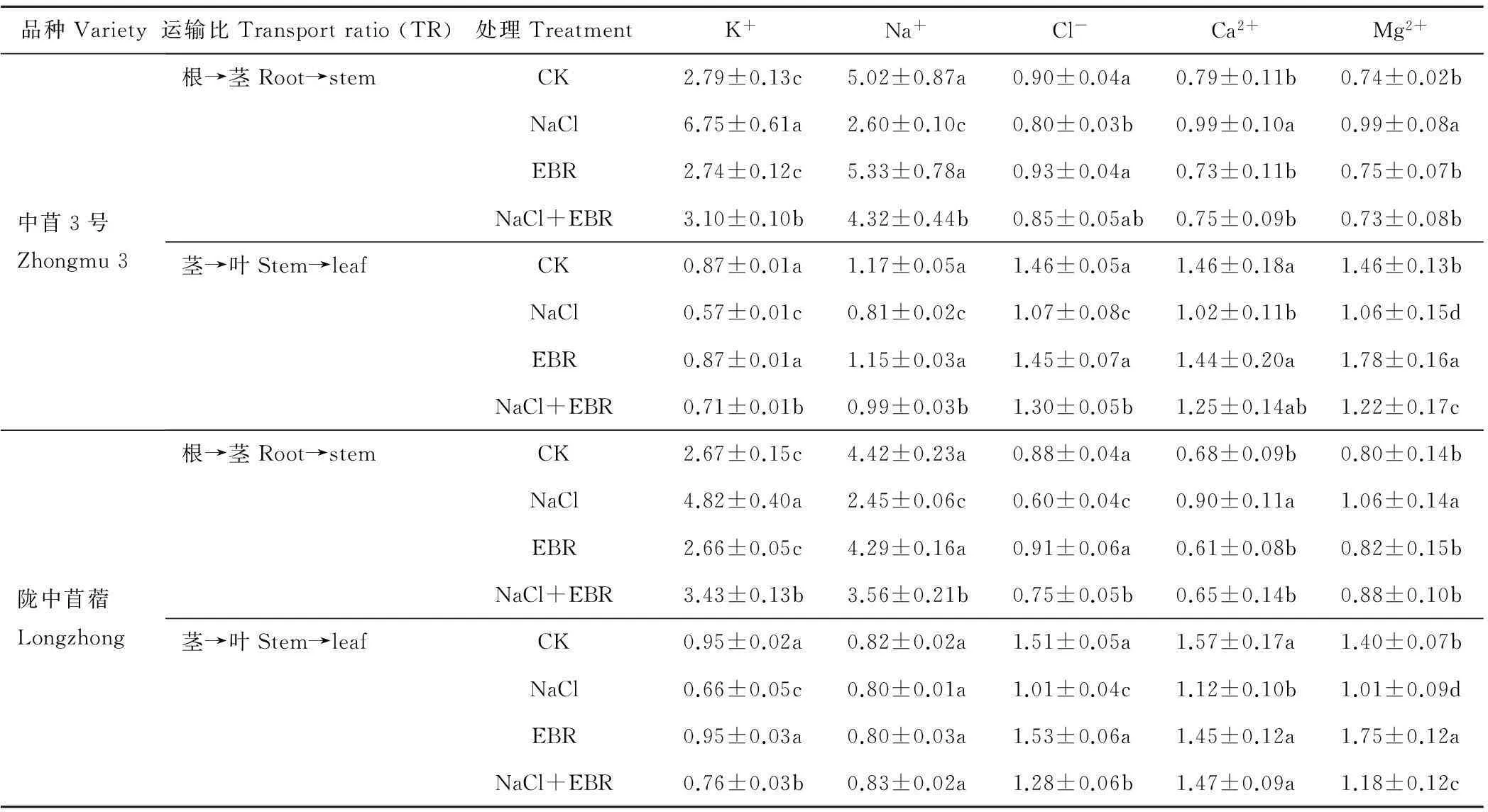
表3 外源EBR对NaCl胁迫下苜蓿幼苗体内无机离子运输比的影响
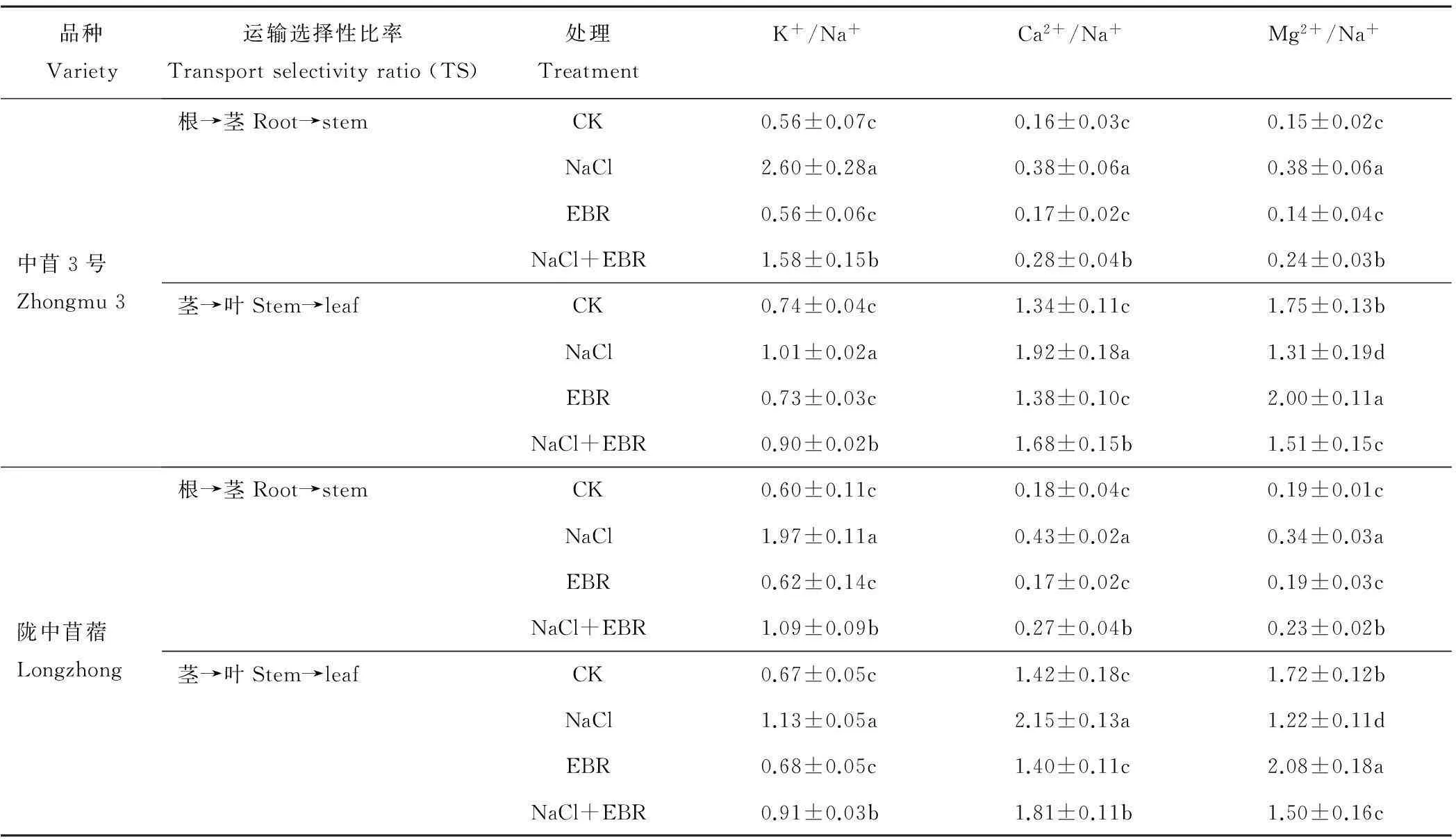
表4 外源EBR对NaCl胁迫下苜蓿幼苗体内阳离子运输选择性比率的影响
3讨论
3.1外源EBR对NaCl胁迫下苜蓿幼苗生物量及光合特性的影响
盐胁迫直接或间接影响植物的个体形态发育,对植物最普遍和最显著的效应就是抑制生长[23]。光合作用是植物体合成有机物质和获得能量的根本源泉,是植物生物量积累的基础。在植物光合系统中,Chla主要存在于PSⅠ、PSⅡ核心复合物及天线色素中,Chlb是PSⅠ、PSⅡ的天线组成成分[24],二者在光能吸收、电子传递过程中具有重要作用,其含量变化直接影响植物的光合速率和干物质的积累[25],Car在光能吸收、维持类囊体膜稳定性、能量分配、色素-蛋白复合物的降解以及光保持等方面起到重要作用[26]。此外,环境因子也会影响植物叶片中光合色素的含量和比例,进而影响植物对光能的吸收转化和利用[27]。本研究中,NaCl胁迫下紫花苜蓿幼苗叶片的Chla、Chlb和Car含量显著降低,Pn和生物量显著下降,说明NaCl胁迫下苜蓿幼苗叶绿素酶活性提高,加速了Chl的降解,抑制了Chl的合成,光系统及外周天线受到了损伤,叶绿体类囊体结构被破坏,从而降低了叶绿体对光能的吸收,导致紫花苜蓿幼苗光合速率和地上、地下生物量下降。Chla/Chlb代表类囊体的垛叠程度,Chla/Chlb越小,类囊体的垛叠程度越小,光抑制越强[28],而Chl/Car与植物耐受性有关,随着盐度升高,Chl/Car升高[29],因此本研究中Chla/Chlb值下降、Chl/Car值升高,也是光合作用降低的主要原因之一。
寇江涛和师尚礼[16,30]研究表明,喷施外源EBR可有效缓解NaCl胁迫对紫花苜蓿幼苗及根系生长的抑制作用,促进生物量的积累,但其机理尚不明确。本研究中,NaCl胁迫下施用外源EBR后,苜蓿幼苗叶片的Chla、Chlb、Chla+b、Chlx·c含量及Chla/Chlb值显著升高,Chl/Car值显著降低,究其原因可能是由于EBR能够保护叶绿体的结构和功能,维持类囊体膜的稳定性,促进了Chl的生物合成并抑制其降解,优化了光合电子传递途径,进而增强叶绿体对光能的吸收能力和利用效率,提高苜蓿幼苗的耐盐性。以上结论与玉米(Zeamays)[31]、水稻(Oryzasativa)[32]、番茄[33]上的研究结果一致。
逆境胁迫下植物光合作用下降的原因包括两类,由气孔的部分关闭导致的气孔限制因素和叶肉细胞光合活性下降导致的非气孔限制因素[34],根据Farquhar和Sharkey[35]的气孔限制值分析观点认为,Ci的大小是判定气孔限制和非气孔限制的依据,如果Gs和Ci同时下降,Pn下降主要是由气孔限制因素引起,如果Gs下降而Ci维持不变甚至上升,Pn下降则主要由非气孔限制因素所致。本研究表明,NaCl处理下苜蓿幼苗的Pn、Tr、Gs、WUE显著降低,Ci显著升高,说明NaCl胁迫下苜蓿幼苗Pn的下降是由于非气孔因素阻碍了CO2的利用所致,这与吴雪霞等[36]的研究结果一致。外源EBR处理减轻了NaCl胁迫下苜蓿幼苗Pn、Tr、Gs、WUE的下降程度,降低了Ci,这与张永平等[37]、李宁等[38]的研究结果相似。说明外源EBR能够通过维持一定程度的气孔导度,抑制NaCl胁迫下苜蓿幼苗叶肉细胞光合活性的下降,维持较高的光合速率。
3.2外源EBR对NaCl胁迫下苜蓿幼苗无机离子吸收、运输和分配的影响
NaCl胁迫下,高浓度盐离子(Na+、Cl-)的毒性效应和渗透效应改变了植物的营养平衡,致使植物营养匮乏、活性氧的氧化胁迫伤害加剧,从而影响植物正常生长代谢[39]。K+、Ca2+、Mg2+对调控植物的抗盐性具有重要作用[40]。本研究中,NaCl处理下苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量及Cl-/Na+显著升高,高浓度的Na+通过与K+、Ca2+、Mg2+等营养元素之间的相互竞争,减少对营养元素的吸收,Na+还会影响生物膜对离子的选择性吸收,进而影响根系对营养元素的吸收,导致苜蓿幼苗不同器官(叶片、茎秆、根系)中K+、Ca2+、Mg2+含量及K+/Na+、Ca2+/Na+、Mg2+/Na+显著降低,表明NaCl胁迫导致苜蓿植株体内的离子代谢发生紊乱。K+可促进植株的生长,增加气孔导度[41]。Ca2+有助于细胞生长和质膜稳定,是植物信号传导中第2信使,可与脱落酸、活性氧物质等一起参与植物抗逆性的信号传递和表达[42]。Mg2+是叶绿素合成的主要成分之一,能够促进光合作用、调节气孔关闭和呼吸作用,同时也影响Na+和K+的吸收、转运和细胞的离子平衡[43]。本研究中,NaCl胁迫下苜蓿幼苗叶片Na+含量增加,K+、Ca2+、Mg2+含量降低,和Chl、Pn、Gs的降低等结果相一致,束胜等[44]、吴雪霞等[45]也得到了类似的研究结果。外源EBR处理降低了NaCl胁迫下苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量及Cl-/Na+值,提高了K+、Ca2+、Mg2+含量及K+/Na+、Ca2+/Na+、Mg2+/Na+值,这与陆晓民和郭世荣[46]的研究结果相似,表明外源EBR能够调控NaCl胁迫下苜蓿幼苗营养元素的吸收、运输及分配,维持各器官离子平衡,有效缓解盐分离子对光合机构的破坏,提高苜蓿幼苗的耐盐性。
研究表明,盐胁迫环境能够影响苜蓿体内Na+、K+、Ca2+、Mg2+的吸收、运输和分配[47]。盐胁迫下,植物细胞可以通过吸收大量的无机离子来维持渗透势,但高浓度的无机离子特别是Na+会不可避免地对细胞中的代谢系统造成伤害[48]。本研究中,NaCl胁迫下苜蓿幼苗体内无机离子的运输比及阳离子的运输选择性比率发生紊乱,导致苜蓿幼苗体内盐分离子(Na+、Cl-)大量积累,从而引起苜蓿幼苗体内产生了离子毒害效应,同时苜蓿幼苗不同器官和组织对离子选择性吸收和运输的能耗增加,导致离子代谢紊乱[49]。外源EBR能够提高逆境胁迫下植物根系的活力水平[50],促进逆境胁迫下植物对K+、Ca2+、Mg2+等营养离子的吸收,增强植物对逆境胁迫的耐受性[46]。NaCl胁迫下施用外源EBR可有效调控苜蓿幼苗体内无机离子的运输比及阳离子的运输选择性比率,降低苜蓿幼苗对Na+、Cl-的吸收,促进对K+、Ca2+、Mg2+的选择性吸收和运输,使得苜蓿幼苗体内的离子分配平衡,从而有效缓解了NaCl胁迫苜蓿植株的离子毒害效应,提高苜蓿幼苗对盐胁迫的耐受性。这可能是由于外源EBR提高了NaCl胁迫下苜蓿幼苗的根系活力,促进根系中生长素的合成,同时外源EBR处理下苜蓿幼苗光合能力的提高,也有利于无机离子的吸收、运输和分配。
4结论
综上所述,150 mmol/L NaCl胁迫下,苜蓿幼苗叶片的光合色素含量和Pn显著降低,生长受到抑制,无机离子的吸收、运输和分配等代谢过程失调。NaCl胁迫下,施用0.1 μmol/L外源EBR后,苜蓿幼苗叶片的Chla、Chlb、Chla+b、Chlx·c含量及Chla/Chlb显著提高,Chl/Car显著降低,Pn、Tr、Gs、WUE均显著提高,光合能力增强,地上、地下生物量增加,同时苜蓿幼苗不同器官(叶片、茎秆、根系)中的Na+、Cl-含量及Cl-/Na+显著下降,K+、Ca2+、Mg2+含量及K+/Na+、Ca2+/Na+、Mg2+/Na+显著升高,并可有效调控苜蓿幼苗体内无机离子的运输比及阳离子的运输选择性比率。表明外源EBR能够有效缓解盐胁迫对苜蓿幼苗造成的光抑制,增强有机物的合成和积累,促进对无机离子的选择性吸收和运输,维持体内的离子代谢平衡,提高苜蓿幼苗的耐盐性。
References:
[1]Evelin H, Kapoor R, Giri B. Arbuscular mycorrhizal fungi in alleviation of salt stress: A review. Annals of Botany, 2009, 104: 1263-1280.
[2]Rozema J, Flowers T. Crops for a salinized world. Science, 2008, 322: 1478-1480.
[3]Jan A, Osman M B, Amanullah. Response of chickpea to nitrogen sources under salinity stress. Journal of Plant Nutrition, 2013, 36: 1373-1382.
[4]Apse M P, Aharon G S, Snedden W A,etal. Salt tolerance conferred by overexpression of a vacuolar Na+/H+ antiporter inArabidopsis. Science, 1999, 285: 1256-1258.
[5]Zhu J K. Plant salt tolerance. Trends in Plant Science, 2001, 6(2): 66-71.
[6]Zhu J K. Cell signaling under salt, water and cold stresses. Current Opinion in Plant Biology, 2001, 4(5): 401-406.
[7]Prasad P V V, Vu J C V, Boote K J,etal. Enhancement in leaf photosynthesis and upregulation of rubisco in the C4sorghum plant at elevated growth carbon dioxide and temperature occur at early stages of leaf ontogeny. Functional Plant Biology, 2009, 36: 761-769.
[8]Peng Y Q, Xie T, Zhou F,etal. Response of plant growth and photosynthetic characteristics inSuaedaglaucaandAtriplextriangularisseedlings to different concentrations of salt treatmengts. Acta Prataculturae Sinica, 2012, 21(6): 64-74.
[9]Kang Y Y, Yang X, Guo S R,etal. Effects of 2,4-epibrassinolide on carbohydrate metabolism and enhancement of tolerance to root-zone hypoxia in cucumber (CucumissativusL.). Scientia Agricultura Sinica, 2011, 44(12): 2495-2503.
[10]Ma M, Liu R, Zheng C F,etal. Regulation of exogenous brassinosteroid on growth of salt-stressed canola seedlings and its physiological mechanism. Acta Ecologica Sinica, 2015, 35(6): 1837-1844.
[11]Li N, Guo S R, Shu S,etal. Effects of exogenous 2,4-epibrassinolide on leaf morphology and photosynthetic characteristics of tomato seedlings under low light stress. Chinese Journal of Applied Ecology, 2015, 26(3): 847-852.
[12]Schlüter U, Köpke D, Altmann T,etal. Analysis of carbohydrate metabolism of CPD antisense plants and the brassinosteroids-deficientcbb1 mutant. Plant Cell and Environment, 2002, 25: 783-791.
[13]Yu J Q, Huang L F, Hu W H,etal. A role for brassinosteroids in the regulation of photosynthesis inCucumissativus. Journal of Experimental Botany, 2004, 55: 1135-1143.
[14]Munns R, Tester M. Mechanisms of salinity tolerance. Annual Review of Plant Biology, 2008, 59: 651-681.
[15]He X L, Chen S F, Wang Z H,etal. Effect of saline water irrigation on sand soil salt and the physiology and growth ofPopuluseuphraticaOliv. Acta Ecologica Sinica, 2012, 32(11): 3449-3459.
[16]Kou J T, Shi S L. Effect of 2,4-epibrassinolide on seed germination and seedling growth ofMedicagosativaunder salt stress. Grassland and Turf, 2015, 35(1): 1-8, 19.
[17]Arnon D I. Copper enzymes in isolated chloroplasts: polyphenol oxidase inBetavulgaris. Plant Physiology, 1949, 24: 1-15.
[18]Mao M F, Zhao B B, Yue W. Study on effect of diluted hydrochloric acid extracting metal elements in plant. Journal of Zhejiang Agricultural Sciences, 1985, (2): 29-35.
[19]Ji X J, Li C Y, Mao M F. Discussion on pretreatment method of chlorine determination in plant. Journal of Zhejiang Agricultural Sciences, 1997, (2): 89-91.
[20]Bao S D. Soil Agrochemical Analysis (The third edition)[M]. Beijing: China Agricultural Press, 2000.
[21]Zhang K, Zhang D Y, Wang L,etal. Study on the ionic absorption and transport inSalicorniaeuropaeaL. growing in natural habitats in Xinjiang. Arid Zone Research, 2007, 24(4): 480-486.
[22]Wang S M. Effects of salt stress on the characteristics of ion absorption and distribution inPuccinelliatenuirora. Acta Agresita Sinica, 1996, 4(3): 186-193.
[23]Cui J J, Zhang X H, Li Y T,etal. Effect of silicon addition on seedling morphological and physiological indicators ofGlycyrrhizauralensisunder salt stress. Acta Prataculturae Sinica, 2015, 24(10): 214-220.
[24]Zhu J, Liang Y C, Ding Y F,etal. Effect of silicon on photosynthesis and its related physiological parameters in two winter wheat cultivars under cold stress. Scientia Agricultura Sinica, 2006, 39(9): 1780-1788.
[25]Zhu X C, Song F B, Xu H W. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics of maize under low temperature stress. Chinese Journal of Applied Ecology, 2010, 21(2): 470-475.
[26]Merzlyak M N, Solovchenko A E. Photostability of pigments in ripening apple fruit: a possible photoprotective role of carotenoids during plant senescence. Plant Science, 2002, 163: 881-888.
[27]Wang L, Long X H, Meng X F,etal. Effects of salicylic acid on photosynthesis and ion absorptionHelianthustuberosusseedlings under NaCl stress. Chinese Journal of Ecology, 2011, 30(9): 1901-1907.
[28]Aro E M, McCaffery S, Anderson J M. Photo inhibition and D1 protein degradation in peas acclimated to different growth irradiances. Plant Physiology, 1993, 103: 835-843.
[29]Rout N P, Shaw B P. Salt tolerance in aquatic macrophytes: possible involvement of the antioxidative enzymes. Plant Science, 2001, 160: 415-423.
[30]Kou J T, Shi S L. 2,4-epibrassinolide protection aginest root growth inhibition and oxidative damage ofMedicagosativaL. seedling under NaCl stress. Chinese Journal of Eco-Agriculture, 2015, 23(8): 1010-1019.
[31]Shen X Y, Dai J Y, Hu A C. Studies on physiological effects of brassinolide (BR) on drought resistance in maize. Journal of Shenyang Agricultural University, 1990, 21(3): 191-195.
[32]Weng X Y, Jiang D A, Lu Q,etal. Effect of epi-brassinolid on grain yield and photosynthesis of rice. Journal of Zhejiang Agricultural University, 1995, 21(1): 51-54.
[33]Yin B, Liang G P, Jia W,etal. Exogenous EBR mediated the plant growth and absorption and accumulation of Cu, Fe and Zn in tomato seedlings under Cu stress. Chinese Journal of Eco-Agriculture, 2014, 22(5): 578-584.
[34]Steduto P, Albrizio R, Giorio P,etal. Gas exchange response and stomatal and non-stomatal limitations to carbon assimilation of sunflower under salinity. Environmental and Experimental Botany, 2000, 44: 243-255.
[35]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317-345.
[36]Wu X X, Yu L, Zhu W M. Effect of exogenous nitric oxide on chlorophyll fluorescence characteristics in tomato seedlings under NaCl stress. Chinese Journal of Eco-Agriculture, 2009, 17(4): 746-751.
[37]Zhang Y P, Yang S J, Chen Y Y. Effects of 2,4-epibrassinolide on antioxidant enzyme activities and photosynthesis in melon seedlings under high temperature stress. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(7): 1347-1354.
[38]Li N, Wang M Y, Sun J,etal. Effects of exogenous 2,4-epibrassinoloide on growth and photosynthesis of tomato seedlings under low light stress. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(7): 1395-1402.
[39]Zhao K F, Li F Z, Zhang F S. Halophyte Flora in China (The second edition)[M]. Beijing: Science Press, 2013.
[40]Zhang Z H, Liu Q, Song H X,etal. The salinity tolerance of rice (OryzasativaL.) genotypes as affected by nutrients (K+,Ca2+and Mg2+) at seedling stage. Scientia Agricultura Sinica, 2010, 43(15): 3088-3097.
[41]Ashraf M Y, Sarwar G. Salt tolerance potential in some members of brassicaceae physiological studies on water relations and mineral contents. Prospects for Saline Agriculture, 2002, 37: 237-245.
[42]Zhu X J, Yang J S, Liang Y C,etal. Effects of exogenous calcium on photosynthesis and its related physiological characteristics of rice seedlings under salt stress. Scientia Agricultura Sinica, 2004, 37(10): 1497-1503.
[43]Loupassaki M H, Chartzoulakis K S, Digalaki N B,etal. Effects of salt stress on concentration of nitrogen, phosphorus, potassium, calcium, magnesium and sodium in leaves, shoots and roots of six olive cultivars. Journal of Plant Nutrition, 2002, 25(11): 2457-2482.
[44]Shu S, Sun J, Guo S R,etal. Effects of distribution exogenous putrescine on PSⅡ photochemistry and ion of cucumber seedlings under salt stress. Acta Horticulture Sinica, 2010, 37(7): 1065-1072.
[45]Wu X X, Zhu Y L, Zhu W M,etal. Effects of exogenous nitric oxide on photosynthesis and ionic contents of tomato seedlings under NaCl stress. Plant Nutrition and Fertilizer Science, 2007, 13(4): 658-663.
[46]Lu X M, Guo S R. Effects of brassinolide on the polyamines roots of cucumber seedlings under hypoxia ATPase activity and stress. Chinese Journal of Ecology, 2013, 32(3): 611-614.
[47]Jing Y X, Yuan Q H. Effects of salt stress on seedling growth of alfalfa (Medicagosativa) and ion distribution in different alfalfa organs. Acta Prataculturae Sinica, 2011, 20(2): 134-139.
[48]Tester M, Davenport R. Na+tolerance and Na+transport in higher plants. Annals of Botany, 2003, 91(5): 503-527.
[49]Cheeseman J M. Mechanism of salinity tolerance in plants. Plant Physiology, 1988, 87: 547-550.
[50]Lu X M, Sun J, Guo S R,etal. Effects of brassinolide on the mitochondria antioxidant system and ultrastructure of cucumber seedling roots under hypoxic stress. Acta Horticulture Sinica, 2012, 39(5): 888-896.
参考文献:
[8]彭益全, 谢橦, 周峰, 等. 碱蓬和三角叶滨藜幼苗生长、光合特性对不同盐度的响应. 草业学报, 2012, 21(6): 64-74.
[9]康云艳, 杨暹, 郭世荣, 等. 2,4-表油菜素内酯对低氧胁迫下黄瓜幼苗碳水化合物代谢的影响. 中国农业科学, 2011, 44(12): 2495-2503.
[10]马梅, 刘冉, 郑春芳, 等. 油菜素内酯对盐渍下油菜幼苗生长的调控效应及其生理机制. 生态学报, 2015, 35(6): 1837-1844.
[11]李宁, 郭世荣, 束胜, 等. 外源2,4-表油菜素内酯对弱光胁迫下番茄幼苗叶片形态及光合特性的影响. 应用生态学报, 2015, 26(3): 847-852.
[16]寇江涛, 师尚礼. 2,4-表油菜素内酯对盐胁迫下紫花苜蓿种子萌发及幼苗生长的影响. 草原与草坪, 2015, 35(1): 1-8, 19.
[18]毛美飞, 赵冰波, 岳薇. 稀盐酸提取植物中金属元素的效果研究. 浙江农业科学, 1985, (2): 29-35.
[19]计小江, 李超英, 毛美飞. 植物内氯测定前处理方法探讨. 浙江农业科学, 1997, (2): 89-91.
[20]鲍士旦. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社, 2000.
[21]张科, 张道远, 王雷, 等. 自然生境下盐角草的离子吸收-运输特征. 干旱区研究, 2007, 24(4): 480-486.
[22]王锁民. 不同程度盐胁迫对碱茅离子吸收与分配的影响. 草地学报, 1996, 4(3): 186-193.
[23]崔佳佳, 张新慧, 李月彤, 等. 外源Si对盐胁迫下甘草幼苗形态及生理指标的影响. 草业学报, 2015, 24(10): 214-220.
[24]朱佳, 梁永超, 丁燕芳, 等. 硅对低温胁迫下冬小麦幼苗光合作用及相关生理特性的影响. 中国农业科学, 2006, 39(9): 1780-1788.
[25]朱先灿, 宋凤斌, 徐洪文. 低温胁迫下丛枝菌根真菌对玉米光合特性的影响. 应用生态学报, 2010, 21(2): 470-475.
[27]王磊, 隆小华, 孟宪法, 等. 水杨酸对NaCl胁迫下菊芋幼苗光合作用及离子吸收的影响. 生态学杂志, 2011, 30(9): 1901-1907.
[30]寇江涛, 师尚礼. 2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗根系生长抑制及氧化损伤的缓解效应. 中国生态农业学报, 2015, 23(8): 1010-1019.
[31]沈秀瑛, 戴俊英, 胡安畅. 油菜素内酯对玉米耐旱性的生理效应. 沈阳农业大学学报, 1990, 21(3): 191-195.
[32]翁晓燕, 蒋德安, 陆庆, 等. 表油菜素内酯对水稻产量和光合特性的影响. 浙江农业大学学报, 1995, 21(1): 51-54.
[33]尹博, 梁国鹏, 贾文, 等. 外源油菜素内酯介导Cu胁迫下番茄生长及Cu、Fe、Zn 的吸收与分配. 中国生态农业学报, 2014, 22(5): 578-584.
[36]吴雪霞, 于力, 朱为民. 外源一氧化氮对NaCl 胁迫下番茄幼苗叶绿素荧光特性的影响. 中国生态农业学报, 2009, 17(4): 746-751.
[37]张永平, 杨少军, 陈幼源. 2,4-表油菜素内酯对高温胁迫下甜瓜幼苗抗氧化酶活性和光合作用的影响. 西北植物学报, 2011, 31(7): 1347-1354.
[38]李宁, 王美月, 孙锦, 等. 外源2,4-表油菜素内酯对弱光胁迫下番茄幼苗生长及光合作用的影响. 西北植物学报, 2013, 33(7): 1395-1402.
[39]赵可夫, 李法曾, 张福锁. 中国盐生植物(第二版)[M]. 北京: 科学出版社, 2013.
[40]张振华, 刘强, 宋海星, 等. K+, Ca2+和Mg2+对不同水稻(OryzasativaL.)基因型苗期耐盐性的影响. 中国农业科学, 2010, 43(15): 3088-3097.
[42]朱晓军, 杨劲松, 梁永超, 等. 盐胁迫下钙对水稻幼苗光合作用及相关生理特性的影响. 中国农业科学, 2004, 37(10): 1497-1503.
[44]束胜, 孙锦, 郭世荣, 等. 外源腐胺对盐胁迫下黄瓜幼苗叶片PSⅡ光化学特性和体内离子分布的影响. 园艺学报, 2010, 37(7): 1065-1072.
[45]吴雪霞, 朱月林, 朱为民, 等. 外源一氧化氮对NaCl 胁迫下番茄幼苗光合作用和离子含量的影响. 植物营养与肥料学报, 2007, 13(4): 658-663.
[46]陆晓民, 郭世荣. 油菜素内酯对低氧胁迫黄瓜幼苗根系多胺、ATPase活性及无机离子含量的影响. 生态学杂志, 2013, 32(3): 611-614.
[47]景艳霞, 袁庆华. NaCl胁迫对苜蓿幼苗生长及不同器官中盐离子分布的影响. 草业学报, 2011, 20(2): 134-139.
[50]陆晓民, 孙锦, 郭世荣, 等. 油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响. 园艺学报, 2012, 39(5): 888-896.
Effect of exogenous 2,4-epibrassinolide on the uptake, transport, and disputation of ions, and photosynthetic characteristics ofMedicagosativaseedlings under NaCl stress
KOU Jiang-Tao, KANG Wen-Juan, MIAO Yang-Yang, SHI Shang-Li*
CollegeofGrasslandScience,GansuAgriculturalUniversity,KeyLaboratoryofEcosystemMinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-USCenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
Abstract:The aim of this study was to explore the salt resistance and physiological regulation mechanisms induced by exogenous 2,4-epibrassinolide (EBR) in alfalfa (Medicago sativa) seedlings. The effect of EBR on photosynthetic pigment contents, gas exchange parameters, and ion uptake, transport, and disputation in seedlings of M. sativa cv. Zhongmu No.3 and M. sativa cv. Longzhong under NaCl stress were investigated using a hydroponic method. In the 150 mmol/L NaCl stress treatment, alfalfa seedling leaves showed significant decreases in photosynthetic pigment contents and photosynthetic ability, and disrupted metabolic processes of ion uptake, transport, and disputation. When EBR at 0.1 μmol/L was supplied to seedlings under NaCl stress, the chlorophyll a, b, and a+b contents increased, the chlorophyll a/b increased, and the chlorophyll/carotenoid decreased. Also, the photosynthetic rate, transpiration rate, stomatal conductance, water use efficiency, and photosynthetic ability increased after 0.1 μmol/L EBR treatment. These changes would facilitate the accumulation of aboveground and underground biomass. In the NaCl-stressed seedlings treated with 0.1 μmol/L EBR, the Na+ and Cl- contents and the Cl-/Na+ in different organs (leaf, stem, and root) significantly decreased, and the contents of K+, Ca(2+), and Mg(2+) and the K+/Na+, Ca(2+)/Na+, and Mg(2+)/Na+ significantly increased. The transport ratio of inorganic ions and transport selectivity ratio of cations were effectively regulated in the seedlings treated with EBR. Together, these results show that EBR treatment effectively alleviated photo inhibition caused by NaCl stress in alfalfa seedlings, and promoted the synthesis and accumulation of organic matter. Treatment with EBR also improved the selective absorption and transport of inorganic ions, helping to maintain the metabolic ion balance and improve the NaCl-resistance of alfalfa seedlings.
Key words:Medicago sativa; NaCl stress; 2,4-epibrassinolide; photosynthesis; ion metabolism
*通信作者
Corresponding author. E-mail:shishl@gsau.edu.cn
作者简介:寇江涛(1986-),男,甘肃镇原人,在读博士。E-mail: koujiangtao@st.gsau.edu.cn
基金项目:国家现代牧草产业技术体系建设专项(CARA-35)和全国种质资源保种(NB2130135)资助。
*收稿日期:2015-06-05;改回日期:2015-11-09
DOI:10.11686/cyxb2015289
http://cyxb.lzu.edu.cn
寇江涛, 康文娟, 苗阳阳, 师尚礼. 外源2,4-表油菜素内酯对NaCl胁迫下紫花苜蓿幼苗光合特性及离子吸收、运输和分配的影响.草业学报, 2016, 25(4): 91-103.
KOU Jiang-Tao, KANG Wen-Juan, MIAO Yang-Yang, SHI Shang-Li. Effect of exogenous 2,4-epibrassinolide on the uptake, transport, and disputation of ions, and photosynthetic characteristics ofMedicagosativaseedlings under NaCl stress. Acta Prataculturae Sinica, 2016, 25(4): 91-103.

