沙蓬粗寡糖对GK大鼠胰岛素抵抗的影响
包书茵,韩淑英,澈力格尔,朝日雅,奥·乌力吉
(1.内蒙古民族大学,内蒙古通辽 028000;2.华北理工大学基础医学院,河北唐山 063000)
沙蓬粗寡糖对GK大鼠胰岛素抵抗的影响
包书茵1,2,韩淑英2,澈力格尔1,朝日雅1,奥·乌力吉1
(1.内蒙古民族大学,内蒙古通辽 028000;2.华北理工大学基础医学院,河北唐山 063000)
目的 观察沙蓬粗寡糖(AOS)对糖尿病GK大鼠降血糖、改善胰岛素抵抗作用,探讨可能机制。方法 将符合2型糖尿病GK大鼠随机分为模型对照组(MC)、格列苯脲组(GLB)、沙蓬粗寡糖高(AOS-H)、中(AOS-M)、低剂量组(AOS-L),以同源Wistar大鼠为正常对照(NC)。各组均灌胃给药8周,测定给药前后空腹血糖(FBG)、随机血糖(RBG)、糖耐量(OGTT);给药8周测定非空腹非糖负荷状态的给药前后血糖及血清胰岛素含量变化;结束时测空腹血清血糖(FPG)、胰岛素(FINS)、OGTT,计算胰岛素抵抗指数(HOMA-IR);取胰腺常规石蜡包埋,HE染色,观察其病理组织形态改变。结果 AOS对GK大鼠空腹血糖影响不明显,但明显降低随机血糖,改善糖耐量,增加胰岛素敏感性,且明显减小AUC(P<0.01),以中剂量效果更好,与格列苯脲相似;AOS能促进胰岛素释放,以AOS中、低剂量促胰岛素释放作用更强,在释放时间和释放量上均早于和强于格列本脲;AOS可抑制GK大鼠胰岛组织病理改变,增加胰岛及胰岛细胞数量,与模型组比较,AOS 给药组胰岛组织结构改变明显减轻。结论 AOS具有明显改善胰岛素抵抗和降低血糖作用,其机制可能是与快速促进胰岛素释放,增加胰岛细胞增值,改善胰岛功能有关。
沙蓬;粗寡糖;2型糖尿病;GK大鼠;胰岛素抵抗;血糖
胰岛素抵抗(insulin resistance,IR)是多种代谢疾病的病理基础,是引起2型糖尿病的关键机制,也是2型糖尿病的主要特征及病情进展的关键因素[1-2]。因此,改善IR药物的研究备受人们关注。GK大鼠(Goto-Kakizaki Rat)是国际公认的研究2型糖尿病较为理想的自发性非肥胖型动物模型[3],主要表现胰岛功能受损及胰岛素抵抗,与人类2型糖尿病发病因素及病程特点尤为相似,在新药研究与开发中具有重要价值[4]。沙蓬为藜科植物沙蓬Agriophyllum squarrosum(L.)Moq.的干燥地上部分,是中国蒙医常用传统药材,具有祛疫、清热、解毒、利尿功能,亦用于治疗消渴病[5-7]。目前尚未见有关沙蓬提取的粗寡糖(AOS)对胰岛素抵抗影响的研究报道。本实验应用AOS干预自发2型糖尿病GK大鼠,观察其对胰岛素抵抗的影响,为沙蓬的进一步开发应用提供研究基础。
1 材料
1.1 实验动物 ♂SPF级自发性2型糖尿病GK大鼠,体质量210~240 g,10~13周龄;购自上海斯莱克斯实验动物责任有限公司,许可证号:SCXK(沪)2012-0002;♂SPF级Wistar大鼠,体质量230 ~240 g,12~13周;购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0002;大鼠饲料购自中国解放军军事医学科学院,许可证号:SCXK(军)2014-0001;高脂饲料由北京华阜康生物科技股份有限公司提供,合格证号:SCXK(京)2009-0008;均于华北理工大学动物实验中心SPF级屏障实验室,以每笼5只进行饲养。
1.2 受试药物 沙蓬粗寡糖(AOS)由内蒙古蒙医药工程技术研究院提供。为沙蓬稀醇提取,大孔树脂纯化,脱色得粗寡糖。
1.3 主要药品、试剂 格列苯脲(glibenclamide)(天津太平洋制药有限公司,批号:1301120),葡萄糖氧化酶试剂盒(长春汇力生物技术有限公司,批号:20140505),CHO、TG、HDL-C、LDL-C试剂盒(北京瑞正善达生物工程技术有限公司,批号:20140330),胰岛素试剂盒(美国拜力生物科技有限公司,批号:20150505)。
1.4 实验仪器 电子天平(型号FA2104N,上海菁海仪器有限公司),高速低温离心机(型号5180R,德国Eppendorf公司),实验室超纯水制备系统(型号RODI-P,上海和泰仪器有限公司),生物安全柜(型号BSC-1300IIA2,上海博讯实业有限公司),γ放射免疫计数器(型号GC-1200,安徽中科中佳科学仪器有限公司),罗氏血糖仪及试纸(德国罗氏诊断有限公司),生物组织自动石蜡包埋机(型号TB718,湖北泰维科技实业有限公司),轮转式切片机(型号RM2245,德国Leica公司),电热恒温鼓风干燥机(型号DGG-9140A,上海森信实验仪器有限公司),高倍显微镜(型号OLYMPUS BX5,日本奥林巴斯有限公司),真彩病理图像分析系统(型号HMIAS-2000,高腾科技有限公司)。
2 方法
2.1 给药剂量与给药途径设计 受试药物沙蓬原药材临床用法与用量为65 g·d-1,相当于1.083 g ·kg-1生药(成人体质量按60 kg计算)。每克沙蓬粗寡糖(AOS)相当14.4 g生药,成人AOS用量为0.075 g·kg-1。大鼠与人的等效剂量比为6.3∶1,故大鼠治疗的等效剂量为0.475 g·kg-1(0.48),相当6.83 g·kg-1生药。大鼠实验时采用3个剂量,分别相当于人临床用量的2倍、1倍(等倍)及0.5倍。给药量分别为AOS 0.96、0.48、0.24 g·kg-1。给药途径为口服(灌胃),容量为5 ml·kg-1,每天一次,均为上午8~10点给药。格列苯脲给药剂量为1.2 mg·kg-1(为人用量6.3倍,相当于人等效量),给药容积为5 ml·kg-1。
2.2 2型糖尿病模型的确定标准 大鼠随机血糖及糖负荷2 h血糖均高于11.1 mmol·L-1,即认为已形成2型糖尿病。由于GK大鼠空腹血糖升高不明显(在4~8 mmol·L-1),随机血糖有1/2在11.1 mmol·L-1,糖负荷2 h有3/4血糖在11.1 mmol· L-1以上,因此随机血糖在11.1 mmol·L-1以下大鼠给予高脂饲料诱导4~5周。65只GK大鼠经5周的高脂饲料诱导,有53只(81.5%)大鼠随机血糖及糖耐量2 h血糖均高于11.1 mmol·L-1,即符合2型糖尿病模型。
2.3 分组与给药 将符合成模标准的53只大鼠,剔除体重较低或较高及血糖过高的3只大鼠,余下50只,按随机数字表法分为5组,加上正常对照组共6组,每组10只。分别为:模型对照组(MC)、格列苯脲组(GLB)、AOS高(AOS-H)、中(AOS-M)、低剂量组(AOS-L)、正常对照组(NC)。分组后,按设计灌胃给予相应药物,模型对照组与正常对照组每天灌胃同容积蒸馏水。各组均在上午8~10点灌胃给药,每天1次,连续8周。
2.4 观察指标
2.4.1 空腹和随机血糖 分别于给药前、后用罗氏血糖仪测定禁食16 h空腹血糖(fasting blood glu-cose,FBG)和非禁食的随机血糖(random blood glu-cose,RBG)(上午8:00给药后30 min)。
2.4.2 非葡萄糖负荷的血糖、胰岛素变化及糖耐量(OGTT) 给药7周进行非禁食情况下(上午8:00点)灌胃给药,分别于给药前(0 min)及给药后30、60和120 min用毛细管取眼眶静脉丛血,用血糖仪测定血糖,同时分离血清用放免法测定0、60、120 min的血清胰岛素含量,目的是观察药物对胰岛素释放的影响及与血糖关系;OGTT:给药8周(处死之前)用血糖仪测定葡萄糖耐量:即前一天晚上断食不断水,更换垫料,断食16 h后,用血糖仪检测0 min血糖值,灌胃葡萄糖(2.5 g·kg-1)后30、60、120 min血糖值,根据血糖值和梯形面积求和法计算曲线下面积(AUC),其中G0、G30、G60、G180为各点血糖值。AUC=15(G0+G30)+15(G30+G60)+30 (G60+G120)。
2.4.3 血清空腹血糖(FPG)、胰岛素(FINS)和胰岛素抵抗指数(HOMA-IR) 给药8周后禁食12 h,大鼠用10%水合氯醛以3 ml·kg-1腹腔注射麻醉,经腹主动脉取血并分离血清,用葡萄糖氧化酶法测定FPG(fasting plasma glucose,FPG),放射免疫法测定FINS含量并计算HOMA-IR,HOMA-IR=(FPG× FINS)/22.5。
2.4.4 大鼠胰腺组织HE染色病理观察 大鼠取血后,立即剖腹取胰腺,固定于4%多聚甲醛中(72 h以上)。将胰腺从固定液中取出,作常规石蜡包埋,HE染色。将染色的组织切片置于OLYMPUS BX50高倍显微镜下观察并用病理图像分析系统记录和拍照组织形态改变。
3 结果
3.1 AOS对GK大鼠FBG和RBG的影响 Tab 1显示,给药前后所有GK大鼠FBG和RBG均明显高于正常对照组(P<0.01),给药前、后各GK大鼠间FBG无差异(P>0.05);AOS干预8周后,与模型组比较,AOS各剂量组大鼠RBG明显降低(P<0.01),AOS 3个剂量之间无明显量效关系(P>0.05),以中剂量效果更好,与格列本脲相近。
Tab 1 Effect of AOS on FBG and RBG of GK rats(±s,n=10;mmol·L-1)

Tab 1 Effect of AOS on FBG and RBG of GK rats(±s,n=10;mmol·L-1)
△△P<0.01 vs normal group;**P<0.01 vs model group
Group Dose /mg·kg-1 FBG RBG 0 wk 8 wk 0 wk 8 wk CN - 4.33±0.54 4.62±0.53 5.25±0.49 5.60±0.54 MC - 5.66±0.58△△ 5.64±0.29△△ 13.45±1.57△△ 17.49±2.88△△GLB 1.2 5.61±0.97△△ 5.84±0.97△△ 13.57±1.52△△ 〗9.07±1.07**△△AOS-H 960 5.68±1.13△△ 5.71±0.43△△ 13.65±2.48△△ 11.58±3.02**△△AOS-M 480 5.89±0.91△△ 5.63±0.50△△ 13.97±2.70△△ 11.10±3.85**△△AOS-L 240 5.63±1.51△△ 5.67±0.64△△ 13.87±2.55△△ 12.39±1.97**△△
Tab 2 Effect of no sugar load status blood glucose and elevated blood sugar percentage of GK rats(±s,n=7;mmol·L-1)

Tab 2 Effect of no sugar load status blood glucose and elevated blood sugar percentage of GK rats(±s,n=7;mmol·L-1)
△△P<0.01 vs normal group;*P<0.05,**P<0.01 vs model group;“-”indicates reduction
Group 0 min 30 min(↑%) 60 min(↑%) 120 min(↑%)CN 5.31±0.55 5.54±0.55 (4.35±0.39)5.77±0.43 (8.41±0.47)5.66±0.64 (6.68±0.57)9.72±1.4.24△△**(-17.64±2.48△△**)AOS-M 11.04±2.82△△** 10.17±1.87△△**(-7.74±1.28△△**)MC 14.28±2.99△△ 16.08±1.78△△(12.61±1.27△△)17.18±0.94△△(20.58±3.23△△)8.86±2.09△△**(-21.10±3.35△△**)AOS-H 12.13±1.95△△* 11.29±1.48△△**(-6.76±1.05△△**)16.28±3.41△△(14.71±2.06△△)GLB 11.23±2.28△△** 11.06±2.05△△**(-1.52±0.54△△**)10.19±2.18△△**(-9.53±2.35△△**)11.17±1.11△△**(-7.44±1.08△△**)8.74±0.82△△**(-20.83±3.53△△**)AOS-L 12.41±2.851△△* 11.38±2.04△△**(-9.65±2.10△△**)9.28±1.10△△**(-15.94±2.47△△**)11.51±2.27△△**(-7.25±1.59△△**)10.68±1.69△△**(-13.94±2.25△△**)
Tab 3 Effect of no sugar load status serum insulin and elevated serum insulin percentage of GK rats(±s,n=7;μg·L-1)

Tab 3 Effect of no sugar load status serum insulin and elevated serum insulin percentage of GK rats(±s,n=7;μg·L-1)
△P<0.05,△△P<0.01 vs normal group;*P<0.05,**P<0.01 vs model group;“-”indicates reduction
Group 0 min 30 min(↑%) 60 min(↑%) 120 min(↑%)CN 0.99±0.35 1.07±0.28 (8.01±1.51)1.31±0.181 (32.36±0.47)1.35±0.15 (36.3±4.46)1.13±0.35 (94.82±16.83△△**)AOS-M 0.42±0.22△* 0.64±0.28△(52.38±6.26△△**)MC 0.86±0.35 0.85±0.36△(-1.11±0.33△△)0.82±0.32△△(-4.65±1.26△△)1.16±0.34 (78.89±12.62△△**)AOS-H 0.58±0.19 0.61±0.27△(5.17±1.12△△**)1.01±0.31△(17.09±4.37△△)GLB 0.65±0.47 0.80±0.29△(23.08±3.83△△**)0.92±0.36 (41.45±6.27△**)0.63±0.22△△(8.63±2.41△△**)1.07±0.26△△(154.75±15.74△△**)AOS-L 0.32±0.18△△* 0.49±0.23△△(53.13±8.46△△**)0.68±0.31△△(61.91±9.41△△**)0.52±0.23△△(62.65±8.35△△**)0.93±0.32△(190.63±15.51△△**)
3.2 AOS对GK大鼠非葡萄糖负荷的血糖、胰岛素的影响 Tab 2~3和Fig 1~2为非禁食非糖负荷情况下观察(上午8点)灌胃给药前(0 min)、后(30、60、120 min)血糖和血清胰岛素变化情况,目的是观察AOS对胰岛素释放的影响及与血糖的关系。结果显示。正常对照大鼠血糖略有升高,而GK模型组大鼠血糖明显升高,可能是由于眼眶取血对大鼠应激性刺激使血糖升高;格列本脲及AOS各剂量组大鼠血糖并未升高;反而有不同程度降低。与灌胃给药前比较,灌胃给药30 min AOS各组血糖就开始降低,血糖降低百分率明显高于格列本脲;给药60 min血糖降低百分率以AOS中剂量最明显(15.94%),其次是格列本脲(9.53%);120 min血糖降低百分率AOS中剂量组(20.83%)与格列本脲(21.10%)非常相近,其次为AOS高(17.64%)、低(13.94%)剂量,见Fig 1、Tab 2。

Fig 1 Effect of AOS on no sugar load status before and after dosing changes in blood glucose of GK rats
从Tab 3和Fig 2可见,正常大鼠胰岛素水平随着血糖升高而增加,以120 min增加更明显;与0 min比较,模型对照组胰岛素升高百分比在30 min 和60 min为0,在120 min有低幅度升高;格列本脲和AOS各剂量组均能升高血清胰岛素水平,并且血清胰岛素含量与血糖水平呈负相关;虽然在不同剂量AOS组各时间点胰岛素含量上均低于格列本脲,但与0 min比较,AOS各点胰岛素含量提高百分率均明显高于格列本脲(P<0.01),以AOS中、低剂量升高更明显。提示AOS可促进胰岛素释放,在释放时间和释放量上均早于和强于格列本脲。

Fig 2 Effect of AOS on no sugar load status before and after dosing changes in serum insulin level of GK rats
3.3 AOS对GK大鼠OGTT的影响 给药8周后OGTT结果显示,与模型组比较,AOS对葡萄糖负荷后的血糖升高均有明显抑制作用,以AOS中剂量血糖降低幅度最大(P<0.01),AUC最小;其次是AOS低、高剂量(P<0.01);AOS降血糖作用好于格列本脲(P<0.05);AOS各剂量间差异不明显,见Tab 4。
3.4 AOS对GK大鼠FPG、FINS及HOMA-IR的影响 给药8周后禁食12 h,各组GK大鼠FPG明显高于正常对照组(P<0.01),与模型组比较,GLB 和AOS-M组FPG值明显降低(P<0.05),AOS-H与AOS-L组FPG值也较低,但与模型组比较差异无统计学意义(P>0.05);FINS含量以正常对照组最高,明显高于各组GK大鼠(P<0.05,P<0.01),各药物干预组FINS含量与模型组比较无统计学差异;而各药物干预组HOMA-IR均低于模型组(P<0.05,P<0.01),其中以AOS-M最低,AOS高、中、低剂量组间差异无统计学意义(P>0.05)。见Tab 5。
Tab 4 Effect of AOS on glucose tolerance of GK rats(±s,n=10;mmol·L-1)

Tab 4 Effect of AOS on glucose tolerance of GK rats(±s,n=10;mmol·L-1)
△△P<0.01 vs normal group;*P<0.05,**P<0.01 vs model group
Group 0 min 30 min 60 min 120 min AUC CN 4.62±0.53 6.59±0.61 6.91±0.70 5.48±0.74 742.35±82.9 MC 5.64±0.29△△ 16.10±1.73△△ 15.84±1.59△△ 15.31±1.5△△ 1827.30±185.36△△GLB 5.84±0.97△△ 14.47±1.33△△* 13.71±1.79△△** 9.11±2.05△△** 1407.96±186.38△△**AOS-H 5.71±0.43△△ 12.81±2.14△△** 11.56±2.08△△** 10.19±1.90△△** 1295.77±221.38△△**AOS-M 5.63±0.50△△ 11.05±2.74△△** 10.02±2.36△△** 8.12±1.13△△** 1110.45±229.23△△**AOS-L 5.67±0.64△△ 12.43±3.00△△** 10.81±1.71△△** 9.30±1.83△△** 1222.95±231.33△△**
Tab 5 Effect of AOS on FPG,FINS and HOMA-IR of GK rats(±s,n=10)

Tab 5 Effect of AOS on FPG,FINS and HOMA-IR of GK rats(±s,n=10)
△P<0.05,△△P<0.01 vs normal group;*P<0.05,**P<0.01 vs model group
Group FPG/mmol·L-1 FINS/ng·L-1HOMA-IR CN 4.91±0.52 0.75±0.16 0.16±0.04 MC 6.87±0.60△△ 0.59±0.16△ 0.18±0.05△GLB 6.21±0.49△△* 0.62±0.17△ 0.17±0.01*AOS-H 6.29±0.57△△ 0.57±0.15△△ 0.16±0.03*AOS-M 6.16±0.62△△* 0.56±0.11△△ 0.15±0.04**AOS-L 6.28±0.67△△ 0.58±0.17△ 0.16±0.03*
3.5 AOS对GK大鼠胰腺病理组织结构的影响正常大鼠胰岛为圆形、椭圆形细胞团,与周围组织界限清晰,形态规则,胰岛数及胰岛内细胞数较多,胰岛细胞胞质丰富,核圆、较大且居中,未见异常(Fig 3A);GK模型大鼠胰岛与周围组织界限模糊不清,形态不规则,部分胰岛细胞完全萎缩,胞质疏松或空泡化,间质明显增生,胰岛组织出现明显的纤维化(Fig 3B);与模型组相比,格列本脲(Fig 3C)组大鼠胰岛形态有所改善,但也存在胰岛数量减少,形状不规则,胰岛内细胞数和体积较模型组有所增加;AOS高(Fig 3D)、中(Fig 3E)、低剂量(Fig 3F)组大鼠胰岛与周围组织界限较清晰,形态稍不规则,胰岛细胞排列基本整齐,细胞间质少量增生,同时可见散在胰岛细胞团块增殖,特别是在血管周围出现胰岛细胞增殖现象,尤其是AOS中剂量胰岛体积较大,与周围组织分布界线较清晰,胰岛细胞排列较整齐,出现散在胰岛细胞团,胰岛细胞增殖现象更明显。
4 讨论
2型糖尿病早期阶段以胰岛素抵抗为主,随着病程延长,胰岛β细胞功能逐渐减退,胰岛素分泌减少,使得2型糖尿病病情进一步恶化。目前对糖类的降血糖作用研究主要集中在多糖成分,而对寡糖的降血糖作用研究尚较少[8]。更未见有关沙蓬粗寡糖(AOS)对胰岛素抵抗影响的研究报道。本实验应用AOS高、中、低剂量干预GK大鼠,考察了AOS的降糖和改善胰岛素抵抗作用,并探讨可能机制。
本实验显示,GK大鼠主要特点为空腹血糖升高不明显,并且随着空腹时间延长,血糖反而逐渐降低;但餐后血糖及非空腹血糖(随机血糖)明显升高,随着大鼠周龄的增加而升高;同时发现胰岛及β细胞数量减少、有明显胰岛素抵抗,非常符合2型糖尿病特点,与文献报道一致[9-10]。AOS能明显降低GK大鼠随机血糖(P<0.01),增加胰岛素释放,改善胰岛素抵抗,促进胰岛细胞增殖/和抑制胰岛细胞凋亡。
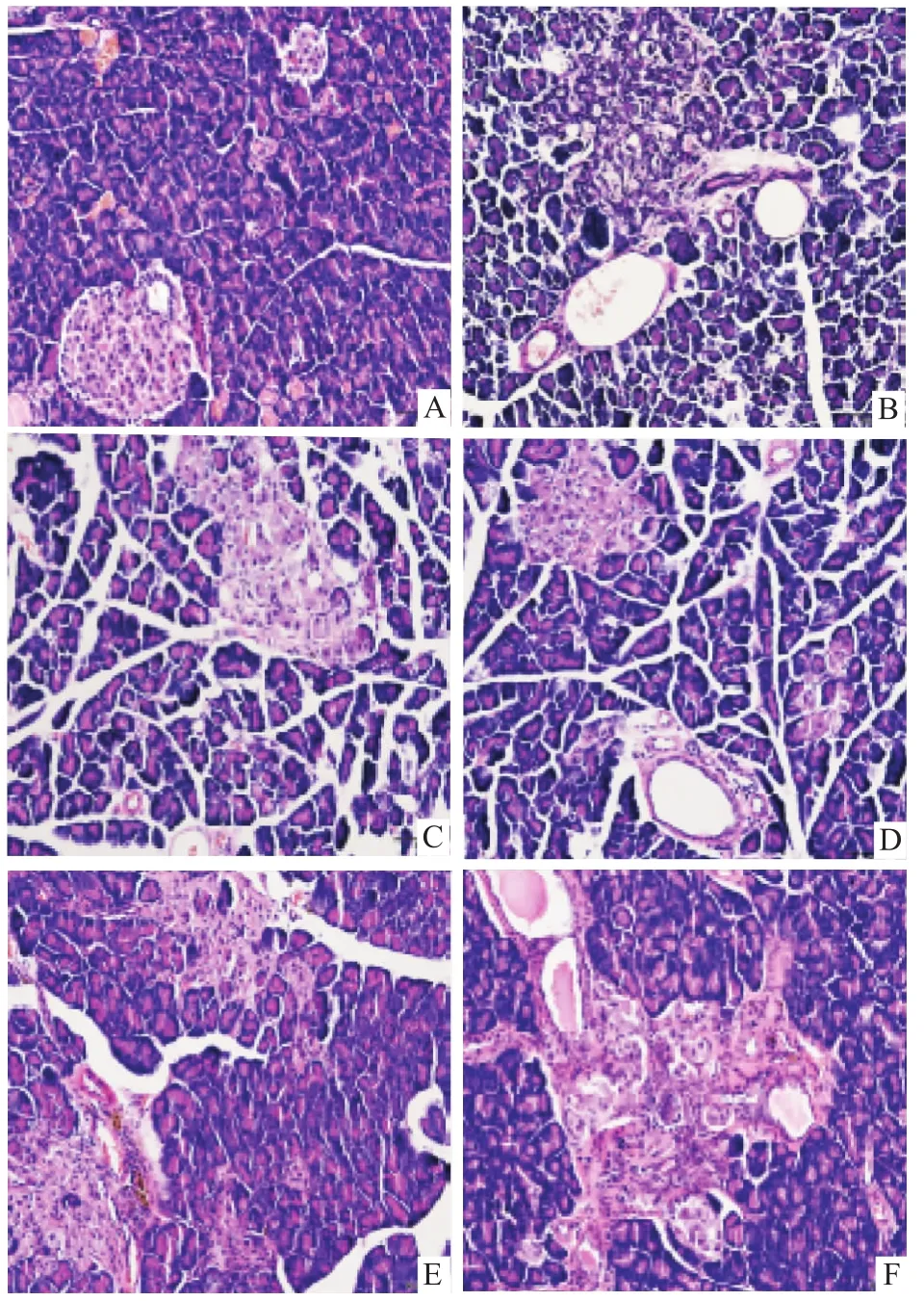
Fig 3 Effect of AOS on pancreatic pathology organization structure of GK rats
AOS对GK大鼠空腹12 h血糖有降低作用,而对空腹16 h血糖无影响,但能明显降低随机血糖及糖负荷后的血糖,说明AOS对糖尿病GK大鼠血糖有稳定作用。AOS各剂量之间无明显量效关系(P >0.05),其中,中剂量使大鼠RBG下降最为明显,与格列本脲的结果相近,说明其效果更好。为探讨AOS降糖作用的机制,考察了在非糖负荷非空腹状态下,应用AOS后血糖变化与胰岛素释放情况,排除了糖负荷刺激胰岛细胞释放胰岛素的可能。结果发现GK模型大鼠血糖明显升高,可能是由于眼眶取血对大鼠应激性刺激使血糖升高,同时GK模型大鼠血清胰岛素在30~60 min低于0 min,到120 min较0 min增加了17%,这符合2型糖尿病特点;灌胃给药60 min,AOS中剂量的血糖降低百分率比格列本脲的大;120 min时AOS中剂量组与格列本脲相近;各剂量AOS均能升高血清胰岛素水平,并且血清胰岛素含量与血糖水平呈负相关;与0 min比较,AOS给药组各点胰岛素含量提高百分率均明显高于格列本脲(P<0.01),以AOS中、低剂量升高更明显。提示AOS可促进胰岛素释放,在时间和剂量上均早于和强于格列本脲。进一步OGTT实验也显示,AOS对糖负荷后的血糖升高也有抑制作用,明显降低AUC,其中AOS中剂量降低AUC最明显。2型糖尿病患者胰岛素分泌特点是,第一时相项分泌消失,第二时相项分泌迟缓(峰值后移)[11-12]。本研究证明AOS应用后第一时相项即能促进胰岛素分泌,提示其对糖尿病餐食血糖调节可能更好。
令人兴奋的是不管是空腹还是非空腹血清胰岛素,在给AOS前均低于模型组,进一步证明AOS促进胰岛素的释放。同时发现,AOS能降低HOMA-IR,以AOS-M最明显,表明AOS能降低胰岛素抵抗,增加胰岛素敏感性,降糖作用可能还存在其它降糖机制。
胰岛β细胞具有一定的自我复制和再生功能,且不需要特定的祖细胞或干细胞参与分化[13-14],因此如何长期维持胰岛β细胞的数量和正常功能以及促进β细胞增殖已成为治疗糖尿病的关键因素之一[15-16]。有研究表明,维持胰岛细胞功能最直接有效的方法就是利用药物或其他因子在胰腺内刺激胰岛β细胞增殖或诱导其他细胞向胰岛β细胞转化[17]。本研究通过显微镜观察胰岛组织病理形态结构发现,AOS可使糖尿病GK大鼠胰岛组织病变有不同程度改善,使胰岛体积增大,增加胰岛及胰岛细胞数量,特别是在血管周围出现散在胰岛细胞团块,认为AOS可促进胰岛细胞增殖。可能是AOS中的成分刺激胰岛β细胞增殖或诱导其他细胞向胰岛β细胞转化或抑制胰岛β细胞凋亡,值得深入研究。
综上所述,AOS对自发性2型糖尿病GK大鼠有明显降低随机血糖、改善糖耐量、降低胰岛素抵抗,其中中剂量的结果与格列本脲相近,或是优于格列本脲,说明AOS中剂量效果最好。同时中剂量组比高剂量组的剂量小一倍,从经济方面考虑,其亦为最佳剂量。AOS作用机制可能是快速促进胰岛素释放,促进胰岛细胞增殖,但确切机制有待进一步研究。
(致谢:本研究及论文实验内容是在华北理工大学实验动物中心、基础医学院、河北省慢性疾病重点实验室及唐山市慢性病临床基础研究重点实验室完成的,在药物提取及制备过程中白明刚老师给予很大帮助及支持,在此一并表示衷心感谢!)
[1] 陆菊明.胰岛素抵抗与2型糖尿病的发生发展[J].药品评价,2014,11(23):12-5.
[1] Lu J M.Insulin resistance and type 2 diabetes[J].Drug Evalua-tion,2014,11(23):12-5.
[2] Laakso M,Zilinskaite J,Hansen T,st al.Insulin sensitivity,insu-lin release and glucagon-like peptide-1 levels in persons with im-paired fasting glucose and/or impaired glucose tolerance in the EU-GENE2 study[J].Diabetologia,2008,51(3):502-11.
[3] Janssen U,Phillips AO,Floege J.Rodent models of nephropathy associated with typeⅡdiabetes[J].J Nephrol,1999,12(3):159 -72.
[4] Partha B.Programmed disorders of beta-cell development and function as one cause of for type 2 diabetes he GK rat paradigm [J].Diabetes Metab Res Rev,2005,21(6):495-504.
[5] 国家中医药管理局中华本草编委会.中华本草,蒙药分卷[M].上海:上海科学技术出版社,2000:236.
[5] The state administration of traditional Chinese medicine of Chinese materia medica editorial board.Chinese Materia Medica,Mongoli-an part[M].Shanghai:Shanghai Scientific and Technical Pub-lishers,2000:236.
[6] 朱亚民.内蒙古植物药志[M],第1卷.呼和浩特:内蒙古人民出版社,2000:299.
[6] Zhu Y M.Inner Mongolia plant medicine[M],Volume 1.Hohhot :Inner Mongolia People’s Publishing House,2000:299.
[7] 清·占布拉道尔吉.无误蒙药鉴[M].呼和浩特:内蒙古人民出版社,1988:144-5.
[7] Qing·ZHAN Bu-la-dao-er-ji.Correct Mongolian guide[M].Ho-hhot:Inner Mongolia People’s Publishing House,1988:144-5.
[8] 郭丽民,张汝学,贾正平.寡糖的药理作用和机制研究进展[J].中成药,2006,28(9):1353-6.
[8] Guo L M,Zhang R X,Jia Z P.Oligosaccharide’s research pro-gress of pharmacological action and mechanism[J].Chin Tradit Patent Med,2006,28(9):1353-6.
[9] 徐 倍,吴国亭,韩玉麒,盛春君,等.2型糖尿病GK大鼠病程进展与组织形态学改变[J].同济大学学报(医学版),2007,28(5):17-25.
[9] Xu B,Wu G T,Han Y Q,Sheng C J,et al.Relationship of pro-gressive course and morphologic changes in spontaneously diabetic Goto-Kakizaki rats[J].J Tongji Univ(Med Sci),2007,28(5):17-25.
[10]顾 迁,高 鑫,徐 平,等.GK糖尿病大鼠生物学特性观察[J].中国比较医学杂志,2007,17(12):688-92.
[10]Gu Q,Gao X,Xu P,et al.Observation of biological characteris-tics of GK rat a new model of type 2 diabetes[J].Chin J Compar Med,2007,17(12):688-92.
[11]林 敏,杨 明,张 敏,等.糖尿病患者胰岛素释放峰值后移的临床意义及其与胰岛β细胞功能的相关性研究[J].实用医院临床杂志,2011,8(6):83-5.
[11]Lin M,Yang M,Zhang M,et al.Clinical significance of delayed peak of insulin release in diabetics and its correlation with function of islet beta cell[J].Pract J Clin Med,2011,8(6):83-5.
[12]Lei Q.B-cell dysfunction and insulin screasetion with type 2 Dia- betes[J].Diabetes Metab Res Rev,2009,25:144-9.
[13]Meier J J,Butler A E,Saisho Y,et al.Beta-cell replication is the primary mechanism subserving the postnatal explication of beta-cell mass in humans[J].Diabetes,2008,57(6):1584-94.
[14]Seaberg R M,Smukler S R,Kieffer T J,et al.Clonal identifica-tion of multipent precursors from adult mouse pancreas hant gener-ate neural and pancreatic lineages[J].Nat Biotechnol,2004,22 (9):1115-24.
[15]Pittenger G L,Taylor-Fishwick D,Vinik A I.A role for islet neo-genesis in curing diabetes[J].Diabetologia,2009,52(5):735 -8.
[16]庾璐婷,杨孟奇,王 彤,等.重组Reg3α蛋白促进胰岛β细胞增殖活性及其机制的研究[J].药物生物技术,2014,21 (6):487-93.
[16]Yu L T,Yang M Q,Wang T,et al.Proliferation of pancreatic is-let β cell stimulated by recombinant reg3α protein[J].Pharma-ceut Biotechnol,2014,21(6):487-93.
[17]章 毅,刘云峰,高瞡英,等.染料木黄酮对大鼠胰岛素分泌的调控作用[J].中国药理学通报,2015,31(5):737-8.
[17]Zhang Y,Liu Y F,Gao J Y,et al.Regulatory effects of genistein on insulin secretion from rat pancreatic cells[J].Chin Pharmacol Bull,2015,31(5):737-8.
Effects of agiophyllum oligo saccharides on insulin resistance of Goto-Kakizaki rats
BAO Shu-yin1,2,HAN Shu-ying2,Cheli-geer1,Chao-riya1,AO·Wu-liji1
(1.Inner Mongolia University for Nationalities,Tongliao Inner Mongolia 028300,China;2.School of Basic Medical Sciences,North China Universitiy of Science and Technology for Hebei,Tangshan Hebei 063000,China)
Aim To observe the effect of agiophyllum oligo saccharides(AOS)on reducing blood sugar,im-proving insulin resistance on diadetic Goto-Kakizaki (GK)rats,and to explore the possible mechanism.Methods The type 2 diabetes GK rats were divided into six groups:model control group(MC),Glenn benzene urea group(GLB),high agriophyllum squar-rosum coarse oligosaccharides(AOS-H),medium (AOS-M),low dose group(AOS-L),homologous Wistar rats as normal control(NC).All animals were administered with AOS by oral gavage,for 8 weeks.The fasting blood glucose(FBG),random blood sugar (RBG),glucose tolerance(OGTT)were tested before and after administration.No fasting sugar load status before and after dosing changes in blood glucose and serum insulin level in rats were measured in the previ-ous 8 weeks.At the end of administration,the fasting serum glucose(FPG),insulin(FINS),OGTT and in-sulin resistance index(HOMA IR)in fasting rats were analyzed.Lastly,the pathological changing of pancreas was observed by HE staining.Results The blood glu- cose of fasting GK rats was not influenced after using AOS.However,the random blood glucose significantly reduced,the glucose tolerance was improved and AUC was obviously reduced(P<0.01)after using AOS.The best effect was on AOS-M group,which was simi-lar with Glenn benzene urea.Through our research,we found AOS could promote release of insulin.This best effect was on AOS-M and AOS-L groups,and the time and quantity of release were better than Glenn benzene urea.Finally,AOS inhibited the pathological changes of islet tissue on GK rats,increased the quan-tity of pancreas and islet cells.Compared with model group,the changing of islet structure was significantly reduced in AOS group.Conclusion AOS could obvi-ously improve insulin resistance and lower blood sugar,and the mechanism of this effect may be related with rapidly promoting insulin release,increasing the islet cell proliferation,and improving the function of islet.Key words:agriophylli herba;crude oligosaccha-rides;type 2 diabetes mellitus;Goto-Kakizaki rat;insu-lin resistance;blood sugar
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.042.html
10.3969/j.issn.1001-1978.2016.03.021
A
1001-1978(2016)03-0403-07
E-332;R284.1;R322.57;R458.5;R587.1
2015-10-12,
2015-11-10
国家“十二五”科技支撑项目(No 2012BAI28B01)
包书茵(1988-),女,硕士,助教,研究方向:中蒙药药理学,Tel:0475-8314242,E-mail:325110003@qq.com;奥·乌力吉(1961-),男,博士,教授,博士生导师,研究方向:蒙医内治法研究与蒙药新药研发,Tel:0475-8314240,E-mail:wuliji@126.com