联氮杂芳环含能化合物研究进展
张俊林, 毕福强, 王伯周, 霍 欢, 翟连杰, 王锡杰
(西安近代化学研究所, 陕西 西安 710065)
1 引 言
呋咱、氧化呋咱、三唑、四唑及四嗪等氮杂芳环含有大量氮氮及碳氮键,生成焓较高[1-3]且燃烧产物清洁; 依据Hückel分子轨道理论[4],氮杂芳环体系的π电子数符合[4n+2]规则且缺电子效应明显,化学稳定性较高[5],因此,富氮含能化合物多数具有氮杂芳环结构单元。现代战争对武器装备高效毁伤能力提出了更高要求,而获得更高能量密度及氮含量水平的新型化合物则是提高含能材料性能的物质基础。目前,氮杂单环含能化合物能量水平有限,不能满足高能量密度材料发展的需求,故迫切需要发展氮杂多环结构的新型含能化合物。目前获得氮杂多环高能化合物的技术途径主要有三类[6-7]: (1)氮杂稠环含能化合物; (2)氮杂笼型含能化合物; (3)联氮杂芳环含能化合物。氮杂稠环及氮杂笼型含能化合物国内外已有较多研究[8-9]。近年,数个氮杂芳环通过C—C、C—N及N—N单键键合形成的联氮杂芳环含能化合物成为氮杂多环高能化合物研究的新热点。
联氮杂芳环键合方式多样,依据不同双环结构可分为对称型的双呋咱与双氧化呋咱含能化合物,双四唑含能化合物,双三唑含能化合物,双咪唑含能化合物,双异呋咱含能化合物; 非对称型的呋咱联四唑含能化合物,四唑联三唑含能化合物等。除双环结构外还包含氮杂多呋咱含能化合物及其他氮杂多环含能化合物。较单环类型富氮芳环含能化合物,联氮杂芳环体系的氮含量有所增加,生成焓显著提升[10],同时现代有机合成化学的发展为各类富氮芳环间通过C—C、C—N及N—N单键键合提供了高效便捷的途径[11-12],令此类新型含能化合物的结构多样性构建成为可能。以5,5′-联四唑-1,1′-二氧二羟胺(HATO or TKX-50)[13-14]、1,1′-二羟基-3,3′-二硝基-5,5′-联-1,2,4-三唑二羟胺盐(MAD-X1)[15]及3,4-双(4-硝基呋咱-3-基)-氧化呋咱(DNTF)[16]为代表的一批联氮杂芳环含能化合物因合成较为简捷且综合性能突出,成为近年来含能材料领域的标志性研究成果。但总体而言,相关环系构建策略仍较为有限,实现更为高效、多样的环系构建方法及键合模式仍是该领域研究进一步的发展方向。为此,本文综述了目前联氮杂芳环含能化合物的环系构建方法,从不同类型键合单键和环系特征的角度对联氮杂芳环结构体系进行了梳理,同时就典型联氮杂芳环含能化合物的性能及应用前景进行了讨论,以期对此类新型含能化合物的进一步研发提供参考。
2 含能富氮双环化合物
2.1 对称型富氮双环含能化合物
2.1.1 双呋咱与双氧化呋咱含能化合物
呋咱、氧化呋咱是重要的含能化合物结构单元[17-19],在分子中引入呋咱、氧化呋咱可以显著提高含能化合物的密度[20]并改善氧平衡[21]。1985年Coburn等[22]通过二氯乙二肟制备二氰基乙二肟,之后经羟胺进攻并环化构建4,4′-二氨基-3,3′-二呋咱3,将氨基通过双氧水氧化生成3,3′-二硝基-4,4′-二呋咱4。Coburn等为此类对称二环体系的研究做出了开创性工作,2014年,Klapötke等[23]在化合物3基础上制备出多种的含能离子盐(Scheme 1),其中羟胺盐爆轰性能优异(爆速9363 m·s-1,密度1.93 g·cm-3,摩擦感度288 N,撞击感度11 J,静电感度0.1 J)。2015年,Shreeve等[24]首次实现了类似单环体系3,4-二硝胺呋咱合成,通过路线优化发展了安全性可接受的工艺过程,进一步证实了呋咱硝胺化合物的潜在应用前景。

Scheme1Synthesis of nitramines with furazan structure[22-24]
富氮芳环间通过C-C单键键合有可能提高分子密度。2014年,Klapötke等[25]对对称型双硝基氧化呋咱结构的合成进行了探索(Scheme 2): 化合物10经环化,重排得到4,4′-二氨基-3,3′-二氧化呋咱12,之后氧化发现仅痕量的13可被高分辨质谱检测到。化合物13结构高度紧凑,计算结果表明其晶体密度173 K下达到2.007 g·cm-3,氧平衡为零,理论爆速为9525 m·s-1,整体能量水平与RDX[25]相近(90 K下密度1.858 g·cm-3, 氧平衡-22,理论爆速8855 m·s-1),但鉴于化合物12中氨基所连接的氧化呋咱环电子云密度过低,其有效氧化尚有待继续研究。

Scheme2Synthesis of diaminobisfuroxane[25]
2.1.2 双四唑含能化合物
二氯乙二肟中氯原子可被多种负离子取代并成环,如2012年毕福强[13]及Klapötke等[14]利用NaN3取代二氯乙二肟中氯原子并环化制备HATO(Scheme 3),其密度近1.9 g·cm-3,爆速9698 m·s-1,静电感度0.1 J,略高于RDX,HMX(表1)。HATO合成简捷且能量水平优异,摩擦感度和撞击感度较低,在高能炸药领域具有较好的应用前景。2014年,赵廷兴等[26]实现了HATO的50 g量级制备,近期西安近代化学研究所完成了其10 kg级工程化制备。
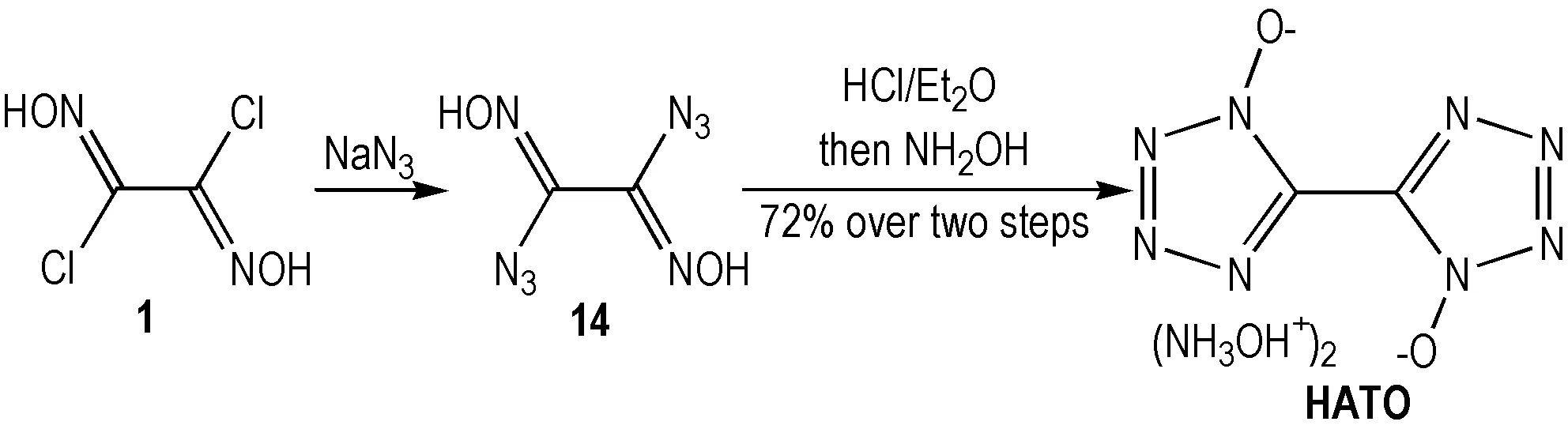
Scheme3Synthesis of HATO[13-14]
2008年, Klein等[27]实现了5,5′-联四唑双负离子16与部分稀土金属成盐产物,之后2011年Klapötke等[28]系统研究了5,5'-联四唑双负离子16与碱土金属成盐产物(Scheme 4),其中35%的Sr-BT,40% NH4NO3,18%金属Mg及7%乙烯醇酯树脂(VAAR)混合体系16c和30% Ba-BT, 35% NH4NO3,11%金属Mg, 17% PVC 及7% VAAR混合体系16d燃烧分别快速呈现高强度无烟红色和白色火焰,燃烧后无任何残留,是潜在的绿色高能烟火剂。
表1HATO与部分高能炸药性能比较[14]
Table1Performance comparison of HATO and some high energy explosives[14]

explosiveimpactsensitivity/Jfrictionsensitivity/Nρ/g·cm-3oxygenbalance/%Tdec/℃Ddet/m·s-1ΔHf/kJ·mol-1TNT153531.648-73.962907459-55.5RDX7.51201.806-21.61210898386.3HMX71121.904-21.612799221116.1CL⁃204482.035-10.952159455365.4HATO201201.877-27.102219698446.6
Note:ρis density;Tdecis temperature decomposition;Ddetis detonation velocity; ΔHfis enthalpy of formation.

Scheme4Synthesis of alkaline earth metal salts of 5,5′-bistetrazole[28]
BT胺化无法通过成环后直接引入胺基实现,为实现BT氮原子的胺化,2014年,Klapötke等[29]采取迂回的方式构建含胺基的前体后环化,硝化中和得到5,5′-联四唑-1,1′-二胺二钾盐(K2DNABT)(Scheme 5)。2015年,Yedukondalu等[30]就K2DNABT的结构稳定性等进行了研究。K2DNABT密度1.93 g·cm-3,爆速9967 m·s-1且感度较高(摩擦感度<1 N,撞击感度1 J),在高效起爆药领域具有一定的应用前景(表2)。

Scheme5Synthesis of potassium 1,1′-dinitramino-5,5′-bistetrazolate[29]
表2K2DNABT与PbN3部分爆轰及计算性能比较[29]
Table2Comparison of the some detonation properties data and the calculated performance ones of lead azide and K2DNABT[29]

explosiveimpactsensitivity/Jfrictionsensitivity/Nr/g·cm-3oxygenbalance/%Tdec/℃Ddet/m·s-1ΔHf/kJ·mol-1PbN32.5-40.1-14.8-11.03155920450.1K2DNABT1<12.17-4.82008330326.4
2.1.3 双三唑含能化合物
2015年,Klapötke等[31]利用廉价的二氨基胍(盐酸盐)与草酸(二水合物)为原料一步法合成出高热稳定性的化合物22,通过复分解反应所得离子盐4,4′,5,5′-四氨基-3,3′-双-1,2,4-三唑阳离子体系与不同富氧阴离子配对,合成了多种高热稳定性的含能离子盐(Scheme 6)。其成盐产物密度可达1.826 g·cm-3,热分解温度342 ℃,生成热301.5 kJ·mol-1,理论爆速9053 m·s-1,与TNT相容性良好且摩擦、撞击及静电感度(5 J,360 N,0.8 J)适宜[31],可作为潜在的廉价绿色高能钝感含能材料。
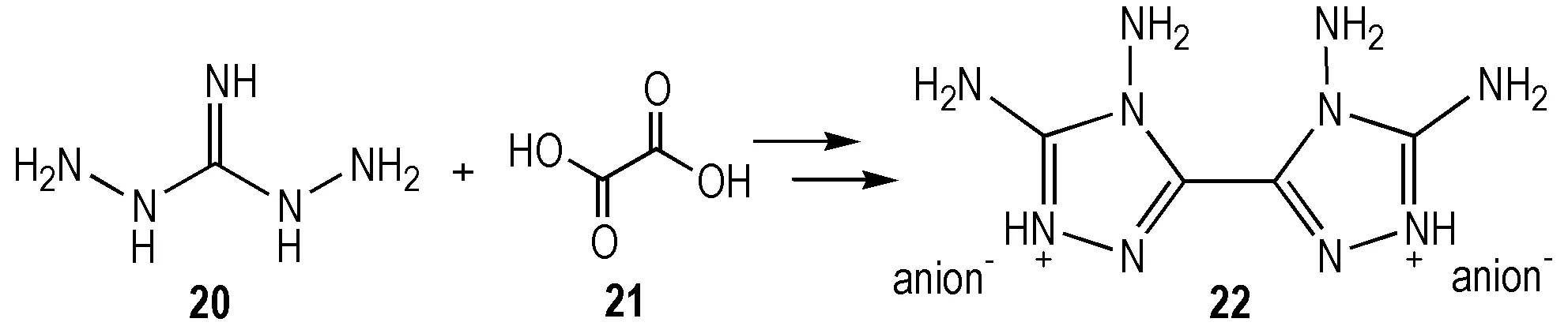
Scheme6Synthesis of bis(3,4-diamino-1,2,4-triazolium) cation[31]
2013年,Klapötke等[15]利用乙二酸为起始原料缩合环化及重氮化取代实现了5,5′-二硝基-3,3′-联-1,2,4-三唑(DNBT)制备,DNBT氧化可制备1,1′-二羟基-3,3′-二硝基-5,5′-联-1,2,4-三唑二羟胺盐(MAD-X1)。 2015年,罗义芬等[32]进一步对该MAD-X1的合成进行了探讨。MAD-X1经复分解反应获得一系列含能离子盐(Scheme 7)。Klapötke等的研究比较了MAD-X1与RDX的密度、爆速和爆压[15],表明MAD-X1具有一定潜在的替代RDX作为无烟CMDB推进剂的应用前景。
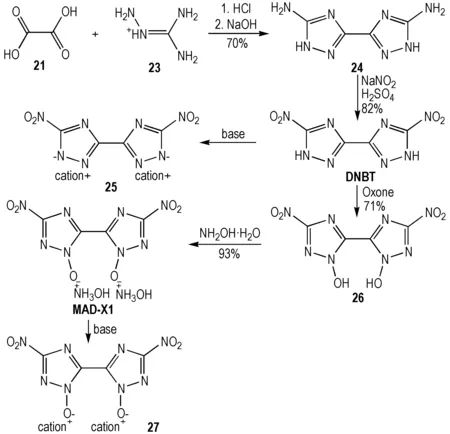
Scheme7Synthesis of MAD-X1[15]
1992年,Baryshnikov等[33]利用消除及环化反应实现了4,4′-双(5-硝基-1,2,3-2H-三唑)的合成,Shreeve等[34]则于2014年在此基础上采取与MAD-X1研究工作相似策略,经Oxone的作用实现氧化。其含能离子盐32a与32b(Scheme 8)整体能量水平与RDX接近(表3),有望作为RDX替代品。
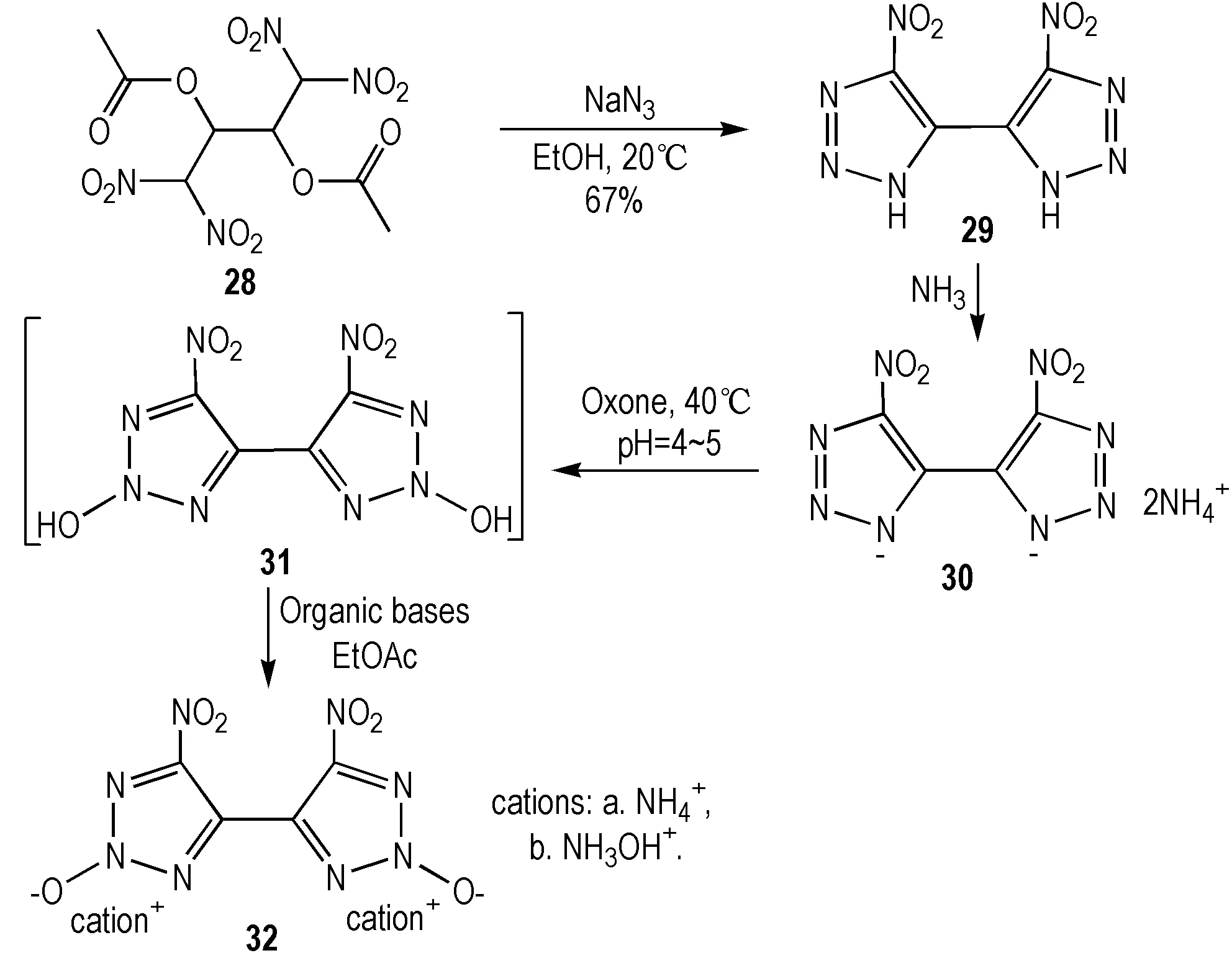
Scheme8Synthesis of nitro-1,2,3-triazoles[33-34]
表332a和32b物理化学性质与RDX比较[33]
Table3Comparison of the physicochemical properties of compounds32a-band RDX[33]

explosiveimpactsensitivity/Jρ/g·cm-3oxygenbalance/%Tdec/℃Ddet/m·s-1ΔHf/kJ·mol-1RDX7.51.80-21.61210898386.332a>401.81-10.92518744152.232b-1.8801729171271.9
2.1.4 双咪唑含能化合物
1983年,Bernaducci等[35]报道了乙二醛与氨缩合形成2,2′-联咪唑(BI)的方法,2012年,Klapötke等[36]对BI进行硝化合成出4,4′,5,5′-四硝基-2,2′-二咪唑(TNBI)同时制备了一系列的含能离子化合物(Scheme 9),而在2011年,Srinivasan等[37]即对TNBI进行了计算化学研究。2015年,Lewczuk等[38]对利用TNBI作为配体构建的铜离子配合物进行了研究,获得了该类化合物的配合物体系含能化合物。正离子胍含能离子盐具有优异的热稳定性(Tdec=328 ℃)和较好的能量性能(Ddet=8070 m·s-1),可作为六硝基茋(HNS)[39-40]的潜在替代品,在耐高温爆破器材等领域应用前景广阔。

Scheme9Synthesis of 4,4′,5,5′-tetranitro-2,2′-bisimidazole[35-36]
2.1.5 双异呋咱含能化合物
富氮含能杂环骨架连接硝仿基团研究较为有限,这与硝仿基的引入方法相对特殊有关[41]。1991年,Kiseleva等[42]实现了二氨乙二肟与丙二酸二乙酯环化构建对称结构37的工作。Klapötke等[43]于2014年在此基础上利用不同硝化试剂对酯基邻位进行二硝化反应,之后脱羧及再次硝化成功构建了硝仿基团(Scheme 10)。100 K下化合物40的密度高达2.02 g·cm-3,原因可能是分子内及分子间大量的氮原子与氧原子间的静电作用,而相关的爆轰参数尚未见报道。该研究为类似体系硝仿基团的引入提供了重要的参考。
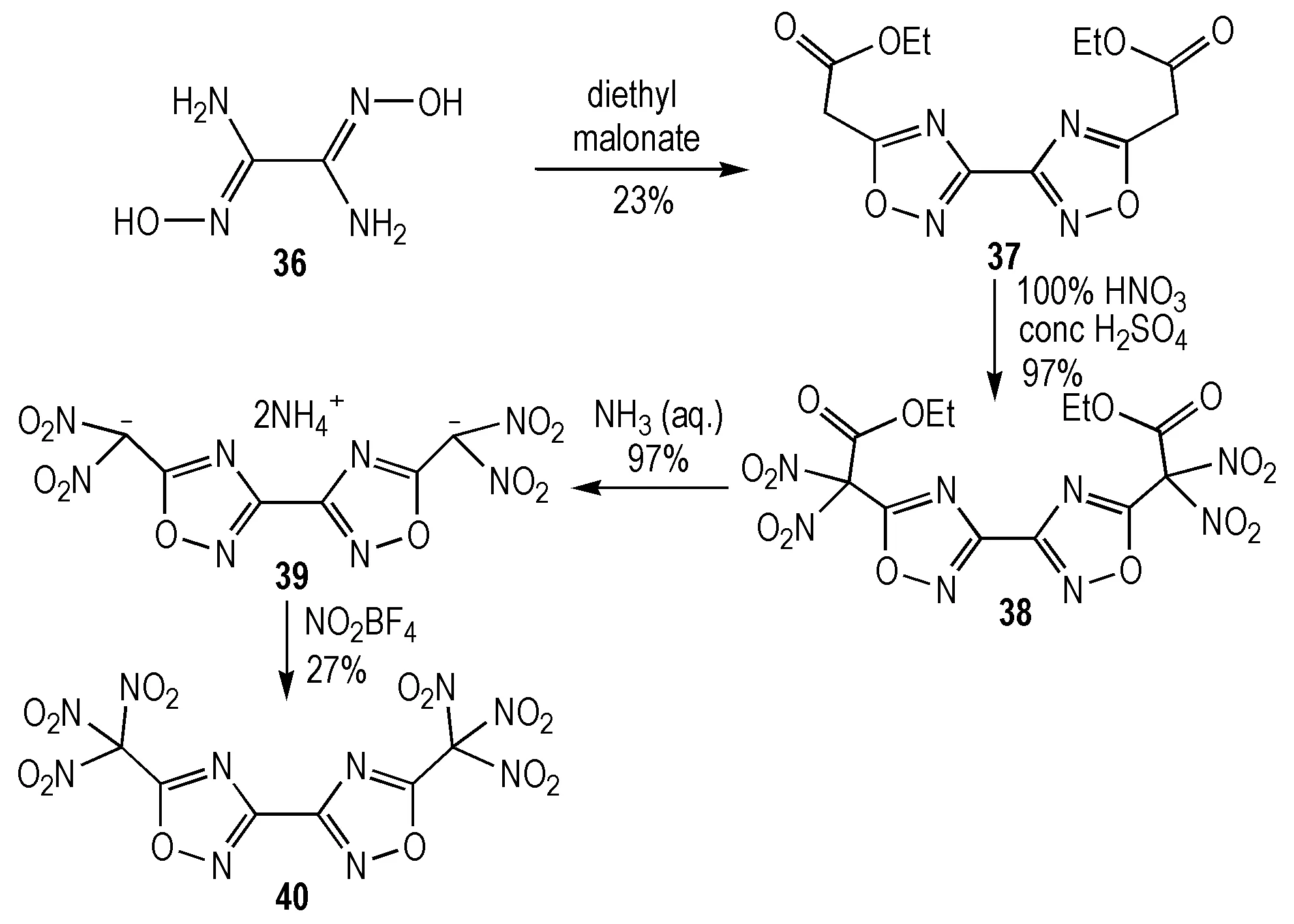
Scheme10Synthesis of bis(hydroxylammonium) 5,5′-dinitromethyl-3,3′-bis(1,2,4-oxadiazolate)[43]
2.2 非对称型双环含能化合物
2.2.1 呋咱联四唑含能化合物
2001年Tselinskii等[44]通过叠氮化钠与4-氨基-1,2,5-二氮唑基-3-氯羟胺41发生环化反应实现了呋咱与氧化四唑的连接。2015年,Shreeve等[45]利用该类结构制备了氨基取代呋咱联氧化四唑类含能离子化合物,与其之前所发展的氨基取代呋咱联四唑结构[46]相比(Scheme 11)。氧化四唑与氨基呋咱所存在的分子间氢键大大增强了体系的稳定性,是潜在的不敏感高能炸药,也为类似不敏感材料的设计提供了借鉴。

Scheme11Synthesis of furazan-tetrazole structures[44-46]
2.2.2 四唑联三唑含能化合物
1965年,Child等[47]利用氰基叠氮与二氨基胍20一锅煮实现3,4,5-三氨基-1-四唑基-1,2,4-三唑(TATT)的制备,但未能提出反应机理。2009年,Shreeve等[48]对该反应进行了深入机理探讨,认为氰基叠氮两次参与成环历程(Scheme 12)。TATT生成焓较高,热稳定性好且感度较低(表4),具有良好应用前景。
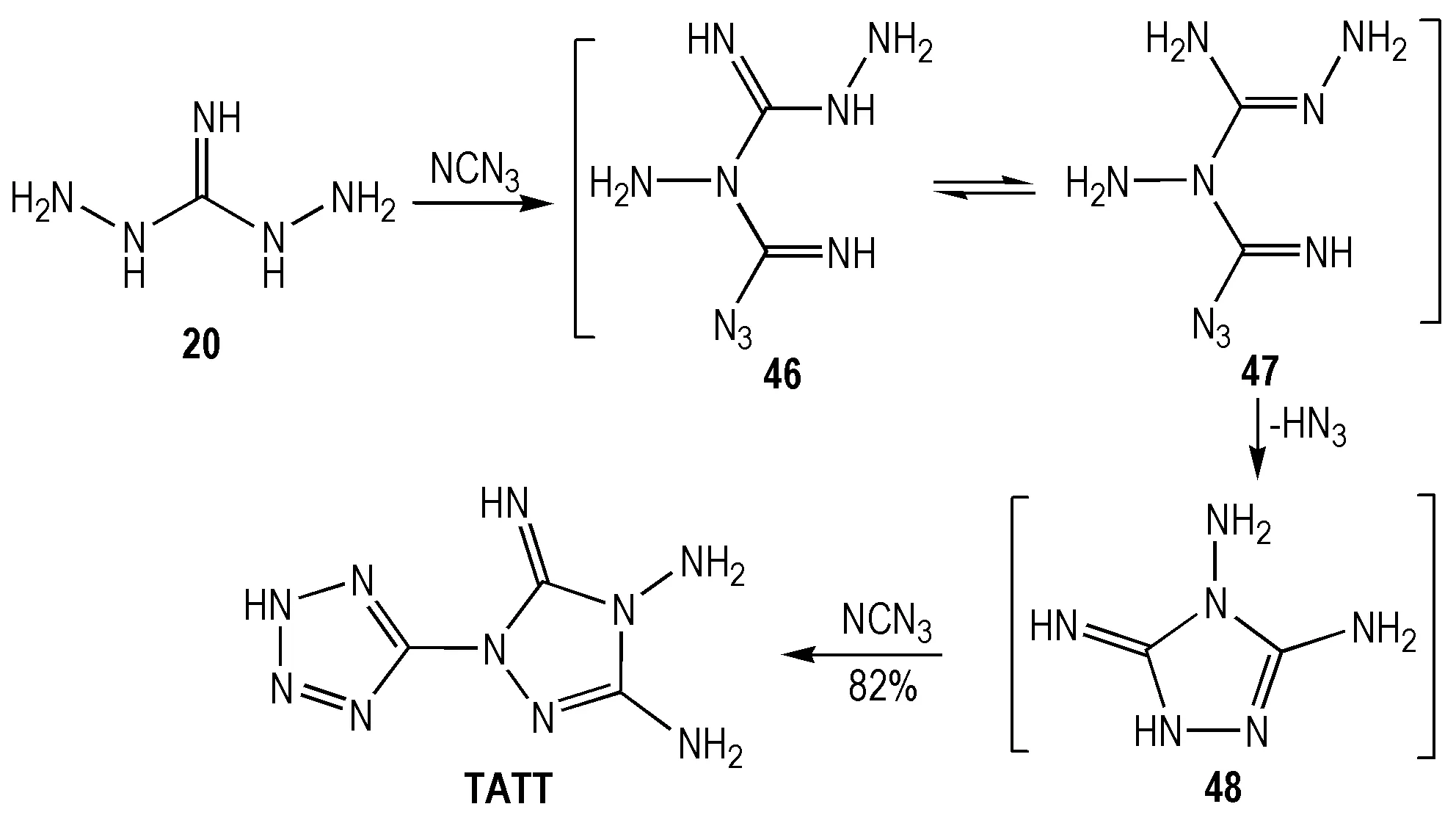
Scheme12Synthesis of TATT[48]
表4TATT与TNT, HMX 及 TATB性能比较[48]
Table4Comparison of the properties of TATT with TNT, HMX and TATB[48]
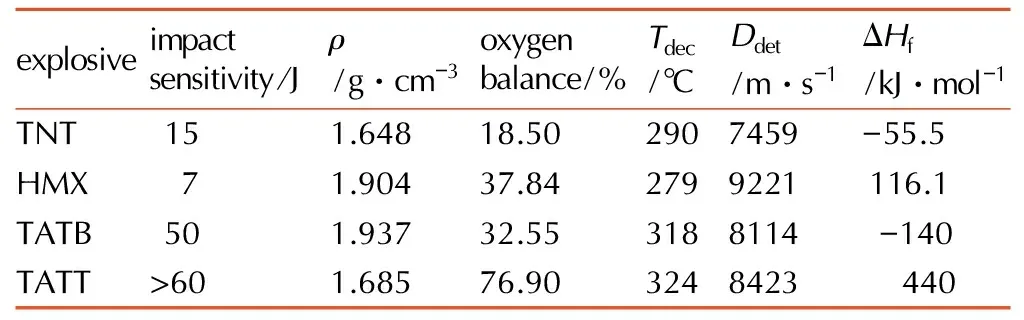
explosiveimpactsensitivity/Jρ/g·cm-3oxygenbalance/%Tdec/℃Ddet/m·s-1ΔHf/kJ·mol-1TNT151.64818.502907459-55.5HMX 71.90437.842799221116.1TATB501.93732.553188114-140TATT>601.68576.903248423 440
2014年,Klapötke等[49]合成了含能离子配体HATT,同年,Klapötke等[50]进一步通过ATT及HATT与金属离子Cu2+及Co2+形成相应的金属络合物(Scheme 13),而这两类化合物均可作为潜在的起爆药。
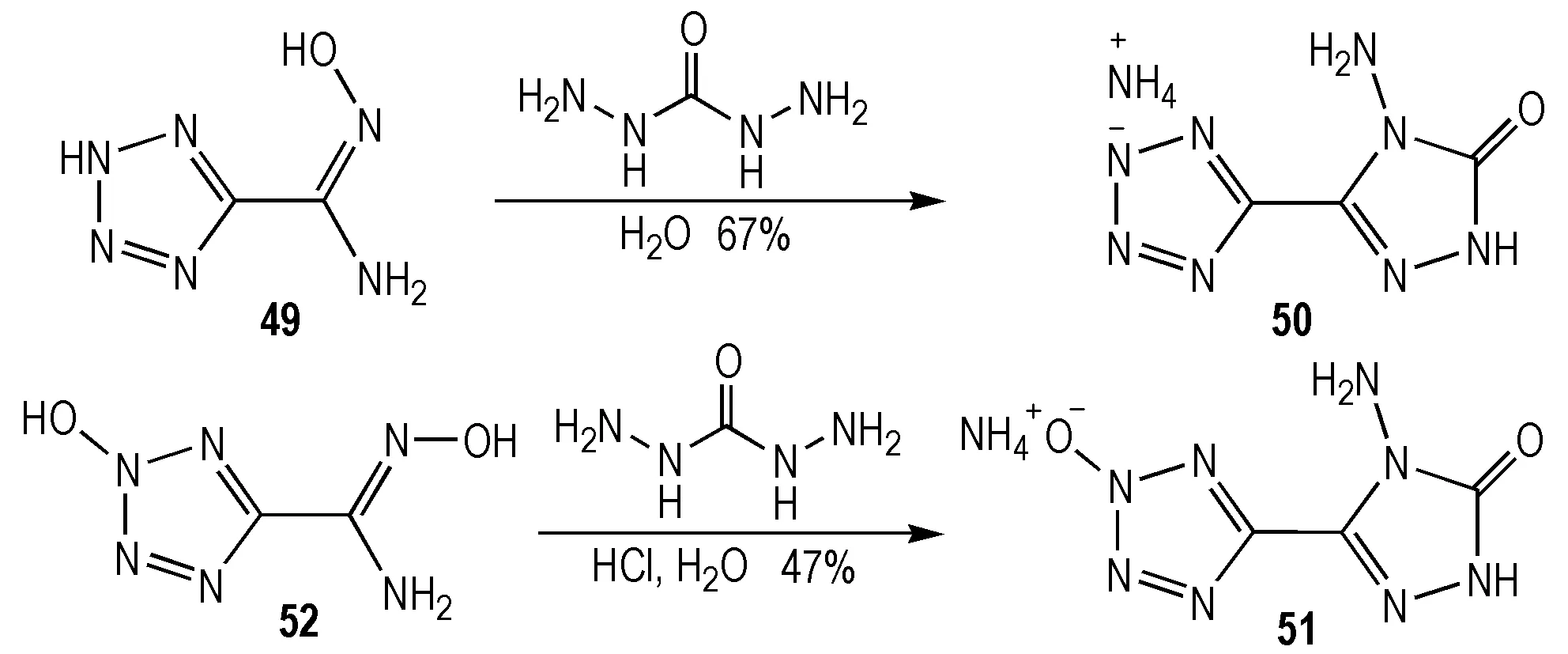
Scheme13Synthesis of 5-(4-amino-1,2,4-triazol-3-on-5′-yl)-1H-tetrazole[49]and 5-(4-amino-1,2,4-triazol-3-on-5-yl)tetrazole[50]
3 氮杂多环含能化合物
3.1 多呋咱含能化合物
C—C单键连接数个呋咱及氧化呋咱所形成的氮杂多环含能化合物具有较高的能量水平和较低的感度。作为能量水平与CL-20接近的三代单质炸药,DNTF分子较低(110 ℃)的熔点和较为钝感的性质使其在熔铸炸药领域独具优势,针对DNTF的合成及性能已有相关综述报道[16]。DNTF分子及其类似物合成策略的核心是对其中呋咱及氧化呋咱体系的有效构建。2005年,Sheremetev等[51]利用甲基氨基呋咱为原料合成了DNTF,但产率仅12%。2015年,Tsyshevsky等[52]报道了DNTF分子合成,总收率37%。(Scheme 14)。
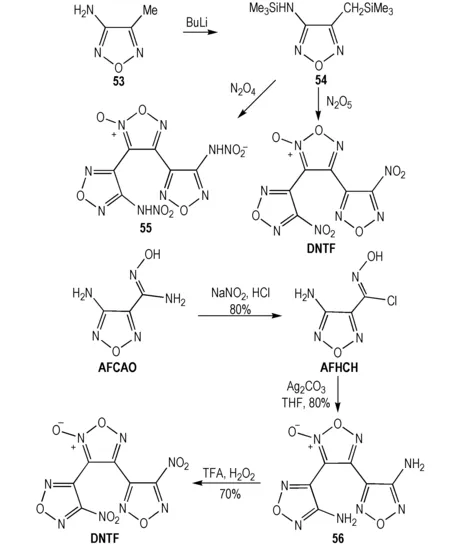
Scheme14Synthesis of DNTF[51-52]
呋咱醚类含能化合物具有熔点低、能量高、可塑性强的优点,2012年,王锡杰等[53]及周彦水等[54]报道了三呋咱并氧杂环庚三烯(TFO)分子和双呋咱并[3,4.b:3′,4′-f]氧化呋咱并[3″,4″-d]氧杂环庚三烯(BFFO)分子的结构及合成方法,该类方法分别以3,4-双(3′-硝基呋咱-4′-基)呋咱(BNTF)及DNTF为原料进行分子内硝基醚化反应,实现了呋咱环醚的构建。TFO与BFFO熔点分别为77 ℃和92 ℃,理论密度1.935 g·cm-3及1.866 g·cm-3,计算爆速分别为8646 m·s-1和8256 m·s-1,均有望作为熔铸炸药中的液相载体组份,也可作为固体推进剂中的含能增塑剂与氧化剂。与呋咱醚类研究类似,Stepanov等[55]则以胺或肼作为亲核试剂与BNFF发生取代反应,合成了氮杂环庚三烯衍生物的结构,贾思媛等[56]利用类似的方法通过HNO3进一步将两个不同的氮杂环庚三烯进行了偶联(Scheme 15)。

Scheme15Synthesis of TFO, BFFO and other analogues[53-56]
3.2 其他氮杂多环含能化合物
1989年,Laval等[57]利用4,6-二氯-5-硝基嘧啶(DCNP)与3-硝基-5-氨基-l,2,4-三唑(ANTA)钠盐反应得到5-硝基-4,6-双(5-氨基-3-硝基-三唑)嘧啶(DANTNP)。DANTNP密度为1.86 g·cm-3,熔点大于320℃,爆速约为8600 m·s-1,撞击感度达到50 cm (Type 12),是良好的高能、低感及耐热炸药[58]。2008年,贾思媛等[59]对其合成方法进行了改进(Scheme 16),同年,王伯周等[60]利用计算化学辅助,探讨了该分子热分解机理,发现热分解始于N—H键的断裂。

Scheme16Synthesis of DANTNP[57, 59]
2008年,Dinca等[61]人通过Click反应合成了H3BTI,并以其为配体,通过与CoCl2在碱性条件下的自组装反应获得了一种具有混合价态的新型钴化合物(Scheme 17)。4,5-二(1H-四唑-5-基)-1H-咪唑(H3BTI)的氮含量达到68.61%,分解产物氮气含量较高,在低特征信号推进剂或气体发生剂领域具有潜在应用前景。2013年,毕福强等[62]对其合成及热分解行为进行了研究: 结果表明,H3BTI无熔化过程,324.6 ℃时的放热峰为固相分解过程,分解热约为208 kJ·mol-1。以不同升温速率的DSC研究了H3BTI的非等温反应动力学,研究结果表明,热分解反应受随机成核和随后生长控制,反应机理服从n=3/4的Avrami Erofeev方程,临界爆炸温度为Tcr=556.38 K,峰温处热分解反应的活化焓和活化自由能分别为193.66 kJ·mol-1和173.33 kJ·mol-1。

Scheme17Synthesis of H3BTI[61-62]
2011年,周智明等[63]利用二氰基取代的氧化呋咱,通过Click反应快速构建了相应四唑-氧化呋咱-四唑的含能双负离子盐化合物(Scheme 18),密度为1.56~1.85 g·cm-3,爆速为7939~8915 m·s-1。该组合模式并未如化合物DNTF(密度1.86 g·cm-3,爆速8930 m·s-1)那样具有较高的能量水平[64],因而极大限制了其应用研究的潜力。

Scheme18Synthesis of 3,4-bis(1H-5-tetrazolyl)furoxan[63]
4 结论与展望
氮杂含能芳环因其结构中存在较多高能碳氮及氮氮键,故氮含量及生成焓均较高,燃烧产物清洁。氮杂单芳环通过C—C、C—N等单键进行键合,合成了种类繁多的联氮杂芳环含能化合物,有利于实现相关含能化合物的多样性合成。合成性能更为优异的联氮杂芳环含能化合物对含能材料领域的发展影响深远,目前相关环系构建策略仍然较为有限,在一定程度上限制了结构多样性的合成探索研究。下一步该领域研究应侧重以下两点。
(1)富氮芳环体系结构多样,发展简捷、高效及条件温和的新型环系合成方法将直接推动该类含能材料的发展,引入α-多硝甲基氧化偶氮基团[65-67]等新型高能基团设计完成新型联氮杂芳环含能化合物应是下一阶段研究的重点。
(2)不同环系的组合对联氮杂芳环含能化合物整体能量密度水平及稳定性有怎样的影响需进行深入的研究探索,得出具有一定指导意义的理论数据和规律特点将直接影响此类含能化合物结构设计和性能预估。
参考文献:
[1] Sikder, A K, Sikder N. A review of advanced high performance, insensitive and thermally stable energetic materials emerging for military and space applications[J].JournalofHazardousMaterialsA, 2004, 112(1-2): 1-15.
[2] Dagley I J, Spear R J. Organic energetic compounds [M]. New York: Nova Science Publishers Inc, 1996.
[3] Agrawal J P, Hodgson R D. Organic chemistry of explosives[M]. Chichester: John Wiley & Sons Ltd, 2006.
[4] Feixas F, Matito E, Solà M, et al. Analysis of Hückel′s [4n + 2] rule through electronic delocalization measures[J].TheJournalofPhysicalChemistryA, 2008, 112 (50): 13231-13238.
[5] Petrucci R H, Herring F G, Madura J D, et al. General chemistry: principles and modern applications[M]. Upper Saddle River: Prentice Hall, 2011.
[6] Pagoria P F, Lee G S, Mitchell A R, et al. A review of energetic materials synthesis[J].ThermochimicaActa, 2002, 384(1-2): 187-204.
[7] Badgujar D M, Talawar M B, Asthana S N, et al. Advances in science and technology of modern energetic materials: an overview[J].JournalofHazardousMaterials, 2008, 151(2-3): 289-305.
[8] 王瑞, 徐志斌, 孟子晖, 等. 硝基脲类含能材料的合成及性能研究进展[J]. 含能材料, 2015, 23(5): 450-453.
WANG Rui, XU Zhi-bin, MENG Zi-hui, et al. Progress in synthesis and performance of nitrourea energetic materials[J].ChineseJournalofEnergeticMaterials, 2015, 23(5): 450-453.
[9] 公绪滨, 孙成辉, 庞思平, 等. 异伍兹烷衍生物的研究进展[J]. 有机化学, 2012, (03): 486-496 .
GONG Xu-bin, SUN Cheng-hui, PANG Si-ping, et al. Research progress in study of isowurtzitane derivatives[J].ChineseJournalofOrganicChemistry, 2012, (03): 486-496 .
[10] Singh R P, Verma R D, Meshri D T, et al. Energetic nitrogen-rich salts and ionic liquids[J].AngewandteChemieInternationalEdition, 2006, 45(22): 3584-3601.
[11] Colacot T J, Spivey J. New trends in cross-coupling: theory and applications[M]. New York: WILEY-VCH, 2015.
[12] Nicolaou K C, Bulger P G, David S. Palladium-catalyzed cross-coupling reactions in total synthesis[J].AngewandteChemieInternationalEdition, 2005, 44(29): 4442-4489.
[13] 毕福强, 樊学忠, 许诚, 等. 1,1′-二羟基-5,5′-联四唑的合成及理论研究[J]. 火炸药学报, 2013, 36(4): 22-25.
BI Fu-qiang, FAN Xue-zhong, XU Cheng, et al. Synthesis and theoretical study of 1,1′-dihydroxy-5,5′-bitetrazole[J].ChineseJournalofExplosives&Propellants, 2013, 36(04): 22-25.
[14] Fischer N, Fischer D, Klapötke T M, et al. Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].JournalofMaterialsChemistry, 2012, 22(38): 20418-20422.
[15] Dippold A A, Klapötke T M. A study of dinitro-bis-1,2,4-triazole-1,1′-diol and derivatives: design of high-performance insensitive energetic materials by the introduction ofN-oxides[J].JournaloftheAmericanChemicalSociety, 2013, 135(26): 9931-9938.
[16] 郑伟, 王江宁. 3,4-二硝基呋咱基氧化呋咱(DNTF)的研究进展[J]. 含能材料, 2006, 14(6): 463-466.
ZHENG Wei, WANG Jiang-ning. Review on 3,4-bisnitrofurazanfuroxan (DNTF)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2006, 14(6): 463-466.
[17] Sheremetev A B. Chemistry of furazans fused to five-membered rings[J].JournalofHeterocyclicChemistry, 1995, 32(2): 371-384.
[18] 李战雄, 唐松青, 欧育湘. 呋咱含能衍生物合成研究进展[J]. 含能材料, 2002, 10(2): 59-65.
LI Zhan-xiong,TANG Song-qing, OU Yu-xiang.Synthesis status of furazano energetic derivatives[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2002, 10(2): 59-65.
[19] 张德雄, 张衍, 王琦. 呋咱系列高能量密度材料的发展[J]. 固体火箭技术, 2004, 27(1): 32-37.
ZHANG De-xiong, ZHANG Yan, WANG Qi. Advances in high energe density matter of furazan series[J].JournalofSolidRocketTechnology, 2004, 27(1): 32-37.
[20] Pivina T S, Sukhachev D V, Evtushenko A V. Comparative characteristic of energy content calculating methods for the furazan series as an example of energetic materials[J].Propellants,Explosives,Pyrotechnics, 1995, 20(1): 5-10.
[21] 陈天娜, 汤业朋, 宋华杰. 氧化呋咱二聚体分子间相互作用的理论计算[J]. 含能材料, 2007, 15(6): 641-645.
CHEN Tian-na, TANG Ye-peng, SONG Hua-jie. Theoretical study on intermolecular interaction of furoxan dimmers[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2007, 15(6): 641-645.
[22] Coburn W D. Synthesis and unusual NMR spectra of 4,4′-dinitro-3,3′-bifurazanyl-4,4′-13C[J].JournalofLabelledCompoundsandRadiopharmaceuticals, 1984, 12(2): 183-188.
[23] Fischer D, Klapötke T M, Reymann M, Stierstorfer J. Dense energetic nitraminofurazanes[J].Chemistry-AEuropeanJournal, 2014, 20(21): 6401-6411.
[24]Tang Y X, Zhang J H, Mitchell L A, et al. Taming of 3,4-di(nitramino)furazan[J].JournaloftheAmericanChemicalSociety, 2015, 137 (51): 15984-15987.
[25] Fischer D, Klapötke T M, Stierstorfer J. Synthesis and characterization of diaminobisfuroxane[J].EuropeanJournalofInorganicChemistry, 2014(34): 5808-5811.
[26] 赵廷兴, 田均均, 李磊, 等. 5,5′-联四唑-1,1′-二氧二羟铵(TKX-50)50克量级制备放大工艺[J].含能材料, 2014, 22(6): 744-747.
ZHAO Ting-xing, TIAN Jun-jun, LI Lei, et al. Up-sizing 50 grams-scale synthesis technology of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate (TKX-50)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(6): 744-747.
[27] Eulgem P J, Klein A, Maggiarosa N, et al. New rare earth metal complexes with nitrogen-rich ligands: 5,5′-bitetrazolate and 1,3-bis(tetrazol-5-yl)triazenate-on the borderline between coordination and the formation of salt-like compounds[J].Chemistry-AEuropeanJournal, 2008, 14(12): 3727-3736.
[28] Fischer N, Klapötke T M, Peters K, et al. Alkaline earth metal salts of 5,5′-bistetrazole from academical interest to practical application[J].ZeitschriftfürAnorganischeundAllgemeineChemie, 2011, 637(12): 1693-1701.
[29] Fischer D, Klapötke T M, Stierstorfer J. Potassium 1,1′-dinitramino-5,5′-bistetrazolate: a primary explosive with fast detonation and high initiation power[J].AngewandteChemieInternationalEdition, 2014, 53(31): 8172-8175.
[30] Yedukondalu N, Vaitheeswaran G. Structural stability, vibrational, and bonding properties of potassium 1, 1′-dinitroamino-5, 5′-bistetrazolate: An emerging green primary explosive[J].TheJournalofChemicalPhysics, 2015, 143(6): 064508.
[31] Klapötke T M, Schmida P C, Schnella S, et al. Thermal stabilization of energetic materials by the aromatic nitrogen-rich bis(3,4-diamino-1,2,4-triazolium) cation[J].JournalofMaterialsChemistryA, 2015, 3(6): 2658-2668.
[32] 罗义芬, 王子俊, 毕福强, 等. 不敏感含能材料 MAD-X1的合成及性能[J]. 火炸药学报, 2015, 38(5): 13-17.
LUO Yi-fen, WANG Zi-jun, BI Fu-qiang, et al. Synthetic and properties of insensitive energetic material[J].ChineseJournalofExplosives&Propellants, 2015, 38(5): 13-17.
[33]Baryshnikov A T, Erashko V I, Zubanova N L, et al. Gem-dinitro compounds in organic synthesis. 4 Use of the condensation product of glyoxal and dinitromethane in the synthesis of nitro-1,2,3-triazoles[J].BulletinoftheRussianAcademyofSciences,DivisionofChemicalScience, 1992, 41(9): 1657-1664.
[34] He C L, Shreeve J M. Energetic materials with promising properties: synthesis and characterization of 4,4′-bis(5-nitro-1,2,3-2H-triazole) derivatives[J].AngewandteChemie, 2015, 127(21): 1-6.
[35] Bernarducci E E , Bharadwaj K P, Lalancette R A. Molecular structures, electronic spectra, and ESR spectra of bis( 4,4′,5,5′- tetramethyl-2,2′-biimidazole) copper (Ⅱ) dinitrate and bis(4,4′,5,5′-tetramethyl-2,2′ -biimidazole)zinc(Ⅱ)0.90copper(Ⅱ)0.10dinitrate[J].InorganicChemistry, 1983, 22(26): 3911-3920.
[36] Klapötke T M, Preimesser A, Stierstorfer J. Energetic derivatives of 4,4′-5,5′-tetranitro-2,2′-bisimidazole (TNBI)[J].ZeitschriftfürAnorganischeundAllgemeineChemie, 2012, 638 (9): 1278-1286.
[37] Srinivasan P, Asthana S N, Pawar R B, et al. A theoretical charge density study on nitrogen-rich 4,4′,5,5′-tetranitro-2,2′-bi-1H-imidazole (TNBI) energetic molecule[J].StructuralChemistry, 2011, 22(6): 1213-1220.
[38] Szala M, Lewczuk R. New synthetic methods for 4,4′,5,5′-tetranitro-2,2′-bi-1H-imidazole (TNBI)[J].CentralEuropeanJournalofEnergeticMaterials, 2015, 12(2): 261-270.
[39] 郁卫飞, 廖龙渝, 陈娅, 等. TATB和HNS超细炸药的微结构和分形特性[J]. 含能材料, 2015, 23(12): 1198-1201.
YU Wei-fei, LIAO Long-yu, CHEN Ya, et al. Microstructure and fractal characteristics of superfine TATB and HNS[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2015, 23(12): 1198-1201.
[40] FENG Zeng-guo, CHEN Bo-ren. Synthesis of 3,3′-bis(2,2′,4,4′,6,6′-hexanitrostilbene)[J].Propellants,Explosives,Pyrotechnics, 1991, 16(1): 12-15.
[41] 毕福强, 王伯周, 许诚, 等. 含能材料中间体硝仿的研究进展[J]. 化学试剂, 2012, 34(3): 219-223.
BI Fu-qiang, WANG Bo-zhou, XU Cheng, et al. Progress of nitroform (NF), an important intermediate in the preparation of energetic materials[J].ChemicalReagents, 2012, 34(3): 219-223.
[42] Kiseleva V V, Gakh A A, Fainzil′berg A A. Synthesis of C-Azolylacetic acid esters based on carbethoxyethylacetimidate[J].RussianChemicalBulletin, 1990, 39(9): 1888-1895.
[43] Klapötke T M, Mayr N, Stierstorfer J, et al. Maximum compaction of ionic organic explosives: bis(hydroxylammonium) 5,5′-dinitromethyl-3,3′-bis(1,2,4-oxadiazolate) and its derivatives[J].Chemistry-AEuropeanJournal, 2014, 20(5): 1410-1417.
[44] Tselinskii I V, Mel′Nikova S F, Romanova T V. Synthesis and reactivity of carbohydroximoyl azides: II. 4-substituted 1,2,5-oxadiazole-3-carbohydroximoyl azides and 1-hydroxy-5-(4-R-1,2,5-oxadiazol-3-yl) tetrazoles[J].RussianJournalofOrganicChemistry, 2001, 37(11): 1638-1642.
[45] ZHANG Jia-heng, Mitchell L A, Parrish D A, et al. Enforced layer-by-layer stacking of energetic salts towards high-performance insensitive energetic materials[J].JournaloftheAmericanChemicalSociety, 2015, 137(33): 10532-10535.
[46] WANG Rui-hu, GUO Yong, ZENG Zhuo, et al. Furazan-functionalized tetrazolate-based salts: a new family of insensitive energetic materials[J].Chemistry-AEuropeanJournal, 2009, 15(11): 2625-2634.
[47] Child R G. A new synthesis of 3,4,5-triamino-4H-1,2,4-triazole (guanazine)[J].JournalofHeterocyclicChemistry, 1965, 2(1): 98-99.
[48] Tao Guo-hong, Twamley B, Shreeve J M. A thermally stable nitrogen-rich energetic material-3,4,5-triamino-1-tetrazolyl-1,2,4-triazole (TATT)[J].JournalofMaterialsChemistry, 2009, 19(32): 5850-5854.
[49] Fischer N, Hüll K, Klapötke T M, et al. Synthesis and characterization of the new heterocycle 5-(4-amino-1,2,4-triazol-3-on-5′-yl)-1H-tetrazole and some ionic nitrogen- rich derivatives[J].JournalofHeterocyclicChemistry, 2014, 51(1): 85-95.
[50] Joas M, Kieβling S, Klapötke T M, et al. Energetic complexes of 5-(4-amino-1,2,4-triazol-3-on-5-yl)tetrazole and ionic derivatives of its 2N-oxide[J].ZeitschriftfüranorganischeundallgemeineChemie, 2014, 640(14): 2759-2765.
[51] Sheremetev A B, Ivanova E A. Desilylative nitration of C,N-disilylated 3-amino-4-methylfurazan[J].JournalofHeterocyclicChemistry, 2005, 42: 1237.
[52] Tsyshevsky R, Pagoria P, Zhang Mao-xi, et al. Searching for low-sensitivity cast-melt high-energy-density materials: synthesis, characterization, and decomposition kinetics of 3,4-Bis(4-nitro-1,2,5-oxadiazol-3-yl)- 1,2,5-oxadiazole-2-oxide[J].JournalofPhysicalChemistryC, 2015, 119(7): 3509-3521.
[53] 王锡杰, 王伯周, 贾思媛, 等. 三呋咱并氧杂环庚三烯(TFO)合成研究[J]. 含能材料, 2012, 20(2): 258-259.
WANG Xi-jie, WANG Bo-zhou, JIA Si-yuan, et al. The designed synthetic routes of TFO[J].ChineseJournalofEnergeticMaterials, 2012, 20(2): 258-259.
[54] 周彦水, 王伯周, 王锡杰, 等. 双呋咱并[3,4-b:3′,4,-f]氧化呋咱并[3″,4″d]氧杂环庚三烯的合成[J]. 含能材料, 2012, 20(1): 137-138.
ZHOU Yan-shui, WANG Bo-zhou, WANG Xi-jie, et al. Synthesis of bifurazano[3,4-b:3′,4′-f]furoxano[3″,4″-d]oxacyclohetpatriene[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(1): 137-138.
[55] Stepanov A I, Dashko D V, Astrat′ev A A. 3,4-Bis(4′-nitrofurazan-3′-yl)furoxan: a melt cast powerful explosive and a valuable building block in 1,2,5-oxadiazole chemistry[J].CentralEuropeanJournalofEnergeticMaterials, 2012, 9(4): 329-342.
[56] 贾思媛, 张海昊, 周诚, 等. 7H-三呋咱并[3,4-b:3′,4′-f: 3′,4′-d]氮杂环庚三烯及衍生物的合成与表征[J]. 有机化学, 2015, 35(4): 851-857.
JIA Si-yuan, ZHANG Hai-hao, ZHOU Cheng, et al. Synthesis and characterization of 7-H-trifurazano[3,4-b:3′,4′-f:3″,4″-d]azepine and its analogues[J].ChineseJournalofOrganicChemistry, 2015, 35(4): 851-857.
[57] Wartenberg C H, Charrue P, Laval F. Conception, synthesis and characterization of a new insensitive high explosive-DANTNP[J].Propellants,Explosives,Pyrotechnics, 1995, 20(1): 23-26.
[58] 贺云, 范桂娟, 张光全, 等. 5-氨基-3-硝基-1,2,4-三唑的合成及反应性研究进展[J]. 含能材料, 2012, 20(6): 715-720.
HE Yun, FAN Gui-juan, ZHANG Guang-quan, et al. Review on synthesis and reactivity of 5-amino-3-nitro-1,2, 4-trizole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(6): 715-720.
[59] 贾思媛, 王锡杰, 王伯周, 等. 4,6-双(5-氨基-3-硝基-1,2,4-三唑-1-基)-5-硝基嘧啶(DANTNP)合成工艺改进[J]. 含能材料, 2008, 16(3): 251-253.
JIA Si-yuan, WANG Xi-jie, WANG Bo-zhou, et al. Improvement of the Synthetic Process of 4,6-Bis-(5-amino-3-nitro-1,2,4-triazol-1-yl)-5-nitropyrimidine[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2008, 16(3): 251-253.
[60] 王伯周, 来蔚鹏, 廉鹏, 等. 4,6-双-(5-氨基-3-硝基-1,2,4-三唑-1-基)-5-硝基嘧啶(DANTNP)性能的量子化学研究[J]. 计算机与应用化学, 2008, 25(1): 35-38.
WANG Bo-zhou, LAI Wei-peng, LIAN Peng, et al. Study of the properties of 4,6-bis(5-amino-3-nitro-1,2,4-triazol-1-yl)-5-nitropyrimidine (DANTNP) by quantum chemistry[J].ComputersandAppliedChemistry, 2008, 25(1): 35-38.
[61] Dinca M, Harris T D, Lavarone A T. Synthesis and characterization of the cubic coordination cluster [Co6III(IBT)12]14-[J].JournalofMolecularStruture, 2008, 65(6): 1403.
[62] 毕福强, 李吉祯, 许诚, 等. 4, 5-二(1H-四唑-5-基)-1H-咪唑的合成及热性能[J]. 含能材料, 2013, 4(21): 443-448.
BI Fu-qiang, LI Ji-zhen, XU Cheng, et al. Synthesis and thermal decomposition properties of 4,5-bis(1H-tetrazol-5-yl)-1H-imidazole[J].ChineseJournalofEnergeticMaterials, 2013, 4(21): 443-448.
[63] HUANG Hai-feng, ZHOU Zhi-ming, LIANG Li-Xuan, et al. Nitrogen-rich energetic dianionic salts of 3,4-bis(1H-5-tetrazolyl)furoxan with excellent thermal stability[J].ZeitschriftfürAnorganischeundAllgemeineChemie, 2012, 638(2): 392-400.
[64] 郑伟, 王江宁. 3,4-二硝基呋咱基氧化呋咱(DNTF)的研究进展[J]. 含能材料, 2006, 14(6): 463-466.
ZHENG Wei, WANG Jiang-ning. Review on 3,4-bisnitrofurazanfuroxan (DNTF)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2006, 14(6): 463-466.
[65] Luk′yanov O A, Parakhin V V, Pokhvisneva G V, et al. 3-Amino-4-(α-nitroalkyl-ONN-azoxy) furazans and some of their derivatives[J].RussianChemicalBulletin, 2012, 61(2): 355-359.
[66] Luk′yanov O A, Pokhvisneva G V, Ternikova T V, et al. 3, 4-Bis (α-nitroalkyl-ONN-azoxy) furazans and some of their derivatives[J].RussianChemicalBulletin, 2012, 61(2): 360-365.
[67] Lukyanov O A, Pokhvisneva G V, Ternikova T V, et al. α-Nitroalkyl-ONN-azoxyfurazanes and some of their derivatives[J].RussianChemicalBulletin, 2011, 60(8): 1703-1711.

