离子液体中CL-20的高收率低污染硝解方法
董 波, 钱 华,2, 任丽萍
(1. 南京理工大学化工学院, 江苏 南京 210094; 2. 国家民用爆破器材质量监督检验中心, 江苏 南京 210094; 3. 中国兵器标准化研究所, 北京 100089)
1 引 言
六硝基六氮杂异伍兹烷(CL-20)属于笼型多硝胺化合物,是迄今为止综合性能最好的单质炸药之一[1]。CL-20具有高张力的笼形结构,合成难度高。通常先合成笼形胺,再将其硝解为相应的硝胺。可用于硝解制备CL-20的中间体有近15种[2],但四乙酰基六氮杂异伍兹烷(TAIW)是最常用的硝解底物[3-5]。
根据已报道的文献,针对TAIW的硝解共有五类硝解体系。但工业上仍采用硝硫混酸硝解TAIW制备CL-20[6-8]。该工艺反应时间短,产品收率及纯度高,但硫酸用量大,综合处理成本高。N2O5/HNO3是绿色硝化剂,废酸易处理。电解法制备N2O5技术的发展[9-11],使其竞争力进一步提高。钱华[12-14]研究了N2O5/HNO3硝解TAIW制备CL-20方法。由于N2O5/HNO3硝解能力较弱,CL-20收率仅80%左右; 当以10%CF3SO3H/树脂为催化剂时,收率提高至87.4%。但强酸性条件下的负载型催化剂耗费量大,难以有效回收。
因此,合成催化性能佳、易回收的催化剂具有现实意义。而酸性离子液体易制备、稳定性高,便于回收,且近年来已被引入到HMX、RDX等的制备并取得一定成效[15-18]。为此,本研究根据文献[19-23]合成出四类酸性离子液体,并将其用于N2O5/HNO3硝解TAIW反应中,考察了离子液体种类、酸度、用量及反应时间对CL-20收率及纯度的影响,拟探索出一条高收率、低污染制备CL-20的新方法。
2 实验部分
2.1 试剂与仪器
N2O5、纯HNO3,实验室自制; TAIW,工业品,纯度>99%(HPLC测试,面积归一法),辽宁庆阳特种化工有限公司提供; 蒸馏水,自制; 1-甲基咪唑,1-乙烯基咪唑,1,3-丙磺酸内酯,苯磺酸,均为分析纯,阿拉丁; 4-硝基苯胺,己内酰胺,分析纯,国药集团; 三乙胺,三氟乙酸,均为分析纯,成都市科龙有限公司。
纯度检测采用Agilent 1200系列高效液相色谱仪,色谱柱 Sepelco LC-18(C18) 250 mm×4.6 mm (5 m); 流动相: 甲醇和水(体积比50∶50); 检测波长: 230 nm; 流速: 1 mL·min-1。
相对酸强度检测采用UV-240紫外-可见分光光度计。
2.2 离子液体的制备
[Et3N(CH2)4SO3H]X、[Capl][HSO4]、[MIMPS][HSO4]、[PyPS][HSO4]四类离子液体,结构详见Scheme 1。
Scheme1Structures of ionic liquids (ILs)
2.3 离子液体的酸强度测试
离子液体的Brønsted酸性可依据文献[24]进行测试。随着离子液体的加入,碱性指示剂4-硝基苯胺的紫外吸收峰减小。等量离子液体滴加前后峰面积的比值可衡量其酸强度。Hammett常数H0按式(1)计算。
H0=0.99+log ([I] / [IH+])
(1)
式中,0.99是4-硝基苯胺的pKa,[I]和[IH+]分别是离子液体加入前后紫外吸收峰的面积
2.4 CL-20的制备
在0~5 ℃下,将N2O5/HNO3溶液置于100 mL三口烧瓶中,加入一定量离子液体,搅拌,缓慢加入TAIW 3 g(9 mmol),保温10 min后继续升温至40 ℃,保温0.5 h,逐渐升温至60~80 ℃并恒温反应。反应结束后冷却至室温,向反应液中加入20 mL蒸馏水。过滤,洗涤至中性。产品真空干燥,称重,经FT-IR,MS,NMR鉴定结构,HPLC测定纯度。
FT-IR:3033(w,C—H),1608(νs,νas(N—NO2)),1331(s,C—C),1277,1257(νs, N—NO2),879(νs, C—N),750, 658(骨架);1H NMR(CD3COCD3),δ: 8.20(s ,2H,CH),8.35(s ,4H,CH); MS(ESI),m/z: 500(M+HNO3—H),473(M+Cl35),475(M+Cl37)。

Scheme2Nitrolysis of TAIW
3 结果与讨论
3.1 离子液体种类的影响
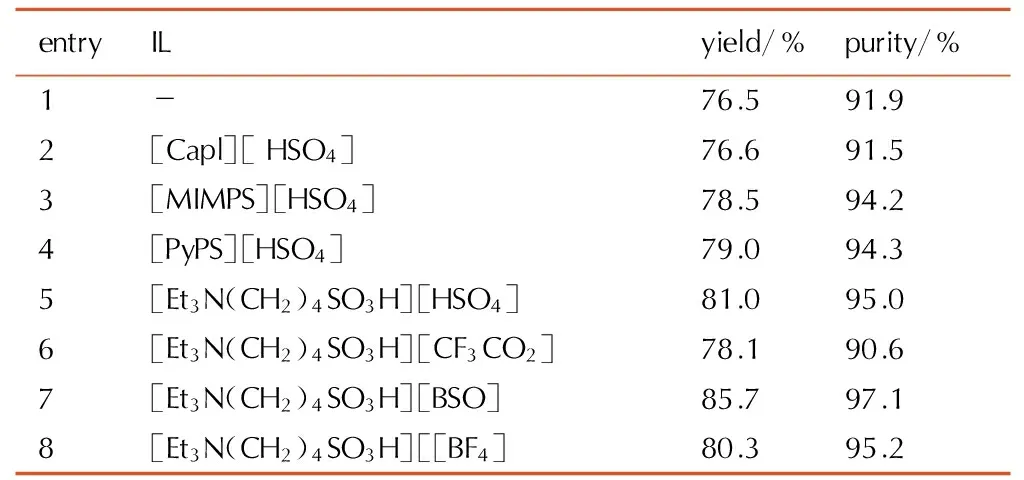
反应温度60~80 ℃,时间4 h,料比m(ILs)∶m(TAIW)∶m(N2O5)∶V(HNO3)=0.5 g∶3 g∶4 g∶15 mL,考察离子液体种类对CL-20收率和纯度的影响,结果见表1。
表1离子液体种类对CL-20收率纯度的影响
Table1Effects of different ILs on the yield and purity of CL-20
entryILyield/%purity/%1-76.591.92[Capl][HSO4]76.691.53[MIMPS][HSO4]78.594.24[PyPS][HSO4]79.094.35[Et3N(CH2)4SO3H][HSO4]81.095.06[Et3N(CH2)4SO3H][CF3CO2]78.190.67[Et3N(CH2)4SO3H][BSO]85.797.18[Et3N(CH2)4SO3H][[BF4]80.395.2
首先固定阴离子[HSO4]-,考察不同阳离子配伍下离子液体的催化性能。由表1可知,四种离子液体均具有正催化性能,其中三乙胺和吡啶离子液体效果较好,这可能与酸性强弱和空间位阻有关。以催化效果最佳的季铵盐类[Et3N(CH2)4SO3H]+为基准,考察不同阴离子配伍下的催化性能。结果表明,[Et3N(CH2)4SO3H][BSO]催化效果最好。与同样条件不加催化剂相比,CL-20产率提高12.0%,纯度提高5.7%。
为了进一步研究离子液体酸强度与催化性能的关联性,以季铵盐离子液体为例,测试含不同阴离子的季铵盐离子液体的酸强度,图1为4-硝基苯胺在不同阴离子季铵盐离子液体中的350 nm紫外吸收光谱。

图14-硝基苯胺在不同阴离子季铵盐离子液体下的吸收光谱
Fig.1Absorption spectra of 4-nitroaniline in ILs of quaternary ammonium salts with different anions
由图1可知,纯4-硝基苯胺在未被质子化时350 nm处的最大吸收峰。根据文献[24]可知,通过测量不同离子液体加入后[I]/[IH+]的比值,可计算出Hammett函数值H0(表2)。
结合表1和表2可知,离子液体阳离子相同时,阴离子对应的共轭酸酸性越强,催化效果越明显,离子液体酸强度与催化性能呈正相关关系。其中[Et3N(CH2)4SO3H][BSO]由于具有较强的酸强度而表现出最佳的催化效果: CL-20收率达到85.7%,纯度97.1%。
表2Hammett函数值(H0)
Table2Hammett Function (H0) Values

ILH0[Et3N(CH2)4SO3H][HSO4] 0.38[Et3N(CH2)4SO3H][CF3CO2] 1.32[Et3N(CH2)4SO3H][BSO] -0.27[Et3N(CH2)4SO3H][[BF4] 0.43
3.2 离子液体用量的影响
反应温度60~80 ℃,时间4 h,料比m(TAIW)∶m(N2O5)∶V(HNO3)=3 g∶4 g∶15 mL,考察离子液体[Et3N(CH2)4SO3H][BSO]用量对CL-20收率和纯度的影响,结果见表3。
由表3可知,随着离子液体用量的增加,CL-20的收率先增加后减少。当离子液体为0.5 g时,CL-20的收率最高。随着离子液体的加入量进一步增加,体系的粘度增大,传质传热性能降低,导致CL-20的收率降低。
表3离子液体用量对CL-20收率和纯度的影响
Table3Effects of amount of ILs on the yield and purity of CL-20

entryIL/gyield/%purity/%1-76.591.920.380.595.030.585.797.140.784.997.151.082.597.061.579.897.2
Note:m(TAIW)=3 g
3.3 反应时间的影响
反应温度60~80 ℃,料比m(ILs)∶m(TAIW)∶m(N2O5)∶V(HNO3)=0.5 g∶3 g∶4 g∶15 mL,考察反应时间的影响,结果见表4。
由表4可知,随着反应时间延长,CL-20的收率及纯度逐渐升高。这可能是因为目标产物笼形结构导致硝解条件较苛刻。尤其是当笼形骨架只剩下最后一个取代基时,5个硝基的吸电子效应和笼形骨架的空间位阻,使反应很难进行完全,需要较长的时间。但超过7 h后,随着反应时间的延长,少量产品会在强酸中分解。综合考虑,最佳的反应时间为7 h,此时收率为94.5%,纯度为98.1%。
表4反应时间对CL-20收率和纯度的影响
Table4Effects of reaction timeon the yield and purity of CL-20

entryt/hyield/%purity/%1379.391.52485.797.13593.196.34794.598.151093.298.3
3.4 HNO3和离子液体的循环利用
混酸硝解工艺的最大缺陷是硫酸处理成本高,污染严重。如果新硝解工艺中的催化剂和废酸能重复利用,则可进一步提高该方法的竞争力。因此,反应终止后,过滤得到产品CL-20; 50 ℃下减压(0.07 Mpa)蒸馏母液回收HNO3,回收率80%以上,通过电位滴定法检验回收的HNO3质量分数为98.1%; 70 ℃下继续减压除去多余的水分; 剩下的即为离子液体,回收率95%。体系的回收流程图如图2所示。

图2硝酸和离子液体回收流程图
Fig.2Flow chart of nitric acid and ILs recycling
将回收的HNO3和离子液体直接用于下一轮反应中,考察其重复使用情况。由图3可知,回收的硝酸能够用于下一批次反应而不影响CL-20的收率和纯度。离子液体重复使用5次,CL-20的收率和纯度没有明显降低,显示出较好的催化活性和稳定性。

图3硝酸和离子液体重复利用
Fig.3Recycling and reuse of nitric acid and ILs
3.5 不同硝解体系的比较
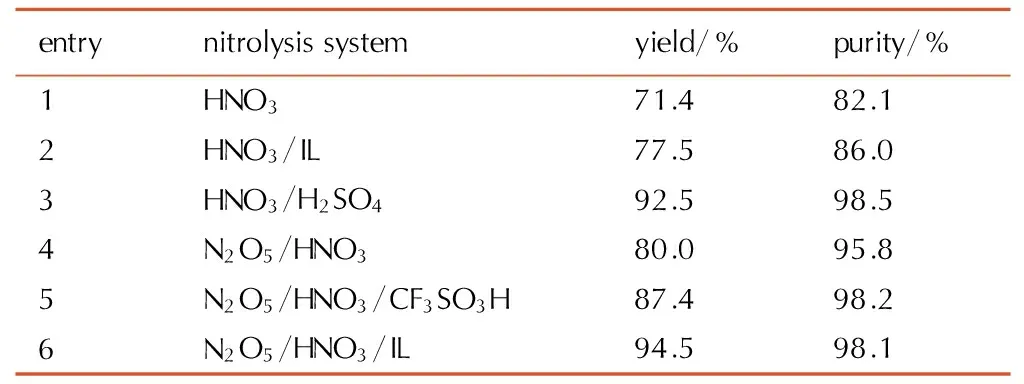
反应温度60~80 ℃,反应时间7 h下,不同硝解体系对CL-20产率的影响见表5。
由表5可知,HNO3、HNO3/IL、N2O5/HNO3体系组分简单,但硝解能力弱,产率低,N2O5/HNO3/CF3SO3H体系中催化剂CF3SO3H价格高,毒性大,不易回收; HNO3/H2SO4产率高、纯度好,但硫酸处理成本高,污染严重; N2O5/HNO3/IL体系产率纯度均较好,离子液体及硝酸易回收,绿色环保,具有较强的应用前景,是较优的硝解体系。
表5不同硝解体系对CL-20产率的影响
Table5Comparison of differentnitrolysis systems
entrynitrolysissystemyield/%purity/%1HNO371.482.12HNO3/IL77.586.03HNO3/H2SO492.598.54N2O5/HNO380.095.85N2O5/HNO3/CF3SO3H87.498.26N2O5/HNO3/IL94.598.1
4 结 论
(1) 将酸性离子液体[Et3N(CH2)4SO3H][BSO]引入到N2O5/HNO3硝解TAIW,得到了较佳CL-20制备工艺: N2O5/HNO3/IL 体系,反应温度60~80 ℃,反应时间7 h,料比m([Et3N(CH2)4SO3H][BSO])∶m(TAIW)∶m(N2O5)∶V(HNO3)=0.5 g∶3 g∶4 g∶15 mL,此时CL-20收率为94.5%,纯度为98.1%;
(2) 通过分步减压蒸馏,离子液体和未反应的硝酸可以回收。硝酸的回收率为80%,离子液体的回收率为95%。
(3) N2O5/HNO3/IL体系反应温和,无硫酸污染,具有较好的应用前景。
参考文献:
[1] Nielsen A T. Caged polynitamine compound: US, 5693794[P], 1997-12-02.
[2] 公绪宾, 孙成辉, 庞思平, 等. 异伍兹烷衍生物的研究进展[J]. 有机化学, 2012, 32(3): 486-496.
GONG Xu-bin, SUN Cheng-hui, PANG Si-ping, et al. Research progress in study of isowurtzitane derivatives[J].ChineseJournalofOrganicChemistry, 2012, 32(3): 486- 496.
[3] 赵信岐, 方涛, 孙成辉. 六硝基六氮杂异伍兹烷制备工艺开发新进展[J]. 兵工学报, 2004, 25(3): 354-358.
ZHAO Xin-qi, FANG Tao, SUN Cheng-hui. Research and development of HNIW synthesis[J].ActaArmamentarii, 2004, 25(3): 354-358.
[4] 王晰, 彭翠枝. 国外六硝基六氮杂异伍兹烷的发展现状[J]. 火炸药学报, 2007, 30(5): 42-44.
WANG Xi, PENG Cui-zhi. Development of hexanitrohexaazaisowurtaitane at abroad[J].ChineseJournalofExplosivesandPropellants, 2007, 30(5): 42-44.
[5] 王振宇. 国外高能量密度化合物研究新进展[J]. 飞航导弹, 2003 (2): 34-37.
WANG Zhen-yu. New development of high energy density compound at abroad[J].WingedMissilesJournal, 2003 (2): 34-37.
[6] 赵信歧, 倪承志. 六硝基六氮杂异伍兹烷的晶型结构[J]. 科学通报,1995, 40(23): 2158-2160.
ZHAO Xin-qi, NI Cheng-zhi. Crystal structure of γ-hexanitrohexaazaisowurtzitane[J].ScienceBulletin, 1995, 40(23): 2158- 2160.
[7] Jai P A. Some high energy materials and their formulations for specialized applications[J].Propellants,Explosives,Pyrotechnics, 2005, 30(5): 316-328.
[8] Mandal A K, Pant C S, Kasar S M, et al. Process optimization for synthesis of CL-20[J].JournalofEnergeticMaterials, 2009, 27(4): 231- 246.
[9] 张香文, 王庆法, 王范, 等. 电化学制备五氧化二氮装置及方法: CN,1746335A[P], 2006-03-15.
ZHANG Xiang-wen, WANG Qing-fa, WANG Fan, et al. Electrochemical device and method of preparation of N2O5: CN, 1746335A[P], 2006-03-15.
[10] Wang Q F, Su M, Zhang X W, et al. Electrochemical synthesis of N2O5by oxidation of N2O4in nitric acid with PTFE membrane[J].ElectrochemicaActa, 2007, 52(11): 3667-3672.
[11] 苏敏. 新型绿色硝化剂N2O5的电化学合成[D]. 天津: 天津大学,2006.
SU Min. Electrochemical synthesis of new green nitrating agent N2O5[D]. Tianjing: Tianjin University, 2006.
[12] 钱华, 吕春绪, 叶志文. 绿色硝解合成六硝基六氮杂异伍兹烷[J]. 火炸药学报, 2006, 29(3): 52-53.
QIAN Hua, Lü Chun-xu, YE Zhi-wen. Synthesis of CL-20 by clean nitration[J].ChineseJournalofExplosivesandPropellants, 2006, 29(3): 52-53.
[13] 钱华, 叶志文, 吕春绪. N2O5/HNO3硝化硝解TAIW制备CL-20[J]. 应用化学, 2008, 25(3): 378-380.
QIAN Hua, YE Zhi-wen, Lü Chun-xu. Nitration and nitrolysis of TAIW with N2O5/HNO3to synthesize CL-20[J].ChineseJournalofAppliedChemistry, 2008, 25(3): 378-380.
[14] 胡小玲, 吴秋洁, 钱华. N2O5/HNO3硝化硝解TAIW制备CL-20[J]. 火炸药学报, 2015, 38(2): 35-38.
HU Xiao-ling, WU Qiu-jie, QIAN Hua. Synthesis of CL-20 by nitrolysis of TAIW with N2O5/HNO3[J].ChineseJournalofExplosivesandPropellants, 2015, 38(2): 35-38.
[15] Zhi H Z, Luo J, Feng G A, et al. An efficient method to synthesize HMX by nitrolysis of DPT with N2O5and a novel ionic liquid[J].ChineseChemicalLetters, 2009, 20(4): 379-382.
[16] 何志勇. 离子液体催化N2O5硝解反应制备HMX及硝解机理研究[D]. 南京: 南京理工大学, 2012.
HE Zhi-yong. Synthesis of HMX by nitrolysis with dinitrogen pentoxide catalyzed by acidic ionic liquid and study on the nitrolysis mechanism[D]. Nanjing: Nanjing university of science and Technology, 2012.
[17] 吕春绪. 绿色硝化研究进展[J]. 火炸药学报, 2011, 34(1): 1-7.
Lü Chun-xu. Study progress on green nitration[J].ChineseJournalofExplosivesandPropellants, 2011, 34(1): 1-7.
[18] CHENG Guang-bin, LI Xia, QI Xiu-fang, et al. Synthesis of RDX by nitrolysis of hexamethylenetetramine in the presence of bronsted acidic ionic liquids[M].VIII. Beijing: Science Press, 2009: 48-51.
[19] Chum H L, Koch V R, Miller L L, et al. Electrochemical scrutiny of organometallic iron complexes and hexamethylbenzene in a room temperature molten salt[J].JAmChemSoc, 1975, 97(11): 3264-3265.
[20] Fang D, Luo J, Zhou X L, et al. Mannich reaction in water using acidic ionic liquid as recoverable and reusable catalyst[J].CatalysisLetters, 2007, 116(2): 76-80.
[21] Fang D,Luo J, Zhou X L, et al. One pot green procedure for biginelli reaction catalyed by novel task specific room temperature ionic liquids[J].JournalofMolecularCatalysisA:Chemical, 2007, 274: 208-211.
[22] Mark T S, Paul C T, Jean P M, et al. Kineticinhibitor of hydrate crystallization[J].JAmChemSoc, 2004, 126: 1569-1576.
[23] Hua Qian, Ya Wang, Dabin Liu. Ultrasound accelerated Synthesis of Substituted 2′-hydroxychalcones by reusable ionic liquids[J].IndustrialEngineeringChemistryReserach, 2013, 52: 13272-13275.
[24] Thomazeau C, Bourbigou H, Luts S, Gillber B. Determination of an acidic scale in room temperature ionic liquids[J].JAmChemSoc,2003, 125: 5264-5265.

